第五单元 课题3 利用化学方程式的简单计算 同步练习(含解析) 2022-2023学年上学期河南省九年级化学期末试题选编
文档属性
| 名称 | 第五单元 课题3 利用化学方程式的简单计算 同步练习(含解析) 2022-2023学年上学期河南省九年级化学期末试题选编 |  | |
| 格式 | docx | ||
| 文件大小 | 543.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-21 20:16:44 | ||
图片预览



文档简介
第五单元 课题3 利用化学方程式的简单计算 同步练习
一、单选题
1.(2022秋·河南平顶山·九年级统考期末)铜与稀盐酸、稀硫酸均不反应,但铜却能与稀硝酸发生反应:。下列说法正确的是
A.X的化学式为NO2
B.反应前后铜元素化合价从0变为+2
C.反应后原子的数目减少
D.参加反应的铜和生成的水的质量之比为32:9
2.(2022秋·河南新乡·九年级统考期末)2021年12月14日0时09分,我国在西昌卫星发射中心用长征三号乙运载火箭,成功将天链二号02星发射升空。该火箭推进器采用偏二甲肼(C2H8N2)与N2O4反应,该反应的化学方程式为:。下列说法不正确的是
A.X的化学式为CO2 B.生成N2和H2O的质量比为3:4
C.N2O4属于氧化物 D.偏二甲肼中碳的质量分数为40%
3.(2022秋·河南鹤壁·九年级统考期末)密闭容器内有a、b、c、d四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,下列说法不正确的是
物质 a b c d
反应前质量/g 1 20 15 2
反应后质量/g m 29 0 8
A.a可能是该反应催化剂
B.表中m的值为1
C.该反应是分解反应
D.若b与d的相对分子质量之比为2:l,则反应中b与d的化学计量数之比为4:3
4.(2022秋·河南周口·九年级统考期末)乙炔(C2H2)在氧气中燃烧生成二氧化碳和水,若生成8.8克二氧化碳,则需要乙炔质量为
A.1.3克 B.2.6克 C.3.9克 D.5.2克
5.(2022秋·河南周口·九年级统考期末)镁在空气中燃烧发生如下两个反应:,,已知12g镁在纯氧中燃烧得到20g产物,则12g镁在空气中完全燃烧所得产物的质量
A.大于20g B.小于20g C.等于20g D.大于、小于或等于20g
6.(2022秋·河南驻马店·九年级统考期末)相同质量的H2O2、KClO3和KMnO4与等质量MnO2混合,充分反应后,生成氧气的质量
A.H2O2最多,KMnO4最少 B.KClO3最多,H2O2最少
C.H2O2最多,KClO3最少 D.KMnO4最多,H2O2最少
7.(2022秋·河南驻马店·九年级统考期末)将10g的H2和O2的混合气体点燃并充分反应,发现还剩余1g O2,原混合气体中H2 和O2的质量比为( )
A.1:8 B.1:9 C.1:4 D.2:1
8.(2022秋·河南许昌·九年级期末)将一定质量的镁粉、铝粉和锌粉的混合物与足量的稀盐酸充分反应,生成0.2g氢气,则原金属混合物的质量不可能是
A.2.4g B.2.7g C.4.6g D.6.5g
9.(2022秋·河南焦作·九年级统考期末)一定质量的CaCO3样品高温煅烧,若样品分解了75.0%,则剩余固体中含Ca元素的质量分数为
A.53.3% B.71.4% C.59.7% D.34.6%
二、填空题
10.(2022秋·河南驻马店·九年级统考期末)“中国芯”是指由我国自主研发并生产制造的计算机处理芯片,芯片大多数使用的是丰富、廉价的硅元素。下图是用沙子制取硅的化学反应微观示意图。
该反应的化学方程式为 ,物质甲和乙的质量比是 。
11.(2022秋·河南南阳·九年级统考期末)“宏观辨识与微观探析”是化学核心素养之一。工业上用甲和乙两种物质在一定条件下反应生成丙和丁,反应的微观示意图如下所示。
(1)反应前后化合价没有变化的元素是 ;
(2)写出该反应的化学方程式 ;
(3)生成丙和丁的质量比为 。
12.(2022秋·河南平顶山·九年级统考期末)利用催化剂可消除室内装修材料释放的甲醛(CH2O),下图为该反应的微观示意图。
(1)图中属于单质的是 (填化学式)。
(2)写出该反应的化学方程式 。
(3)参加反应的乙和生成的丙的质量比为 。
13.(2022秋·河南周口·九年级统考期末)如图是某反应的微观示意图,图中的单质为 ;该反应前后化合价没有发生变化的元素为 ;生成物的质量比为 .
14.(2022秋·河南安阳·九年级校考期末)乙烯(C2H4)可用作催熟水果。一定质量的C2H4 在不充足的O2中燃烧,生成 CO,同时得到 8.8gCO2 和5.4gH2O,则参加反应的 C2H4的质量为 ;反应的化学方程式为 ;若乙烯完全燃烧生成CO2和H2O,则还需要氧气的质量为 。
15.(2022秋·河南许昌·九年级统考期末)浓盐酸和氯酸钾反应可以生成氯气(Cl2)、氯化钾和一种氧化物,则该反应的化学方程式为 ;现有氯酸钾和二氧化锰的混合物30g,加热至不再产生气体后,冷却、称量,得到20.4g固体,则混合物中二氧化锰的质量为 g。
三、简答题
16.(2022秋·河南许昌·九年级期末)下图是某一反应过程的微观示意图,回答下列问题:
(1)写出该反应的化学方程式。
(2)在反应中生成物的质量之比是多少?
17.(2022秋·河南驻马店·九年级统考期末)如图是氨气和氧气在一定条件下发生反应的微观示意图。
(1)写出该反应的化学方程式。
(2)该反应中生成物丙、丁的质量比是多少?
四、实验题
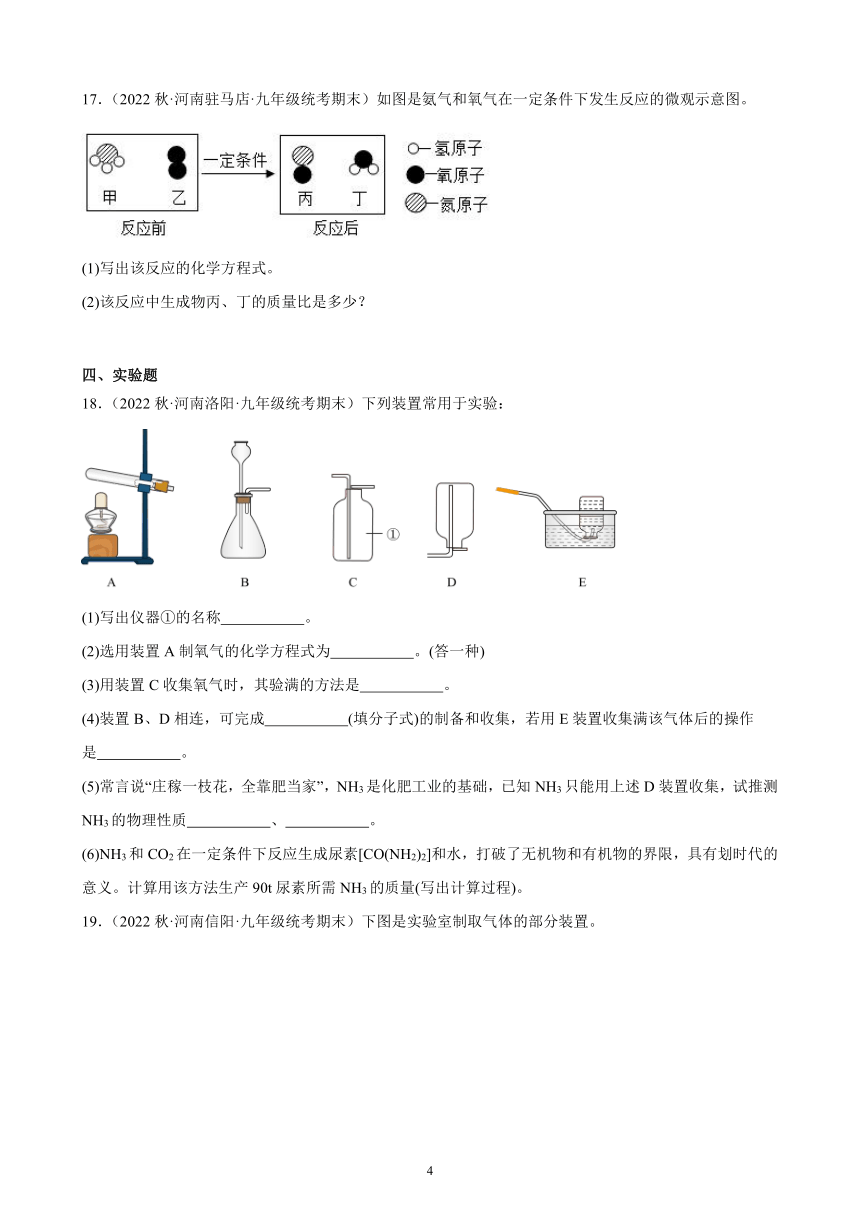
18.(2022秋·河南洛阳·九年级统考期末)下列装置常用于实验:
(1)写出仪器①的名称 。
(2)选用装置A制氧气的化学方程式为 。(答一种)
(3)用装置C收集氧气时,其验满的方法是 。
(4)装置B、D相连,可完成 (填分子式)的制备和收集,若用E装置收集满该气体后的操作是 。
(5)常言说“庄稼一枝花,全靠肥当家”,NH3是化肥工业的基础,已知NH3只能用上述D装置收集,试推测NH3的物理性质 、 。
(6)NH3和CO2在一定条件下反应生成尿素[CO(NH2)2]和水,打破了无机物和有机物的界限,具有划时代的意义。计算用该方法生产90t尿素所需NH3的质量(写出计算过程)。
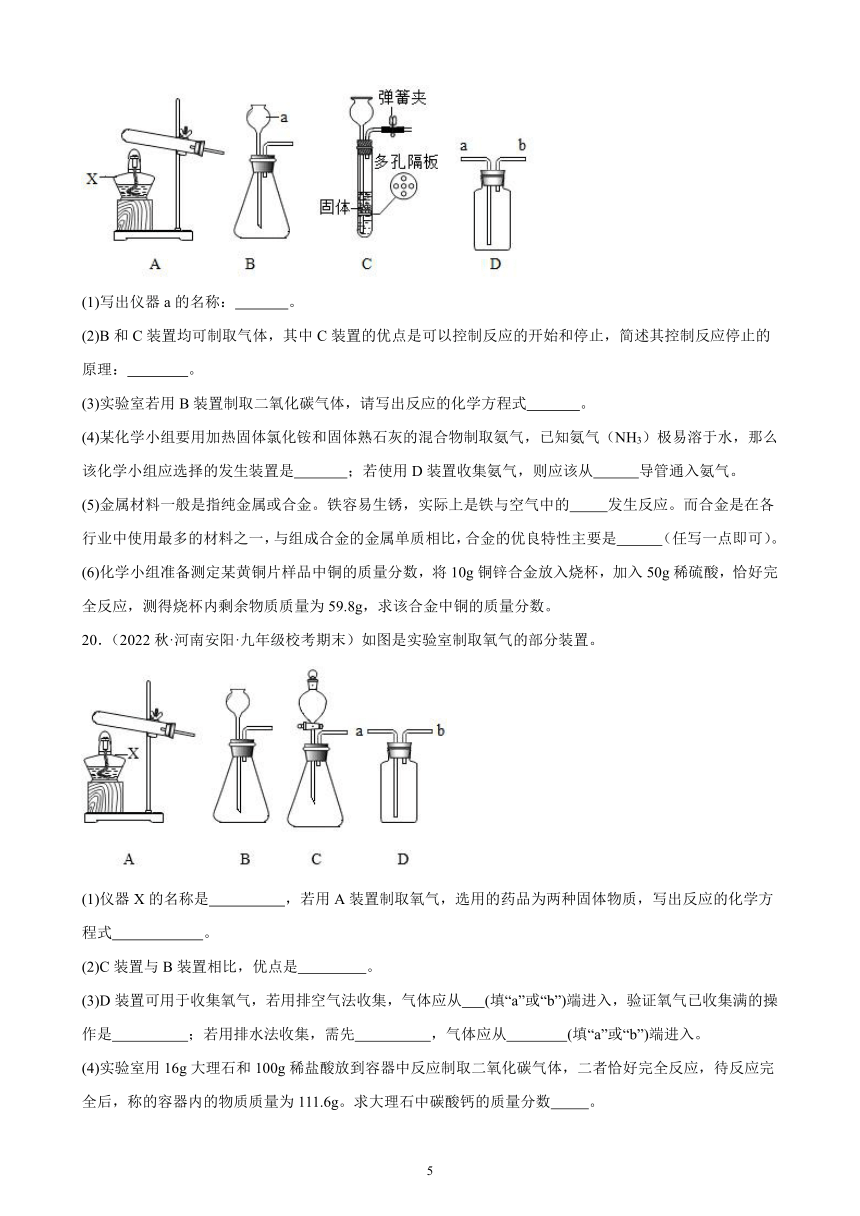
19.(2022秋·河南信阳·九年级统考期末)下图是实验室制取气体的部分装置。
(1)写出仪器a的名称: 。
(2)B和C装置均可制取气体,其中C装置的优点是可以控制反应的开始和停止,简述其控制反应停止的原理: 。
(3)实验室若用B装置制取二氧化碳气体,请写出反应的化学方程式 。
(4)某化学小组要用加热固体氯化铵和固体熟石灰的混合物制取氨气,已知氨气(NH3)极易溶于水,那么该化学小组应选择的发生装置是 ;若使用D装置收集氨气,则应该从 导管通入氨气。
(5)金属材料一般是指纯金属或合金。铁容易生锈,实际上是铁与空气中的 发生反应。而合金是在各行业中使用最多的材料之一,与组成合金的金属单质相比,合金的优良特性主要是 (任写一点即可)。
(6)化学小组准备测定某黄铜片样品中铜的质量分数,将10g铜锌合金放入烧杯,加入50g稀硫酸,恰好完全反应,测得烧杯内剩余物质质量为59.8g,求该合金中铜的质量分数。
20.(2022秋·河南安阳·九年级校考期末)如图是实验室制取氧气的部分装置。
(1)仪器X的名称是 ,若用A装置制取氧气,选用的药品为两种固体物质,写出反应的化学方程式 。
(2)C装置与B装置相比,优点是 。
(3)D装置可用于收集氧气,若用排空气法收集,气体应从 (填“a”或“b”)端进入,验证氧气已收集满的操作是 ;若用排水法收集,需先 ,气体应从 (填“a”或“b”)端进入。
(4)实验室用16g大理石和100g稀盐酸放到容器中反应制取二氧化碳气体,二者恰好完全反应,待反应完全后,称的容器内的物质质量为111.6g。求大理石中碳酸钙的质量分数 。
五、综合应用题
21.(2022秋·河南平顶山·九年级统考期末)某兴趣小组利用下列所示的仪器进行实验并探究。
(1)实验室用氯酸钾和为原料制氧气,反应的化学方程式为 ,若要收集到干燥的氧气,则收集装置为 (从A~E中选择)。
(2)若用溶液和来制氧气,应选用的发生装置是 (从A~E中选择)。为了证明的催化作用,甲同学通过以下装置来进行实验探究:图1中加入溶液,然后塞入带火星木条的橡胶塞,如图2所示,观察到的现象是 。再通过漏斗加入,如图3所示,此时观察到的现象是 。充分反应后,将图3的混合液进行过滤、洗涤、干燥、称量,固体仍为,甲同学认为是催化剂。
(3)乙同学认为甲同学的结论不严谨,请你帮乙同学说出理由: 。
(4) (填“能”或“否”)用图4来探究铁在氧气中的燃烧实验。
(5)我国神舟十三号乘组航天员将志刚、王亚平、叶光富已完成太空任务返回地球。航天飞行器座舱的空气更新过程如图所示:
假设一个成年人每天呼吸大约需氧气0.64千克,三名航天员在太空呼吸所需氧气都来自装置(Ⅲ)中水的电解,则为供给他们在太空3个月呼吸所需氧气(每月按30天计),理论上一共电解的水至少有多少千克?
22.(2022秋·河南漯河·九年级统考期末)下图装置常用于实验室制取气体。
(1)仪器①的名称是 。
(2)用装置甲制取氧气,采用该收集方法的依据是 ;检验集气瓶中已经充满氧气的方法是 ;发生反应需要的催化剂是 。
(3)用装置乙制取气体,实验结束时,为防止水槽里的水倒流,应采取的操作是 。
(4)在加热条件下,用醋酸钠(CH3COONa)固体与碱石灰中氢氧化钠反应制取甲烷,同时生成碳酸钠,应选用的装置是 (填“甲”或“乙”),反应的化学方程式为 。
(5)取氯酸钾和二氧化锰的混合物13g,用乙装置加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为8.2g,计算:
①生成氧气的质量是 。
②原混合物中氯酸钾的质量是 。
23.(2022秋·河南新乡·九年级统考期末)下图是实验室制取气体的常用装置。
(1)写出图中的仪器名称:① ② 。
(2)请组合一套用高锰酸钾制取纯净的氧气的装置 (用字母表示),并写出该反应的化学方程式 。
(3)实验室制取CO2的发生装置可选择B或C,与B相比较,C的主要优点是什么 。
(4)下所示装置可用于收集氧气,若用排空气法收集,气体应从 (填“a”或“b”)端进入,验证氧气已收集满的操作是 。
(5)取10.0g石灰石样品,加入100.0g的稀盐酸,反应结束后烧杯内物质的总质量为107.8g,请计算该石灰石样品中碳酸钙的质量。
六、计算题
24.(2022秋·河南郑州·九年级期末)上海世博会上,燃料电池观光车,靠氢气和氧气反应提供能源,由于只生成水,真正实现了“零排放”.若有1千克氢气反应,生成水的物质的量为多少摩尔?(写出计算过程)
25.(2022秋·河南新乡·九年级统考期末)“化学氧自救呼吸器”是一种在缺氧环境中通过制氧剂临时供氧的装置。制氧剂的主要成分是超氧化钾(),产生氧气的主要原理是超氧化钾与人体呼出的水汽反应,其化学方程式为:4KO2+2H2O=4KOH+3O2↑。若呼吸器中装有200g样品,完全反应后能为使用者提供48g氧气。求样品中超氧化钾的质量分数。
26.(2022秋·河南郑州·九年级期末)利用化学方程式计算:实验室通过加热分解氯酸钾固体的方法制备氧气.现有氯酸钾和二氧化锰的混合物27g,加热至质量不再减少,测得剩余固体的质量为17.4g。求:
(1)制得氧气的质量为 ?
(2)原混合物中二氧化锰的质量为 ?
参考答案:
1.B
【详解】A、反应前后铜原子都是3个,氢原子都是8个,反应前氮原子是8个,反应后应该是8个,其中2个包含在未知物质中,反应前氧原子是24个,反应后应该是24个,其中2个包含在未知物质中,X的化学式为NO,该选项说法不正确;
B、反应前铜单质中铜的化合价是0价,反应后硝酸铜中铜元素化合价是+2价,该选项说法正确;
C、在化学变化中原子的数目、种类和质量不变,该选项说法不正确;
D、根据方程式参加反应的铜和生成的水的质量之比为=24:9,该选项说法不正确;
故选:B。
2.B
【详解】A、根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含C、H、N、O的个数分别是2、8、6、8,生成物中含C、H、N、O的个数分别是0、8、6、4,故生成物中还应含2个C、4个O,故X的化学式为CO2,不符合题意;
B、生成氮气和水的质量比为:(28×3):(18×4)=7:6,符合题意;
C、四氧化二氮是由N、O元素组成的化合物,属于氧化物,不符合题意;
D、偏二甲肼中碳的质量分数为:,不符合题意。
故选B。
3.D
【详解】A、根据质量守恒定律,反应后a的质量为:,即在反应前后a的质量没有改变,a在该反应前后质量没有改变,可能是催化剂,也可能是杂质,与反应无关,若确定其是否为催化剂,还需要检验其在该反应前后的化学性质是否改变和其是否改变了该反应的反应速率,故A选项正确;
B、由A中分析可知,表中m的值为1,故B选项正确;
C、根据表中数据可知,反应后b和d的质量增加了,c的质量减小了,即c反应后生成b和d,一种物质反应生成两种物质,属于分解反应,故C选项正确;
D、根据表中数据可知,该反应中b和d的质量比为:,设b和d的化学计量数之比为,则有,则,故D选项错误;
故选D。
4.B
【详解】乙炔燃烧生成二氧化碳和水,反应的化学方程式为2C2H2+5O24CO2+2H2O;设生成8.8克二氧化碳,需要乙炔质量为x,则
x=2.6g
故选B。
5.B
【详解】氧化镁中镁、氧元素的质量比为24:16=3:2,氮化镁中镁、氧元素的质量比为(24×3):(14×2)=18:7,即说明等质量的镁完全与氧气反应生成氧化镁的质量要比完全与氮气反应生成的氮化镁的质量要多,已知12g镁在纯氧中燃烧得到20g产物,而在空气中燃烧时,部分镁会与氮气反应生成氮化镁,故12g镁在空气中完全燃烧所得产物的质量要小于20g。即选B。
【点睛:】
6.A
【详解】解:设过氧化氢、氯酸钾、高锰酸钾的质量均为m
过氧化氢完全分解生成氧气的质量为:
综上所述:过氧化氢最多,高锰酸钾最少。
选择A。
7.B
【分析】氢气在氧气中点燃生成水。
【详解】由于剩余1g的氧气,所以生成的水的质量为
设氢气的质量为x
则原混合气体中H2和O2的质量比为
故选B。
【点睛】根据质量守恒定律,反应物的总质量等于生成物的总质量,剩余1g的氧气,所以生成的水的质量为。
8.D
【详解】解:设生成0.2g氢气时需要铝的质量是x,锌的质量是y,镁的质量为z,
,解得x=1.8g
,解得y=6.5g
,解得z=2.4g
所以原混合物质量范围是大于1.8g,小于6.5g,而2.4g 、2.7g、 4.6g都在该范围内,所以金属混合物的质量不可能是6.5g;
故选D。
【点睛】解题的关键是要分析清楚要使金属混合物跟足量稀硫酸反应生成0.2g氢气,所需的金属质量的取值范围,主要是采用极端假设的方法完成。
9.C
【分析】假设样品的质量为100g,根据分解情况可以求解分解的碳酸钙的质量,计算生成二氧化碳的质量,进一步计算剩余固体中含Ca元素的质量分数。
【详解】解:设样品的质量为100g,则样品中Ca元素的质量为;
分解的碳酸钙的质量为100g×75.0%=75.0g。
设生成的二氧化碳的质量为x。
则剩余国体中含Ca元素的质量分数为;
故选C
【点睛】本题考查学生对化学方程式的计算、化合物中某元素的质量与质量分数计算方法的掌握与应用的能力。
10. 5:2
【详解】图中所示的反应是,二氧化硅与碳单质反应,生成硅单质、一氧化碳,反应的化学方程式为:,物质甲是二氧化硅,物质乙是碳单质,根据化学方程式可知,。
11.(1)氢元素/H
(2)
(3)27:14
【分析】由反应的微观示意图可知,氨分子和氧分子在一定条件下生成氮分子和水分子,;
【详解】(1)反应前氨气中氮元素的化合价是-3价,氢元素的化合价是+1价,氧气中氧元素的化合价是0价,反应后水中氢元素的化合价为+1价,氧元素的化合价为-2价,氮气中氮元素的化合价是0价,则反应前后化合价没有变化的元素是氢元素。
(2)氨气和氧气在一定条件下反应生成水和氮气,反应的化学方程式为。
(3)由化学方程式可知,生成丙和丁的质量比为(6×18):(2×28)=27:14。
12.(1)O2
(2)
(3)8∶11
【分析】根据微观示意图可知,甲为CH2O,乙为O2,丙为CO2,丁为H2O;
【详解】(1)根据上述分析,属于单质是O2;
(2)甲醛和氧气反应生成二氧化碳和水,化学方程式为:;
(3)根据化学方程式,乙和丙的质量比为32:44=8:11。
13. 氮气 氧元素 22:7
【详解】由化学反应的微观示意图可知,该反应是一氧化碳和一氧化氮在一定条件下反应生成了二氧化碳和氮气,反应的方程式是:2NO+2CO2CO2+N2。由方程式可知,单质为氮气;由反应的方程式可知,氮元素的化合价由+2价变为0价,碳元素的化合价由+2价变为+4价,氧元素的化合价在反应前后没有发生改变;由反应的方程式可知,生成物二氧化碳和氮气的质量比为:[2×(12+16×2)]:(14×2)=22:7。
14. 4.2g 3C2H4+8O24CO2+2CO+6H2O 1.6g
【分析】一定质量的C2H4 在不充足的O2中燃烧,生成 CO,同时得到 8.8gCO2 和5.4gH2O,可以根据氢原子守恒,用H2O的质量计算C2H4的质量,然后根据质量比求出计量数之比,写出化学方程式;乙烯完全燃烧只生成CO2和H2O,此时消耗的氧气的质量和不完全燃烧消耗氧气的质量相比较,二者之差即为乙烯完全燃烧还需要的氧气的质量。
【详解】根据分析,因为C2H4→2H2O,设参加反应的C2H4的质量为x,则
根据4.2gC2H4生成的8.8gCO2 和5.4gH2O,三者的个数比为,故C2H4不完全燃烧的化学方程式为3C2H4+8O24CO2+2CO+6H2O;
设不完全燃烧消耗氧气的质量为y,则
乙烯完全燃烧的化学方程式为C2H4+3O22CO2+2H2O;
设完全燃烧消耗的氧气的质量为z,则
故还需要氧气的质量为14.4g-12.8g=1.6g。
15. 5.5
【详解】根据质量守恒定律可知,化学反应前后元素的种类不变,在浓盐酸和氯酸钾的反应中反应前含有H、Cl、K、O四种元素,反应后含有Cl、K两种元素,则该氧化物中一定含H元素,故该氧化物为H2O,该反应的化学方程式为6HCl(浓)+KClO3=3H2O+KCl+3Cl2↑;
设原混合物中氯酸钾的质量为x
x=24.5g
则原混合固体中二氧化锰的质量为30g-24.5g=5.5g。
【点睛】本题主要考查质量守恒定律以及化学方程式的书写和计算的内容。
16.(1)
(2)根据反应方程式可知,生成物氮气与二氧化碳的质量比为(14×2):2×(12+16×2)=7:22
答:在反应中生成物氮气与二氧化碳的质量比为7:22。
【详解】(1)由微观示意图可知,该反应为一氧化碳与一氧化氮造催化剂的作用下反应生成氮气和二氧化碳,该反应方程式为:;
(2)见答案。
17.(1)
(2)(30×4):(18×6)=10:9
【详解】(1)甲为NH3,乙为O2,丙为NO,丁为H2O,反应的化学方程式为;
(2)依据反应方程式,丙和丁的质量比为(30×4):(18×6)=10:9。
18.(1)集气瓶
(2)
(3)将带火星的木条置于集气瓶口,若木条复燃,则已满
(4) H2 先将导管移出水槽,用玻璃片盖住集气瓶口,小心移出水面,倒放在实验台上
(5) NH3密度比空气小 易溶于水
(6)解:设用该方法生产90t尿素所需NH3的质量为
=51t
答:用该方法生产90t尿素所需NH3的质量为51t
【详解】(1)仪器①是集气瓶;
(2)装置A适用于固体加热反应制取气体,且试管口有一团棉花,适用于加热高锰酸钾制取氧气,高锰酸钾在加热的条件下反应生成锰酸钾、二氧化锰和氧气,反应的化学方程式为;
(3)用装置C收集氧气时,氧气具有助燃性,其验满的方法是将带火星的木条置于集气瓶口,若木条复燃,则已满;
(4)装置B适合反应物为固体和液体,反应条件是常温的气体的制取,装置D适合密度比空气小的气体的收集,装置B、D相连,可完成H2的制备和收集,若用E装置收集满该气体后的操作是先将导管移出水槽,用玻璃片盖住集气瓶口,小心移出水面,倒放在实验台上;
(5)装置D适合密度比空气小的气体的收集,NH3只能用D装置收集,说明NH3的密度比空气小,易溶于水;
(6)见答案。
19.(1)长颈漏斗
(2)当关闭弹簧夹时,产生的气体无法排出,使试管内气压增大,将液体压回到长颈漏斗,使液面降到多孔塑料隔板以下,固液分离,反应停止
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑
(4) A b
(5) 氧气和水蒸气(或O2和H2O) 熔点低、硬度大、耐腐蚀
(6)解:根据质量守恒定律,生成氢气的质量为10g+50g-59.8g=0.2g,
设该合金中锌的质量为x,
x=6.5g
则该合金中铜的质量分数为,
答:该合金中铜的质量分数为35%。
【详解】(1)a为长颈漏斗;
(2)B和C装置均可制取气体,其中C装置的优点是可以控制反应的开始和停止,其控制反应停止的原理是当关闭弹簧夹时,产生的气体无法排出,使试管内气压增大,将液体压回到长颈漏斗,使液面降到多孔塑料隔板以下,固液分离,反应停止;
(3)实验室若用B装置制取二氧化碳气体,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,该反应的化学方程式为;
(4)用加热固体氯化铵和固体熟石灰的混合物制取氨气,该反应为固固加热型,发生装置可选择A;由于氨气密度比空气密度小,若使用D装置收集氨气,则应该从短管b导管通入氨气;
(5)铁容易生锈,实际上是铁与空气中的氧气和水蒸气发生反应;
而合金是在各行业中使用最多的材料之一,与组成合金的金属单质相比,合金的优良特性主要是熔点低、硬度大、耐腐蚀;
(6)见答案。
20.(1) 酒精灯 2KClO32KCl+3O2↑
(2)通过控制液体的滴加量和滴加速率来控制化学反应
(3) a 将带火星的小木条放在b导管口,若小木条复燃,则氧气已经收集满 将集气瓶装满水 b
(4)62.5%
【分析】本题考查了氧气的发生装置和收集装置,以及溶液中有关化学方程式的计算问题。
(1)
根据常见化学仪器的名称判断,X的名称为酒精灯;选用两种固体药品制取氧气,即选择氯酸钾和二氧化锰加热制取氧气,氯酸钾在二氧化锰的催化下受热分解生成氯化钾和氧气,该反应的化学方程式为2KClO3 2KCl+3O2↑;
(2)
C装置中用到了分液漏斗,和B装置相比,优点是可以通过控制液体的滴加量和滴加速率来控制反应速率;
(3)
D装置为“万用瓶”。由于氧气的密度大于空气的密度,应用向上排空气法收集,故气体应从a端进入;
氧气具有助燃性,验证氧气已收集满的操作是将带火星的小木条放在b导管口,若小木条复燃,则氧气已经收集满;
若用排水法收集氧气,首先应将集气瓶装满水,氧气的密度比水小,然后气体应从b端进入;
(4)
解:设大理石中碳酸钙的质量为x,反应中生成的二氧化碳质量=16g+100g-111.6g=4.4g,则由,则大理石中碳酸钙的质量分数为。
【点睛】“万用瓶”有多种用途。当用于向上排空气法收集气体时,瓶体正放,气体应“长进短出”;当用于向下排空气法收集气体时,瓶体正放,气体应“短进长出”;当用于排水法收集气体时,首先瓶中装满水,然后气体“短进长出”;当用作洗气瓶时,气体必须“长进短出”。
21.(1) D
(2) A 木条不复燃 产生大量气泡,木条复燃
(3)未证明的化学性质也保持不变(合理即可)
(4)能
(5)解:三个宇航员三个月呼吸氧气质量为:
设理论上一共电解水的质量至少为x
答:理论上一共电解的水至少有194.4千克。
【详解】(1)氯酸钾在二氧化锰的催化下加热分解生成氯化钾和氧气,该反应的化学方程式为:;
氧气密度比空气大,可选择向上排空气法收集,氧气不易溶于水,可选择排水法收集,而向上排空气法收集的氧气较排水法干燥,故若要收集到干燥的氧气,则收集装置为D向上排空气法;
(2)若用 H2O2 溶液和 MnO2 来制氧气,该反应为固液常温型,应选用的发生装置是A;
为了证明 MnO2 的催化作用,图1中加入 amLH2O2 溶液,然后塞入带火星木条的橡胶塞,如图2所示,观察到木条不复燃。再通过漏斗加入 bgMnO2 ,如图3所示,此时观察到产生大量气泡,木条复燃,即可说明二氧化锰可以加快过氧化氢分解;
(3)根据催化剂的特点是能改变化学反应的速率,而本身的质量和化学性质在反应前后不变,所以甲同学的结论不严谨,因为未证明 MnO2 的化学性质在反应前后也保持不变;
(4)图4中集气瓶底有少量细沙,可以防止生成的高温熔融物溅落炸裂集气瓶底,能用图4来探究铁在氧气中的燃烧实验;
(5)见答案。
22.(1)长颈漏斗
(2) 氧气密度比空气大 将带火星的木条放在集气瓶口,木条复燃说明氧气已充满 /二氧化锰
(3)先移出导管,再熄灭酒精灯
(4) 乙
(5) 生成氧气的质量是13g-8.2g=4.8g
答:生成氧气的质量是4.8g。 解:设原混合物中氯酸钾的质量为。
解得
答:混合物中氯酸钾的质量为12.25g。
【详解】(1)仪器①的名称是长颈漏斗。
(2)因氧气的密度大于空气,所以装置甲中收集装置为向上排空气法;检验集气瓶中已经充满氧气的方法是将带火星的木条放在集气瓶口,木条复燃说明氧气已充满;该装置制取氧气的反应是过氧化氢在二氧化锰的催化作用下反应生成水和氧气,所以反应需要的催化剂为。
(3)为防止水槽里的水倒流,应采取的操作是先移出导管,再熄灭酒精灯;
(4)反应物醋酸钠和碱石灰都是固体,反应条件是加热,所以应选用的装置是乙;醋酸钠和碱石灰在加热条件下反应生成甲烷和碳酸钠,所以反应方程式为。
(5)详解见答案。
23.(1) 长颈漏斗 锥形瓶
(2) AF/FA
(3)控制反应速率
(4) a 将带火星的木条放在b口,若木条复燃,则说明已收集满
(5)根据质量守恒,可知生成的二氧化碳的质量为10g+100g-107.8g=2.2g,设石灰石样品中碳酸钙的质量为x,则
解得x=5g
答:该石灰石样品中碳酸钙的质量为5g。
【详解】(1)由图可知,仪器①为长颈漏斗;仪器②为锥形瓶。
(2)高锰酸钾加热生成锰酸钾、二氧化锰和氧气,该反应为加热固体的反应,发生装置选A,氧气不易溶于水,若想制取纯净的氧气,收集装置选F,则装置组合为AF;
反应的化学方程式为。
(3)与装置B相比,装置C中的分液漏斗能控制液体的滴加速度,从而控制反应速率。
(4)氧气密度比空气大,应用向上排空气法收集,则气体应从a端通入;
氧气验满的方法为:将带火星的木条放在b口,若木条复燃,则说明已收集满。
(5)见答案。
24.解:设1千克氢气完全燃烧生成的水的物质的量为x
x=500mol
答:反应1千克的氢气生成的水的物质的量为500mol。
【详解】列化学方程式,利用氢气的质量计算氧气的量,过程见答案。
25.解:设样品中超氧化钾的质量分数为x
x=71%
答:样品中超氧化钾的质量分数为71%
【详解】见答案。
26.(1)9.6g
(2)2.5g
解:设氯酸钾的质量为x
x=24.5g
因氯酸钾和二氧化锰的混合物27g,所以二氧化锰质量为:27-24.5=2.5g
答:制得氧气质量为9.6g,原混合物中二氧化锰质量为2.5g。
【解析】(1)
根据质量守恒定律,生成氧气的质量=27g﹣17.4g=9.6g;
(2)
解析见答案。
一、单选题
1.(2022秋·河南平顶山·九年级统考期末)铜与稀盐酸、稀硫酸均不反应,但铜却能与稀硝酸发生反应:。下列说法正确的是
A.X的化学式为NO2
B.反应前后铜元素化合价从0变为+2
C.反应后原子的数目减少
D.参加反应的铜和生成的水的质量之比为32:9
2.(2022秋·河南新乡·九年级统考期末)2021年12月14日0时09分,我国在西昌卫星发射中心用长征三号乙运载火箭,成功将天链二号02星发射升空。该火箭推进器采用偏二甲肼(C2H8N2)与N2O4反应,该反应的化学方程式为:。下列说法不正确的是
A.X的化学式为CO2 B.生成N2和H2O的质量比为3:4
C.N2O4属于氧化物 D.偏二甲肼中碳的质量分数为40%
3.(2022秋·河南鹤壁·九年级统考期末)密闭容器内有a、b、c、d四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,下列说法不正确的是
物质 a b c d
反应前质量/g 1 20 15 2
反应后质量/g m 29 0 8
A.a可能是该反应催化剂
B.表中m的值为1
C.该反应是分解反应
D.若b与d的相对分子质量之比为2:l,则反应中b与d的化学计量数之比为4:3
4.(2022秋·河南周口·九年级统考期末)乙炔(C2H2)在氧气中燃烧生成二氧化碳和水,若生成8.8克二氧化碳,则需要乙炔质量为
A.1.3克 B.2.6克 C.3.9克 D.5.2克
5.(2022秋·河南周口·九年级统考期末)镁在空气中燃烧发生如下两个反应:,,已知12g镁在纯氧中燃烧得到20g产物,则12g镁在空气中完全燃烧所得产物的质量
A.大于20g B.小于20g C.等于20g D.大于、小于或等于20g
6.(2022秋·河南驻马店·九年级统考期末)相同质量的H2O2、KClO3和KMnO4与等质量MnO2混合,充分反应后,生成氧气的质量
A.H2O2最多,KMnO4最少 B.KClO3最多,H2O2最少
C.H2O2最多,KClO3最少 D.KMnO4最多,H2O2最少
7.(2022秋·河南驻马店·九年级统考期末)将10g的H2和O2的混合气体点燃并充分反应,发现还剩余1g O2,原混合气体中H2 和O2的质量比为( )
A.1:8 B.1:9 C.1:4 D.2:1
8.(2022秋·河南许昌·九年级期末)将一定质量的镁粉、铝粉和锌粉的混合物与足量的稀盐酸充分反应,生成0.2g氢气,则原金属混合物的质量不可能是
A.2.4g B.2.7g C.4.6g D.6.5g
9.(2022秋·河南焦作·九年级统考期末)一定质量的CaCO3样品高温煅烧,若样品分解了75.0%,则剩余固体中含Ca元素的质量分数为
A.53.3% B.71.4% C.59.7% D.34.6%
二、填空题
10.(2022秋·河南驻马店·九年级统考期末)“中国芯”是指由我国自主研发并生产制造的计算机处理芯片,芯片大多数使用的是丰富、廉价的硅元素。下图是用沙子制取硅的化学反应微观示意图。
该反应的化学方程式为 ,物质甲和乙的质量比是 。
11.(2022秋·河南南阳·九年级统考期末)“宏观辨识与微观探析”是化学核心素养之一。工业上用甲和乙两种物质在一定条件下反应生成丙和丁,反应的微观示意图如下所示。
(1)反应前后化合价没有变化的元素是 ;
(2)写出该反应的化学方程式 ;
(3)生成丙和丁的质量比为 。
12.(2022秋·河南平顶山·九年级统考期末)利用催化剂可消除室内装修材料释放的甲醛(CH2O),下图为该反应的微观示意图。
(1)图中属于单质的是 (填化学式)。
(2)写出该反应的化学方程式 。
(3)参加反应的乙和生成的丙的质量比为 。
13.(2022秋·河南周口·九年级统考期末)如图是某反应的微观示意图,图中的单质为 ;该反应前后化合价没有发生变化的元素为 ;生成物的质量比为 .
14.(2022秋·河南安阳·九年级校考期末)乙烯(C2H4)可用作催熟水果。一定质量的C2H4 在不充足的O2中燃烧,生成 CO,同时得到 8.8gCO2 和5.4gH2O,则参加反应的 C2H4的质量为 ;反应的化学方程式为 ;若乙烯完全燃烧生成CO2和H2O,则还需要氧气的质量为 。
15.(2022秋·河南许昌·九年级统考期末)浓盐酸和氯酸钾反应可以生成氯气(Cl2)、氯化钾和一种氧化物,则该反应的化学方程式为 ;现有氯酸钾和二氧化锰的混合物30g,加热至不再产生气体后,冷却、称量,得到20.4g固体,则混合物中二氧化锰的质量为 g。
三、简答题
16.(2022秋·河南许昌·九年级期末)下图是某一反应过程的微观示意图,回答下列问题:
(1)写出该反应的化学方程式。
(2)在反应中生成物的质量之比是多少?
17.(2022秋·河南驻马店·九年级统考期末)如图是氨气和氧气在一定条件下发生反应的微观示意图。
(1)写出该反应的化学方程式。
(2)该反应中生成物丙、丁的质量比是多少?
四、实验题
18.(2022秋·河南洛阳·九年级统考期末)下列装置常用于实验:
(1)写出仪器①的名称 。
(2)选用装置A制氧气的化学方程式为 。(答一种)
(3)用装置C收集氧气时,其验满的方法是 。
(4)装置B、D相连,可完成 (填分子式)的制备和收集,若用E装置收集满该气体后的操作是 。
(5)常言说“庄稼一枝花,全靠肥当家”,NH3是化肥工业的基础,已知NH3只能用上述D装置收集,试推测NH3的物理性质 、 。
(6)NH3和CO2在一定条件下反应生成尿素[CO(NH2)2]和水,打破了无机物和有机物的界限,具有划时代的意义。计算用该方法生产90t尿素所需NH3的质量(写出计算过程)。
19.(2022秋·河南信阳·九年级统考期末)下图是实验室制取气体的部分装置。
(1)写出仪器a的名称: 。
(2)B和C装置均可制取气体,其中C装置的优点是可以控制反应的开始和停止,简述其控制反应停止的原理: 。
(3)实验室若用B装置制取二氧化碳气体,请写出反应的化学方程式 。
(4)某化学小组要用加热固体氯化铵和固体熟石灰的混合物制取氨气,已知氨气(NH3)极易溶于水,那么该化学小组应选择的发生装置是 ;若使用D装置收集氨气,则应该从 导管通入氨气。
(5)金属材料一般是指纯金属或合金。铁容易生锈,实际上是铁与空气中的 发生反应。而合金是在各行业中使用最多的材料之一,与组成合金的金属单质相比,合金的优良特性主要是 (任写一点即可)。
(6)化学小组准备测定某黄铜片样品中铜的质量分数,将10g铜锌合金放入烧杯,加入50g稀硫酸,恰好完全反应,测得烧杯内剩余物质质量为59.8g,求该合金中铜的质量分数。
20.(2022秋·河南安阳·九年级校考期末)如图是实验室制取氧气的部分装置。
(1)仪器X的名称是 ,若用A装置制取氧气,选用的药品为两种固体物质,写出反应的化学方程式 。
(2)C装置与B装置相比,优点是 。
(3)D装置可用于收集氧气,若用排空气法收集,气体应从 (填“a”或“b”)端进入,验证氧气已收集满的操作是 ;若用排水法收集,需先 ,气体应从 (填“a”或“b”)端进入。
(4)实验室用16g大理石和100g稀盐酸放到容器中反应制取二氧化碳气体,二者恰好完全反应,待反应完全后,称的容器内的物质质量为111.6g。求大理石中碳酸钙的质量分数 。
五、综合应用题
21.(2022秋·河南平顶山·九年级统考期末)某兴趣小组利用下列所示的仪器进行实验并探究。
(1)实验室用氯酸钾和为原料制氧气,反应的化学方程式为 ,若要收集到干燥的氧气,则收集装置为 (从A~E中选择)。
(2)若用溶液和来制氧气,应选用的发生装置是 (从A~E中选择)。为了证明的催化作用,甲同学通过以下装置来进行实验探究:图1中加入溶液,然后塞入带火星木条的橡胶塞,如图2所示,观察到的现象是 。再通过漏斗加入,如图3所示,此时观察到的现象是 。充分反应后,将图3的混合液进行过滤、洗涤、干燥、称量,固体仍为,甲同学认为是催化剂。
(3)乙同学认为甲同学的结论不严谨,请你帮乙同学说出理由: 。
(4) (填“能”或“否”)用图4来探究铁在氧气中的燃烧实验。
(5)我国神舟十三号乘组航天员将志刚、王亚平、叶光富已完成太空任务返回地球。航天飞行器座舱的空气更新过程如图所示:
假设一个成年人每天呼吸大约需氧气0.64千克,三名航天员在太空呼吸所需氧气都来自装置(Ⅲ)中水的电解,则为供给他们在太空3个月呼吸所需氧气(每月按30天计),理论上一共电解的水至少有多少千克?
22.(2022秋·河南漯河·九年级统考期末)下图装置常用于实验室制取气体。
(1)仪器①的名称是 。
(2)用装置甲制取氧气,采用该收集方法的依据是 ;检验集气瓶中已经充满氧气的方法是 ;发生反应需要的催化剂是 。
(3)用装置乙制取气体,实验结束时,为防止水槽里的水倒流,应采取的操作是 。
(4)在加热条件下,用醋酸钠(CH3COONa)固体与碱石灰中氢氧化钠反应制取甲烷,同时生成碳酸钠,应选用的装置是 (填“甲”或“乙”),反应的化学方程式为 。
(5)取氯酸钾和二氧化锰的混合物13g,用乙装置加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为8.2g,计算:
①生成氧气的质量是 。
②原混合物中氯酸钾的质量是 。
23.(2022秋·河南新乡·九年级统考期末)下图是实验室制取气体的常用装置。
(1)写出图中的仪器名称:① ② 。
(2)请组合一套用高锰酸钾制取纯净的氧气的装置 (用字母表示),并写出该反应的化学方程式 。
(3)实验室制取CO2的发生装置可选择B或C,与B相比较,C的主要优点是什么 。
(4)下所示装置可用于收集氧气,若用排空气法收集,气体应从 (填“a”或“b”)端进入,验证氧气已收集满的操作是 。
(5)取10.0g石灰石样品,加入100.0g的稀盐酸,反应结束后烧杯内物质的总质量为107.8g,请计算该石灰石样品中碳酸钙的质量。
六、计算题
24.(2022秋·河南郑州·九年级期末)上海世博会上,燃料电池观光车,靠氢气和氧气反应提供能源,由于只生成水,真正实现了“零排放”.若有1千克氢气反应,生成水的物质的量为多少摩尔?(写出计算过程)
25.(2022秋·河南新乡·九年级统考期末)“化学氧自救呼吸器”是一种在缺氧环境中通过制氧剂临时供氧的装置。制氧剂的主要成分是超氧化钾(),产生氧气的主要原理是超氧化钾与人体呼出的水汽反应,其化学方程式为:4KO2+2H2O=4KOH+3O2↑。若呼吸器中装有200g样品,完全反应后能为使用者提供48g氧气。求样品中超氧化钾的质量分数。
26.(2022秋·河南郑州·九年级期末)利用化学方程式计算:实验室通过加热分解氯酸钾固体的方法制备氧气.现有氯酸钾和二氧化锰的混合物27g,加热至质量不再减少,测得剩余固体的质量为17.4g。求:
(1)制得氧气的质量为 ?
(2)原混合物中二氧化锰的质量为 ?
参考答案:
1.B
【详解】A、反应前后铜原子都是3个,氢原子都是8个,反应前氮原子是8个,反应后应该是8个,其中2个包含在未知物质中,反应前氧原子是24个,反应后应该是24个,其中2个包含在未知物质中,X的化学式为NO,该选项说法不正确;
B、反应前铜单质中铜的化合价是0价,反应后硝酸铜中铜元素化合价是+2价,该选项说法正确;
C、在化学变化中原子的数目、种类和质量不变,该选项说法不正确;
D、根据方程式参加反应的铜和生成的水的质量之比为=24:9,该选项说法不正确;
故选:B。
2.B
【详解】A、根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含C、H、N、O的个数分别是2、8、6、8,生成物中含C、H、N、O的个数分别是0、8、6、4,故生成物中还应含2个C、4个O,故X的化学式为CO2,不符合题意;
B、生成氮气和水的质量比为:(28×3):(18×4)=7:6,符合题意;
C、四氧化二氮是由N、O元素组成的化合物,属于氧化物,不符合题意;
D、偏二甲肼中碳的质量分数为:,不符合题意。
故选B。
3.D
【详解】A、根据质量守恒定律,反应后a的质量为:,即在反应前后a的质量没有改变,a在该反应前后质量没有改变,可能是催化剂,也可能是杂质,与反应无关,若确定其是否为催化剂,还需要检验其在该反应前后的化学性质是否改变和其是否改变了该反应的反应速率,故A选项正确;
B、由A中分析可知,表中m的值为1,故B选项正确;
C、根据表中数据可知,反应后b和d的质量增加了,c的质量减小了,即c反应后生成b和d,一种物质反应生成两种物质,属于分解反应,故C选项正确;
D、根据表中数据可知,该反应中b和d的质量比为:,设b和d的化学计量数之比为,则有,则,故D选项错误;
故选D。
4.B
【详解】乙炔燃烧生成二氧化碳和水,反应的化学方程式为2C2H2+5O24CO2+2H2O;设生成8.8克二氧化碳,需要乙炔质量为x,则
x=2.6g
故选B。
5.B
【详解】氧化镁中镁、氧元素的质量比为24:16=3:2,氮化镁中镁、氧元素的质量比为(24×3):(14×2)=18:7,即说明等质量的镁完全与氧气反应生成氧化镁的质量要比完全与氮气反应生成的氮化镁的质量要多,已知12g镁在纯氧中燃烧得到20g产物,而在空气中燃烧时,部分镁会与氮气反应生成氮化镁,故12g镁在空气中完全燃烧所得产物的质量要小于20g。即选B。
【点睛:】
6.A
【详解】解:设过氧化氢、氯酸钾、高锰酸钾的质量均为m
过氧化氢完全分解生成氧气的质量为:
综上所述:过氧化氢最多,高锰酸钾最少。
选择A。
7.B
【分析】氢气在氧气中点燃生成水。
【详解】由于剩余1g的氧气,所以生成的水的质量为
设氢气的质量为x
则原混合气体中H2和O2的质量比为
故选B。
【点睛】根据质量守恒定律,反应物的总质量等于生成物的总质量,剩余1g的氧气,所以生成的水的质量为。
8.D
【详解】解:设生成0.2g氢气时需要铝的质量是x,锌的质量是y,镁的质量为z,
,解得x=1.8g
,解得y=6.5g
,解得z=2.4g
所以原混合物质量范围是大于1.8g,小于6.5g,而2.4g 、2.7g、 4.6g都在该范围内,所以金属混合物的质量不可能是6.5g;
故选D。
【点睛】解题的关键是要分析清楚要使金属混合物跟足量稀硫酸反应生成0.2g氢气,所需的金属质量的取值范围,主要是采用极端假设的方法完成。
9.C
【分析】假设样品的质量为100g,根据分解情况可以求解分解的碳酸钙的质量,计算生成二氧化碳的质量,进一步计算剩余固体中含Ca元素的质量分数。
【详解】解:设样品的质量为100g,则样品中Ca元素的质量为;
分解的碳酸钙的质量为100g×75.0%=75.0g。
设生成的二氧化碳的质量为x。
则剩余国体中含Ca元素的质量分数为;
故选C
【点睛】本题考查学生对化学方程式的计算、化合物中某元素的质量与质量分数计算方法的掌握与应用的能力。
10. 5:2
【详解】图中所示的反应是,二氧化硅与碳单质反应,生成硅单质、一氧化碳,反应的化学方程式为:,物质甲是二氧化硅,物质乙是碳单质,根据化学方程式可知,。
11.(1)氢元素/H
(2)
(3)27:14
【分析】由反应的微观示意图可知,氨分子和氧分子在一定条件下生成氮分子和水分子,;
【详解】(1)反应前氨气中氮元素的化合价是-3价,氢元素的化合价是+1价,氧气中氧元素的化合价是0价,反应后水中氢元素的化合价为+1价,氧元素的化合价为-2价,氮气中氮元素的化合价是0价,则反应前后化合价没有变化的元素是氢元素。
(2)氨气和氧气在一定条件下反应生成水和氮气,反应的化学方程式为。
(3)由化学方程式可知,生成丙和丁的质量比为(6×18):(2×28)=27:14。
12.(1)O2
(2)
(3)8∶11
【分析】根据微观示意图可知,甲为CH2O,乙为O2,丙为CO2,丁为H2O;
【详解】(1)根据上述分析,属于单质是O2;
(2)甲醛和氧气反应生成二氧化碳和水,化学方程式为:;
(3)根据化学方程式,乙和丙的质量比为32:44=8:11。
13. 氮气 氧元素 22:7
【详解】由化学反应的微观示意图可知,该反应是一氧化碳和一氧化氮在一定条件下反应生成了二氧化碳和氮气,反应的方程式是:2NO+2CO2CO2+N2。由方程式可知,单质为氮气;由反应的方程式可知,氮元素的化合价由+2价变为0价,碳元素的化合价由+2价变为+4价,氧元素的化合价在反应前后没有发生改变;由反应的方程式可知,生成物二氧化碳和氮气的质量比为:[2×(12+16×2)]:(14×2)=22:7。
14. 4.2g 3C2H4+8O24CO2+2CO+6H2O 1.6g
【分析】一定质量的C2H4 在不充足的O2中燃烧,生成 CO,同时得到 8.8gCO2 和5.4gH2O,可以根据氢原子守恒,用H2O的质量计算C2H4的质量,然后根据质量比求出计量数之比,写出化学方程式;乙烯完全燃烧只生成CO2和H2O,此时消耗的氧气的质量和不完全燃烧消耗氧气的质量相比较,二者之差即为乙烯完全燃烧还需要的氧气的质量。
【详解】根据分析,因为C2H4→2H2O,设参加反应的C2H4的质量为x,则
根据4.2gC2H4生成的8.8gCO2 和5.4gH2O,三者的个数比为,故C2H4不完全燃烧的化学方程式为3C2H4+8O24CO2+2CO+6H2O;
设不完全燃烧消耗氧气的质量为y,则
乙烯完全燃烧的化学方程式为C2H4+3O22CO2+2H2O;
设完全燃烧消耗的氧气的质量为z,则
故还需要氧气的质量为14.4g-12.8g=1.6g。
15. 5.5
【详解】根据质量守恒定律可知,化学反应前后元素的种类不变,在浓盐酸和氯酸钾的反应中反应前含有H、Cl、K、O四种元素,反应后含有Cl、K两种元素,则该氧化物中一定含H元素,故该氧化物为H2O,该反应的化学方程式为6HCl(浓)+KClO3=3H2O+KCl+3Cl2↑;
设原混合物中氯酸钾的质量为x
x=24.5g
则原混合固体中二氧化锰的质量为30g-24.5g=5.5g。
【点睛】本题主要考查质量守恒定律以及化学方程式的书写和计算的内容。
16.(1)
(2)根据反应方程式可知,生成物氮气与二氧化碳的质量比为(14×2):2×(12+16×2)=7:22
答:在反应中生成物氮气与二氧化碳的质量比为7:22。
【详解】(1)由微观示意图可知,该反应为一氧化碳与一氧化氮造催化剂的作用下反应生成氮气和二氧化碳,该反应方程式为:;
(2)见答案。
17.(1)
(2)(30×4):(18×6)=10:9
【详解】(1)甲为NH3,乙为O2,丙为NO,丁为H2O,反应的化学方程式为;
(2)依据反应方程式,丙和丁的质量比为(30×4):(18×6)=10:9。
18.(1)集气瓶
(2)
(3)将带火星的木条置于集气瓶口,若木条复燃,则已满
(4) H2 先将导管移出水槽,用玻璃片盖住集气瓶口,小心移出水面,倒放在实验台上
(5) NH3密度比空气小 易溶于水
(6)解:设用该方法生产90t尿素所需NH3的质量为
=51t
答:用该方法生产90t尿素所需NH3的质量为51t
【详解】(1)仪器①是集气瓶;
(2)装置A适用于固体加热反应制取气体,且试管口有一团棉花,适用于加热高锰酸钾制取氧气,高锰酸钾在加热的条件下反应生成锰酸钾、二氧化锰和氧气,反应的化学方程式为;
(3)用装置C收集氧气时,氧气具有助燃性,其验满的方法是将带火星的木条置于集气瓶口,若木条复燃,则已满;
(4)装置B适合反应物为固体和液体,反应条件是常温的气体的制取,装置D适合密度比空气小的气体的收集,装置B、D相连,可完成H2的制备和收集,若用E装置收集满该气体后的操作是先将导管移出水槽,用玻璃片盖住集气瓶口,小心移出水面,倒放在实验台上;
(5)装置D适合密度比空气小的气体的收集,NH3只能用D装置收集,说明NH3的密度比空气小,易溶于水;
(6)见答案。
19.(1)长颈漏斗
(2)当关闭弹簧夹时,产生的气体无法排出,使试管内气压增大,将液体压回到长颈漏斗,使液面降到多孔塑料隔板以下,固液分离,反应停止
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑
(4) A b
(5) 氧气和水蒸气(或O2和H2O) 熔点低、硬度大、耐腐蚀
(6)解:根据质量守恒定律,生成氢气的质量为10g+50g-59.8g=0.2g,
设该合金中锌的质量为x,
x=6.5g
则该合金中铜的质量分数为,
答:该合金中铜的质量分数为35%。
【详解】(1)a为长颈漏斗;
(2)B和C装置均可制取气体,其中C装置的优点是可以控制反应的开始和停止,其控制反应停止的原理是当关闭弹簧夹时,产生的气体无法排出,使试管内气压增大,将液体压回到长颈漏斗,使液面降到多孔塑料隔板以下,固液分离,反应停止;
(3)实验室若用B装置制取二氧化碳气体,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,该反应的化学方程式为;
(4)用加热固体氯化铵和固体熟石灰的混合物制取氨气,该反应为固固加热型,发生装置可选择A;由于氨气密度比空气密度小,若使用D装置收集氨气,则应该从短管b导管通入氨气;
(5)铁容易生锈,实际上是铁与空气中的氧气和水蒸气发生反应;
而合金是在各行业中使用最多的材料之一,与组成合金的金属单质相比,合金的优良特性主要是熔点低、硬度大、耐腐蚀;
(6)见答案。
20.(1) 酒精灯 2KClO32KCl+3O2↑
(2)通过控制液体的滴加量和滴加速率来控制化学反应
(3) a 将带火星的小木条放在b导管口,若小木条复燃,则氧气已经收集满 将集气瓶装满水 b
(4)62.5%
【分析】本题考查了氧气的发生装置和收集装置,以及溶液中有关化学方程式的计算问题。
(1)
根据常见化学仪器的名称判断,X的名称为酒精灯;选用两种固体药品制取氧气,即选择氯酸钾和二氧化锰加热制取氧气,氯酸钾在二氧化锰的催化下受热分解生成氯化钾和氧气,该反应的化学方程式为2KClO3 2KCl+3O2↑;
(2)
C装置中用到了分液漏斗,和B装置相比,优点是可以通过控制液体的滴加量和滴加速率来控制反应速率;
(3)
D装置为“万用瓶”。由于氧气的密度大于空气的密度,应用向上排空气法收集,故气体应从a端进入;
氧气具有助燃性,验证氧气已收集满的操作是将带火星的小木条放在b导管口,若小木条复燃,则氧气已经收集满;
若用排水法收集氧气,首先应将集气瓶装满水,氧气的密度比水小,然后气体应从b端进入;
(4)
解:设大理石中碳酸钙的质量为x,反应中生成的二氧化碳质量=16g+100g-111.6g=4.4g,则由,则大理石中碳酸钙的质量分数为。
【点睛】“万用瓶”有多种用途。当用于向上排空气法收集气体时,瓶体正放,气体应“长进短出”;当用于向下排空气法收集气体时,瓶体正放,气体应“短进长出”;当用于排水法收集气体时,首先瓶中装满水,然后气体“短进长出”;当用作洗气瓶时,气体必须“长进短出”。
21.(1) D
(2) A 木条不复燃 产生大量气泡,木条复燃
(3)未证明的化学性质也保持不变(合理即可)
(4)能
(5)解:三个宇航员三个月呼吸氧气质量为:
设理论上一共电解水的质量至少为x
答:理论上一共电解的水至少有194.4千克。
【详解】(1)氯酸钾在二氧化锰的催化下加热分解生成氯化钾和氧气,该反应的化学方程式为:;
氧气密度比空气大,可选择向上排空气法收集,氧气不易溶于水,可选择排水法收集,而向上排空气法收集的氧气较排水法干燥,故若要收集到干燥的氧气,则收集装置为D向上排空气法;
(2)若用 H2O2 溶液和 MnO2 来制氧气,该反应为固液常温型,应选用的发生装置是A;
为了证明 MnO2 的催化作用,图1中加入 amLH2O2 溶液,然后塞入带火星木条的橡胶塞,如图2所示,观察到木条不复燃。再通过漏斗加入 bgMnO2 ,如图3所示,此时观察到产生大量气泡,木条复燃,即可说明二氧化锰可以加快过氧化氢分解;
(3)根据催化剂的特点是能改变化学反应的速率,而本身的质量和化学性质在反应前后不变,所以甲同学的结论不严谨,因为未证明 MnO2 的化学性质在反应前后也保持不变;
(4)图4中集气瓶底有少量细沙,可以防止生成的高温熔融物溅落炸裂集气瓶底,能用图4来探究铁在氧气中的燃烧实验;
(5)见答案。
22.(1)长颈漏斗
(2) 氧气密度比空气大 将带火星的木条放在集气瓶口,木条复燃说明氧气已充满 /二氧化锰
(3)先移出导管,再熄灭酒精灯
(4) 乙
(5) 生成氧气的质量是13g-8.2g=4.8g
答:生成氧气的质量是4.8g。 解:设原混合物中氯酸钾的质量为。
解得
答:混合物中氯酸钾的质量为12.25g。
【详解】(1)仪器①的名称是长颈漏斗。
(2)因氧气的密度大于空气,所以装置甲中收集装置为向上排空气法;检验集气瓶中已经充满氧气的方法是将带火星的木条放在集气瓶口,木条复燃说明氧气已充满;该装置制取氧气的反应是过氧化氢在二氧化锰的催化作用下反应生成水和氧气,所以反应需要的催化剂为。
(3)为防止水槽里的水倒流,应采取的操作是先移出导管,再熄灭酒精灯;
(4)反应物醋酸钠和碱石灰都是固体,反应条件是加热,所以应选用的装置是乙;醋酸钠和碱石灰在加热条件下反应生成甲烷和碳酸钠,所以反应方程式为。
(5)详解见答案。
23.(1) 长颈漏斗 锥形瓶
(2) AF/FA
(3)控制反应速率
(4) a 将带火星的木条放在b口,若木条复燃,则说明已收集满
(5)根据质量守恒,可知生成的二氧化碳的质量为10g+100g-107.8g=2.2g,设石灰石样品中碳酸钙的质量为x,则
解得x=5g
答:该石灰石样品中碳酸钙的质量为5g。
【详解】(1)由图可知,仪器①为长颈漏斗;仪器②为锥形瓶。
(2)高锰酸钾加热生成锰酸钾、二氧化锰和氧气,该反应为加热固体的反应,发生装置选A,氧气不易溶于水,若想制取纯净的氧气,收集装置选F,则装置组合为AF;
反应的化学方程式为。
(3)与装置B相比,装置C中的分液漏斗能控制液体的滴加速度,从而控制反应速率。
(4)氧气密度比空气大,应用向上排空气法收集,则气体应从a端通入;
氧气验满的方法为:将带火星的木条放在b口,若木条复燃,则说明已收集满。
(5)见答案。
24.解:设1千克氢气完全燃烧生成的水的物质的量为x
x=500mol
答:反应1千克的氢气生成的水的物质的量为500mol。
【详解】列化学方程式,利用氢气的质量计算氧气的量,过程见答案。
25.解:设样品中超氧化钾的质量分数为x
x=71%
答:样品中超氧化钾的质量分数为71%
【详解】见答案。
26.(1)9.6g
(2)2.5g
解:设氯酸钾的质量为x
x=24.5g
因氯酸钾和二氧化锰的混合物27g,所以二氧化锰质量为:27-24.5=2.5g
答:制得氧气质量为9.6g,原混合物中二氧化锰质量为2.5g。
【解析】(1)
根据质量守恒定律,生成氧气的质量=27g﹣17.4g=9.6g;
(2)
解析见答案。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
