第九单元 课题3 溶液的浓度 同步练习(含解析) 2022-2023学年上学期河南省九年级化学期末试题选编
文档属性
| 名称 | 第九单元 课题3 溶液的浓度 同步练习(含解析) 2022-2023学年上学期河南省九年级化学期末试题选编 |

|
|
| 格式 | docx | ||
| 文件大小 | 647.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-21 00:00:00 | ||
图片预览

文档简介
第九单元 课题3 溶液的浓度 同步练习
一、单选题
1.(2022秋·河南商丘·九年级统考期末)已知某甲醛(HCHO)的水溶液中,氢元素的质量分数为10%,则溶液中甲醛的质量分数是
A.10% B.15% C.20% D.25%
2.(2022秋·河南郑州·九年级统考期末)60℃时,向100g水中加入一定量KNO3固体形成溶液,再降温至20℃,析出固体质量的变化如图1所示,结合图2,下列说法正确的是
A.加入的KNO3质量为41.6g
B.降温过程中KNO3溶液始终为饱和溶液
C.20℃时,向所得饱和溶液中加入100g水溶质质量分数减小一半
D.20℃时,100gKNO3饱和溶液中有31.6gKNO3
3.(2022秋·河南濮阳·九年级校考期末)溶液加水稀释前后,溶液中保持不变的是
A.溶液中溶质质量分数 B.溶液的质量
C.溶质的质量 D.溶剂的质量
4.(2022秋·河南南阳·九年级统考期末)用氯化钠固体和蒸馏水配制100g10%的氯化钠溶液,不需要的仪器是
A.玻璃棒 B.蒸发皿 C.烧杯 D.托盘天平
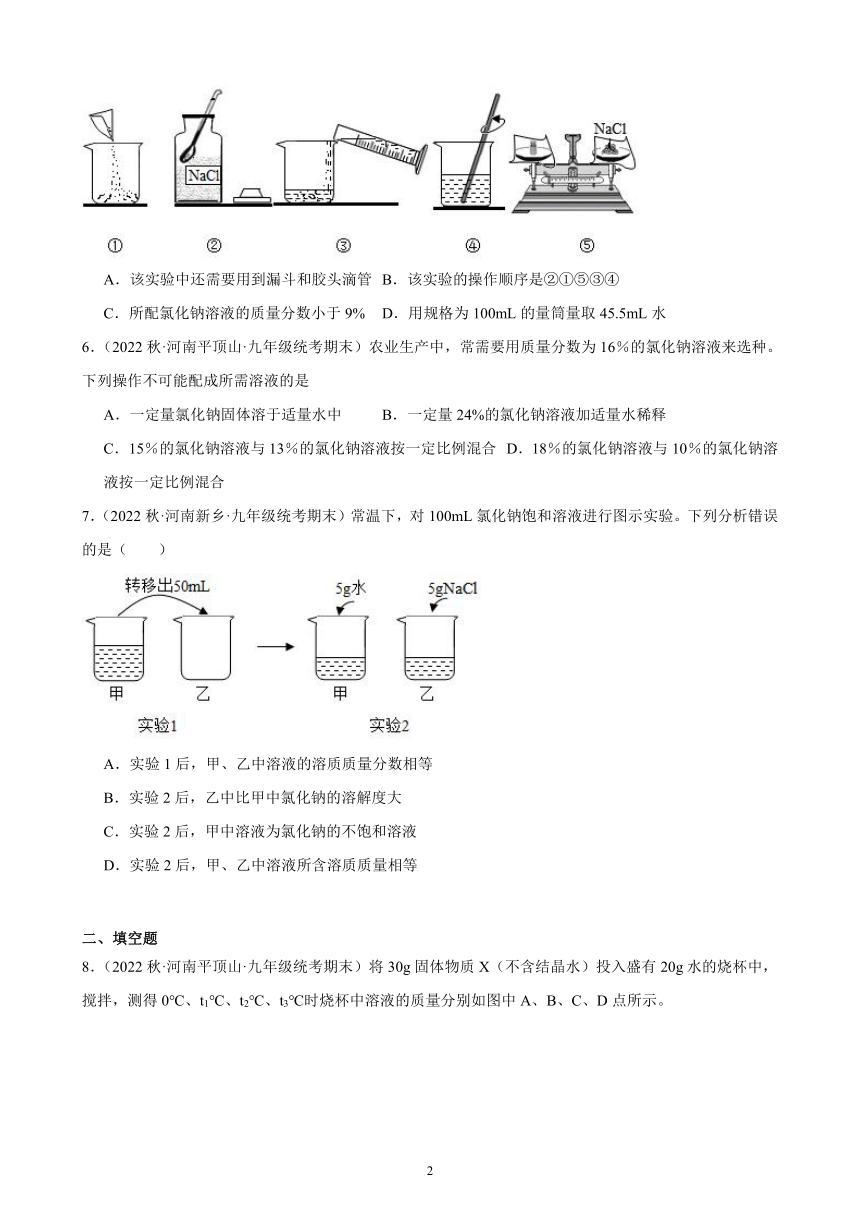
5.(2022秋·河南信阳·九年级统考期末)实验室配制50g质量分数为9%的氯化钠溶液,实验操作如图所示。下列说法正确的是
A.该实验中还需要用到漏斗和胶头滴管 B.该实验的操作顺序是②①⑤③④
C.所配氯化钠溶液的质量分数小于9% D.用规格为100mL的量筒量取45.5mL水
6.(2022秋·河南平顶山·九年级统考期末)农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。下列操作不可能配成所需溶液的是
A.一定量氯化钠固体溶于适量水中 B.一定量24%的氯化钠溶液加适量水稀释
C.15%的氯化钠溶液与13%的氯化钠溶液按一定比例混合 D.18%的氯化钠溶液与10%的氯化钠溶液按一定比例混合
7.(2022秋·河南新乡·九年级统考期末)常温下,对100mL氯化钠饱和溶液进行图示实验。下列分析错误的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲、乙中溶液所含溶质质量相等
二、填空题
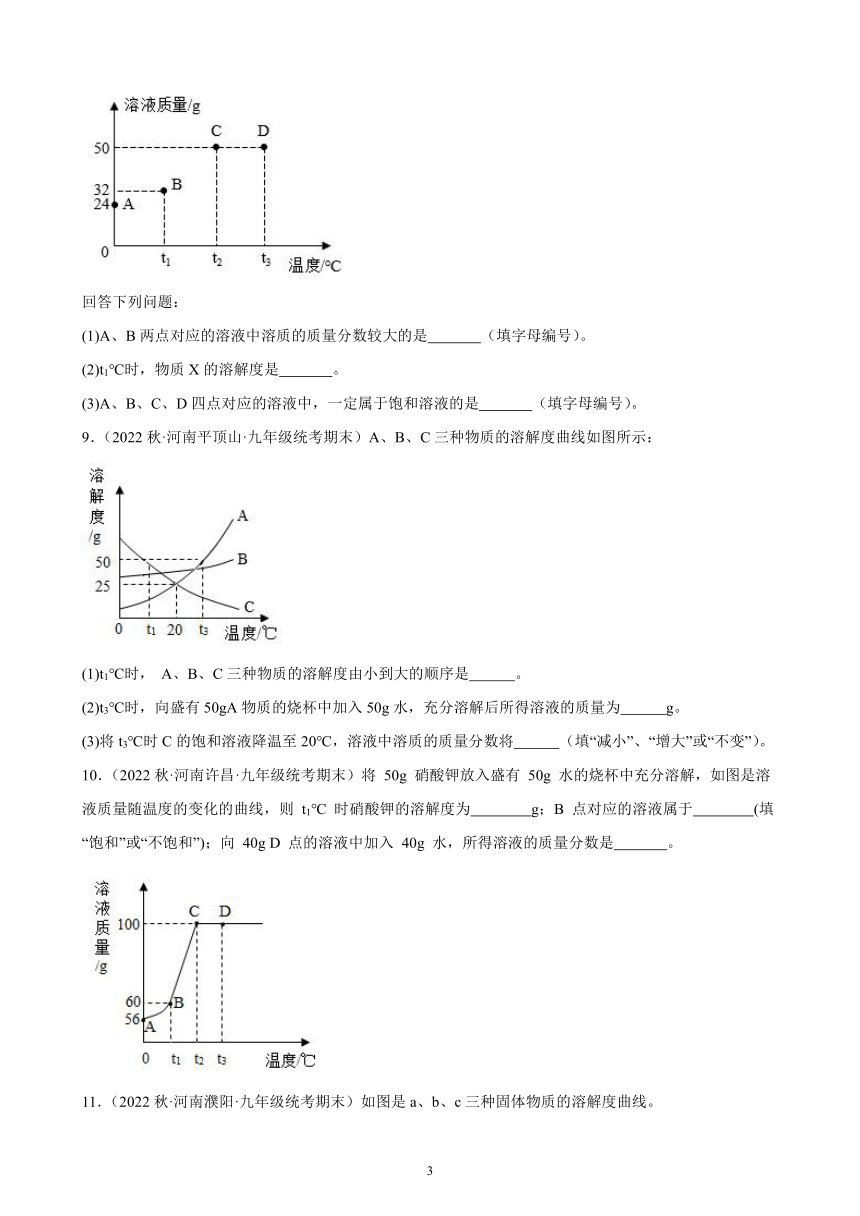
8.(2022秋·河南平顶山·九年级统考期末)将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得0℃、t1℃、t2℃、t3℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。
回答下列问题:
(1)A、B两点对应的溶液中溶质的质量分数较大的是 (填字母编号)。
(2)t1℃时,物质X的溶解度是 。
(3)A、B、C、D四点对应的溶液中,一定属于饱和溶液的是 (填字母编号)。
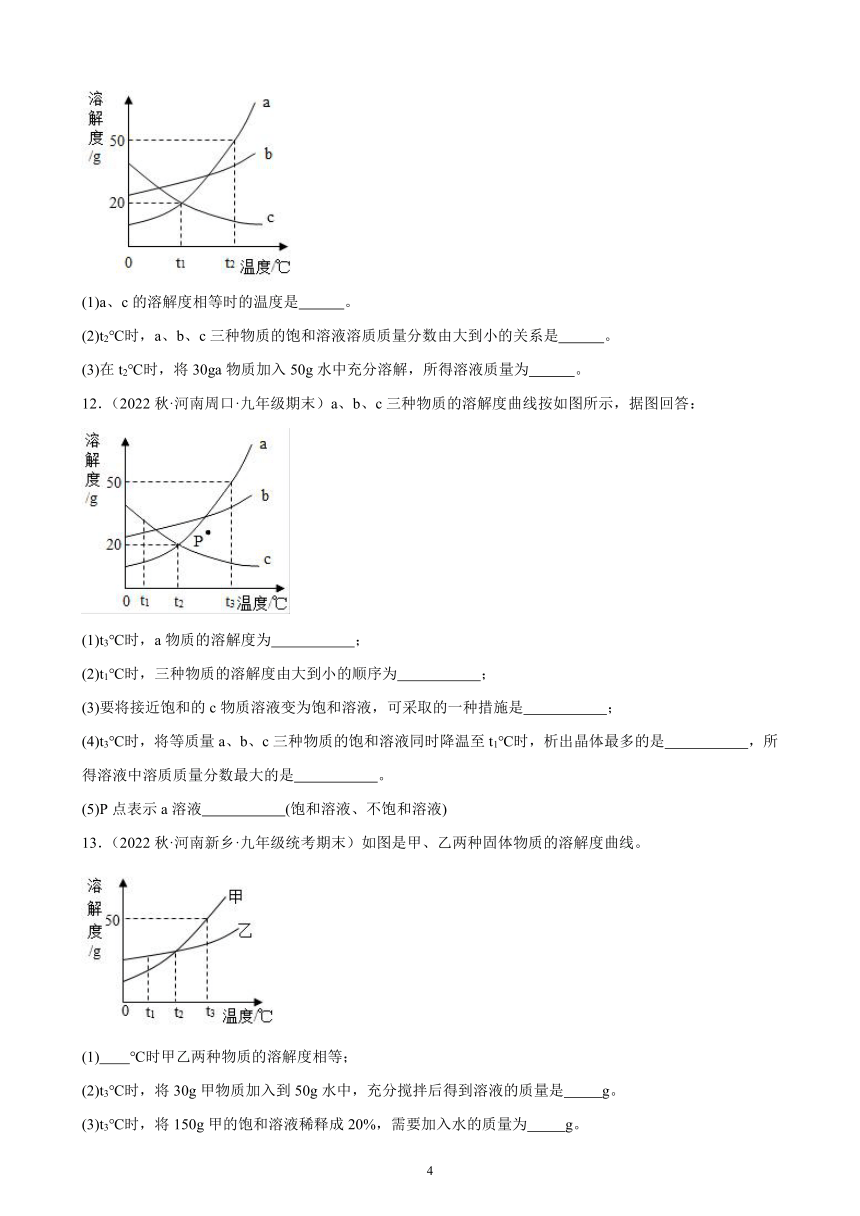
9.(2022秋·河南平顶山·九年级统考期末)A、B、C三种物质的溶解度曲线如图所示:
(1)t1℃时, A、B、C三种物质的溶解度由小到大的顺序是 。
(2)t3℃时,向盛有50gA物质的烧杯中加入50g水,充分溶解后所得溶液的质量为 g。
(3)将t3℃时C的饱和溶液降温至20℃,溶液中溶质的质量分数将 (填“减小”、“增大”或“不变”)。
10.(2022秋·河南许昌·九年级统考期末)将 50g 硝酸钾放入盛有 50g 水的烧杯中充分溶解,如图是溶液质量随温度的变化的曲线,则 t1℃ 时硝酸钾的溶解度为 g;B 点对应的溶液属于 (填“饱和”或“不饱和”);向 40g D 点的溶液中加入 40g 水,所得溶液的质量分数是 。
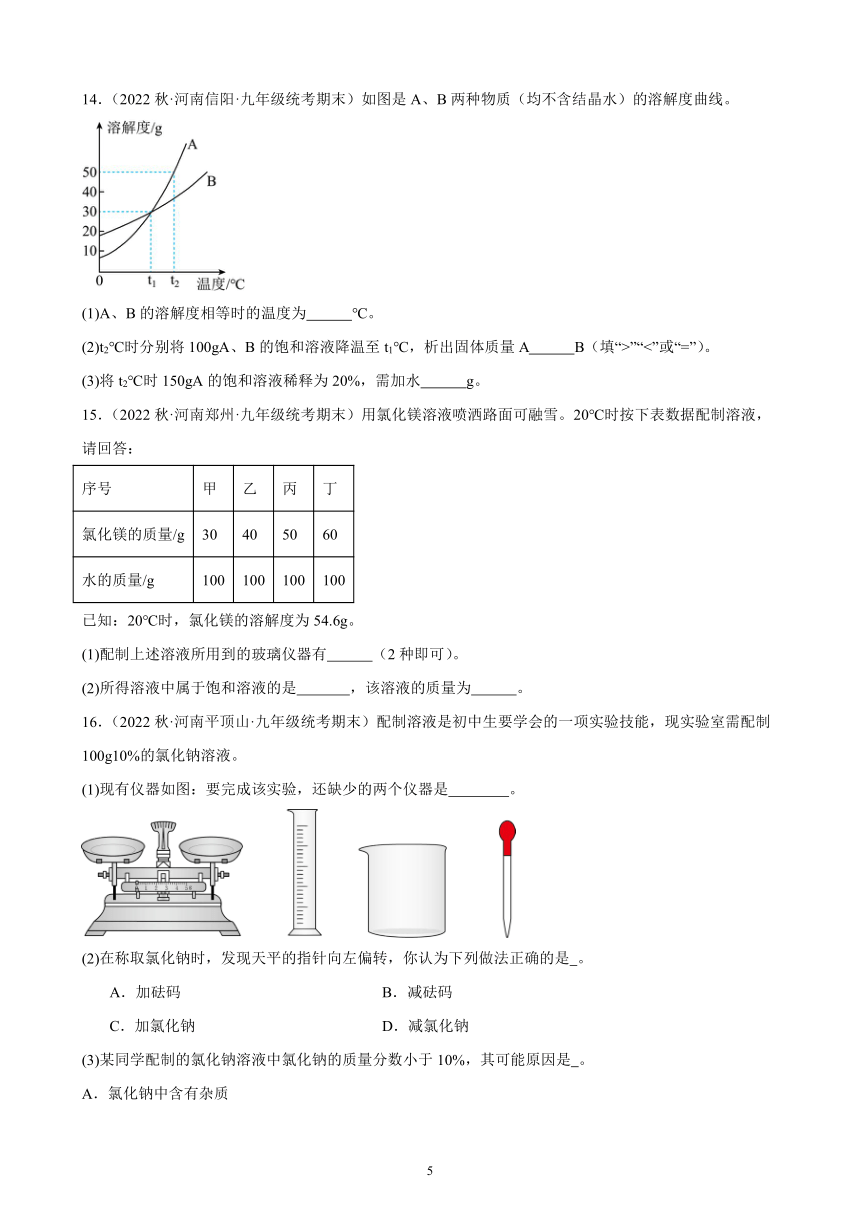
11.(2022秋·河南濮阳·九年级统考期末)如图是a、b、c三种固体物质的溶解度曲线。
(1)a、c的溶解度相等时的温度是 。
(2)t2℃时,a、b、c三种物质的饱和溶液溶质质量分数由大到小的关系是 。
(3)在t2℃时,将30ga物质加入50g水中充分溶解,所得溶液质量为 。
12.(2022秋·河南周口·九年级期末)a、b、c三种物质的溶解度曲线按如图所示,据图回答:
(1)t3℃时,a物质的溶解度为 ;
(2)t1℃时,三种物质的溶解度由大到小的顺序为 ;
(3)要将接近饱和的c物质溶液变为饱和溶液,可采取的一种措施是 ;
(4)t3℃时,将等质量a、b、c三种物质的饱和溶液同时降温至t1℃时,析出晶体最多的是 ,所得溶液中溶质质量分数最大的是 。
(5)P点表示a溶液 (饱和溶液、不饱和溶液)
13.(2022秋·河南新乡·九年级统考期末)如图是甲、乙两种固体物质的溶解度曲线。
(1) ℃时甲乙两种物质的溶解度相等;
(2)t3℃时,将30g甲物质加入到50g水中,充分搅拌后得到溶液的质量是 g。
(3)t3℃时,将150g甲的饱和溶液稀释成20%,需要加入水的质量为 g。
14.(2022秋·河南信阳·九年级统考期末)如图是A、B两种物质(均不含结晶水)的溶解度曲线。
(1)A、B的溶解度相等时的温度为 ℃。
(2)t2℃时分别将100gA、B的饱和溶液降温至t1℃,析出固体质量A B(填“>”“<”或“=”)。
(3)将t2℃时150gA的饱和溶液稀释为20%,需加水 g。
15.(2022秋·河南郑州·九年级统考期末)用氯化镁溶液喷洒路面可融雪。20℃时按下表数据配制溶液,请回答:
序号 甲 乙 丙 丁
氯化镁的质量/g 30 40 50 60
水的质量/g 100 100 100 100
已知:20℃时,氯化镁的溶解度为54.6g。
(1)配制上述溶液所用到的玻璃仪器有 (2种即可)。
(2)所得溶液中属于饱和溶液的是 ,该溶液的质量为 。
16.(2022秋·河南平顶山·九年级统考期末)配制溶液是初中生要学会的一项实验技能,现实验室需配制100g10%的氯化钠溶液。
(1)现有仪器如图:要完成该实验,还缺少的两个仪器是 。
(2)在称取氯化钠时,发现天平的指针向左偏转,你认为下列做法正确的是 。
A.加砝码 B.减砝码
C.加氯化钠 D.减氯化钠
(3)某同学配制的氯化钠溶液中氯化钠的质量分数小于10%,其可能原因是 。
A.氯化钠中含有杂质
B.称量物与码放反了
C.配制时有少量氯化钠洒落在烧杯外面
D.量水时仰视读数
17.(2022秋·河南南阳·九年级统考期末)用MgCl2溶液喷洒路面可融雪、防尘。20℃时,按下表数据配制溶液,回答问题。
序号 ① ② ③ ④
MgCl2的质量/g 30 40 50 60
水质量/g 100 100 100 100
(已知:20℃时,MgCl2的溶解度约为55g)。
(1)所得溶液中,溶质与溶剂的质量比为1:2的是(填序号) ;
(2)①中溶质的质量分数约为 (保留一位小数);
(3)所得溶液中,属于饱和溶液的是(填序号) 。
三、简答题
18.(2022秋·河南许昌·九年级统考期末)甲、乙、丙三种固体物质的溶解度曲线如图所示,按要求填空。
(1)在 ℃时,甲和丙的溶解度相等。
(2)t1℃时,将乙溶液的状态由M点变为N点,方法是 。
(3)t3℃时,将40g甲放入50g水中,充分溶解后所得溶液的溶质质量分数为 。
19.(2022秋·河南许昌·九年级统考期末)一定质量分数溶液的配制是初中化学重要的探究实验。某化学兴趣小组用氯化钠配制50g溶质质量分数为6%的氯化钠溶液。
(1)现有以下操作:①溶解、②称取氯化钠、③过滤、④量取水、⑤计算。请从以上操作中选出正确的操作顺序是 。
(2)若其它操作正确,量取水时仰视量筒读数,对结果会造成什么影响?
(3)用已配好的50g溶质质量分数为6%的氯化钠溶液,配制溶质质量分数为3%的氯化钠溶液,需要加水的质量为 g。
四、实验题
20.(2022秋·河南平顶山·九年级统考期末)以下是实验室配制一定溶质质量分数的氯化钠溶液的流程示意图 请根据示意图回答:
(1)托盘天平左盘中固体氯化钠的质量为 g,量筒中水的体积为 mL;
(2)称量氯化钠固体时,若氯化钠固体与砝码放反,所配制溶液的溶质质量分数 (填“偏大”“偏小”或“不变”) (称量时1g以下用游码)
(3)上述溶液取 10g加水 40g进行稀释,所得氯化钠溶液的溶质质量分数是
21.(2022秋·河南濮阳·九年级统考期末)实验室选用下列仪器配制50g质量分数为6%的氯化钠溶液。
(1)所需氯化钠固体的质量为 g。
(2)完成该实验,上图中有一种仪器不必用到,请写出该仪器的名称。
(3)若其他操作正确,量取水时仰视量筒读数,会对溶液配制结果造成什么影响?
22.(2022秋·河南商丘·九年级校联考期末)配制一定溶质质量分数的氯化钠溶液的过程如图所示:
(1)配制50g质量分数为5%的氯化钠溶液,所需氯化钠和水的质量分别为 。
(2)溶解过程中玻璃棒的作用 。
23.(2022秋·河南新乡·九年级统考期末)实验室配制50g溶质质量分数为3%的NaCl溶液,操作示意图如下。请回答:
(1)配制50g溶质质量分数为3%的NaCl溶液,需要NaCl的质量为 。
(2)图示中正确的操作顺序为 (填序号)。
(3)溶解时用玻璃棒搅拌的目的是 。
五、综合应用题
24.(2022秋·河南平顶山·九年级统考期末)金属材料在人类发展的历史长河中起着非常重要的作用。
(1)铝是地壳中含量最高的金属元素。
①铝合金的强度和硬度一般比纯铝 (填“高”或“低”)。
②铝制品应用广泛,是因为铝具有 等优良性能。
(2)中国高铁,世界第一。近年来,我国高铁建设飞速发展,建造高铁需要大量的钢铁。如图为模拟炼铁的装置,写出a中发生反应的化学方程式 ;描述b处反应的现象 。
(3)某电镀厂为减少污染并变废为宝,从排放的废液中回收铜、铁和硫酸锌溶液,设计的操作流程如下图所示。
①步骤Ⅰ、Ⅲ中包含的相同操作是什么 ?
②写出步骤Ⅰ所得固体的成分 。
③确定步骤Ⅲ中的X后,写出有关反应的化学方程式 。
(4)晋葛洪(抱朴子内篇·黄白)记载“曾青涂铁,铁赤色如铜”曾青即硫酸铜溶液,“涂铁”后其反应原理为铁与硫酸铜溶液反应。将2.8g铁粉边搅拌边缓缓加入80g硫酸铜溶液中,二者恰好完全反应,请计算该硫酸铜溶液中溶质的质量分数。
25.(2022秋·河南许昌·九年级统考期末)金属在生产和生活中有着广泛的用途,铁是目前世界上使用最多的金属。
(1)请将上边虚线框内铁原子的结构示意图补画完整。
(2)铁可制成铁锅烹调食物,利用了铁的延展性和 性。
(3)用如图所示微型装置模拟工业炼铁。
V形管中A处可观察到的现象是 ;B处V形管内的溶液变浑浊,则发生反应的化学方程式 。
(4)某化学小组用一定量AgNO3和Al(NO3)3的混合溶液进行了如图实验,已知溶液甲呈蓝色。请写出该实验过程中所发生反应的化学方程式 (写出一个即可);向固体乙上滴加盐酸时 (填“有”或“没有”)气泡产生;溶液甲中一定含有的溶质是 (写化学式)。
(5)某工厂利用废硫酸与铁反应制取硫酸亚铁。9.8t废硫酸与1.12t铁恰好完全反应。计算废硫酸中溶质的质量分数是多少?
26.(2022秋·河南郑州·九年级统考期末)北京冬奥会将于2022年2月4日开幕。北京冬奥会的理念是“绿色、低碳、可持续发展”。
(1)届时国家游泳中心由水立方转为“冰立方”,20天内即可完成“水一冰”场地转换。请从微粒视角分析此转化 。
(2)为实现北京冬奥会“碳中和”目标,通过张北柔性直流电网工程,将张北地区的风能、太阳能等生产的绿电输入北京,赛事期间北京冬奥会所有场馆将实现100%绿电供应。北京冬奥会境内接力火炬将全部应用氢燃料。
①请写出火炬接力时,奥运圣火燃烧的化学方程式 。
②北京冬奥会场馆使用绿电与使用燃煤发电相比,其优点是什么: 。(答一条即可)
(3)以玉米、薯类及秸秆等可再生资源为原材料生产的可降解餐具,将代替塑料制品为冬奥会提供相关服务。玉米、薯类不仅可用于做餐具,而且发酵可制得乙醇,写出乙醇燃烧的化学方程式 。
(4)作为北京市区唯一新建的场馆国家速滑馆“冰丝带”,采用世界跨度最大的单层双向正交马鞍形索网屋面,用钢量仅为传统屋面的四分之一。
①炼钢的原材料是生铁。写出工业上用赤铁矿(主要成分是氧化铁)冶炼生铁的化学方程式 。
②为了探究铁与另外两种金属的活动性,某同学收集了包括铁在内的三种金属片,分别编号为X、Y、Z。他把X、Y分别放入稀硫酸中,Y溶解并产生氢气,X不反应;把X和Z分别放入硝酸银溶液中,过一会儿,在X表面有银析出,而Z没有变化。根据以上实验事实,判断铁与另外两种金属的活动性顺序 (铁用化学式表示)。请写出一个符合题意的X与硝酸银反应的化学方程式 (X要用具体物质表示)。
(5)国家速滑馆、五棵松体育中心等冬奥场馆,选用二氧化碳跨临界制冷系统,冰面温差控制在0.5℃以内,碳排量接近于零。实验室可用大理石与稀盐酸反应制取CO2。
①选用的发生和收集装置依次是 ,你选择上述发生装置的理由是 。
②向盛有12g大理石(杂质不参与反应)的反应容器中,加入100g稀盐酸,恰好完全反应后,反应容器内固体与溶液的总质量为107.6g,请计算稀盐酸的溶质质量分数 。(忽略二氧化于水的质量)
六、计算题
27.(2022秋·河南周口·九年级期末)根据所学知识回答下列问题:
(1)要配置质量分数为4%的氯化钠溶液100g来选种,需要氯化钠的质量为 ,水的质量为 。
(2)如果对100g 4%的NaCl溶液进行如下处理,求所得溶液中溶质质量分数。(假设每次增加的溶质皆完全溶解。以下各题要求写出计算过程,结果精确到0.1%)
①蒸发10g水,所得溶液的溶质质量分数是多少?
②增加5g氯化钠后,所得溶液的溶质质量分数是多少?
③增加5g氯化钠和5g水后,所得溶液的溶质质量分数是多少?
参考答案:
1.D
【详解】甲醛分子中氢原子和氧原子的个数比为2:1,水分子中氢原子和氧原子的个数比也为2:1,则甲醛的水溶液中氢元素和氧元素的质量比为(1×2):16=1:8;氢元素的质量分数为10%,则氧元素的质量分数为80%,则甲醛的水溶液中碳元素的质量分数为1-10%-80%=10%;则溶液中甲醛的质量分数为10%÷( ×100%)=25%。故选D。
2.A
【详解】A、20℃时,硝酸钾的溶解度为31.6g,即该温度下,100g水中最多能溶解31.6g硝酸钾,故60℃时,向100g水中加入一定量KNO3形成溶液,再降温至20℃,共析出10g硝酸钾,说明加入硝酸钾的质量为41.6g,符合题意;
B、由图2可知,硝酸钾的溶解度随温度的升高而增加,由图1可知,降温过程中,一开始没有溶质析出,说明一开始是不饱和溶液,后有溶质析出,变为饱和溶液,不符合题意;
C、20℃时,硝酸钾的溶解度为31.6g,该温度下,饱和溶液的溶质质量分数为:,向所得131.6g饱和溶液中加入100g水,所得溶液的溶质质量分数为:,不符合题意;
D、20℃时,硝酸钾的溶解度为31.6g,131.6g硝酸钾饱和溶液中硝酸钾的质量31.6g,不符合题意。
故选A。
3.C
【详解】溶液加水稀释,溶剂质量增加,溶液质量增加,溶质质量不变,溶质质量分数减小。
故选C。
4.B
【详解】用氯化钠固体和蒸馏水配制100g10%的氯化钠溶液,需要用到的仪器有:电子天平、药匙(称量所需的氯化钠)、量筒、胶头滴管(量取所需的水)、烧杯(溶解氯化钠)、玻璃棒(搅拌,加速溶解),不需要使用蒸发皿。
故选B。
5.C
【详解】A、用固体配制一定溶质质量分数的溶液,所需仪器为:托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒,故还需胶头滴管,无需漏斗,不符合题意;
B、用固体配制一定溶质质量分数的溶液,实验步骤为:计算、称量、量取、溶解、装瓶贴标签,故操作顺序是:②⑤①③④,不符合题意;
C、用托盘天平称量物品时,应遵循“左物右码”的原则,图中氯化钠和砝码的位置放反了,会导致溶质质量偏小,故所配氯化钠溶液的质量分数小于9%,符合题意;
D、量筒量程的选择应遵循“大而近”的原则,故应选择50mL的量筒量取45.5mL水,不符合题意。
故选C。
6.C
【详解】A、一定量氯化钠固体溶于适量水中氯化钠和水的质量比4:21可以配成质量分数为16%的氯化钠溶液,故选项不符合题意;
B、一定量24%的氯化钠溶液加适量水稀释,24%的氯化钠溶液和加入水的质量比为2:1可以配成质量分数为16%的氯化钠溶液,故选项不符合题意;
C、15%的氯化钠溶液与13%的氯化钠溶液溶质质量分数都小于16%,不可能配成质量分数为16%的氯化钠溶液,故选项符合题意;
D、18%的氯化钠溶液与10%的氯化钠溶液按质量比3:1可以配成质量分数为16%的氯化钠溶液,故选项不符合题意;
故选:C。
7.B
【详解】A、实验1后,甲、乙中溶液的溶质质量分数相等正确,故A正确;
B、实验2后,乙中比甲中氯化钠的溶解度大错误,因为温度不变,溶解度不变,故B不正确;
C、实验2后,甲中溶液为氯化钠的不饱和溶液正确,因为加入了溶剂,故C正确;
D、实验2后,甲、乙中溶液所含溶质质量相等正确,因为乙中的溶质不再溶解,故D正确。故选B。
8.(1)B
(2)60g/60克
(3)AB/BA
【详解】(1)A、B两点对应的溶液中,温度不同,溶剂质量均为20g,B点对应的溶液中溶解的溶质多,则溶质的质量分数较大的是B;
(2)t1℃时,B点对应溶液质量为32g,溶剂质量为20g,则溶质质量为:32g-20g=12g<30g,所以固体物质X部分溶解,为饱和溶液,故t1℃时,物质X的溶解度为 ;
(3)A点对应的溶液中溶质质量为:24g-20g=4g<30g,B点对应的溶液中溶质质量为:32g-20g=12g<30g,所以A、B两点对应的溶液中溶质部分溶解,A、B两点对应的溶液是饱和溶液;C、D点对应的溶液中,溶质质量为:50g-20g=30g,固体全部溶解,C、D点没有剩余固体,可能都属于不饱和溶液;故A、B、C、D四点对应的溶液中,一定属于饱和溶液的是AB。
9.(1)A(2)75
(3)不变
【详解】(1)由溶解度曲线图可知,t1℃时, A、B、C三种物质的溶解度由小到大的顺序是A(2)t3℃时,A物质的溶解度为50g,50g水中最多溶解的A物质的质量为,则向盛有50gA物质的烧杯中加入50g水,最多溶解的A物质的质量为25g,故充分溶解后所得溶液的质量为。
(3)由溶解度曲线图可知,C物质的溶解度随温度的升高而减小,则将t3℃时C的饱和溶液降温至20℃,C物质的溶解度变大,C的饱和溶液变成不饱和溶液,但是溶液组成不变,故溶液中溶质的质量分数将不变。
10. 20 饱和 25%
【详解】将50g硝酸钾放入盛有50g水的烧杯中充分溶解,如图可知,t1℃时,溶液的质量为60g,即该温度下,50g水最多能溶解10g硝酸钾,故100g水最多能溶解20g硝酸钾,故t1℃时硝酸钾的溶解度为20g;
由图可知,将50g硝酸钾放入盛有50g水的烧杯中充分溶解,一开始,随着温度的升高,硝酸钾溶液的质量逐渐增加,说明一开始,溶质未全部溶解,随着温度的升高,溶解度增加,溶质不断溶解,到C点时,溶液质量不再变化,说明C点时,50g硝酸钾恰好溶解到50g水中,溶液恰好达到饱和,之后溶液质量不再变化,是不饱和溶液,故在A、B、C、D4个点对应的溶液中A、B、C点的溶液一定是饱和溶液;
由图可知,D点溶液的溶质质量分数为:,故40gD点溶液的溶质质量为:40g×50%=20g;故向40gD点的溶液中加入40g水,所得溶液的溶质质量分数为:。
11.(1)t1℃
(2)a>b>c
(3)75g
【详解】(1)由溶解度曲线可知,a、c的溶解度相等时的温度是t1℃;
(2)t2℃时,a、b、c三种物质的溶解度大小为a>b>c,根据饱和溶液的溶质的质量分数为,则它们的溶质质量分数由大到小的关系a>b>c;
(3)在t2℃时,a物质的溶解度为50g,即100g水中最多溶解50ga物质,将30ga物质加入50g水中充分溶解,只有25ga溶于水中,即溶质质量为25g,溶剂质量为50g,所得溶液质量为75g。
12.(1)50g
(2)c>b>a
(3)加入c物质(合理均可)
(4) a b
(5)不饱和溶液
【解析】(1)
通过分析溶解度曲线可知,t3℃时,a物质的溶解度是50g;
(2)
由图像可知,t1℃时,三种物质的溶解度由大到小的顺序为c>b>a;
(3)
c物质的溶解度随温度的升高而减小,要将接近饱和的c物质溶液变为饱和溶液,可采取的一种措施是加入c物质、升高温度等(合理均可);
(4)
a物质的溶解度受温度影响变化最大,c物质降低温度不会析出晶体,t1℃时的溶解度b大于a,c物质t3℃时的溶解度小于a、b物质t1℃时的溶解度,所以t3℃时,将等质量的a、b、c三种物质的饱和溶液同时降温至t1℃时,析出晶体最多的是a,所得溶液中溶质质量分数最大的是b;
(5)
P点在a溶解度曲线下方,表示a溶液为不饱和溶液。
13.(1)t2
(2)75
(3)解:由图可知,t3℃时,甲的溶解度为50g,则t3℃时,将150g甲的饱和溶液中溶质质量为50g
设需要加入水的质量为x
50g=(150g+x)×20%
x=100g
答:需要加入水的质量为100g。
【详解】(1)由图可知,t2℃时甲乙两种物质的溶解度曲线相交,则t2℃时甲乙两种物质的溶解度相等,故填t2。
(2)由图可知,t3℃时,甲的溶解度为50g,则t3℃时,将30g甲物质加入到50g水中,充分搅拌后溶解的甲的质量为25g,则得到溶液的质量=50g+25g=75g,故填75。
(3)见答案
14.(1)t1
(2)>
(3)100
【详解】(1)据图可知,t1℃时AB溶解度曲线相交于一点,A、B的溶解度相等。
(2)据图可知,A的溶解度随温度的升高而升高,且变化幅度比B大,所以t2℃时分别将100gA、B的饱和溶液降温至t1℃,析出固体质量A>B。
(3)据图可知,t2℃时A的溶解度是50g,
设需加水的质量为x。则
15.(1)托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒(任选两种)
(2) 丁 154.6g
【分析】(1)
用固体配制一定溶质质量分数的溶液,所需仪器为:托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒;
(2)
20℃时,氯化镁的溶解度为54.6g,故该温度下,100g水中最多能溶解54.6g氯化镁,甲、乙、丙均能全部溶解,丁只能溶解54.6g,故所得溶液属于饱和溶液的是丁,所得溶液的质量为:100g+54.6g=154.6g。
16.(1)药匙和玻璃棒
(2)D
(3)ACD
【详解】(1)配制一定溶质质量分数的溶液,需要的仪器有:天平、量筒、烧杯、胶头滴管、玻璃棒、药匙;
(2)天平的指针向左偏转,说明药品质量大,应减少药品的质量,故选D;
(3)A、氯化钠中含有杂质,则称量的氯化钠的质量减少,结果偏小,故A正确;
B、需要称量的氯化钠的质量为:=10g,不需要用砝码,称量物与砝码放反了,不影响氯化钠的质量,结果不变,故B错误;
C、配制时有少量氯化钠洒落在烧杯外面,则溶液中溶质的质量减小,结果偏小,故C正确;
D、量水时仰视读数,读数偏小,实际取水增多,结果偏小,故D正确。
故选ACD。
17.(1)③
(2)23.1%
(3)④
【详解】(1)20℃时,氯化镁的溶解度约为55g,则100g水20℃时最多溶解氯化镁55g,z则所得溶液中,溶质与溶剂的质量比为1:2的是③;
(2)①中溶质的质量分数为故填23.1%;
(3)20℃时,氯化镁的溶解度约为55g,则100g水20℃时最多溶解氯化镁55g,故属于饱和溶液的是④。
18.(1)t2
(2)增加溶剂(或加水)
(3)37.5%
【详解】(1)溶解度曲线的交点,表示二者在该温度下的溶解度相等,所以在t2℃时,甲和丙的溶解度相等,故答案为:t2;
(2)溶解度曲线下方的任意一点,都表示该溶液的不饱和溶液,t1℃时,将乙溶液的状态由M点变为N点,即将乙溶液的状态在该温度下由饱和变为不饱和溶液,方法是增加溶剂或者水,故答案为:增加溶剂(或加水);
(3)t3℃时,甲的溶解度为60 g,即甲在t3℃时,100 g的水中最多溶解甲的质量为60 g,所以t3℃时,50 g的水中最多溶解甲的质量为30 g,所以溶液的溶质质量分数为=,故答案为:37.5%。
【点睛】溶解度曲线的交点,表示二者在该温度下的溶解度相等;溶解度曲线上方的任意一点,都表示该溶液的过饱和溶液,溶解度曲线下方的任意一点,都表示该溶液的不饱和溶液;判断溶液是否是饱和溶液,需要根据该温度下的溶解度综合判断。
19.(1)⑤②④①
(2)会导致所配制溶液质量分数偏小
(3)50
【详解】(1)用氯化钠配制氯化钠溶液的操作步骤为:计算、称量、量取、溶解,故顺序是⑤②④①。
(2)量取水时仰视量筒读数,读数偏小,则量取水的体积比读数偏大,会导致所配制溶液质量分数偏小。
(3)需加水的质量为。
20.(1) 12 68
(2)不变
(3)3%
【解析】(1)
配制一定溶质质量分数的氯化钠溶液,根据溶质质量分数计算得:
托盘天平称量氯化钠质量故为12g,量筒用于量取溶剂水的体积,由水的质量是,水的密度是,故水的体积就是68ml
(2)
称量氯化钠固体时应该左物右码,由本题氯化钠质量为12g,(称量时1g以下用游码),题中放颠倒了,未用到游码故质量没有影响,不会导致最终配制的溶液溶质质量分数变化,但是这种操作是错误的;
(3)
溶液稀释前后溶质不变,
21.(1)3g
(2)漏斗
(3)导致所配制溶液的溶质质量分数偏小
【详解】(1)由题可知,氯化钠溶液的质量为50g,该溶液的溶质质量分数为6%,则溶质氯化钠的质量为50g×6%=3g;
(2)配制溶液需要的仪器有托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒,不必用到漏斗;
(3)若其他操作正确,量取水时仰视量筒读数,导致量取的水的体积偏大,所配制溶液的溶质质量分数偏小。
22.(1)2.5g、47.5g
(2)搅拌,加速溶解
【详解】(1)配制50g质量分数为5%的氯化钠溶液,所需氯化钠质量 ,水的质量50g-2.5g=47.5g,故填:2.5g、47.5g。
(2)溶解过程中玻璃棒的作用搅拌,加速溶解,故填:搅拌,加速溶解。
23.(1)1.5g
(2)②①⑤③④
(3)加速溶解
【详解】(1)需要NaCl的质量为50g×3%=1.5g。
(2)配置一定溶质质量分数的溶液步骤为计算、称量、溶解、装瓶,所以顺序为②①⑤③④。
(3)溶解时用玻璃棒搅拌的目的是通过外力加速氯化钠和水混合,从而加速溶解。
24.(1) 高 密度小、抗腐蚀性强
(2)
澄清石灰水变浑浊
(3) 过滤 Zn、Cu、Fe
(4)解:设硫酸铜溶液中溶质的质量分数为x。
x=10%
答:该硫酸铜溶液中溶质的质量分数是10%。
【详解】(1)①铝合金的强度和硬度一般比纯铝高;
②铝制品应用广泛,是因为铝具有密度小、抗腐蚀性强等优良性能;
(2)一氧化碳和氧化铁高温下生成铁和二氧化碳,化学方程式为:;b处生成的二氧化碳使澄清石灰水变浑浊;
(3)①步骤Ⅰ、Ⅲ中包含的相同操作,将固体和液体分离,是过滤操作;
②步骤Ⅰ加入过量锌粉,锌和硫酸铜反应生成硫酸锌和铜;锌和硫酸亚铁反应生成铁和硫酸锌,过滤后的固体中含有铜、铁和过量的锌;
③步骤Ⅰ后所得的固体中用磁铁吸引,可将铁分离出去,得到铜和锌的混合物,加入硫酸,铜和硫酸不反应,可将铜分离出来,故X为稀硫酸,锌和硫酸反应生成硫酸锌和氢气,化学方程式为:;
(4)过程见答案。
25.(1)
(2)导热
(3) 固体由红棕色逐渐变为黑色
(4) (或) 没有 Al(NO3)3、Zn(NO3)2、Cu(NO3)2
(5)解:设废硫酸中溶质的质量为x,则
废硫酸中溶质的质量分数为
答:废硫酸中溶质的质量分数为20%。
【详解】(1)铁原子的最外层电子数为26-2-8-14=2。
(2)铁可制成铁锅烹调食物,利用了铁的延展性和导热性。
(3)Fe2O3与CO发生反应生成Fe和CO2,V形管中A处可观察到的现象是固体由红棕色逐渐变为黑色;B处V形管内的溶液变浑浊,则发生反应的化学方程式为。
(4)该实验过程中所发生的反应有2个,首先发生反应:;如果AgNO3有剩余,则发生反应:;根据溶液甲呈蓝色,说明溶液中肯定有Cu(NO3)2,2个反应都发生,则锌粉全部溶解,向固体乙上滴加盐酸时没有气泡产生;溶液甲中一定含有的溶质是Al(NO3)3、Zn(NO3)2、Cu(NO3)2。
(5)见答案。
26.(1)水分子之间的间隔增大,而水分子种类不变
(2) 减少二氧化碳的排放
(3)
(4) Fe>X>Z
(5) BC 稀盐酸是液体,大理石是固体,反应条件是常温,因此选择固液常温发生装置 生成二氧化碳的质量为
设稀盐酸中的质量为
稀盐酸的溶质质量分数为。
【解析】(1)
水转化成冰是物质状态的改变,微观是分子之间的间隔增大,而水分子种类不变;故填:分子之间的间隔增大,而水分子种类不变;
(2)
①氢气燃烧生成水,反应的化学方程式为,故填:;
②北京冬奥会场馆使用绿电与使用燃煤发电相比,其优点是减少二氧化碳的排放、减少污染物排放、节约化石燃料等,合理即可。故填:减少二氧化碳的排放;
(3)
乙醇在空气中完全燃烧生成二氧化碳和水,化学方程式为,故填:;
(4)
①氧化铁与一氧化碳在高温的条件下反应生成铁和二氧化碳,化学方程式为,故填:;
②根据金属活动性顺序及其运用,排在氢之前的金属可与稀盐酸和稀硫酸反应,产生氢气。X、Y分别放入稀硫酸中,Y溶液产生氢气,X不反应,所以Y是铁,金属活动性Fe>X,排在前面的金属(除钾钙钠外),可将排在后面的金属从其盐溶液中置换出来,把X和Z分别放入硝酸银溶液中过一会儿。在X表面有银析出,而Z没有变化,所以金属活动性X>Z,综合可知,三者的金属活动性顺序是Fe>X>Z;符合题意的X可以金属铜,铜与硝酸银反应的化学方程式为:,故填:Fe>X>Z;;
(5)
①稀盐酸是液体,大理石是固体,反应条件是是常温,因此选择固液常温发生装置,二氧化碳能溶于水不能使用排水法,密度比空气密度大,选择向上排空气法,故填:BC;稀盐酸是液体,大理石是固体,所以选择固液发生装置B;
②见答案。
【点睛】掌握根据化学方程式的计算即可正确解答最后一题,根据质量守恒定律计算出二氧化碳的质量,是正确解答最后一题的前提和关键。
27.(1) 4g 96g
(2) 蒸发10g水后,溶质的质量分数为:100%≈4.4% 增加5g氯化钠后溶质的质量分数为:100%≈8.6% 增加5g氯化钠和5g水后,溶质的质量分数为:100%≈8.2%
【分析】本题是根据溶质质量分数公式进行计算,, ,。
【详解】(1)将100g4%的NaCl溶液中含氯化钠的质量为:100g×4%=4g;含有水的质量为:100g﹣4g=96g。
(2)①蒸发10g水后,溶质质量不变,溶液质量减少10g,详解见答案。
②增加5g氯化钠后溶质和溶液的质量都增加了5g,详解见答案。
③增加5g氯化钠和5g水后,溶质质量增加了5g,溶液质量增加了10g,详解见答案。
一、单选题
1.(2022秋·河南商丘·九年级统考期末)已知某甲醛(HCHO)的水溶液中,氢元素的质量分数为10%,则溶液中甲醛的质量分数是
A.10% B.15% C.20% D.25%
2.(2022秋·河南郑州·九年级统考期末)60℃时,向100g水中加入一定量KNO3固体形成溶液,再降温至20℃,析出固体质量的变化如图1所示,结合图2,下列说法正确的是
A.加入的KNO3质量为41.6g
B.降温过程中KNO3溶液始终为饱和溶液
C.20℃时,向所得饱和溶液中加入100g水溶质质量分数减小一半
D.20℃时,100gKNO3饱和溶液中有31.6gKNO3
3.(2022秋·河南濮阳·九年级校考期末)溶液加水稀释前后,溶液中保持不变的是
A.溶液中溶质质量分数 B.溶液的质量
C.溶质的质量 D.溶剂的质量
4.(2022秋·河南南阳·九年级统考期末)用氯化钠固体和蒸馏水配制100g10%的氯化钠溶液,不需要的仪器是
A.玻璃棒 B.蒸发皿 C.烧杯 D.托盘天平
5.(2022秋·河南信阳·九年级统考期末)实验室配制50g质量分数为9%的氯化钠溶液,实验操作如图所示。下列说法正确的是
A.该实验中还需要用到漏斗和胶头滴管 B.该实验的操作顺序是②①⑤③④
C.所配氯化钠溶液的质量分数小于9% D.用规格为100mL的量筒量取45.5mL水
6.(2022秋·河南平顶山·九年级统考期末)农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。下列操作不可能配成所需溶液的是
A.一定量氯化钠固体溶于适量水中 B.一定量24%的氯化钠溶液加适量水稀释
C.15%的氯化钠溶液与13%的氯化钠溶液按一定比例混合 D.18%的氯化钠溶液与10%的氯化钠溶液按一定比例混合
7.(2022秋·河南新乡·九年级统考期末)常温下,对100mL氯化钠饱和溶液进行图示实验。下列分析错误的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲、乙中溶液所含溶质质量相等
二、填空题
8.(2022秋·河南平顶山·九年级统考期末)将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得0℃、t1℃、t2℃、t3℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。
回答下列问题:
(1)A、B两点对应的溶液中溶质的质量分数较大的是 (填字母编号)。
(2)t1℃时,物质X的溶解度是 。
(3)A、B、C、D四点对应的溶液中,一定属于饱和溶液的是 (填字母编号)。
9.(2022秋·河南平顶山·九年级统考期末)A、B、C三种物质的溶解度曲线如图所示:
(1)t1℃时, A、B、C三种物质的溶解度由小到大的顺序是 。
(2)t3℃时,向盛有50gA物质的烧杯中加入50g水,充分溶解后所得溶液的质量为 g。
(3)将t3℃时C的饱和溶液降温至20℃,溶液中溶质的质量分数将 (填“减小”、“增大”或“不变”)。
10.(2022秋·河南许昌·九年级统考期末)将 50g 硝酸钾放入盛有 50g 水的烧杯中充分溶解,如图是溶液质量随温度的变化的曲线,则 t1℃ 时硝酸钾的溶解度为 g;B 点对应的溶液属于 (填“饱和”或“不饱和”);向 40g D 点的溶液中加入 40g 水,所得溶液的质量分数是 。
11.(2022秋·河南濮阳·九年级统考期末)如图是a、b、c三种固体物质的溶解度曲线。
(1)a、c的溶解度相等时的温度是 。
(2)t2℃时,a、b、c三种物质的饱和溶液溶质质量分数由大到小的关系是 。
(3)在t2℃时,将30ga物质加入50g水中充分溶解,所得溶液质量为 。
12.(2022秋·河南周口·九年级期末)a、b、c三种物质的溶解度曲线按如图所示,据图回答:
(1)t3℃时,a物质的溶解度为 ;
(2)t1℃时,三种物质的溶解度由大到小的顺序为 ;
(3)要将接近饱和的c物质溶液变为饱和溶液,可采取的一种措施是 ;
(4)t3℃时,将等质量a、b、c三种物质的饱和溶液同时降温至t1℃时,析出晶体最多的是 ,所得溶液中溶质质量分数最大的是 。
(5)P点表示a溶液 (饱和溶液、不饱和溶液)
13.(2022秋·河南新乡·九年级统考期末)如图是甲、乙两种固体物质的溶解度曲线。
(1) ℃时甲乙两种物质的溶解度相等;
(2)t3℃时,将30g甲物质加入到50g水中,充分搅拌后得到溶液的质量是 g。
(3)t3℃时,将150g甲的饱和溶液稀释成20%,需要加入水的质量为 g。
14.(2022秋·河南信阳·九年级统考期末)如图是A、B两种物质(均不含结晶水)的溶解度曲线。
(1)A、B的溶解度相等时的温度为 ℃。
(2)t2℃时分别将100gA、B的饱和溶液降温至t1℃,析出固体质量A B(填“>”“<”或“=”)。
(3)将t2℃时150gA的饱和溶液稀释为20%,需加水 g。
15.(2022秋·河南郑州·九年级统考期末)用氯化镁溶液喷洒路面可融雪。20℃时按下表数据配制溶液,请回答:
序号 甲 乙 丙 丁
氯化镁的质量/g 30 40 50 60
水的质量/g 100 100 100 100
已知:20℃时,氯化镁的溶解度为54.6g。
(1)配制上述溶液所用到的玻璃仪器有 (2种即可)。
(2)所得溶液中属于饱和溶液的是 ,该溶液的质量为 。
16.(2022秋·河南平顶山·九年级统考期末)配制溶液是初中生要学会的一项实验技能,现实验室需配制100g10%的氯化钠溶液。
(1)现有仪器如图:要完成该实验,还缺少的两个仪器是 。
(2)在称取氯化钠时,发现天平的指针向左偏转,你认为下列做法正确的是 。
A.加砝码 B.减砝码
C.加氯化钠 D.减氯化钠
(3)某同学配制的氯化钠溶液中氯化钠的质量分数小于10%,其可能原因是 。
A.氯化钠中含有杂质
B.称量物与码放反了
C.配制时有少量氯化钠洒落在烧杯外面
D.量水时仰视读数
17.(2022秋·河南南阳·九年级统考期末)用MgCl2溶液喷洒路面可融雪、防尘。20℃时,按下表数据配制溶液,回答问题。
序号 ① ② ③ ④
MgCl2的质量/g 30 40 50 60
水质量/g 100 100 100 100
(已知:20℃时,MgCl2的溶解度约为55g)。
(1)所得溶液中,溶质与溶剂的质量比为1:2的是(填序号) ;
(2)①中溶质的质量分数约为 (保留一位小数);
(3)所得溶液中,属于饱和溶液的是(填序号) 。
三、简答题
18.(2022秋·河南许昌·九年级统考期末)甲、乙、丙三种固体物质的溶解度曲线如图所示,按要求填空。
(1)在 ℃时,甲和丙的溶解度相等。
(2)t1℃时,将乙溶液的状态由M点变为N点,方法是 。
(3)t3℃时,将40g甲放入50g水中,充分溶解后所得溶液的溶质质量分数为 。
19.(2022秋·河南许昌·九年级统考期末)一定质量分数溶液的配制是初中化学重要的探究实验。某化学兴趣小组用氯化钠配制50g溶质质量分数为6%的氯化钠溶液。
(1)现有以下操作:①溶解、②称取氯化钠、③过滤、④量取水、⑤计算。请从以上操作中选出正确的操作顺序是 。
(2)若其它操作正确,量取水时仰视量筒读数,对结果会造成什么影响?
(3)用已配好的50g溶质质量分数为6%的氯化钠溶液,配制溶质质量分数为3%的氯化钠溶液,需要加水的质量为 g。
四、实验题
20.(2022秋·河南平顶山·九年级统考期末)以下是实验室配制一定溶质质量分数的氯化钠溶液的流程示意图 请根据示意图回答:
(1)托盘天平左盘中固体氯化钠的质量为 g,量筒中水的体积为 mL;
(2)称量氯化钠固体时,若氯化钠固体与砝码放反,所配制溶液的溶质质量分数 (填“偏大”“偏小”或“不变”) (称量时1g以下用游码)
(3)上述溶液取 10g加水 40g进行稀释,所得氯化钠溶液的溶质质量分数是
21.(2022秋·河南濮阳·九年级统考期末)实验室选用下列仪器配制50g质量分数为6%的氯化钠溶液。
(1)所需氯化钠固体的质量为 g。
(2)完成该实验,上图中有一种仪器不必用到,请写出该仪器的名称。
(3)若其他操作正确,量取水时仰视量筒读数,会对溶液配制结果造成什么影响?
22.(2022秋·河南商丘·九年级校联考期末)配制一定溶质质量分数的氯化钠溶液的过程如图所示:
(1)配制50g质量分数为5%的氯化钠溶液,所需氯化钠和水的质量分别为 。
(2)溶解过程中玻璃棒的作用 。
23.(2022秋·河南新乡·九年级统考期末)实验室配制50g溶质质量分数为3%的NaCl溶液,操作示意图如下。请回答:
(1)配制50g溶质质量分数为3%的NaCl溶液,需要NaCl的质量为 。
(2)图示中正确的操作顺序为 (填序号)。
(3)溶解时用玻璃棒搅拌的目的是 。
五、综合应用题
24.(2022秋·河南平顶山·九年级统考期末)金属材料在人类发展的历史长河中起着非常重要的作用。
(1)铝是地壳中含量最高的金属元素。
①铝合金的强度和硬度一般比纯铝 (填“高”或“低”)。
②铝制品应用广泛,是因为铝具有 等优良性能。
(2)中国高铁,世界第一。近年来,我国高铁建设飞速发展,建造高铁需要大量的钢铁。如图为模拟炼铁的装置,写出a中发生反应的化学方程式 ;描述b处反应的现象 。
(3)某电镀厂为减少污染并变废为宝,从排放的废液中回收铜、铁和硫酸锌溶液,设计的操作流程如下图所示。
①步骤Ⅰ、Ⅲ中包含的相同操作是什么 ?
②写出步骤Ⅰ所得固体的成分 。
③确定步骤Ⅲ中的X后,写出有关反应的化学方程式 。
(4)晋葛洪(抱朴子内篇·黄白)记载“曾青涂铁,铁赤色如铜”曾青即硫酸铜溶液,“涂铁”后其反应原理为铁与硫酸铜溶液反应。将2.8g铁粉边搅拌边缓缓加入80g硫酸铜溶液中,二者恰好完全反应,请计算该硫酸铜溶液中溶质的质量分数。
25.(2022秋·河南许昌·九年级统考期末)金属在生产和生活中有着广泛的用途,铁是目前世界上使用最多的金属。
(1)请将上边虚线框内铁原子的结构示意图补画完整。
(2)铁可制成铁锅烹调食物,利用了铁的延展性和 性。
(3)用如图所示微型装置模拟工业炼铁。
V形管中A处可观察到的现象是 ;B处V形管内的溶液变浑浊,则发生反应的化学方程式 。
(4)某化学小组用一定量AgNO3和Al(NO3)3的混合溶液进行了如图实验,已知溶液甲呈蓝色。请写出该实验过程中所发生反应的化学方程式 (写出一个即可);向固体乙上滴加盐酸时 (填“有”或“没有”)气泡产生;溶液甲中一定含有的溶质是 (写化学式)。
(5)某工厂利用废硫酸与铁反应制取硫酸亚铁。9.8t废硫酸与1.12t铁恰好完全反应。计算废硫酸中溶质的质量分数是多少?
26.(2022秋·河南郑州·九年级统考期末)北京冬奥会将于2022年2月4日开幕。北京冬奥会的理念是“绿色、低碳、可持续发展”。
(1)届时国家游泳中心由水立方转为“冰立方”,20天内即可完成“水一冰”场地转换。请从微粒视角分析此转化 。
(2)为实现北京冬奥会“碳中和”目标,通过张北柔性直流电网工程,将张北地区的风能、太阳能等生产的绿电输入北京,赛事期间北京冬奥会所有场馆将实现100%绿电供应。北京冬奥会境内接力火炬将全部应用氢燃料。
①请写出火炬接力时,奥运圣火燃烧的化学方程式 。
②北京冬奥会场馆使用绿电与使用燃煤发电相比,其优点是什么: 。(答一条即可)
(3)以玉米、薯类及秸秆等可再生资源为原材料生产的可降解餐具,将代替塑料制品为冬奥会提供相关服务。玉米、薯类不仅可用于做餐具,而且发酵可制得乙醇,写出乙醇燃烧的化学方程式 。
(4)作为北京市区唯一新建的场馆国家速滑馆“冰丝带”,采用世界跨度最大的单层双向正交马鞍形索网屋面,用钢量仅为传统屋面的四分之一。
①炼钢的原材料是生铁。写出工业上用赤铁矿(主要成分是氧化铁)冶炼生铁的化学方程式 。
②为了探究铁与另外两种金属的活动性,某同学收集了包括铁在内的三种金属片,分别编号为X、Y、Z。他把X、Y分别放入稀硫酸中,Y溶解并产生氢气,X不反应;把X和Z分别放入硝酸银溶液中,过一会儿,在X表面有银析出,而Z没有变化。根据以上实验事实,判断铁与另外两种金属的活动性顺序 (铁用化学式表示)。请写出一个符合题意的X与硝酸银反应的化学方程式 (X要用具体物质表示)。
(5)国家速滑馆、五棵松体育中心等冬奥场馆,选用二氧化碳跨临界制冷系统,冰面温差控制在0.5℃以内,碳排量接近于零。实验室可用大理石与稀盐酸反应制取CO2。
①选用的发生和收集装置依次是 ,你选择上述发生装置的理由是 。
②向盛有12g大理石(杂质不参与反应)的反应容器中,加入100g稀盐酸,恰好完全反应后,反应容器内固体与溶液的总质量为107.6g,请计算稀盐酸的溶质质量分数 。(忽略二氧化于水的质量)
六、计算题
27.(2022秋·河南周口·九年级期末)根据所学知识回答下列问题:
(1)要配置质量分数为4%的氯化钠溶液100g来选种,需要氯化钠的质量为 ,水的质量为 。
(2)如果对100g 4%的NaCl溶液进行如下处理,求所得溶液中溶质质量分数。(假设每次增加的溶质皆完全溶解。以下各题要求写出计算过程,结果精确到0.1%)
①蒸发10g水,所得溶液的溶质质量分数是多少?
②增加5g氯化钠后,所得溶液的溶质质量分数是多少?
③增加5g氯化钠和5g水后,所得溶液的溶质质量分数是多少?
参考答案:
1.D
【详解】甲醛分子中氢原子和氧原子的个数比为2:1,水分子中氢原子和氧原子的个数比也为2:1,则甲醛的水溶液中氢元素和氧元素的质量比为(1×2):16=1:8;氢元素的质量分数为10%,则氧元素的质量分数为80%,则甲醛的水溶液中碳元素的质量分数为1-10%-80%=10%;则溶液中甲醛的质量分数为10%÷( ×100%)=25%。故选D。
2.A
【详解】A、20℃时,硝酸钾的溶解度为31.6g,即该温度下,100g水中最多能溶解31.6g硝酸钾,故60℃时,向100g水中加入一定量KNO3形成溶液,再降温至20℃,共析出10g硝酸钾,说明加入硝酸钾的质量为41.6g,符合题意;
B、由图2可知,硝酸钾的溶解度随温度的升高而增加,由图1可知,降温过程中,一开始没有溶质析出,说明一开始是不饱和溶液,后有溶质析出,变为饱和溶液,不符合题意;
C、20℃时,硝酸钾的溶解度为31.6g,该温度下,饱和溶液的溶质质量分数为:,向所得131.6g饱和溶液中加入100g水,所得溶液的溶质质量分数为:,不符合题意;
D、20℃时,硝酸钾的溶解度为31.6g,131.6g硝酸钾饱和溶液中硝酸钾的质量31.6g,不符合题意。
故选A。
3.C
【详解】溶液加水稀释,溶剂质量增加,溶液质量增加,溶质质量不变,溶质质量分数减小。
故选C。
4.B
【详解】用氯化钠固体和蒸馏水配制100g10%的氯化钠溶液,需要用到的仪器有:电子天平、药匙(称量所需的氯化钠)、量筒、胶头滴管(量取所需的水)、烧杯(溶解氯化钠)、玻璃棒(搅拌,加速溶解),不需要使用蒸发皿。
故选B。
5.C
【详解】A、用固体配制一定溶质质量分数的溶液,所需仪器为:托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒,故还需胶头滴管,无需漏斗,不符合题意;
B、用固体配制一定溶质质量分数的溶液,实验步骤为:计算、称量、量取、溶解、装瓶贴标签,故操作顺序是:②⑤①③④,不符合题意;
C、用托盘天平称量物品时,应遵循“左物右码”的原则,图中氯化钠和砝码的位置放反了,会导致溶质质量偏小,故所配氯化钠溶液的质量分数小于9%,符合题意;
D、量筒量程的选择应遵循“大而近”的原则,故应选择50mL的量筒量取45.5mL水,不符合题意。
故选C。
6.C
【详解】A、一定量氯化钠固体溶于适量水中氯化钠和水的质量比4:21可以配成质量分数为16%的氯化钠溶液,故选项不符合题意;
B、一定量24%的氯化钠溶液加适量水稀释,24%的氯化钠溶液和加入水的质量比为2:1可以配成质量分数为16%的氯化钠溶液,故选项不符合题意;
C、15%的氯化钠溶液与13%的氯化钠溶液溶质质量分数都小于16%,不可能配成质量分数为16%的氯化钠溶液,故选项符合题意;
D、18%的氯化钠溶液与10%的氯化钠溶液按质量比3:1可以配成质量分数为16%的氯化钠溶液,故选项不符合题意;
故选:C。
7.B
【详解】A、实验1后,甲、乙中溶液的溶质质量分数相等正确,故A正确;
B、实验2后,乙中比甲中氯化钠的溶解度大错误,因为温度不变,溶解度不变,故B不正确;
C、实验2后,甲中溶液为氯化钠的不饱和溶液正确,因为加入了溶剂,故C正确;
D、实验2后,甲、乙中溶液所含溶质质量相等正确,因为乙中的溶质不再溶解,故D正确。故选B。
8.(1)B
(2)60g/60克
(3)AB/BA
【详解】(1)A、B两点对应的溶液中,温度不同,溶剂质量均为20g,B点对应的溶液中溶解的溶质多,则溶质的质量分数较大的是B;
(2)t1℃时,B点对应溶液质量为32g,溶剂质量为20g,则溶质质量为:32g-20g=12g<30g,所以固体物质X部分溶解,为饱和溶液,故t1℃时,物质X的溶解度为 ;
(3)A点对应的溶液中溶质质量为:24g-20g=4g<30g,B点对应的溶液中溶质质量为:32g-20g=12g<30g,所以A、B两点对应的溶液中溶质部分溶解,A、B两点对应的溶液是饱和溶液;C、D点对应的溶液中,溶质质量为:50g-20g=30g,固体全部溶解,C、D点没有剩余固体,可能都属于不饱和溶液;故A、B、C、D四点对应的溶液中,一定属于饱和溶液的是AB。
9.(1)A
(3)不变
【详解】(1)由溶解度曲线图可知,t1℃时, A、B、C三种物质的溶解度由小到大的顺序是A
(3)由溶解度曲线图可知,C物质的溶解度随温度的升高而减小,则将t3℃时C的饱和溶液降温至20℃,C物质的溶解度变大,C的饱和溶液变成不饱和溶液,但是溶液组成不变,故溶液中溶质的质量分数将不变。
10. 20 饱和 25%
【详解】将50g硝酸钾放入盛有50g水的烧杯中充分溶解,如图可知,t1℃时,溶液的质量为60g,即该温度下,50g水最多能溶解10g硝酸钾,故100g水最多能溶解20g硝酸钾,故t1℃时硝酸钾的溶解度为20g;
由图可知,将50g硝酸钾放入盛有50g水的烧杯中充分溶解,一开始,随着温度的升高,硝酸钾溶液的质量逐渐增加,说明一开始,溶质未全部溶解,随着温度的升高,溶解度增加,溶质不断溶解,到C点时,溶液质量不再变化,说明C点时,50g硝酸钾恰好溶解到50g水中,溶液恰好达到饱和,之后溶液质量不再变化,是不饱和溶液,故在A、B、C、D4个点对应的溶液中A、B、C点的溶液一定是饱和溶液;
由图可知,D点溶液的溶质质量分数为:,故40gD点溶液的溶质质量为:40g×50%=20g;故向40gD点的溶液中加入40g水,所得溶液的溶质质量分数为:。
11.(1)t1℃
(2)a>b>c
(3)75g
【详解】(1)由溶解度曲线可知,a、c的溶解度相等时的温度是t1℃;
(2)t2℃时,a、b、c三种物质的溶解度大小为a>b>c,根据饱和溶液的溶质的质量分数为,则它们的溶质质量分数由大到小的关系a>b>c;
(3)在t2℃时,a物质的溶解度为50g,即100g水中最多溶解50ga物质,将30ga物质加入50g水中充分溶解,只有25ga溶于水中,即溶质质量为25g,溶剂质量为50g,所得溶液质量为75g。
12.(1)50g
(2)c>b>a
(3)加入c物质(合理均可)
(4) a b
(5)不饱和溶液
【解析】(1)
通过分析溶解度曲线可知,t3℃时,a物质的溶解度是50g;
(2)
由图像可知,t1℃时,三种物质的溶解度由大到小的顺序为c>b>a;
(3)
c物质的溶解度随温度的升高而减小,要将接近饱和的c物质溶液变为饱和溶液,可采取的一种措施是加入c物质、升高温度等(合理均可);
(4)
a物质的溶解度受温度影响变化最大,c物质降低温度不会析出晶体,t1℃时的溶解度b大于a,c物质t3℃时的溶解度小于a、b物质t1℃时的溶解度,所以t3℃时,将等质量的a、b、c三种物质的饱和溶液同时降温至t1℃时,析出晶体最多的是a,所得溶液中溶质质量分数最大的是b;
(5)
P点在a溶解度曲线下方,表示a溶液为不饱和溶液。
13.(1)t2
(2)75
(3)解:由图可知,t3℃时,甲的溶解度为50g,则t3℃时,将150g甲的饱和溶液中溶质质量为50g
设需要加入水的质量为x
50g=(150g+x)×20%
x=100g
答:需要加入水的质量为100g。
【详解】(1)由图可知,t2℃时甲乙两种物质的溶解度曲线相交,则t2℃时甲乙两种物质的溶解度相等,故填t2。
(2)由图可知,t3℃时,甲的溶解度为50g,则t3℃时,将30g甲物质加入到50g水中,充分搅拌后溶解的甲的质量为25g,则得到溶液的质量=50g+25g=75g,故填75。
(3)见答案
14.(1)t1
(2)>
(3)100
【详解】(1)据图可知,t1℃时AB溶解度曲线相交于一点,A、B的溶解度相等。
(2)据图可知,A的溶解度随温度的升高而升高,且变化幅度比B大,所以t2℃时分别将100gA、B的饱和溶液降温至t1℃,析出固体质量A>B。
(3)据图可知,t2℃时A的溶解度是50g,
设需加水的质量为x。则
15.(1)托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒(任选两种)
(2) 丁 154.6g
【分析】(1)
用固体配制一定溶质质量分数的溶液,所需仪器为:托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒;
(2)
20℃时,氯化镁的溶解度为54.6g,故该温度下,100g水中最多能溶解54.6g氯化镁,甲、乙、丙均能全部溶解,丁只能溶解54.6g,故所得溶液属于饱和溶液的是丁,所得溶液的质量为:100g+54.6g=154.6g。
16.(1)药匙和玻璃棒
(2)D
(3)ACD
【详解】(1)配制一定溶质质量分数的溶液,需要的仪器有:天平、量筒、烧杯、胶头滴管、玻璃棒、药匙;
(2)天平的指针向左偏转,说明药品质量大,应减少药品的质量,故选D;
(3)A、氯化钠中含有杂质,则称量的氯化钠的质量减少,结果偏小,故A正确;
B、需要称量的氯化钠的质量为:=10g,不需要用砝码,称量物与砝码放反了,不影响氯化钠的质量,结果不变,故B错误;
C、配制时有少量氯化钠洒落在烧杯外面,则溶液中溶质的质量减小,结果偏小,故C正确;
D、量水时仰视读数,读数偏小,实际取水增多,结果偏小,故D正确。
故选ACD。
17.(1)③
(2)23.1%
(3)④
【详解】(1)20℃时,氯化镁的溶解度约为55g,则100g水20℃时最多溶解氯化镁55g,z则所得溶液中,溶质与溶剂的质量比为1:2的是③;
(2)①中溶质的质量分数为故填23.1%;
(3)20℃时,氯化镁的溶解度约为55g,则100g水20℃时最多溶解氯化镁55g,故属于饱和溶液的是④。
18.(1)t2
(2)增加溶剂(或加水)
(3)37.5%
【详解】(1)溶解度曲线的交点,表示二者在该温度下的溶解度相等,所以在t2℃时,甲和丙的溶解度相等,故答案为:t2;
(2)溶解度曲线下方的任意一点,都表示该溶液的不饱和溶液,t1℃时,将乙溶液的状态由M点变为N点,即将乙溶液的状态在该温度下由饱和变为不饱和溶液,方法是增加溶剂或者水,故答案为:增加溶剂(或加水);
(3)t3℃时,甲的溶解度为60 g,即甲在t3℃时,100 g的水中最多溶解甲的质量为60 g,所以t3℃时,50 g的水中最多溶解甲的质量为30 g,所以溶液的溶质质量分数为=,故答案为:37.5%。
【点睛】溶解度曲线的交点,表示二者在该温度下的溶解度相等;溶解度曲线上方的任意一点,都表示该溶液的过饱和溶液,溶解度曲线下方的任意一点,都表示该溶液的不饱和溶液;判断溶液是否是饱和溶液,需要根据该温度下的溶解度综合判断。
19.(1)⑤②④①
(2)会导致所配制溶液质量分数偏小
(3)50
【详解】(1)用氯化钠配制氯化钠溶液的操作步骤为:计算、称量、量取、溶解,故顺序是⑤②④①。
(2)量取水时仰视量筒读数,读数偏小,则量取水的体积比读数偏大,会导致所配制溶液质量分数偏小。
(3)需加水的质量为。
20.(1) 12 68
(2)不变
(3)3%
【解析】(1)
配制一定溶质质量分数的氯化钠溶液,根据溶质质量分数计算得:
托盘天平称量氯化钠质量故为12g,量筒用于量取溶剂水的体积,由水的质量是,水的密度是,故水的体积就是68ml
(2)
称量氯化钠固体时应该左物右码,由本题氯化钠质量为12g,(称量时1g以下用游码),题中放颠倒了,未用到游码故质量没有影响,不会导致最终配制的溶液溶质质量分数变化,但是这种操作是错误的;
(3)
溶液稀释前后溶质不变,
21.(1)3g
(2)漏斗
(3)导致所配制溶液的溶质质量分数偏小
【详解】(1)由题可知,氯化钠溶液的质量为50g,该溶液的溶质质量分数为6%,则溶质氯化钠的质量为50g×6%=3g;
(2)配制溶液需要的仪器有托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒,不必用到漏斗;
(3)若其他操作正确,量取水时仰视量筒读数,导致量取的水的体积偏大,所配制溶液的溶质质量分数偏小。
22.(1)2.5g、47.5g
(2)搅拌,加速溶解
【详解】(1)配制50g质量分数为5%的氯化钠溶液,所需氯化钠质量 ,水的质量50g-2.5g=47.5g,故填:2.5g、47.5g。
(2)溶解过程中玻璃棒的作用搅拌,加速溶解,故填:搅拌,加速溶解。
23.(1)1.5g
(2)②①⑤③④
(3)加速溶解
【详解】(1)需要NaCl的质量为50g×3%=1.5g。
(2)配置一定溶质质量分数的溶液步骤为计算、称量、溶解、装瓶,所以顺序为②①⑤③④。
(3)溶解时用玻璃棒搅拌的目的是通过外力加速氯化钠和水混合,从而加速溶解。
24.(1) 高 密度小、抗腐蚀性强
(2)
澄清石灰水变浑浊
(3) 过滤 Zn、Cu、Fe
(4)解:设硫酸铜溶液中溶质的质量分数为x。
x=10%
答:该硫酸铜溶液中溶质的质量分数是10%。
【详解】(1)①铝合金的强度和硬度一般比纯铝高;
②铝制品应用广泛,是因为铝具有密度小、抗腐蚀性强等优良性能;
(2)一氧化碳和氧化铁高温下生成铁和二氧化碳,化学方程式为:;b处生成的二氧化碳使澄清石灰水变浑浊;
(3)①步骤Ⅰ、Ⅲ中包含的相同操作,将固体和液体分离,是过滤操作;
②步骤Ⅰ加入过量锌粉,锌和硫酸铜反应生成硫酸锌和铜;锌和硫酸亚铁反应生成铁和硫酸锌,过滤后的固体中含有铜、铁和过量的锌;
③步骤Ⅰ后所得的固体中用磁铁吸引,可将铁分离出去,得到铜和锌的混合物,加入硫酸,铜和硫酸不反应,可将铜分离出来,故X为稀硫酸,锌和硫酸反应生成硫酸锌和氢气,化学方程式为:;
(4)过程见答案。
25.(1)
(2)导热
(3) 固体由红棕色逐渐变为黑色
(4) (或) 没有 Al(NO3)3、Zn(NO3)2、Cu(NO3)2
(5)解:设废硫酸中溶质的质量为x,则
废硫酸中溶质的质量分数为
答:废硫酸中溶质的质量分数为20%。
【详解】(1)铁原子的最外层电子数为26-2-8-14=2。
(2)铁可制成铁锅烹调食物,利用了铁的延展性和导热性。
(3)Fe2O3与CO发生反应生成Fe和CO2,V形管中A处可观察到的现象是固体由红棕色逐渐变为黑色;B处V形管内的溶液变浑浊,则发生反应的化学方程式为。
(4)该实验过程中所发生的反应有2个,首先发生反应:;如果AgNO3有剩余,则发生反应:;根据溶液甲呈蓝色,说明溶液中肯定有Cu(NO3)2,2个反应都发生,则锌粉全部溶解,向固体乙上滴加盐酸时没有气泡产生;溶液甲中一定含有的溶质是Al(NO3)3、Zn(NO3)2、Cu(NO3)2。
(5)见答案。
26.(1)水分子之间的间隔增大,而水分子种类不变
(2) 减少二氧化碳的排放
(3)
(4) Fe>X>Z
(5) BC 稀盐酸是液体,大理石是固体,反应条件是常温,因此选择固液常温发生装置 生成二氧化碳的质量为
设稀盐酸中的质量为
稀盐酸的溶质质量分数为。
【解析】(1)
水转化成冰是物质状态的改变,微观是分子之间的间隔增大,而水分子种类不变;故填:分子之间的间隔增大,而水分子种类不变;
(2)
①氢气燃烧生成水,反应的化学方程式为,故填:;
②北京冬奥会场馆使用绿电与使用燃煤发电相比,其优点是减少二氧化碳的排放、减少污染物排放、节约化石燃料等,合理即可。故填:减少二氧化碳的排放;
(3)
乙醇在空气中完全燃烧生成二氧化碳和水,化学方程式为,故填:;
(4)
①氧化铁与一氧化碳在高温的条件下反应生成铁和二氧化碳,化学方程式为,故填:;
②根据金属活动性顺序及其运用,排在氢之前的金属可与稀盐酸和稀硫酸反应,产生氢气。X、Y分别放入稀硫酸中,Y溶液产生氢气,X不反应,所以Y是铁,金属活动性Fe>X,排在前面的金属(除钾钙钠外),可将排在后面的金属从其盐溶液中置换出来,把X和Z分别放入硝酸银溶液中过一会儿。在X表面有银析出,而Z没有变化,所以金属活动性X>Z,综合可知,三者的金属活动性顺序是Fe>X>Z;符合题意的X可以金属铜,铜与硝酸银反应的化学方程式为:,故填:Fe>X>Z;;
(5)
①稀盐酸是液体,大理石是固体,反应条件是是常温,因此选择固液常温发生装置,二氧化碳能溶于水不能使用排水法,密度比空气密度大,选择向上排空气法,故填:BC;稀盐酸是液体,大理石是固体,所以选择固液发生装置B;
②见答案。
【点睛】掌握根据化学方程式的计算即可正确解答最后一题,根据质量守恒定律计算出二氧化碳的质量,是正确解答最后一题的前提和关键。
27.(1) 4g 96g
(2) 蒸发10g水后,溶质的质量分数为:100%≈4.4% 增加5g氯化钠后溶质的质量分数为:100%≈8.6% 增加5g氯化钠和5g水后,溶质的质量分数为:100%≈8.2%
【分析】本题是根据溶质质量分数公式进行计算,, ,。
【详解】(1)将100g4%的NaCl溶液中含氯化钠的质量为:100g×4%=4g;含有水的质量为:100g﹣4g=96g。
(2)①蒸发10g水后,溶质质量不变,溶液质量减少10g,详解见答案。
②增加5g氯化钠后溶质和溶液的质量都增加了5g,详解见答案。
③增加5g氯化钠和5g水后,溶质质量增加了5g,溶液质量增加了10g,详解见答案。
同课章节目录
