化学人教版(2019)必修第一册4.3.2共价键 课件(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3.2共价键 课件(共26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-21 21:25:13 | ||
图片预览



文档简介
(共26张PPT)
第三节 课时2
共价键
第四章 物质结构 元素周期律
【为什么?】
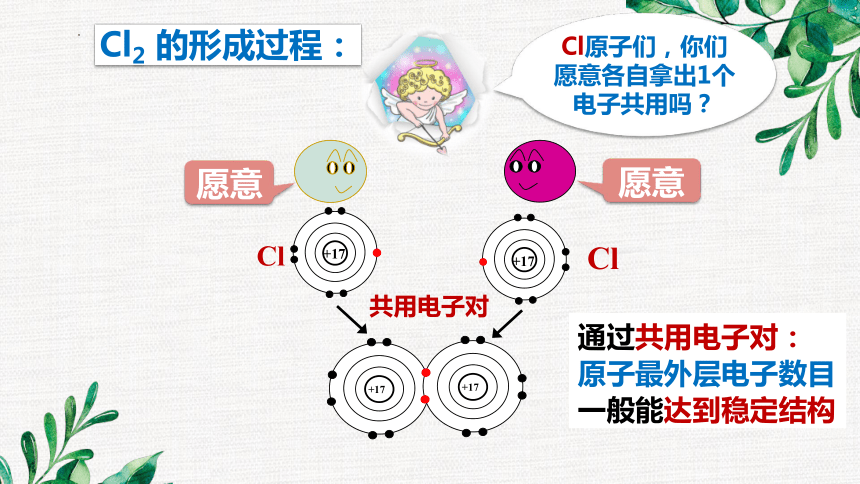
2个H原子结合成氢分子,2个Cl原子结合成氯分子,
而不是3个、4个呢?
为什么1个H原子和1个Cl原子结合成HCl分子,
而不是以其他的个数比结合呢?
愿意
愿意
Cl原子们,你们愿意各自拿出1个电子共用吗?
Cl
+17
Cl
共用电子对
+17
+17
Cl2 的形成过程:
通过共用电子对:
原子最外层电子数目
一般能达到稳定结构
+17
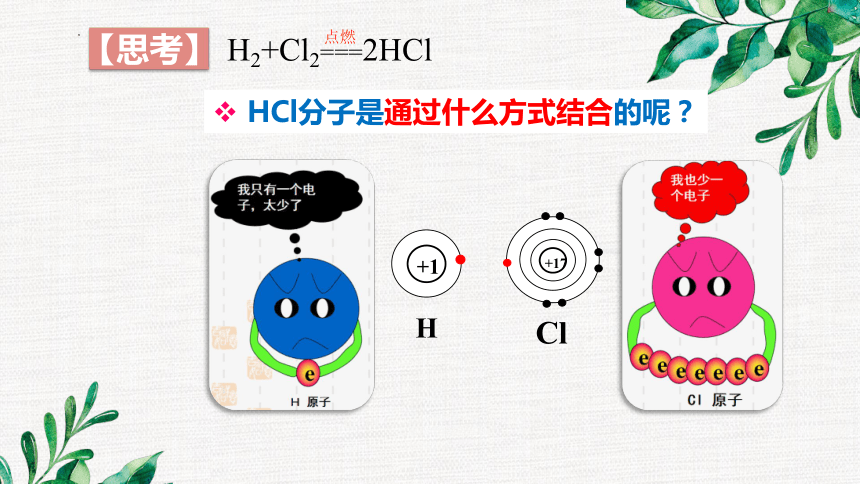
HCl分子是通过什么方式结合的呢?
【思考】
+1
H
+17
Cl
H2+Cl2===2HCl
点燃
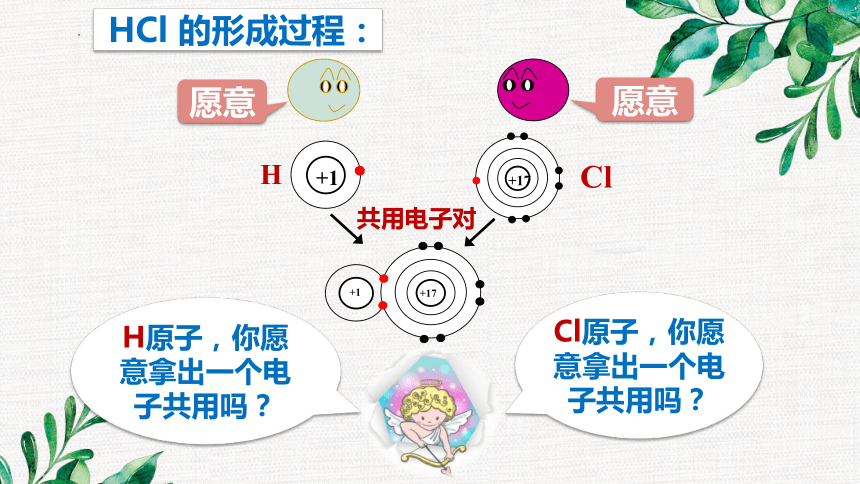
愿意
愿意
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
+1
H
+17
Cl
共用电子对
+17
+1
HCl 的形成过程:
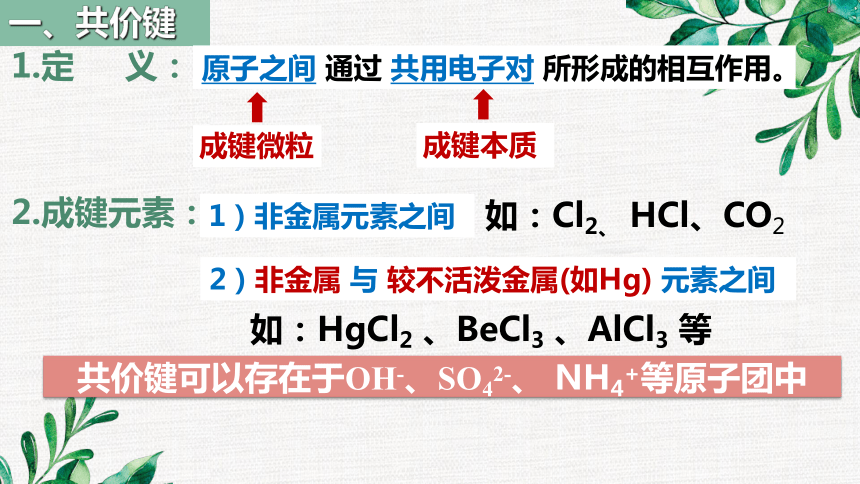
1)非金属元素之间
2)非金属 与 较不活泼金属(如Hg) 元素之间
如:Cl2、 HCl、CO2
如:HgCl2 、BeCl3 、AlCl3 等
一、共价键
原子之间 通过 共用电子对 所形成的相互作用。
成键微粒
成键本质
2.成键元素:
1.定 义:
共价键可以存在于OH-、SO42-、 NH4+等原子团中
如:HCl、 CO2 、NH3
含有共价键的化合物,叫共价化合物
二、共价化合物
(1)含有共价键的分子不一定是共价化合物,
如H2、02是含有共价键的单质。
(2)含有共价键的化合物不一定是共价化合物,
如NaOH、Na2O2是含有共价键的离子化合物。
注意
只
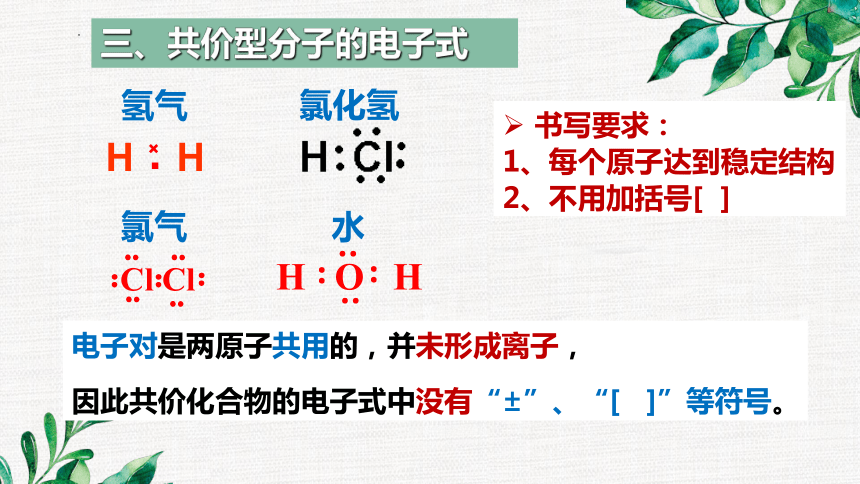
三、共价型分子的电子式
书写要求:
1、每个原子达到稳定结构
2、不用加括号[ ]
电子对是两原子共用的,并未形成离子,
因此共价化合物的电子式中没有“±”、“[ ]”等符号。
氢气
氯化氢
Cl Cl
:
:
:
:
:
:
:
氯气
水
﹕
H O H
﹕
﹕
﹕
H
H
.
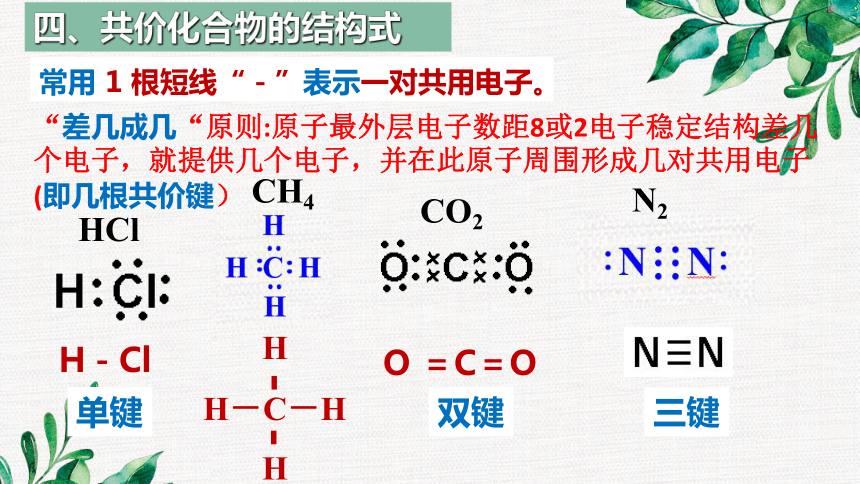
常用 1 根短线“-”表示一对共用电子。
O =C=O
H-Cl
单键
双键
三键
四、共价化合物的结构式
H-C-H
H
H
“差几成几“原则:原子最外层电子数距8或2电子稳定结构差几个电子,就提供几个电子,并在此原子周围形成几对共用电子(即几根共价键)
CH4
CO2
N2
HCl
氯气
氮气
过氧化氢
二氧化碳
甲烷
Cl Cl
:
:
:
:
:
:
:
Cl-Cl
…
N N
··
…
··
N≡N
﹕
﹕
H O O H
﹕
﹕
﹕
﹕
﹕
H-O-O-H
H
H C H
H
﹕
﹕
﹕
﹕
..
..
O C O
..
..
..
..
..
..
O=C=O
H-C -H
H
H
-
-
O = O
氧气
【练习写出下列物质的电子式和结构式】
★ H2 的形成:
H ·
★ HCl分子的形成:
··
· Cl
··
:
· H
+
→
H ·
+
→
Cl
··
··
H
··
··
H H
··
五、共价键的形成过程表示
★ 二氧化碳分子的形成:
★ 氨分子的形成:
3 H·
+
→
· N
··
·
·
﹕
H N
﹕
﹕
﹕
H
H
· C ·
·
·
+
··
· O ·
··
2
→
﹕
O C O
﹕
﹕
﹕
﹕
﹕
﹕
﹕
原子的电子式+原子的电子式 → 分子的电子式
H
H
a=b,
共用电子对无偏向
a> b,
共用电子对偏向Cl
不显电性
相对显正电性
相对显负电性
H
Cl
a
b
a
b
思考: H2中为什么H显0价,HCl中H显+1价 ,Cl显-1价
极性键
成键原子不显电性
一方显正电性,一方显负电性
非极性键
同种
元素
不同种元素
电子对有偏移
电子对没有偏移
共价键
类型
成键元素
成键特征
成键结果
六、共价键的分类
七、化学键 Chemical Bond
小杨老师 15521324728
微信公众号:杨sir化学
1.概念:使离子相结合或原子相结合的作用力。
2.形成与分类:
化学键
离子键
共价键
极性键
非极性键
(得失电子、阴阳离子、静电作用)
(不同原子、共用电子对偏移)
(相同原子、共用电子对不偏移)
【思考】
请判断NaOH、Na2O2属于离子化合物还是共价化合物?写出其相应的电子式,并分析两化合物中的成键情况?
离子键
极性
共价键
非极性共价键
离子键
离子化合物
写出下列物质的电子式,并指出化合物的类型
H2O HClO
NaOH
NH4Cl
共价化合物
共价化合物
离子化合物
离子化合物
课堂练习:
离子化合物
共价化合物
含共价键的离子化合物
课堂练习:
NaOH
H2S
NaOH
MgCl2
H2SO4
KNO3
KNO3
CO2
AlCl3
NH4Cl
NH4Cl
判断下列化合物的类型
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2、NH4Cl、AlCl3
如用化学键的观点来分析H2与Cl2反应的过程,可以把它想象为2个步骤:
步骤一:H2和Cl2中的化学键H-H键和Cl-Cl键断裂(旧化学键的断裂),生成H和Cl原子;
步骤二:H和Cl原子结合生成HCl分子,形成了H和Cl之间的化学键H-Cl(新化学键的形成)
【结论】
一个化学反应的过程,本质上就是旧化学键的断裂和新化学键的形成的过程。
八、用化学键的观点分析化学反应过程
旧键断裂
新键形成
H2+Cl2=2HCl
只有旧化学键断裂没有新化学键形成的变化是化学变化吗?
化学反应中反应物中的化学键会全部被破坏吗
例如:
(NH4)2SO4 + BaCl2 = BaSO4↓ + 2NH4Cl
思考:
SO4 2-中的共价键没有断裂
不是。如食盐的熔化
九、分子间作用力 也叫范德华力
(1)存在:分子之间
分子间存在的将分子聚集在一起的作用力。
(2)强弱:比化学键弱
O
H
H
O
H
H
分子间作用力(较弱)
化学键
(强烈)
1、范德华力:
(3)主要影响:
物质的熔沸点和溶解度
组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。
F2
Cl2
Br2
I2
F2
Cl2
Br2
I2
沸点
熔点
0
-50
-100
-150
-200
-250
50
100
150
200
250
温度/℃
第VIIA族单质的熔、沸点
与相对分子质量的关系
分子间的作用力强弱(范德华力)
0
-50
-100
-150
-200
-250
50
100
150
200
250
温度/℃
×
×
×
×
×
×
CF4
CCl4
CBr4
CF4
CBr4
CI4
沸点
熔点
卤化物的熔沸点与
相对分子质量的关系
CCl4
×
【思考】
请预测下列物质的熔沸点高低变化。
1) CH4 SiH4 GeH4 SnH4
2) HF、HCl、HBr、HI
3) H2O、 H2S 、H2Se、 H2Te
4) NH3、PH3、AsH3、SbH3
一些氢化物的沸点
反常?
氢键的存在
一种特殊的分子间作用力
1. 强弱:化学键>氢键>分子间作用力
主要存在 F、O、N与H之间
2. 主要影响:熔沸点和溶解度
1)使物质的熔沸点升高
(如HF、H2O、NH3)
2)使某些物质在水中的溶解度增大
(如NH3极易溶于水)
六、分子间作用力
2、氢键:
感谢观看!
Thank you!
第三节 课时2
共价键
第四章 物质结构 元素周期律
【为什么?】
2个H原子结合成氢分子,2个Cl原子结合成氯分子,
而不是3个、4个呢?
为什么1个H原子和1个Cl原子结合成HCl分子,
而不是以其他的个数比结合呢?
愿意
愿意
Cl原子们,你们愿意各自拿出1个电子共用吗?
Cl
+17
Cl
共用电子对
+17
+17
Cl2 的形成过程:
通过共用电子对:
原子最外层电子数目
一般能达到稳定结构
+17
HCl分子是通过什么方式结合的呢?
【思考】
+1
H
+17
Cl
H2+Cl2===2HCl
点燃
愿意
愿意
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
+1
H
+17
Cl
共用电子对
+17
+1
HCl 的形成过程:
1)非金属元素之间
2)非金属 与 较不活泼金属(如Hg) 元素之间
如:Cl2、 HCl、CO2
如:HgCl2 、BeCl3 、AlCl3 等
一、共价键
原子之间 通过 共用电子对 所形成的相互作用。
成键微粒
成键本质
2.成键元素:
1.定 义:
共价键可以存在于OH-、SO42-、 NH4+等原子团中
如:HCl、 CO2 、NH3
含有共价键的化合物,叫共价化合物
二、共价化合物
(1)含有共价键的分子不一定是共价化合物,
如H2、02是含有共价键的单质。
(2)含有共价键的化合物不一定是共价化合物,
如NaOH、Na2O2是含有共价键的离子化合物。
注意
只
三、共价型分子的电子式
书写要求:
1、每个原子达到稳定结构
2、不用加括号[ ]
电子对是两原子共用的,并未形成离子,
因此共价化合物的电子式中没有“±”、“[ ]”等符号。
氢气
氯化氢
Cl Cl
:
:
:
:
:
:
:
氯气
水
﹕
H O H
﹕
﹕
﹕
H
H
.
常用 1 根短线“-”表示一对共用电子。
O =C=O
H-Cl
单键
双键
三键
四、共价化合物的结构式
H-C-H
H
H
“差几成几“原则:原子最外层电子数距8或2电子稳定结构差几个电子,就提供几个电子,并在此原子周围形成几对共用电子(即几根共价键)
CH4
CO2
N2
HCl
氯气
氮气
过氧化氢
二氧化碳
甲烷
Cl Cl
:
:
:
:
:
:
:
Cl-Cl
…
N N
··
…
··
N≡N
﹕
﹕
H O O H
﹕
﹕
﹕
﹕
﹕
H-O-O-H
H
H C H
H
﹕
﹕
﹕
﹕
..
..
O C O
..
..
..
..
..
..
O=C=O
H-C -H
H
H
-
-
O = O
氧气
【练习写出下列物质的电子式和结构式】
★ H2 的形成:
H ·
★ HCl分子的形成:
··
· Cl
··
:
· H
+
→
H ·
+
→
Cl
··
··
H
··
··
H H
··
五、共价键的形成过程表示
★ 二氧化碳分子的形成:
★ 氨分子的形成:
3 H·
+
→
· N
··
·
·
﹕
H N
﹕
﹕
﹕
H
H
· C ·
·
·
+
··
· O ·
··
2
→
﹕
O C O
﹕
﹕
﹕
﹕
﹕
﹕
﹕
原子的电子式+原子的电子式 → 分子的电子式
H
H
a=b,
共用电子对无偏向
a> b,
共用电子对偏向Cl
不显电性
相对显正电性
相对显负电性
H
Cl
a
b
a
b
思考: H2中为什么H显0价,HCl中H显+1价 ,Cl显-1价
极性键
成键原子不显电性
一方显正电性,一方显负电性
非极性键
同种
元素
不同种元素
电子对有偏移
电子对没有偏移
共价键
类型
成键元素
成键特征
成键结果
六、共价键的分类
七、化学键 Chemical Bond
小杨老师 15521324728
微信公众号:杨sir化学
1.概念:使离子相结合或原子相结合的作用力。
2.形成与分类:
化学键
离子键
共价键
极性键
非极性键
(得失电子、阴阳离子、静电作用)
(不同原子、共用电子对偏移)
(相同原子、共用电子对不偏移)
【思考】
请判断NaOH、Na2O2属于离子化合物还是共价化合物?写出其相应的电子式,并分析两化合物中的成键情况?
离子键
极性
共价键
非极性共价键
离子键
离子化合物
写出下列物质的电子式,并指出化合物的类型
H2O HClO
NaOH
NH4Cl
共价化合物
共价化合物
离子化合物
离子化合物
课堂练习:
离子化合物
共价化合物
含共价键的离子化合物
课堂练习:
NaOH
H2S
NaOH
MgCl2
H2SO4
KNO3
KNO3
CO2
AlCl3
NH4Cl
NH4Cl
判断下列化合物的类型
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2、NH4Cl、AlCl3
如用化学键的观点来分析H2与Cl2反应的过程,可以把它想象为2个步骤:
步骤一:H2和Cl2中的化学键H-H键和Cl-Cl键断裂(旧化学键的断裂),生成H和Cl原子;
步骤二:H和Cl原子结合生成HCl分子,形成了H和Cl之间的化学键H-Cl(新化学键的形成)
【结论】
一个化学反应的过程,本质上就是旧化学键的断裂和新化学键的形成的过程。
八、用化学键的观点分析化学反应过程
旧键断裂
新键形成
H2+Cl2=2HCl
只有旧化学键断裂没有新化学键形成的变化是化学变化吗?
化学反应中反应物中的化学键会全部被破坏吗
例如:
(NH4)2SO4 + BaCl2 = BaSO4↓ + 2NH4Cl
思考:
SO4 2-中的共价键没有断裂
不是。如食盐的熔化
九、分子间作用力 也叫范德华力
(1)存在:分子之间
分子间存在的将分子聚集在一起的作用力。
(2)强弱:比化学键弱
O
H
H
O
H
H
分子间作用力(较弱)
化学键
(强烈)
1、范德华力:
(3)主要影响:
物质的熔沸点和溶解度
组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。
F2
Cl2
Br2
I2
F2
Cl2
Br2
I2
沸点
熔点
0
-50
-100
-150
-200
-250
50
100
150
200
250
温度/℃
第VIIA族单质的熔、沸点
与相对分子质量的关系
分子间的作用力强弱(范德华力)
0
-50
-100
-150
-200
-250
50
100
150
200
250
温度/℃
×
×
×
×
×
×
CF4
CCl4
CBr4
CF4
CBr4
CI4
沸点
熔点
卤化物的熔沸点与
相对分子质量的关系
CCl4
×
【思考】
请预测下列物质的熔沸点高低变化。
1) CH4 SiH4 GeH4 SnH4
2) HF、HCl、HBr、HI
3) H2O、 H2S 、H2Se、 H2Te
4) NH3、PH3、AsH3、SbH3
一些氢化物的沸点
反常?
氢键的存在
一种特殊的分子间作用力
1. 强弱:化学键>氢键>分子间作用力
主要存在 F、O、N与H之间
2. 主要影响:熔沸点和溶解度
1)使物质的熔沸点升高
(如HF、H2O、NH3)
2)使某些物质在水中的溶解度增大
(如NH3极易溶于水)
六、分子间作用力
2、氢键:
感谢观看!
Thank you!
