化学人教版(2019)必修第一册4.1.2质量数 核素 同位素(共18张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.1.2质量数 核素 同位素(共18张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-21 00:00:00 | ||
图片预览





文档简介
(共18张PPT)
人教版必修第一册
学
第一节 原子结构与元素周期表
第二课时原子结构 核素
第四章 物质结构 元素周期律
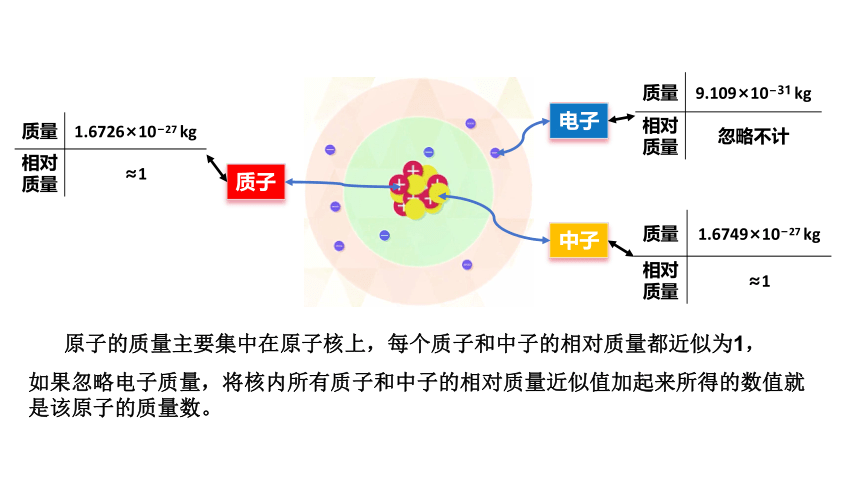
一、原子结构
质子(正电)
原子
(不带电)
原子核
核外电子 (负电)
中子(不带电)
(正电)
电子
质子
中子
质量 1.6726×10 27 kg
相对质量 ≈1
质量 9.109×10 31 kg
相对质量 忽略不计
质量 1.6749×10 27 kg
相对质量 ≈1
原子的质量主要集中在原子核上,每个质子和中子的相对质量都近似为1,
如果忽略电子质量,将核内所有质子和中子的相对质量近似值加起来所得的数值就是该原子的质量数。
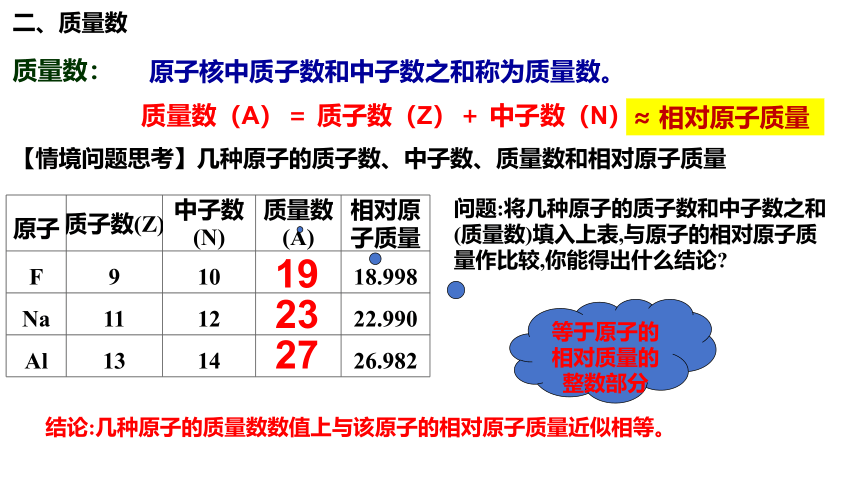
质量数:
原子核中质子数和中子数之和称为质量数。
质量数(A)= 质子数(Z)+ 中子数(N)
【情境问题思考】几种原子的质子数、中子数、质量数和相对原子质量
原子 质子数(Z) 中子数(N) 质量数(A) 相对原子质量
F 9 10 18.998
Na 11 12 22.990
Al 13 14 26.982
问题:将几种原子的质子数和中子数之和(质量数)填入上表,与原子的相对原子质量作比较,你能得出什么结论
19
23
27
等于原子的相对质量的整数部分
结论:几种原子的质量数数值上与该原子的相对原子质量近似相等。
二、质量数
≈ 相对原子质量
原子的表示方法
X
A
Z
质量数 —
质子数 —
—元素符号
含义:
质子数为Z、质量数为A的X原子
理解质量数应注意的问题:
1.质量数一定为整数
2.质量数仅对原子而言,元素没有质量数
3.在计算时,可用质量数代替相对原子质量用于近似计算
O
18
8
质量数A
质子数 Z
质子数=电子数=____
中子数 =_____________
【示例】
8
18 - 8 = 10
12
11
23
11
11 Na 原子中:质子数______,质量数为_____,
中子数为________,电子数为_____。
23
【练一练】
1、氧原子的质量数为16,质子数为8,那么它的中子数是 。
2、钠原子的质量数为23,中子数为12,那么它的质子数是 ,
核外电子数是 。
8
11
11
D
3. 下列关于 的说法错误的是( )
A.质量数为137 B.核内由82个中子
C.核外有55个电子 D.核内有82个质子
氢元素的原子核 原子名称 原子符号
()
质子数(Z) 中子数(N) 1 0 氕
1 1 氘
1 2 氚
请在表格中填写三种氢原子的原子符号
或D
或T
氕、氘、氚的原子结构有何异同?
它们是同一种元素吗?
具有一定数目质子和一定数目中子的一种原子叫做核素。
同一元素的不同核素互称同位素。
元 素
核素1
核素n
核素2
同位素
元素的种类:由原子核内的质子数决定的。
同种元素原子的质子数相同
元素是具有相同质子数(核电荷数)的一类原子的总称。
元素、核素、同位素
元素、核素、同位素、同素异形体的比较
O2和O3互为同位素吗?H2O和D2O互为同位素吗?
元素 核素 同位素 同素异形体
本质 质子数(核电荷数)相同的一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的核素 同种元素组成的不同单质
范畴 同类原子 原子 原子 单质
特性 只有种类, 没有个数 化学反应中的 最小微粒 化学性质相同, 物理性质不同 组成元素相同,性质不同
O2和O3互为同素异构体; H2O和D2O为同种物质。
同位素和同素异形体有什么区别?
3.同位素的应用
(1)、用于制造氢弹;
(2)用于制造原子弹、核发电;
3.同位素的应用
(3)考古时利用测定一些文物的年代;
3.同位素的应用
(4)利用放射性同位素释放的射线育种、治疗恶性肿瘤。
1.在① ② ③ ④ ⑤ ⑥ 中:
(1) 和 互为同位素。
(2) 和 质量数相等,但不能互称同位素。
(3) 和 的中子数相等,但质子数不相等,所以不是同一种元素。
① ⑤
② ⑥
③ ④
7
Li
6
3
N
14
7
Na
23
11
Mg
24
12
Li
3
C
14
6
2、下列各组物质中,互为同位素的是( )
(A)O2、O3 (B)14C、14N
(C)H2O、D2O、 T2O (D)4020Ca 和4220Ca
D
课堂练习
练习1:判断正误:
(1)任何原子都由质子、中子、电子构成( )
(2)23Na和23Mg互为同位素( )
(3)同位素原子的化学性质几乎相同,物理性质略有差异( )
(4)原子的种类大于元素的种类( )
(5) 和+为同一元素的不同微粒( )
练习2:现有下列基本粒子:1H、2H、3H、6Li、7Li、14C、14N、16O、18O、23Na、24Mg、35Cl2、37Cl2、40K、40Ca。请回答下列问题:
(1)以上15种微粒中共有____种核素,共_____种元素。
(2)互为同位素的是_____________、_________、__________。
(3)质量数相等的是_________、__________;中子数相等的是_________、___________。
√
×
×
√
√
1H、2H、3H
6Li、7Li
14C、14N
40K、40Ca
13
10
16O、18O
14C、16O
23Na、24Mg
课堂练习
练习3:同位素示踪技术已广泛应用在农业、工业、医学、地质及考古等领域。下列有关叙述正确的是( )
A.14C与12C是两种不同的元素或核素
B.通过化学变化可以实现16O与18O之间的相互转化
C.35Cl2与37Cl2互为同素异形体
D.铯元素的两种核素中137Cs比133Cs多4个中子
练习4:医学界通过用14C标记的C60发现一种C60的羧酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病病毒的繁殖,则有关14C的正确叙述是( )
A.与12C60中的碳原子化学性质不同 B.核内质子数为8
C.是12C60的同素异形体 D.与12C、13C互为同位素
D
D
一种核素转变成另一种核素不属于物理变化,也不属于化学变化
是原子核的变化,属于核反应
阴、阳离子电子数的计算方法:
原子中:核外电子数=核电荷数 = 质子数 = 原子序数
+11
Na+ Cl-
Na
Cl
Cl-
Na+
2
8
1
+11
2
8
+17
7
8
2
+17
8
8
2
-e-
+e-
阳离子:核外电子数=
质子数 -离子电荷数
阴离子:核外电子数=
质子数+离子电荷数
某微粒用 表示,下列关于该微粒的叙述正确的是( )
(A)所含质子数=A-n (B)所含中子数=A-Z
(C)所含电子数=Z+n (D)质量数=Z+A
B
心情不好~~~
作业好多~~~
人教版必修第一册
学
第一节 原子结构与元素周期表
第二课时原子结构 核素
第四章 物质结构 元素周期律
一、原子结构
质子(正电)
原子
(不带电)
原子核
核外电子 (负电)
中子(不带电)
(正电)
电子
质子
中子
质量 1.6726×10 27 kg
相对质量 ≈1
质量 9.109×10 31 kg
相对质量 忽略不计
质量 1.6749×10 27 kg
相对质量 ≈1
原子的质量主要集中在原子核上,每个质子和中子的相对质量都近似为1,
如果忽略电子质量,将核内所有质子和中子的相对质量近似值加起来所得的数值就是该原子的质量数。
质量数:
原子核中质子数和中子数之和称为质量数。
质量数(A)= 质子数(Z)+ 中子数(N)
【情境问题思考】几种原子的质子数、中子数、质量数和相对原子质量
原子 质子数(Z) 中子数(N) 质量数(A) 相对原子质量
F 9 10 18.998
Na 11 12 22.990
Al 13 14 26.982
问题:将几种原子的质子数和中子数之和(质量数)填入上表,与原子的相对原子质量作比较,你能得出什么结论
19
23
27
等于原子的相对质量的整数部分
结论:几种原子的质量数数值上与该原子的相对原子质量近似相等。
二、质量数
≈ 相对原子质量
原子的表示方法
X
A
Z
质量数 —
质子数 —
—元素符号
含义:
质子数为Z、质量数为A的X原子
理解质量数应注意的问题:
1.质量数一定为整数
2.质量数仅对原子而言,元素没有质量数
3.在计算时,可用质量数代替相对原子质量用于近似计算
O
18
8
质量数A
质子数 Z
质子数=电子数=____
中子数 =_____________
【示例】
8
18 - 8 = 10
12
11
23
11
11 Na 原子中:质子数______,质量数为_____,
中子数为________,电子数为_____。
23
【练一练】
1、氧原子的质量数为16,质子数为8,那么它的中子数是 。
2、钠原子的质量数为23,中子数为12,那么它的质子数是 ,
核外电子数是 。
8
11
11
D
3. 下列关于 的说法错误的是( )
A.质量数为137 B.核内由82个中子
C.核外有55个电子 D.核内有82个质子
氢元素的原子核 原子名称 原子符号
()
质子数(Z) 中子数(N) 1 0 氕
1 1 氘
1 2 氚
请在表格中填写三种氢原子的原子符号
或D
或T
氕、氘、氚的原子结构有何异同?
它们是同一种元素吗?
具有一定数目质子和一定数目中子的一种原子叫做核素。
同一元素的不同核素互称同位素。
元 素
核素1
核素n
核素2
同位素
元素的种类:由原子核内的质子数决定的。
同种元素原子的质子数相同
元素是具有相同质子数(核电荷数)的一类原子的总称。
元素、核素、同位素
元素、核素、同位素、同素异形体的比较
O2和O3互为同位素吗?H2O和D2O互为同位素吗?
元素 核素 同位素 同素异形体
本质 质子数(核电荷数)相同的一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的核素 同种元素组成的不同单质
范畴 同类原子 原子 原子 单质
特性 只有种类, 没有个数 化学反应中的 最小微粒 化学性质相同, 物理性质不同 组成元素相同,性质不同
O2和O3互为同素异构体; H2O和D2O为同种物质。
同位素和同素异形体有什么区别?
3.同位素的应用
(1)、用于制造氢弹;
(2)用于制造原子弹、核发电;
3.同位素的应用
(3)考古时利用测定一些文物的年代;
3.同位素的应用
(4)利用放射性同位素释放的射线育种、治疗恶性肿瘤。
1.在① ② ③ ④ ⑤ ⑥ 中:
(1) 和 互为同位素。
(2) 和 质量数相等,但不能互称同位素。
(3) 和 的中子数相等,但质子数不相等,所以不是同一种元素。
① ⑤
② ⑥
③ ④
7
Li
6
3
N
14
7
Na
23
11
Mg
24
12
Li
3
C
14
6
2、下列各组物质中,互为同位素的是( )
(A)O2、O3 (B)14C、14N
(C)H2O、D2O、 T2O (D)4020Ca 和4220Ca
D
课堂练习
练习1:判断正误:
(1)任何原子都由质子、中子、电子构成( )
(2)23Na和23Mg互为同位素( )
(3)同位素原子的化学性质几乎相同,物理性质略有差异( )
(4)原子的种类大于元素的种类( )
(5) 和+为同一元素的不同微粒( )
练习2:现有下列基本粒子:1H、2H、3H、6Li、7Li、14C、14N、16O、18O、23Na、24Mg、35Cl2、37Cl2、40K、40Ca。请回答下列问题:
(1)以上15种微粒中共有____种核素,共_____种元素。
(2)互为同位素的是_____________、_________、__________。
(3)质量数相等的是_________、__________;中子数相等的是_________、___________。
√
×
×
√
√
1H、2H、3H
6Li、7Li
14C、14N
40K、40Ca
13
10
16O、18O
14C、16O
23Na、24Mg
课堂练习
练习3:同位素示踪技术已广泛应用在农业、工业、医学、地质及考古等领域。下列有关叙述正确的是( )
A.14C与12C是两种不同的元素或核素
B.通过化学变化可以实现16O与18O之间的相互转化
C.35Cl2与37Cl2互为同素异形体
D.铯元素的两种核素中137Cs比133Cs多4个中子
练习4:医学界通过用14C标记的C60发现一种C60的羧酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病病毒的繁殖,则有关14C的正确叙述是( )
A.与12C60中的碳原子化学性质不同 B.核内质子数为8
C.是12C60的同素异形体 D.与12C、13C互为同位素
D
D
一种核素转变成另一种核素不属于物理变化,也不属于化学变化
是原子核的变化,属于核反应
阴、阳离子电子数的计算方法:
原子中:核外电子数=核电荷数 = 质子数 = 原子序数
+11
Na+ Cl-
Na
Cl
Cl-
Na+
2
8
1
+11
2
8
+17
7
8
2
+17
8
8
2
-e-
+e-
阳离子:核外电子数=
质子数 -离子电荷数
阴离子:核外电子数=
质子数+离子电荷数
某微粒用 表示,下列关于该微粒的叙述正确的是( )
(A)所含质子数=A-n (B)所含中子数=A-Z
(C)所含电子数=Z+n (D)质量数=Z+A
B
心情不好~~~
作业好多~~~
