化学人教版(2019)必修第一册3.1.2铁的氢氧化物 铁盐和亚铁盐(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1.2铁的氢氧化物 铁盐和亚铁盐(共24张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 45.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-21 22:07:50 | ||
图片预览





文档简介
(共24张PPT)
铁的氢氧化物 铁盐和亚铁盐
【实验3-1】在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
【实验3-1】在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
FeCl3 溶液 FeSO4溶液
加NaOH溶液
化学方程式 离子方程式
产生红褐色沉淀
FeCl3 + 3NaOH =
Fe(OH)3↓+3NaCl
Fe3++3OH- =Fe(OH)3↓
FeSO4+ 2NaOH =
Fe(OH)2 ↓+Na2SO4
Fe2+ + 2OH- = Fe(OH)2 ↓
4Fe(OH)2 +2H2O + O2= 4Fe(OH)3↓
产生白色絮状沉淀,迅速变成灰绿色,最后变成红褐色
改进实验装置,制造非氧环境。
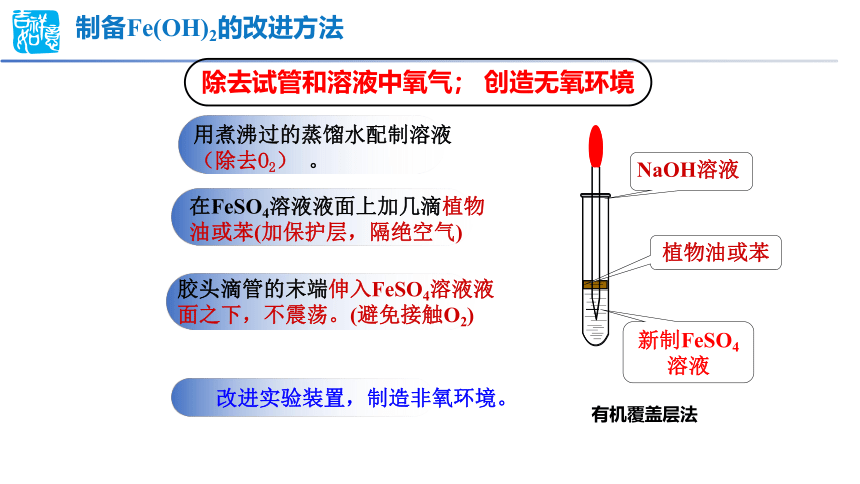
用煮沸过的蒸馏水配制溶液(除去O2) 。
在FeSO4溶液液面上加几滴植物油或苯(加保护层,隔绝空气)
新制FeSO4溶液
植物油或苯
NaOH溶液
胶头滴管的末端伸入FeSO4溶液液面之下,不震荡。(避免接触O2)
除去试管和溶液中氧气; 创造无氧环境
制备Fe(OH)2的改进方法
有机覆盖层法
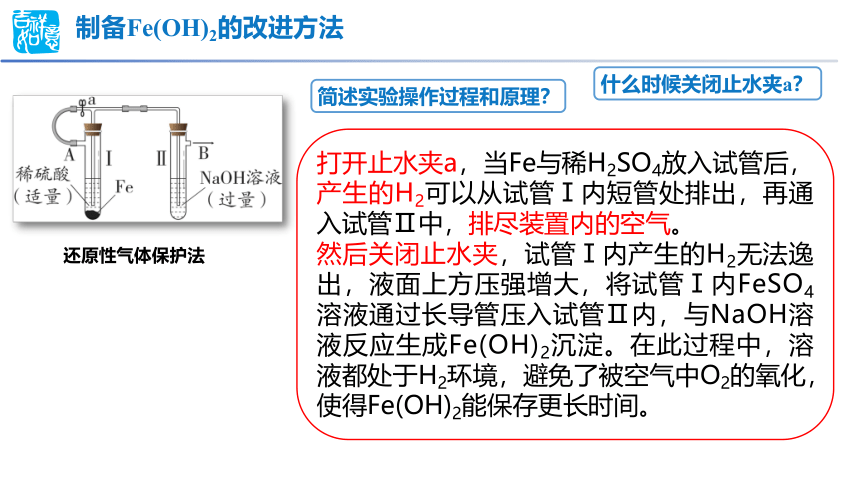
制备Fe(OH)2的改进方法
简述实验操作过程和原理?
打开止水夹a,当Fe与稀H2SO4放入试管后,产生的H2可以从试管Ⅰ内短管处排出,再通入试管Ⅱ中,排尽装置内的空气。
然后关闭止水夹,试管Ⅰ内产生的H2无法逸出,液面上方压强增大,将试管Ⅰ内FeSO4溶液通过长导管压入试管Ⅱ内,与NaOH溶液反应生成Fe(OH)2沉淀。在此过程中,溶液都处于H2环境,避免了被空气中O2的氧化,使得Fe(OH)2能保存更长时间。
什么时候关闭止水夹a?
还原性气体保护法
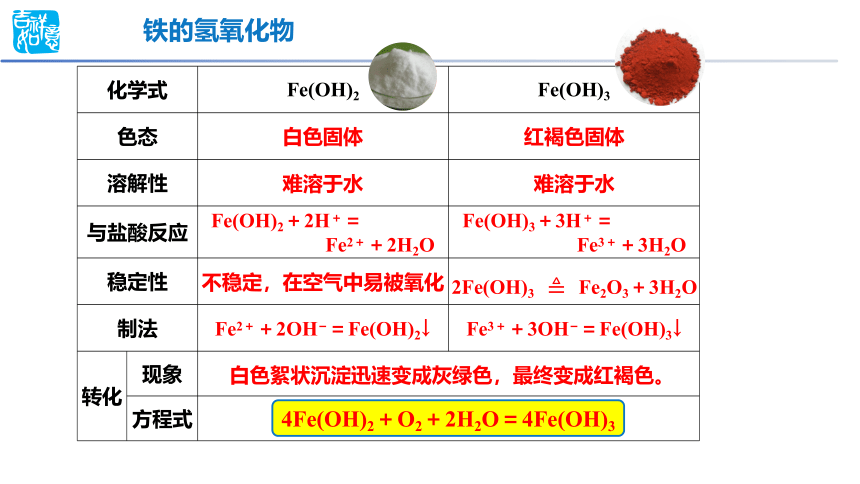
化学式 Fe(OH)2 Fe(OH)3
色态
溶解性
与盐酸反应
稳定性
制法
转化 现象 方程式 铁的氢氧化物
白色固体
红褐色固体
Fe(OH)2+2H+=
Fe2++2H2O
Fe(OH)3+3H+=
Fe3++3H2O
2Fe(OH)3Fe2O3+3H2O
Fe2++2OH =Fe(OH)2↓
Fe3++3OH =Fe(OH)3↓
白色絮状沉淀迅速变成灰绿色,最终变成红褐色。
4Fe(OH)2+O2+2H2O=4Fe(OH)3
难溶于水
难溶于水
不稳定,在空气中易被氧化
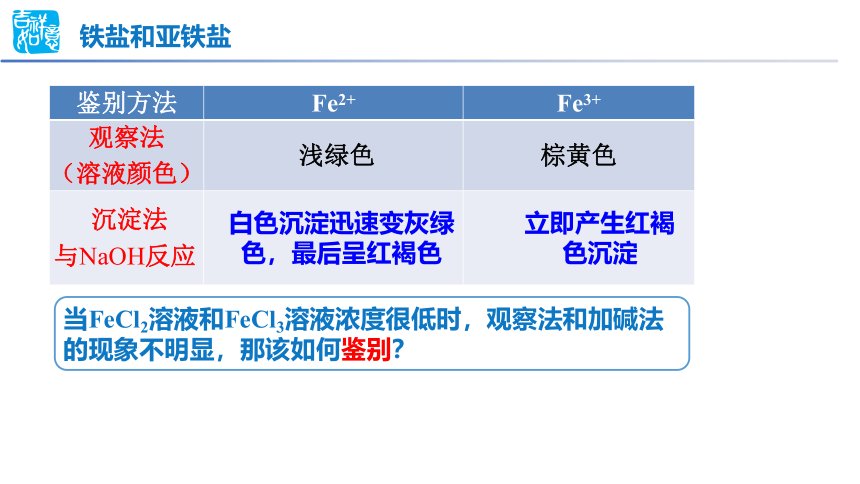
当FeCl2溶液和FeCl3溶液浓度很低时,观察法和加碱法的现象不明显,那该如何鉴别?
铁盐和亚铁盐
鉴别方法 Fe2+ Fe3+
观察法 (溶液颜色) 浅绿色 棕黄色
沉淀法 与NaOH反应
白色沉淀迅速变灰绿色,最后呈红褐色
立即产生红褐色沉淀
铁盐和亚铁盐
【实验3-2】在两支试管中分别加入少量的FeCl3溶液和FeCl2溶液,然后各滴入KSCN溶液。观察并记录现象。
铁盐和亚铁盐
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
【实验3-2】
(棕黄色)
(浅绿色)
溶液呈血红色
无变化
Fe3++3SCN-=Fe(SCN)3
血红色
硫氰化钾
【实验3-3】向盛有 2 mL FeCl3 溶液的试管中加入少量铁粉,振荡试管。充分反应后,滴入几滴KSCN溶液,观察实验现象。把上层清液转移至另一支试管,滴入几滴氯水,又发生了什么变化?
铁盐和亚铁盐
铁盐和亚铁盐
FeCl3溶液
铁粉
无明显现象
溶液变成红色
FeCl3溶液中的Fe3+被铁粉还原成Fe2+,Fe2+不能与KSCN溶液反应,则观察到溶液无明显现象。
2Fe3+ + Fe = 3Fe2+
Fe2+被Cl2氧化成Fe3+,与KSCN溶液反应,观察到溶液变成红色。
2Fe2+ + Cl2=2Fe3+ + 2Cl-
几滴KSCN溶液
几滴氯水
铁盐和亚铁盐
因为Fe2+ 易被氧化生成Fe3+ ,而Fe3+可与铁发生反应,
故配制亚铁盐溶液时加入铁钉或铁粉可防止亚铁盐被氧化。
为什么在配制FeCl2或FeSO4溶液时,通常还要往溶液中加入少量铁钉或铁粉?
2Fe3+ + Fe = 3Fe2+
新制FeSO4溶液
NaOH溶液
思考与讨论
覆铜板是由绝缘板和铜箔热压而成的板状材料,常用来制作印刷电路板。利用FeCl3溶液作为腐蚀液,把不需要的铜腐蚀。预设计好的电路用蜡覆盖,保护电路不被腐蚀。
写出反应原理的化学方程式并用双线桥表示电子转移?
2FeCl3+Cu=2FeCl2+CuCl2
得到 2e
失去 2×e
【思考】如何从使用过的腐蚀废液中回收铜,并重新制得纯净的FeCl3溶液?
分别写出步骤①、⑤中反应的离子方程式① 、 。
⑤ 。
2Fe2++Cl2=2Fe3++2Cl-
Cu
Fe+2Fe3+=3Fe2+
Fe+Cu 2+=Fe2++Cu
铁粉
Fe Cl2
Fe、Cu
FeCl3、FeCl2、CuCl2
盐酸
氯气
Fe、Fe2+、Fe3+的转化(铁三角)
1. Fe只有还原性,可以被氧化成+2价或+3价的铁
①Fe能被Fe3+、Cu2+、H+、S等较弱氧化剂氧化为Fe2+
与Fe3+:__________________________________
与Cu2+:__________________________________
与H+:____________________________________
与S:_____________________________________
Fe+2Fe3+===3Fe2+
Fe+Cu2+===Fe2++Cu
Fe+2H+===Fe2++H2↑
Fe+S === FeS
△
②Fe能被Cl2等强氧化剂氧化为Fe3+
与Cl2:______________________________________
2Fe+3Cl2 ===== 2FeCl3
点燃
2. Fe2+既有氧化性又有还原性,主要表现还原性
①还原性:Fe2+能被Cl2等氧化为Fe3+
与Cl2:_____________________________________________
②氧化性:Fe2+能被Zn等还原为Fe
如与Zn:Fe2++Zn===Fe+Zn2+
2Fe2++Cl2===2Fe3++2Cl-
Fe、Fe2+、Fe3+的转化(铁三角)
3. Fe3+具有较强的氧化性
①能被Fe、Cu还原成Fe2+
与Fe:_____________________________________________
与Cu:______________________________________________
2Fe3++Fe===3Fe2+
2Fe3++Cu===2Fe2++Cu2+
Fe、Fe2+、Fe3+的转化(铁三角)
②能被CO等还原成Fe
如与CO反应:
Fe2O3 + 3CO 2Fe + 3CO2
高温
Fe3+、Cu2+、H+、S
Zn
Cl2
CO
Cl2
Fe、Zn
Fe3+
Fe2+
Fe
思维启迪
Fe、Fe2+和Fe3+的转化关系
铁三角
弱氧化剂
强氧化剂
强氧化剂
课堂练习
为什么在配制FeSO4溶液时,通常还要往溶液中加入铁粉?
Fe(OH)3、FeCl2、FeCl3是否都可由化合反应得到?
防止Fe2+被空气氧化。
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2FeCl3+Fe=3FeCl2
2Fe+3Cl2 2FeCl3
2FeCl2+Cl2=2FeCl3
1、下列物质跟铁反应后的生成物,能跟KSCN溶液作用生成红色溶液的是 ( )
A. 盐酸 B. 氯气 C. CuSO4溶液 D. 稀硫酸
B
2、证明某溶液只含有Fe2+而不含Fe3+的实验方法是( )
A.先滴加氯水,再滴加KSCN溶液后显红色
B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C.滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后显红褐色
D.加入几滴酸性高锰酸钾溶液,高锰酸钾溶液褪色
B
3、有NaCl、FeCl3、FeCl2、 MgCl2、CuCl2五种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是 ( )
A.盐酸 B.AgNO3溶液 C.硫酸 D.烧碱溶液
D
4、(双选)下列反应离子方程式正确的是 ( )
A.铁跟FeCl3溶液反应: Fe+Fe3+ = 2Fe2+
B.Fe跟稀盐酸反应: 2Fe+6H+=2Fe3++3H2↑
C.Fe(OH)3跟盐酸反应: Fe(OH)3+3H+=3H2O+Fe3+
D.FeCl3溶液跟KSCN溶液反应:
3SCN- +Fe3+=Fe(SCN)3↓
CE
E.FeCl2溶液跟Cl2反应:2Fe2+ + Cl2= 2Fe3+ +2Cl-
铁的价类二维图
物质类别
化合价
单质
氧化物
氢氧化物
盐
0
+2
+3
Fe
FeO
Fe2O3
Fe(OH)2
Fe(OH)3
Fe2+
Fe3+
Fe3O4
Fe2(SO4)3
FeSO4
FeCl3
FeCl2
①
②
③
④
⑤
⑥
⑦
写出编号对应的化学方程式或离子方程式?
⑧
⑨
⑩
ⅩⅠ
ⅩⅡ
K2FeO4
+6
铁的氢氧化物 铁盐和亚铁盐
【实验3-1】在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
【实验3-1】在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
FeCl3 溶液 FeSO4溶液
加NaOH溶液
化学方程式 离子方程式
产生红褐色沉淀
FeCl3 + 3NaOH =
Fe(OH)3↓+3NaCl
Fe3++3OH- =Fe(OH)3↓
FeSO4+ 2NaOH =
Fe(OH)2 ↓+Na2SO4
Fe2+ + 2OH- = Fe(OH)2 ↓
4Fe(OH)2 +2H2O + O2= 4Fe(OH)3↓
产生白色絮状沉淀,迅速变成灰绿色,最后变成红褐色
改进实验装置,制造非氧环境。
用煮沸过的蒸馏水配制溶液(除去O2) 。
在FeSO4溶液液面上加几滴植物油或苯(加保护层,隔绝空气)
新制FeSO4溶液
植物油或苯
NaOH溶液
胶头滴管的末端伸入FeSO4溶液液面之下,不震荡。(避免接触O2)
除去试管和溶液中氧气; 创造无氧环境
制备Fe(OH)2的改进方法
有机覆盖层法
制备Fe(OH)2的改进方法
简述实验操作过程和原理?
打开止水夹a,当Fe与稀H2SO4放入试管后,产生的H2可以从试管Ⅰ内短管处排出,再通入试管Ⅱ中,排尽装置内的空气。
然后关闭止水夹,试管Ⅰ内产生的H2无法逸出,液面上方压强增大,将试管Ⅰ内FeSO4溶液通过长导管压入试管Ⅱ内,与NaOH溶液反应生成Fe(OH)2沉淀。在此过程中,溶液都处于H2环境,避免了被空气中O2的氧化,使得Fe(OH)2能保存更长时间。
什么时候关闭止水夹a?
还原性气体保护法
化学式 Fe(OH)2 Fe(OH)3
色态
溶解性
与盐酸反应
稳定性
制法
转化 现象 方程式 铁的氢氧化物
白色固体
红褐色固体
Fe(OH)2+2H+=
Fe2++2H2O
Fe(OH)3+3H+=
Fe3++3H2O
2Fe(OH)3Fe2O3+3H2O
Fe2++2OH =Fe(OH)2↓
Fe3++3OH =Fe(OH)3↓
白色絮状沉淀迅速变成灰绿色,最终变成红褐色。
4Fe(OH)2+O2+2H2O=4Fe(OH)3
难溶于水
难溶于水
不稳定,在空气中易被氧化
当FeCl2溶液和FeCl3溶液浓度很低时,观察法和加碱法的现象不明显,那该如何鉴别?
铁盐和亚铁盐
鉴别方法 Fe2+ Fe3+
观察法 (溶液颜色) 浅绿色 棕黄色
沉淀法 与NaOH反应
白色沉淀迅速变灰绿色,最后呈红褐色
立即产生红褐色沉淀
铁盐和亚铁盐
【实验3-2】在两支试管中分别加入少量的FeCl3溶液和FeCl2溶液,然后各滴入KSCN溶液。观察并记录现象。
铁盐和亚铁盐
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
【实验3-2】
(棕黄色)
(浅绿色)
溶液呈血红色
无变化
Fe3++3SCN-=Fe(SCN)3
血红色
硫氰化钾
【实验3-3】向盛有 2 mL FeCl3 溶液的试管中加入少量铁粉,振荡试管。充分反应后,滴入几滴KSCN溶液,观察实验现象。把上层清液转移至另一支试管,滴入几滴氯水,又发生了什么变化?
铁盐和亚铁盐
铁盐和亚铁盐
FeCl3溶液
铁粉
无明显现象
溶液变成红色
FeCl3溶液中的Fe3+被铁粉还原成Fe2+,Fe2+不能与KSCN溶液反应,则观察到溶液无明显现象。
2Fe3+ + Fe = 3Fe2+
Fe2+被Cl2氧化成Fe3+,与KSCN溶液反应,观察到溶液变成红色。
2Fe2+ + Cl2=2Fe3+ + 2Cl-
几滴KSCN溶液
几滴氯水
铁盐和亚铁盐
因为Fe2+ 易被氧化生成Fe3+ ,而Fe3+可与铁发生反应,
故配制亚铁盐溶液时加入铁钉或铁粉可防止亚铁盐被氧化。
为什么在配制FeCl2或FeSO4溶液时,通常还要往溶液中加入少量铁钉或铁粉?
2Fe3+ + Fe = 3Fe2+
新制FeSO4溶液
NaOH溶液
思考与讨论
覆铜板是由绝缘板和铜箔热压而成的板状材料,常用来制作印刷电路板。利用FeCl3溶液作为腐蚀液,把不需要的铜腐蚀。预设计好的电路用蜡覆盖,保护电路不被腐蚀。
写出反应原理的化学方程式并用双线桥表示电子转移?
2FeCl3+Cu=2FeCl2+CuCl2
得到 2e
失去 2×e
【思考】如何从使用过的腐蚀废液中回收铜,并重新制得纯净的FeCl3溶液?
分别写出步骤①、⑤中反应的离子方程式① 、 。
⑤ 。
2Fe2++Cl2=2Fe3++2Cl-
Cu
Fe+2Fe3+=3Fe2+
Fe+Cu 2+=Fe2++Cu
铁粉
Fe Cl2
Fe、Cu
FeCl3、FeCl2、CuCl2
盐酸
氯气
Fe、Fe2+、Fe3+的转化(铁三角)
1. Fe只有还原性,可以被氧化成+2价或+3价的铁
①Fe能被Fe3+、Cu2+、H+、S等较弱氧化剂氧化为Fe2+
与Fe3+:__________________________________
与Cu2+:__________________________________
与H+:____________________________________
与S:_____________________________________
Fe+2Fe3+===3Fe2+
Fe+Cu2+===Fe2++Cu
Fe+2H+===Fe2++H2↑
Fe+S === FeS
△
②Fe能被Cl2等强氧化剂氧化为Fe3+
与Cl2:______________________________________
2Fe+3Cl2 ===== 2FeCl3
点燃
2. Fe2+既有氧化性又有还原性,主要表现还原性
①还原性:Fe2+能被Cl2等氧化为Fe3+
与Cl2:_____________________________________________
②氧化性:Fe2+能被Zn等还原为Fe
如与Zn:Fe2++Zn===Fe+Zn2+
2Fe2++Cl2===2Fe3++2Cl-
Fe、Fe2+、Fe3+的转化(铁三角)
3. Fe3+具有较强的氧化性
①能被Fe、Cu还原成Fe2+
与Fe:_____________________________________________
与Cu:______________________________________________
2Fe3++Fe===3Fe2+
2Fe3++Cu===2Fe2++Cu2+
Fe、Fe2+、Fe3+的转化(铁三角)
②能被CO等还原成Fe
如与CO反应:
Fe2O3 + 3CO 2Fe + 3CO2
高温
Fe3+、Cu2+、H+、S
Zn
Cl2
CO
Cl2
Fe、Zn
Fe3+
Fe2+
Fe
思维启迪
Fe、Fe2+和Fe3+的转化关系
铁三角
弱氧化剂
强氧化剂
强氧化剂
课堂练习
为什么在配制FeSO4溶液时,通常还要往溶液中加入铁粉?
Fe(OH)3、FeCl2、FeCl3是否都可由化合反应得到?
防止Fe2+被空气氧化。
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2FeCl3+Fe=3FeCl2
2Fe+3Cl2 2FeCl3
2FeCl2+Cl2=2FeCl3
1、下列物质跟铁反应后的生成物,能跟KSCN溶液作用生成红色溶液的是 ( )
A. 盐酸 B. 氯气 C. CuSO4溶液 D. 稀硫酸
B
2、证明某溶液只含有Fe2+而不含Fe3+的实验方法是( )
A.先滴加氯水,再滴加KSCN溶液后显红色
B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C.滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后显红褐色
D.加入几滴酸性高锰酸钾溶液,高锰酸钾溶液褪色
B
3、有NaCl、FeCl3、FeCl2、 MgCl2、CuCl2五种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是 ( )
A.盐酸 B.AgNO3溶液 C.硫酸 D.烧碱溶液
D
4、(双选)下列反应离子方程式正确的是 ( )
A.铁跟FeCl3溶液反应: Fe+Fe3+ = 2Fe2+
B.Fe跟稀盐酸反应: 2Fe+6H+=2Fe3++3H2↑
C.Fe(OH)3跟盐酸反应: Fe(OH)3+3H+=3H2O+Fe3+
D.FeCl3溶液跟KSCN溶液反应:
3SCN- +Fe3+=Fe(SCN)3↓
CE
E.FeCl2溶液跟Cl2反应:2Fe2+ + Cl2= 2Fe3+ +2Cl-
铁的价类二维图
物质类别
化合价
单质
氧化物
氢氧化物
盐
0
+2
+3
Fe
FeO
Fe2O3
Fe(OH)2
Fe(OH)3
Fe2+
Fe3+
Fe3O4
Fe2(SO4)3
FeSO4
FeCl3
FeCl2
①
②
③
④
⑤
⑥
⑦
写出编号对应的化学方程式或离子方程式?
⑧
⑨
⑩
ⅩⅠ
ⅩⅡ
K2FeO4
+6
