化学人教版(2019)必修第一册1.2.2离子反应(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.2.2离子反应(共22张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 843.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-22 08:31:15 | ||
图片预览





文档简介
(共22张PPT)
第2章 第2节
电解质的电离 离子反应
第2课时 离子反应
知识导航
1
2
离子反应及其发生条件
离子方程式的书写及其正误判断
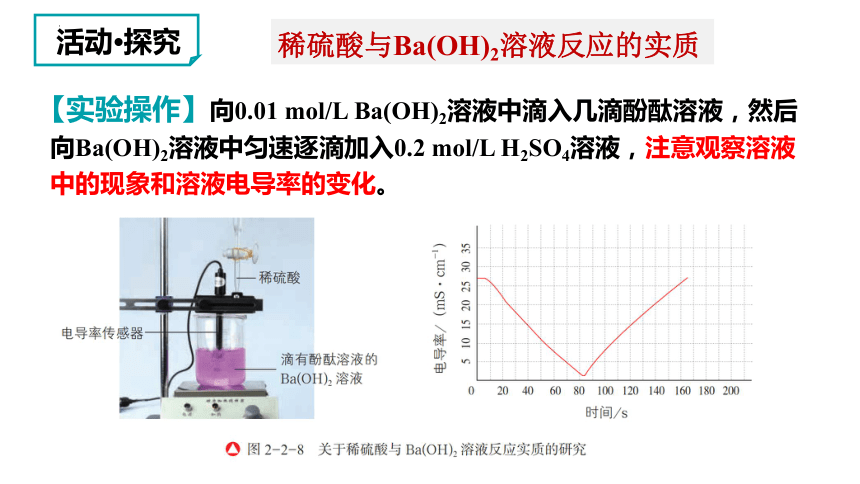
稀硫酸与Ba(OH)2溶液反应的实质
活动 探究
【实验操作】向0.01 mol/L Ba(OH)2溶液中滴入几滴酚酞溶液,然后
向Ba(OH)2溶液中匀速逐滴加入0.2 mol/L H2SO4溶液,注意观察溶液
中的现象和溶液电导率的变化。
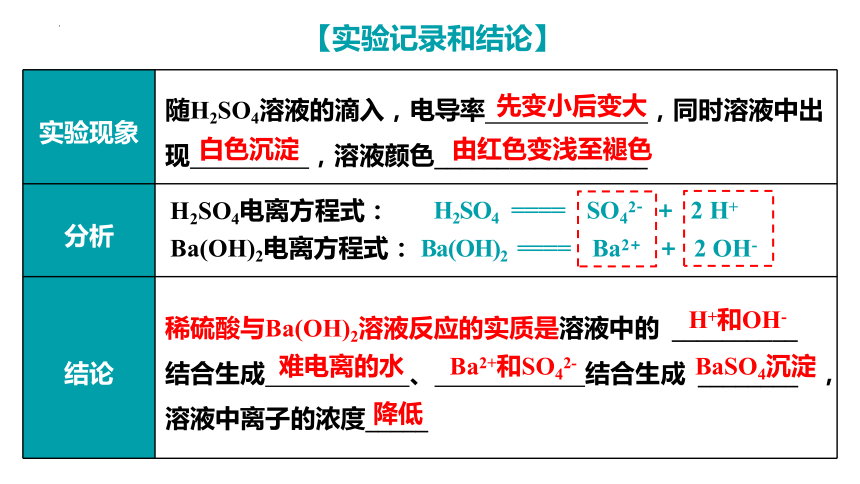
实验现象 随H2SO4溶液的滴入,电导率 ,同时溶液中出现 ,溶液颜色_________________
分析
结论 稀硫酸与Ba(OH)2溶液反应的实质是溶液中的 __________
结合生成 、 结合生成 ________ ,溶液中离子的浓度_____
【实验记录和结论】
先变小后变大
白色沉淀
由红色变浅至褪色
H+和OH-
难电离的水
BaSO4沉淀
降低
Ba2+和SO42-
H2SO4电离方程式:
Ba(OH)2电离方程式:
Ba(OH)2 ==== Ba2+ + 2 OH-
H2SO4 ==== SO42- + 2 H+
稀硫酸与NaOH溶液反应
H2SO4 = 2H+ + SO42-
NaOH= Na+ + OH-
H2SO4 + 2 NaOH = 2 H2O+ Na2SO4
Na2SO4= 2Na+ + SO42-
反应前溶液中的离子
反应后溶液中的离子
反应本质:H+ + OH- = H2O
反应前后离子浓度的变化:H+、OH- 离子浓度减少
CuSO4溶液与NaOH溶液反应
反应前溶液中的离子
反应后溶液中的离子
反应本质: Cu2+ + 2 OH- = Cu(OH)2 ↓
反应前后离子浓度的变化: Cu2+ 、OH- 离子浓度减少
CuSO4 = Cu2+ + SO42-
NaOH= Na+ + OH-
CuSO4 + 2 NaOH = Cu(OH)2↓ + Na2SO4
Na2SO4= 2 Na+ + SO42-
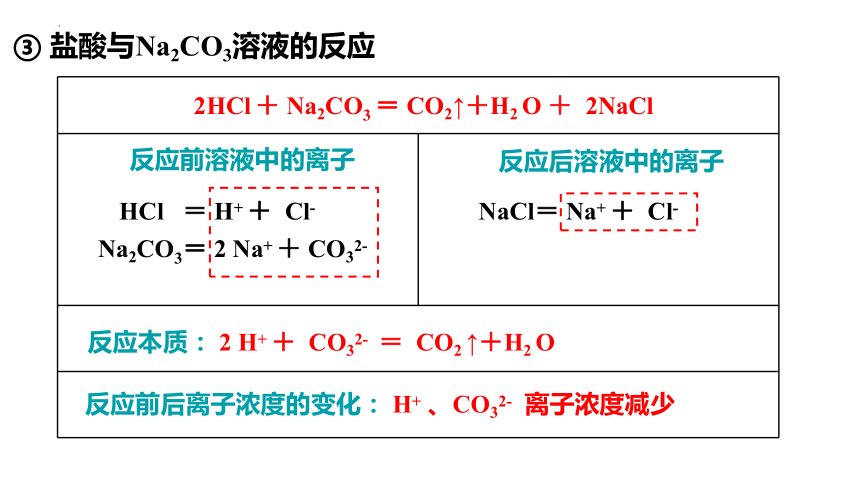
盐酸与Na2CO3溶液的反应
反应前溶液中的离子
反应后溶液中的离子
反应本质: 2 H+ + CO32- = CO2 ↑+H2 O
反应前后离子浓度的变化: H+ 、CO32- 离子浓度减少
HCl = H+ + Cl-
Na2CO3= 2 Na+ + CO32-
2HCl + Na2CO3 = CO2↑+H2 O + 2NaCl
NaCl= Na+ + Cl-
离子反应前后溶液中的离子浓度一定减少吗?
如:Mg+2 HCl === MgCl2 +H2 ↑ 的反应实质是:
Mg+2 H+=== Mg2++H2 ↑
如: Fe+CuSO4 ===FeSO4+Cu 的反应实质是:
Fe+Cu2+=== Fe2++Cu
不一定
离子反应并不是只有复分解反应,溶液中的置换反应也是离子反应
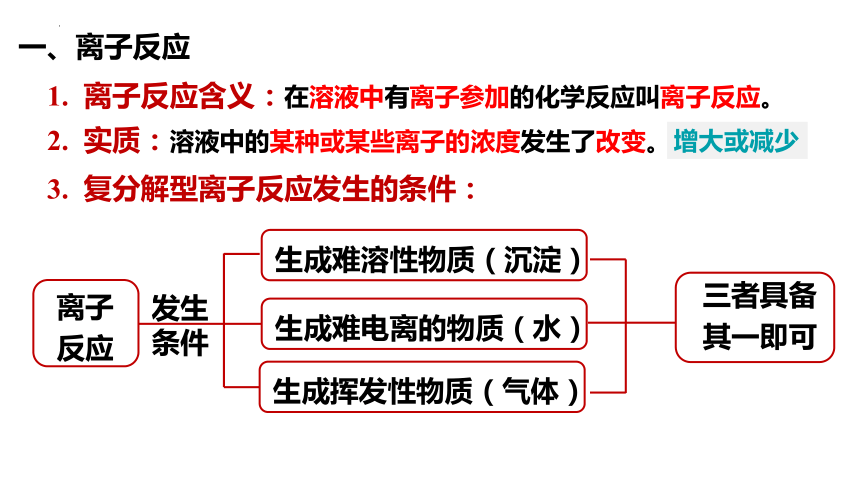
一、离子反应
离子反应含义:在溶液中有离子参加的化学反应叫离子反应。
实质:溶液中的某种或某些离子的浓度发生了改变。
增大或减少
复分解型离子反应发生的条件:
离子反应
生成难溶性物质(沉淀)
生成难电离的物质(水)
生成挥发性物质(气体)
发生条件
三者具备其一即可
二、离子方程式
概念:用实际参加反应的离子的符号来表示离子反应的式子。
离子方程式书写:以稀盐酸与碳酸钙反应为例
写:写出化学反应方程式
2 HCl + CaCO3 = CO2↑+ CaCl2+ H2 O
拆:把易溶于水且易电离的物质拆成离子形式
2 H+ +2 Cl- + CaCO3 = CO2↑ + Ca2+ + 2 Cl- + H2 O
删:删去方程式两边不参加反应的离子,并将方程式化为最简
2H+ + CaCO3 = CO2↑+ Ca2++H2 O
查:检查离子方程式两边各元素的原子个数和电荷总数是否相等
易错提醒
离子方程式中哪些物质可以“拆”,不可拆?
易溶于水且易电离的物质(如强酸、强碱、可溶性盐)可以拆。
单质、氧化物、难电离的物质(如弱酸、弱碱、水)、非电解质、难溶性盐、气体,一律写化学式。
强酸的酸式酸根离子要拆开,如NaHSO4应写成Na+、H+、SO42-;多元弱酸的酸式酸根不能拆,如(HCO3-、HS-、H2PO4-、HSO3-)等不能拆开写,如:HCO3-不能拆成H+和CO32-。
熟记课本142面溶解性表
易错提醒
离子方程式中哪些物质可以“拆”,不可拆?
浓硫酸作为反应物时,H2SO4不能拆写,应写成化学式。
氨水作反应物写NH3·H2O;作生成物,若有加热条件或浓度很大时,可写成NH3(标↑号)。
微溶物如作为反应物,若是澄清溶液应拆写成离子形式,若是悬浊液则应写成化学式;微溶物若作为生成物,一般视为沉淀,应写成化学式并标“↓”符号。如Ca(OH)2:若是澄清水溶液应写成离子,若是石灰乳应写成化学式,作为产物写成化学式。
课堂练习
1、写出稀硫酸与澄清石灰水反应的离子方程式
写:
拆:
删:
查:
H2SO4 + Ca(OH)2 = CaSO4 ↓+ 2 H2O
2 H+ + SO42- + Ca2++ 2 OH- = CaSO4 ↓+ 2 H2O
2 H+ + SO42- + Ca2++ 2 OH- = CaSO4 ↓+ 2 H2O
2 H+ + SO42- + Ca2++ 2 OH- = CaSO4 ↓+ 2 H2O
课堂练习
1、写出Cl2与足量NaOH溶液反应的离子方程式
写:
拆:
删:
查:
Cl2 + 2 NaOH = NaCl + NaClO + 2 H2O
Cl2 + 2 Na+ + 2 OH- = 2 Na+ + Cl- + ClO- + 2 H2O
Cl2 + 2 OH- = Cl- + ClO- + 2 H2O
Cl2 + 2 OH- = Cl- + ClO- + 2 H2O
交流 研讨
写出下列各组物质之间发生反应的离子方程式。
①NaOH溶液与稀硫酸 ;
②KOH溶液与稀盐酸 ;
③BaCl2溶液与Na2SO4溶液 ;
④Ba(NO3)2溶液与Na2SO4溶液 ;
⑤碳酸钙与稀盐酸 ;
H+ + OH- = H2O
H+ + OH- = H2O
Ba2+ + SO42- = BaSO4 ↓
Ba2+ + SO42- = BaSO4 ↓
2H+ + CaCO3 = CO2↑+ Ca2++H2 O
通过观察你认为离子方程式和化学方程式有什么区别和联系?
离子反应方程式不仅表示一个反应,而且可以表示一类反应
三、离子方程式的判断
离子方程式正误判断的“五看”
一看是否符合客观事实
二看各物质的化学式拆写是否正确
(1) 浓盐酸与铁屑反应:2 Fe+6 H+ === 2 Fe3++3 H2↑ ( )
(1) 碳酸钙与盐酸反应:CO32- + 2 H+ === H2O+CO2 ↑ ( )
(2) 用醋酸溶解碳酸钙:CaCO3+ 2 H+ === Ca2++H2O+CO2 ↑ ( )
(3) 碳酸氢钠和硫酸反应:CO32-+ 2 H+ === H2O+CO2 ↑ ( )
×
×
×
×
三、离子方程式的判断
三看是否漏写离子反应
四看原子和电荷是否守恒
五看反应物和生成物的配比是否正确
(1) CuSO4和Ba(OH)2反应:Ba2+ + SO42- === BaSO4 ↓ ( )
(2) 铝和盐酸反应:Al + 2 H+ === Al3+ + H2 ↑ ( )
(1) 钠和水反应:2 Na+ H2O === 2 Na+ + 2 OH- + H2 ↑ ( )
硫酸和Ba(OH)2溶液的反应:
H++ SO42- + Ba2+ + OH- === BaSO4 ↓ + H2O ( )
正确书写:2 H++ SO42- + Ba2+ + 2 OH- === BaSO4 ↓ + 2 H2O
×
×
×
×
1、下列离子方程式正确的是
A.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+===Ca2++2H2O
B.钾与水反应:K+2 H2O===K++2 OH-+H2 ↑
C.铜片插入AgNO3溶液中:Cu+Ag+===Cu2++Ag
D.大理石溶于醋酸:CaCO3+2 CH3COOH===Ca2++2CH3COO-+
CO2↑+H2O
课堂练习
D
CO2与NaOH溶液的反应
Na2CO3与HCl的反应
NaHCO3与Ca(OH)2溶液的反应
关键:少量的化学计量数定为1
NaHCO3少量:
NaHCO3足量:
HCl少量:
HCl足量:
CO2足量:
CO2少量:
CO2 + 2 OH- = CO32- + H2O
CO2 + OH- = HCO3-
CO3 2-+ H+ = HCO3-
CO3 2-+ 2 H+ = H2O + CO2 ↑
HCO3 -+ OH- + Ca2+ = CaCO3 ↓ + H2O
2 HCO3 -+ 2 OH- + Ca2+ = CaCO3 ↓ + CO32- + 2 H2O
四、少量与过量的离子方程式书写
课堂小结
离子反应及其发生条件
1、概念:溶液中有离子参加的反应
2、实质:离子浓度改变
3、复分解型离子反应发生条件
离子反应
离子方程式书写
1、步骤:写、拆、删、查
2、熟记“可拆”和“不可拆”物质
3、离子方程式正误判断:“五看“原则
4、少量与过量离子方程式书写(少量定为1)
离子反应方程式不仅表示一个反应,而且可以表示一类反应
1. 离子反应的本质是电解质溶液中某种离子浓度发生改变,如图是室温下向不同的电解质溶液中加入新物质的操作,请画出溶液电导率随新物质加入量的变化的大致曲线,并解释曲线变化的原因。
课堂练习
2.下列对于离子反应的描述正确的是
A.离子反应中一定有沉淀生成
B.有气体生成的反应一定是离子反应
C.复分解型离子反应发生的条件之一是有难电离物质生成
D.非电解质二氧化碳与足量烧碱溶液的反应不属于离子反应
C
课堂练习
第2章 第2节
电解质的电离 离子反应
第2课时 离子反应
知识导航
1
2
离子反应及其发生条件
离子方程式的书写及其正误判断
稀硫酸与Ba(OH)2溶液反应的实质
活动 探究
【实验操作】向0.01 mol/L Ba(OH)2溶液中滴入几滴酚酞溶液,然后
向Ba(OH)2溶液中匀速逐滴加入0.2 mol/L H2SO4溶液,注意观察溶液
中的现象和溶液电导率的变化。
实验现象 随H2SO4溶液的滴入,电导率 ,同时溶液中出现 ,溶液颜色_________________
分析
结论 稀硫酸与Ba(OH)2溶液反应的实质是溶液中的 __________
结合生成 、 结合生成 ________ ,溶液中离子的浓度_____
【实验记录和结论】
先变小后变大
白色沉淀
由红色变浅至褪色
H+和OH-
难电离的水
BaSO4沉淀
降低
Ba2+和SO42-
H2SO4电离方程式:
Ba(OH)2电离方程式:
Ba(OH)2 ==== Ba2+ + 2 OH-
H2SO4 ==== SO42- + 2 H+
稀硫酸与NaOH溶液反应
H2SO4 = 2H+ + SO42-
NaOH= Na+ + OH-
H2SO4 + 2 NaOH = 2 H2O+ Na2SO4
Na2SO4= 2Na+ + SO42-
反应前溶液中的离子
反应后溶液中的离子
反应本质:H+ + OH- = H2O
反应前后离子浓度的变化:H+、OH- 离子浓度减少
CuSO4溶液与NaOH溶液反应
反应前溶液中的离子
反应后溶液中的离子
反应本质: Cu2+ + 2 OH- = Cu(OH)2 ↓
反应前后离子浓度的变化: Cu2+ 、OH- 离子浓度减少
CuSO4 = Cu2+ + SO42-
NaOH= Na+ + OH-
CuSO4 + 2 NaOH = Cu(OH)2↓ + Na2SO4
Na2SO4= 2 Na+ + SO42-
盐酸与Na2CO3溶液的反应
反应前溶液中的离子
反应后溶液中的离子
反应本质: 2 H+ + CO32- = CO2 ↑+H2 O
反应前后离子浓度的变化: H+ 、CO32- 离子浓度减少
HCl = H+ + Cl-
Na2CO3= 2 Na+ + CO32-
2HCl + Na2CO3 = CO2↑+H2 O + 2NaCl
NaCl= Na+ + Cl-
离子反应前后溶液中的离子浓度一定减少吗?
如:Mg+2 HCl === MgCl2 +H2 ↑ 的反应实质是:
Mg+2 H+=== Mg2++H2 ↑
如: Fe+CuSO4 ===FeSO4+Cu 的反应实质是:
Fe+Cu2+=== Fe2++Cu
不一定
离子反应并不是只有复分解反应,溶液中的置换反应也是离子反应
一、离子反应
离子反应含义:在溶液中有离子参加的化学反应叫离子反应。
实质:溶液中的某种或某些离子的浓度发生了改变。
增大或减少
复分解型离子反应发生的条件:
离子反应
生成难溶性物质(沉淀)
生成难电离的物质(水)
生成挥发性物质(气体)
发生条件
三者具备其一即可
二、离子方程式
概念:用实际参加反应的离子的符号来表示离子反应的式子。
离子方程式书写:以稀盐酸与碳酸钙反应为例
写:写出化学反应方程式
2 HCl + CaCO3 = CO2↑+ CaCl2+ H2 O
拆:把易溶于水且易电离的物质拆成离子形式
2 H+ +2 Cl- + CaCO3 = CO2↑ + Ca2+ + 2 Cl- + H2 O
删:删去方程式两边不参加反应的离子,并将方程式化为最简
2H+ + CaCO3 = CO2↑+ Ca2++H2 O
查:检查离子方程式两边各元素的原子个数和电荷总数是否相等
易错提醒
离子方程式中哪些物质可以“拆”,不可拆?
易溶于水且易电离的物质(如强酸、强碱、可溶性盐)可以拆。
单质、氧化物、难电离的物质(如弱酸、弱碱、水)、非电解质、难溶性盐、气体,一律写化学式。
强酸的酸式酸根离子要拆开,如NaHSO4应写成Na+、H+、SO42-;多元弱酸的酸式酸根不能拆,如(HCO3-、HS-、H2PO4-、HSO3-)等不能拆开写,如:HCO3-不能拆成H+和CO32-。
熟记课本142面溶解性表
易错提醒
离子方程式中哪些物质可以“拆”,不可拆?
浓硫酸作为反应物时,H2SO4不能拆写,应写成化学式。
氨水作反应物写NH3·H2O;作生成物,若有加热条件或浓度很大时,可写成NH3(标↑号)。
微溶物如作为反应物,若是澄清溶液应拆写成离子形式,若是悬浊液则应写成化学式;微溶物若作为生成物,一般视为沉淀,应写成化学式并标“↓”符号。如Ca(OH)2:若是澄清水溶液应写成离子,若是石灰乳应写成化学式,作为产物写成化学式。
课堂练习
1、写出稀硫酸与澄清石灰水反应的离子方程式
写:
拆:
删:
查:
H2SO4 + Ca(OH)2 = CaSO4 ↓+ 2 H2O
2 H+ + SO42- + Ca2++ 2 OH- = CaSO4 ↓+ 2 H2O
2 H+ + SO42- + Ca2++ 2 OH- = CaSO4 ↓+ 2 H2O
2 H+ + SO42- + Ca2++ 2 OH- = CaSO4 ↓+ 2 H2O
课堂练习
1、写出Cl2与足量NaOH溶液反应的离子方程式
写:
拆:
删:
查:
Cl2 + 2 NaOH = NaCl + NaClO + 2 H2O
Cl2 + 2 Na+ + 2 OH- = 2 Na+ + Cl- + ClO- + 2 H2O
Cl2 + 2 OH- = Cl- + ClO- + 2 H2O
Cl2 + 2 OH- = Cl- + ClO- + 2 H2O
交流 研讨
写出下列各组物质之间发生反应的离子方程式。
①NaOH溶液与稀硫酸 ;
②KOH溶液与稀盐酸 ;
③BaCl2溶液与Na2SO4溶液 ;
④Ba(NO3)2溶液与Na2SO4溶液 ;
⑤碳酸钙与稀盐酸 ;
H+ + OH- = H2O
H+ + OH- = H2O
Ba2+ + SO42- = BaSO4 ↓
Ba2+ + SO42- = BaSO4 ↓
2H+ + CaCO3 = CO2↑+ Ca2++H2 O
通过观察你认为离子方程式和化学方程式有什么区别和联系?
离子反应方程式不仅表示一个反应,而且可以表示一类反应
三、离子方程式的判断
离子方程式正误判断的“五看”
一看是否符合客观事实
二看各物质的化学式拆写是否正确
(1) 浓盐酸与铁屑反应:2 Fe+6 H+ === 2 Fe3++3 H2↑ ( )
(1) 碳酸钙与盐酸反应:CO32- + 2 H+ === H2O+CO2 ↑ ( )
(2) 用醋酸溶解碳酸钙:CaCO3+ 2 H+ === Ca2++H2O+CO2 ↑ ( )
(3) 碳酸氢钠和硫酸反应:CO32-+ 2 H+ === H2O+CO2 ↑ ( )
×
×
×
×
三、离子方程式的判断
三看是否漏写离子反应
四看原子和电荷是否守恒
五看反应物和生成物的配比是否正确
(1) CuSO4和Ba(OH)2反应:Ba2+ + SO42- === BaSO4 ↓ ( )
(2) 铝和盐酸反应:Al + 2 H+ === Al3+ + H2 ↑ ( )
(1) 钠和水反应:2 Na+ H2O === 2 Na+ + 2 OH- + H2 ↑ ( )
硫酸和Ba(OH)2溶液的反应:
H++ SO42- + Ba2+ + OH- === BaSO4 ↓ + H2O ( )
正确书写:2 H++ SO42- + Ba2+ + 2 OH- === BaSO4 ↓ + 2 H2O
×
×
×
×
1、下列离子方程式正确的是
A.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+===Ca2++2H2O
B.钾与水反应:K+2 H2O===K++2 OH-+H2 ↑
C.铜片插入AgNO3溶液中:Cu+Ag+===Cu2++Ag
D.大理石溶于醋酸:CaCO3+2 CH3COOH===Ca2++2CH3COO-+
CO2↑+H2O
课堂练习
D
CO2与NaOH溶液的反应
Na2CO3与HCl的反应
NaHCO3与Ca(OH)2溶液的反应
关键:少量的化学计量数定为1
NaHCO3少量:
NaHCO3足量:
HCl少量:
HCl足量:
CO2足量:
CO2少量:
CO2 + 2 OH- = CO32- + H2O
CO2 + OH- = HCO3-
CO3 2-+ H+ = HCO3-
CO3 2-+ 2 H+ = H2O + CO2 ↑
HCO3 -+ OH- + Ca2+ = CaCO3 ↓ + H2O
2 HCO3 -+ 2 OH- + Ca2+ = CaCO3 ↓ + CO32- + 2 H2O
四、少量与过量的离子方程式书写
课堂小结
离子反应及其发生条件
1、概念:溶液中有离子参加的反应
2、实质:离子浓度改变
3、复分解型离子反应发生条件
离子反应
离子方程式书写
1、步骤:写、拆、删、查
2、熟记“可拆”和“不可拆”物质
3、离子方程式正误判断:“五看“原则
4、少量与过量离子方程式书写(少量定为1)
离子反应方程式不仅表示一个反应,而且可以表示一类反应
1. 离子反应的本质是电解质溶液中某种离子浓度发生改变,如图是室温下向不同的电解质溶液中加入新物质的操作,请画出溶液电导率随新物质加入量的变化的大致曲线,并解释曲线变化的原因。
课堂练习
2.下列对于离子反应的描述正确的是
A.离子反应中一定有沉淀生成
B.有气体生成的反应一定是离子反应
C.复分解型离子反应发生的条件之一是有难电离物质生成
D.非电解质二氧化碳与足量烧碱溶液的反应不属于离子反应
C
课堂练习
