3.1.4氢氧化亚铁制备与“铁三角”关系课件(共17张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 3.1.4氢氧化亚铁制备与“铁三角”关系课件(共17张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-22 00:00:00 | ||
图片预览


文档简介
(共17张PPT)
第三章 铁 金属材料
第一节 铁及其化合物
第四课时
Fe(OH)2制备与“铁三角”关系
从氧化还原角度,认识掌握铁三角的关系及一定条件下的相互转化
1min
学习目标
探究Fe(OH)2的制备方法和注意问题
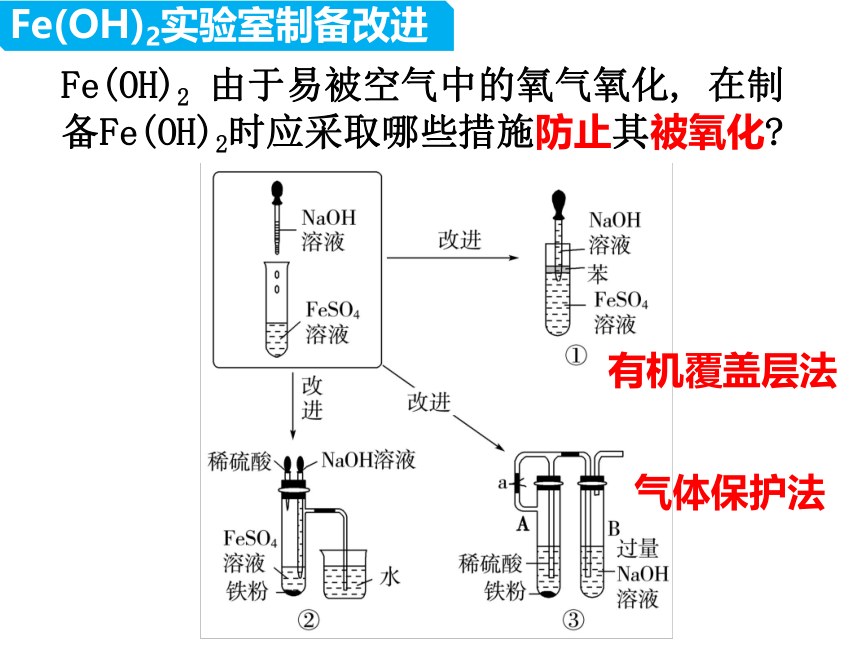
Fe(OH)2 由于易被空气中的氧气氧化, 在制备Fe(OH)2时应采取哪些措施防止其被氧化
有机覆盖层法
气体保护法
Fe(OH)2实验室制备改进
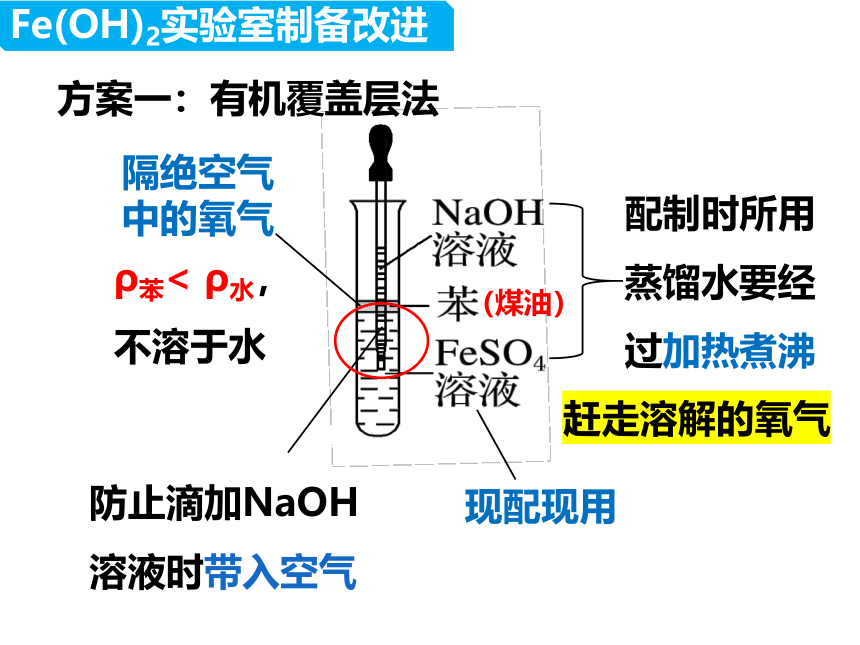
方案一:有机覆盖层法
现配现用
配制时所用蒸馏水要经过加热煮沸
隔绝空气中的氧气
赶走溶解的氧气
防止滴加NaOH溶液时带入空气
ρ苯< ρ水,
不溶于水
(煤油)
Fe(OH)2实验室制备改进
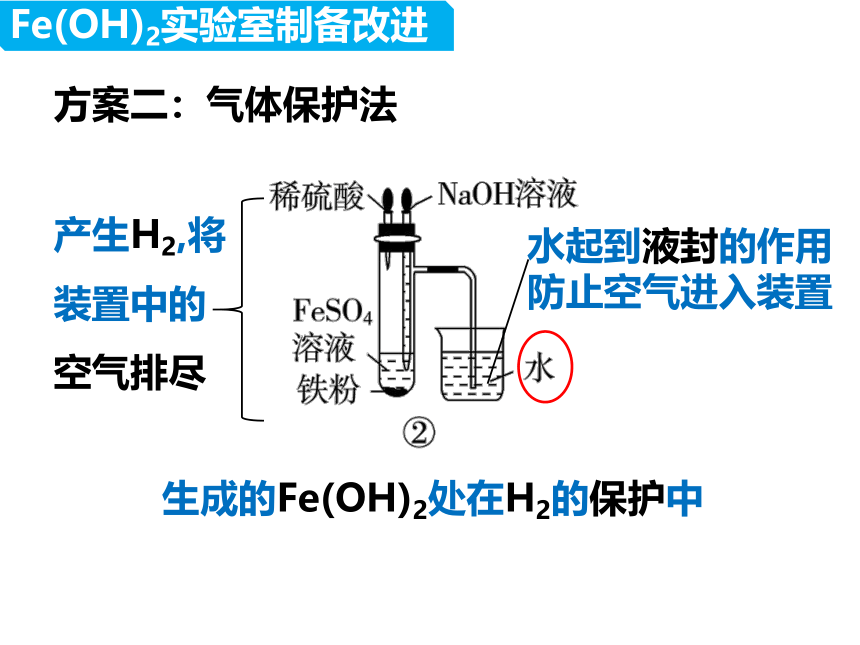
方案二:气体保护法
水起到液封的作用
防止空气进入装置
产生H2,将装置中的空气排尽
生成的Fe(OH)2处在H2的保护中
Fe(OH)2实验室制备改进
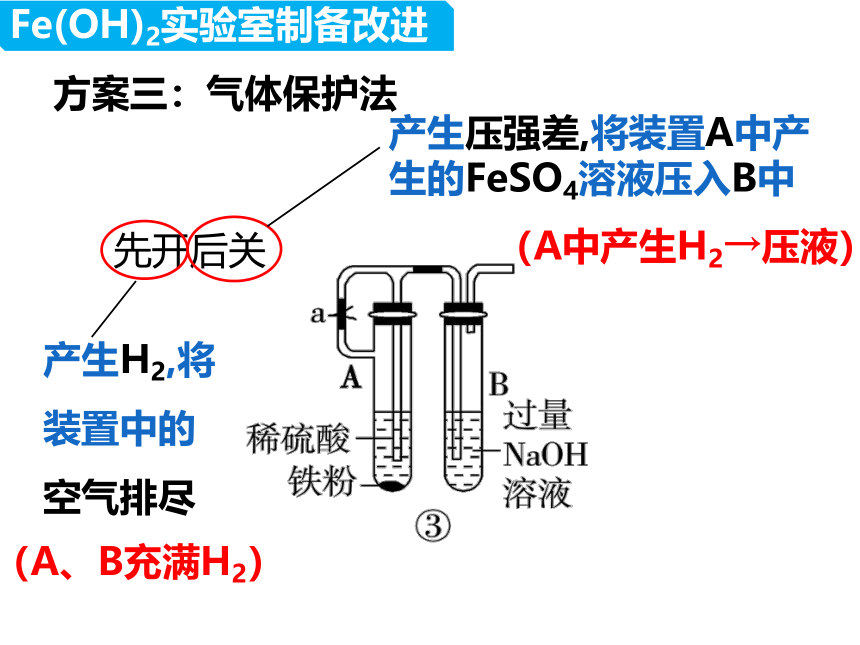
方案三:气体保护法
产生H2,将装置中的空气排尽
产生压强差,将装置A中产生的FeSO4溶液压入B中
(A、B充满H2)
(A中产生H2→压液)
先开后关
Fe(OH)2实验室制备改进
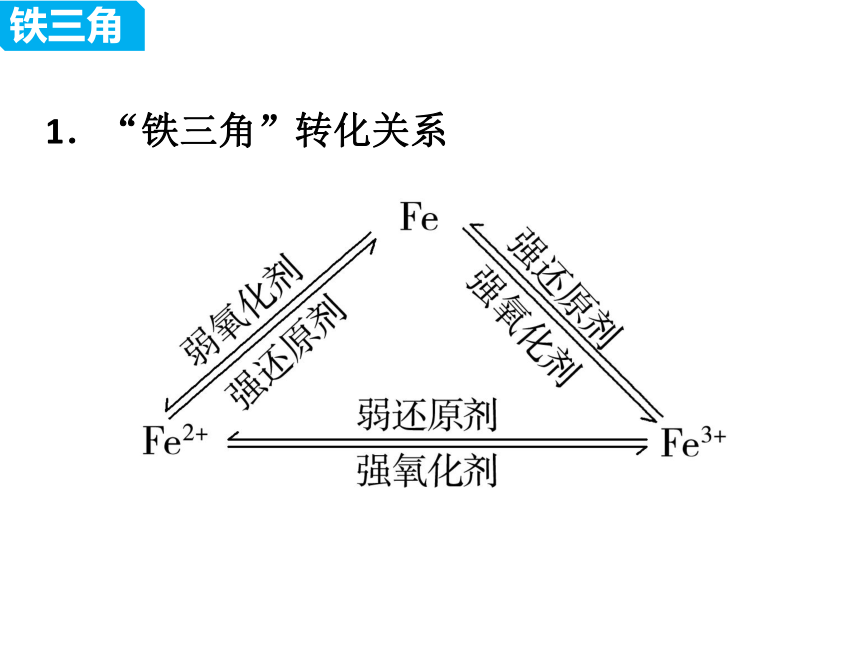
1.“铁三角”转化关系
铁三角
Fe
还原剂
Fe2+
Fe3+
弱氧化剂
Cu2+ H+ S I2
Fe+Cu2+=Fe2++Cu
Fe+2H+=Fe2++H2↑
Fe + S = FeS
Fe + I2 = FeI2
强氧化剂
Cl2 Br2
2Fe+3Br2=2FeBr3
2Fe+3Cl2=2FeCl3
Fe与Cl2反应不论用量多少都生成FeCl3
[判一判]足量的铁与少量的氯气反应生成FeCl2( )
×
Fe
Fe2+
Fe3+
强还原剂
C CO
Al Zn
FeO+CO = Fe+3CO2
高温
Fe2++Zn=Fe+Zn2+
强氧化剂
Cl2 H2O2
KMnO4(H+)
2Fe2++Cl2=2Fe3++2Cl-
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
2Fe2+ +2H++H2O2=2Fe3+ + 2H2O
Fe
Fe2+
Fe3+
弱还原剂
Fe Cu KI
2Fe3+ +2I-= 2Fe2++I2
(淀粉碘化钾试纸变蓝)
Fe+2Fe3+ =3Fe2+
(印刷电路板)Cu + 2Fe3+ = 2Fe2+ + Cu2+
强还原剂
CO Al
Fe2O3+3CO = 2Fe+3CO2
高温
2Al+Fe2O3=2Fe+Al2O3
高温
(铝热反应)
1.实验室用FeCl2和烧碱制备Fe(OH)2,为了使生成的产物不容易被氧化,下列说法不正确的是 ( )A.配制FeCl2溶液和烧碱溶液所用的蒸馏水通常要煮沸B.可在FeCl2溶液的上面加一层苯,以隔绝空气C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入溶液内D.产生Fe(OH)2沉淀后,不能振荡试管
会增大沉淀与空气接触的机会,使沉淀更易被氧化
C
实战演练
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。
填写下列空白:(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是___________________________
铁屑
Fe+2H+=Fe2++H2↑
实战演练
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。
(2)实验开始时先将止水夹E________(填“打开”或“关闭”),C中收集到气体的主要成分是________。
打开
H2
实战演练
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。
(3)简述生成Fe(OH)2的操作过程:__________________________________________________________________________________
关闭止水夹E,A中压强增大,把FeSO4溶液压入B瓶中进行反应
实战演练
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:__________________________________________
4Fe(OH)2+O2+2H2O=4Fe(OH)3
实战演练
(1)稀硫酸应放在____________中(填仪器名称)。
1.某化学兴趣小组拟用如图装置(2个三颈烧瓶及其他仪器)制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
分液漏斗
(2)本实验通过控制A、B、C三个开关,可将装置中的空气排尽,具体操作为关闭开关________,打开开关________,打开分液漏斗活塞;待反应一段时间排尽空气后,再关闭开关________,打开开关________,就可观察到氢氧化亚铁的生成。
A
B、C
B、C
A
1.某化学兴趣小组拟用如图装置(2个三颈烧瓶及其他仪器)制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
试分析实验开始时需排尽装置中空气的理由:______________________________
4Fe(OH)2+O2+2H2O=4Fe(OH)3
(用化学方程式作答)。
第三章 铁 金属材料
第一节 铁及其化合物
第四课时
Fe(OH)2制备与“铁三角”关系
从氧化还原角度,认识掌握铁三角的关系及一定条件下的相互转化
1min
学习目标
探究Fe(OH)2的制备方法和注意问题
Fe(OH)2 由于易被空气中的氧气氧化, 在制备Fe(OH)2时应采取哪些措施防止其被氧化
有机覆盖层法
气体保护法
Fe(OH)2实验室制备改进
方案一:有机覆盖层法
现配现用
配制时所用蒸馏水要经过加热煮沸
隔绝空气中的氧气
赶走溶解的氧气
防止滴加NaOH溶液时带入空气
ρ苯< ρ水,
不溶于水
(煤油)
Fe(OH)2实验室制备改进
方案二:气体保护法
水起到液封的作用
防止空气进入装置
产生H2,将装置中的空气排尽
生成的Fe(OH)2处在H2的保护中
Fe(OH)2实验室制备改进
方案三:气体保护法
产生H2,将装置中的空气排尽
产生压强差,将装置A中产生的FeSO4溶液压入B中
(A、B充满H2)
(A中产生H2→压液)
先开后关
Fe(OH)2实验室制备改进
1.“铁三角”转化关系
铁三角
Fe
还原剂
Fe2+
Fe3+
弱氧化剂
Cu2+ H+ S I2
Fe+Cu2+=Fe2++Cu
Fe+2H+=Fe2++H2↑
Fe + S = FeS
Fe + I2 = FeI2
强氧化剂
Cl2 Br2
2Fe+3Br2=2FeBr3
2Fe+3Cl2=2FeCl3
Fe与Cl2反应不论用量多少都生成FeCl3
[判一判]足量的铁与少量的氯气反应生成FeCl2( )
×
Fe
Fe2+
Fe3+
强还原剂
C CO
Al Zn
FeO+CO = Fe+3CO2
高温
Fe2++Zn=Fe+Zn2+
强氧化剂
Cl2 H2O2
KMnO4(H+)
2Fe2++Cl2=2Fe3++2Cl-
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
2Fe2+ +2H++H2O2=2Fe3+ + 2H2O
Fe
Fe2+
Fe3+
弱还原剂
Fe Cu KI
2Fe3+ +2I-= 2Fe2++I2
(淀粉碘化钾试纸变蓝)
Fe+2Fe3+ =3Fe2+
(印刷电路板)Cu + 2Fe3+ = 2Fe2+ + Cu2+
强还原剂
CO Al
Fe2O3+3CO = 2Fe+3CO2
高温
2Al+Fe2O3=2Fe+Al2O3
高温
(铝热反应)
1.实验室用FeCl2和烧碱制备Fe(OH)2,为了使生成的产物不容易被氧化,下列说法不正确的是 ( )A.配制FeCl2溶液和烧碱溶液所用的蒸馏水通常要煮沸B.可在FeCl2溶液的上面加一层苯,以隔绝空气C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入溶液内D.产生Fe(OH)2沉淀后,不能振荡试管
会增大沉淀与空气接触的机会,使沉淀更易被氧化
C
实战演练
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。
填写下列空白:(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是___________________________
铁屑
Fe+2H+=Fe2++H2↑
实战演练
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。
(2)实验开始时先将止水夹E________(填“打开”或“关闭”),C中收集到气体的主要成分是________。
打开
H2
实战演练
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。
(3)简述生成Fe(OH)2的操作过程:__________________________________________________________________________________
关闭止水夹E,A中压强增大,把FeSO4溶液压入B瓶中进行反应
实战演练
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:__________________________________________
4Fe(OH)2+O2+2H2O=4Fe(OH)3
实战演练
(1)稀硫酸应放在____________中(填仪器名称)。
1.某化学兴趣小组拟用如图装置(2个三颈烧瓶及其他仪器)制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
分液漏斗
(2)本实验通过控制A、B、C三个开关,可将装置中的空气排尽,具体操作为关闭开关________,打开开关________,打开分液漏斗活塞;待反应一段时间排尽空气后,再关闭开关________,打开开关________,就可观察到氢氧化亚铁的生成。
A
B、C
B、C
A
1.某化学兴趣小组拟用如图装置(2个三颈烧瓶及其他仪器)制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
试分析实验开始时需排尽装置中空气的理由:______________________________
4Fe(OH)2+O2+2H2O=4Fe(OH)3
(用化学方程式作答)。
