3.2水的电离和溶液的PH (含解析)同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2水的电离和溶液的PH (含解析)同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 321.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-22 14:36:00 | ||
图片预览


文档简介
3.2水的电离和溶液的PH同步练习题
一、选择题
1.下列操作规范 且能达到实验目的的是
A.用图甲装置配制200 mL 0.1 mol·L-1的盐酸
B.用图乙装置进行酸碱中和滴定
C.用图丙装置分离乙醇和乙酸的混合溶液
D.用图丁装置研究不同催化剂对反应速率的影响
2.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.中性溶液中:NO、Cl-、Ba2+、Fe3+
B.lg>0溶液:CH3COO-、Ba2+、NO、Br-
C.水电离出的c(H+)=1.0×10-12mol·L-1的溶液中:Na+、NH、S2-、Br-
D.在澄清透明溶液中:Cu2+、SO、NO、Na+
3.下列叙述能证明次氯酸是弱酸的是
A.次氯酸易溶于水。
B.次氯酸溶液的导电能力比盐酸弱
C.常温下,的次氯酸溶液
D.等体积、等浓度的次氯酸溶液与溶液恰好完全反应
4.某温度下,重水(D2O)的离子积常数为1.6×10-15,若用定义pH一样来规定pD=-lg c(D+),则在该温度下,下列叙述正确的是
A.纯净的重水中,pD=7
B.0.01 mol DCl溶于重水配成1 L溶液,其pD=2
C.0.01 mol NaOD溶于重水配成1 L溶液,其pD=12
D.0.01 mol DCl溶于重水配成1 L溶液,重水电离的c水(D+)=10-12mol/L
5.常温下,在溶液中加入溶液,所得溶液呈
A.碱性 B.强酸性 C.中性 D.弱酸性
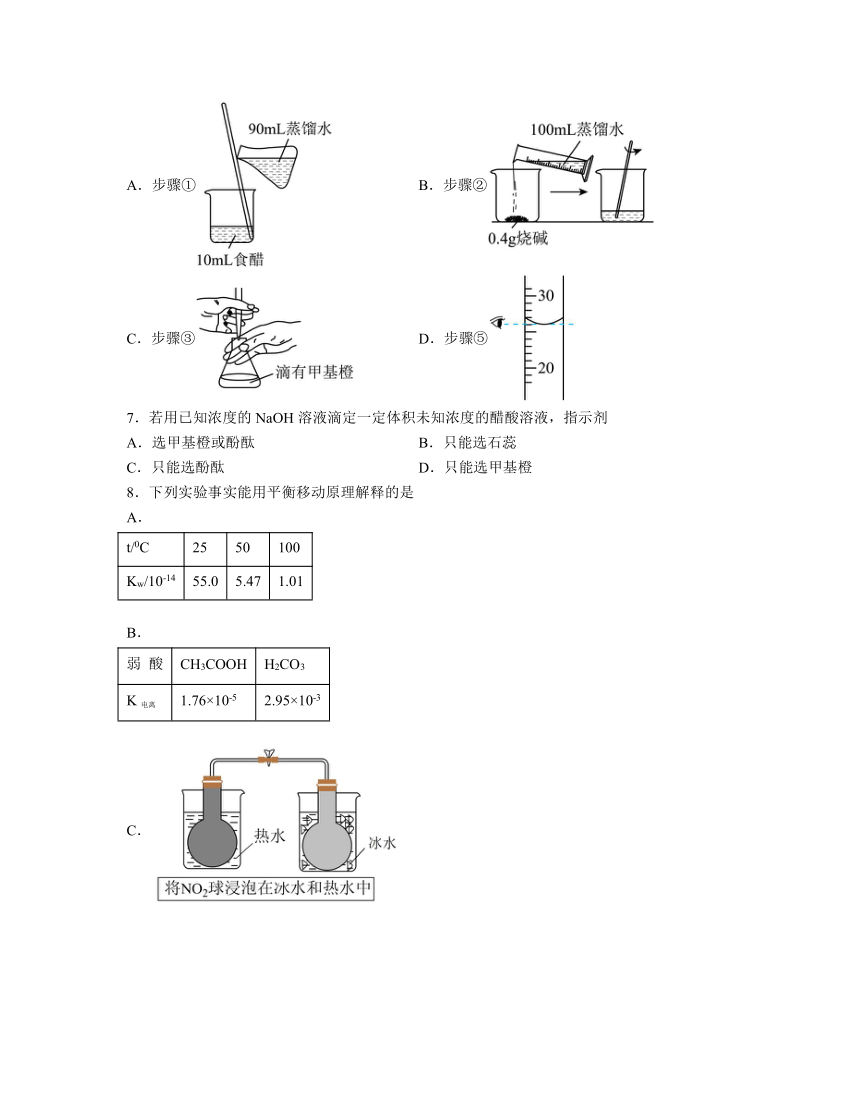
6.测定食醋中总酸度有以下步骤:①将食醋精确稀释到原来的10倍;②用烧碱固体配制100mL浓度约为0.1mol L-1的溶液;③用邻苯二甲酸氢钾固体标定步骤②所得溶液;④用移液管取20.00mL待测液;⑤用已知浓度NaOH溶液滴定。以下对应步骤中的操作及选用仪器正确的是
A.步骤① B.步骤②
C.步骤③ D.步骤⑤
7.若用已知浓度的NaOH溶液滴定一定体积未知浓度的醋酸溶液,指示剂
A.选甲基橙或酚酞 B.只能选石蕊
C.只能选酚酞 D.只能选甲基橙
8.下列实验事实能用平衡移动原理解释的是
A.
t/0C 25 50 100
Kw/10-14 55.0 5.47 1.01
B.
弱 酸 CH3COOH H2CO3
K电离 1.76×10-5 2.95×10-3
C.
D.
二、非选择题
9.已知某温度下,水的离子积常数,请回答下列问题:
(1)此温度_______________(填“>”“<”或“=”),原因是_________________。
(2)对水进行下列操作,能抑制水的电离的是_______________(填标号,双选)。
A.通入适量气体 B.加入适量溶液
C.升温至 D.加入一小块Na
(3)此温度下纯水中的______________________。
10.(1)某温度时,测得0.01mol·L-1 NaOH溶液的pH为11,则该温度下水的离子积常数Kw=_________,该温度________(填“高于”或“低于”)25℃。
(2)在(1)所述温度下,将pH=a的NaOH溶液V1L与pH=b的H2SO4溶液V2L混合(忽略体积变化)。
①若所得混合溶液呈中性,且a=12, b=2,则V1:V2=_________。
②若所得混合溶液的pH=10,且a=12, b=2,则V1:V2=_________。
【参考答案】
一、选择题
1.B
解析:A.配制200mL0.1mol/L的盐酸,需用250mL的容量瓶,故A错误;
B.酸碱中和滴定,常用滴定管和锥形瓶,故B正确;
C.乙醇和乙酸互溶,不能用分液法分离,故C错误;
D.所用过氧化氢质量分数不同,不能比较不同催化剂对反应速率的影响,故D错误;
答案为B。
2.D
解析:A.在中性条件下会水解转化成,不能大量存在,A错误;
B.即是该溶液为酸性,该条件下和不能大量共存,B错误;
C.常温下,水电离出的的溶液既可以为酸性溶液又可以为碱性溶液;酸性溶液中,不能大量存在,碱性溶液中,不能大量存在,C错误;
D.该组离子不会相互反应,在透明澄清溶液中可以共存,D正确;
故选D。
3.C
解析:A.次氯酸易溶于水属于物理性质,与酸性无关,A错误;
B.溶液导电能力与溶液中离子或电荷浓度有关,比较同浓度的次氯酸和盐酸的导电能力才能得出次氯酸酸性强弱结论,B错误;
C.常温下,的次氯酸溶液pH大于2,说明次氯酸没有完全电离,可证明其是弱酸,C正确;
D.次氯酸是一元酸,根据反应方程式:,等体积、等浓度的次氯酸溶液与NaOH溶液恰好完全反应,与次氯酸酸性强弱无关,D错误;
故选C。
4.B
解析:A.c(D+)=mol/L=4×10-8mol/L,所以pD>7,故A错误;
B.c(DCl)=0.01mol÷1L=0.01mol/L,则c(D+)=0.01mol/L,所以pD=2,故B正确;
C.c(NaOD)=0.01mol÷1L=0.01mol/L,则c(D+)=mol/L=1.6×10-13mol/L,则pD>12,故C错误;
D.c(DCl)=0.01mol÷1L=0.01mol/L,则c(D+)=0.01mol/L,重水电离的c水(D+)= c水(OD-)= mol/L =1.6×10-13mol/L,,故D错误;
故选B。
5.C
解析:HCl与KOH按照1:1反应,且n(HCl)=n(KOH)=48mL×0.1mol/L=12mL×0.4mol/L=4.8×10-3mol,因此反应后溶液显中性,故选C。
6.B
解析:A.步骤①:将食醋精确稀释到原来的10倍,应是配制一定物质的量浓度的溶液,因此需要用到仪器是容量瓶等,故A错误;
B.因为需要标定,因此步骤②是粗配溶液,0.4gNaOH的物质的量为0.1mol,100mL蒸馏水约为0.1L,则浓度约为0.1mol/L,故B正确;
C.用邻苯二甲酸氢钾标定NaOH时,滴定终点显碱性,应用酚酞作指示剂,故C错误;
D.步骤⑤是用NaOH溶液进行滴定,滴定管的刻度从上到下逐渐增大,而图中仪器刻度从上到下逐渐减小,故D错误;
答案为B。
7.C
解析:用已知浓度的NaOH溶液滴定未知浓度的醋酸溶液,恰好反应时生成醋酸钠,溶液呈碱性,用甲基橙作指示剂时误差较大,石蕊的变色范围太宽,不适宜用于滴定指示剂,故只能选用酚酞作指示剂,故答案为:C。
8.C
解析:A.水的离子积常数随着温度的升高逐渐变大,表格中数据逐渐减小,不能用平衡移动原理解释,A错误;
B.乙酸和碳酸的电离常数不同,为物质的本身性质,与平衡移动原理无关,B错误;
C.正反应为放热反应,升高温度平衡向逆反应移动,颜色加深,可用平衡移动原理解释,C正确;
D.加入催化剂,平衡不发生移动,不能用平衡移动原理解释,D错误;
故选C。
二、非选择题
9. > 水的电离是吸热过程,升高温度,促进水的电离,水的离子积常数随温度的升高而增大 AB
解析:(1)由于若电解质的电离是个吸热的过程,因为此温度下的大于时的,说明此温度高于,故答案为:>;水的电离是吸热过程,升高温度,促进水的电离,水的离子积常数随温度的升高而增大;
(2)A.通入适量气体,与反应生成,抑制水的电离,A符合题意;
B.加入适量溶液,其电离出的抑制水的电离,符合题意;
C.升温促进水的电离,不合题意;
D.加入Na,Na与电离出的反应,促进了水的电离,不合题意;
故答案为:AB;
(3)纯水中,又有此温度下,所以,故答案为:。
10. 1×10-13mol2·L-2 高于 1∶10 1∶9
解析:(1)某温度时,NaOH溶液中c平(OH-)=0.01mol·L-1,c平(H+)=1×10-11 mol·L-1,则Kw= c平(OH-)·c平(H+)=0.01mol·L-1×1×10-11mol·L-1=1×10-13 mol2·L-2>1×10-14 mol2·L-2,水的离子积常数随温度的升高而增大,故该温度高于25℃;
(2)该温度下水的离子积Kw=1×10-13 mol2·L-2;
①若所得混合溶液呈中性,则10-13+a·V1=10-b·V2,将a=12, b=2代入,得V1:V2=1:10;
②若所得混合溶液的pH=10,呈碱性,则c平(OH-)=1×10-3 mol·L-1,c平(OH-)=mol·L-1,将a=12, b=2代入,得V1:V2=1:9
一、选择题
1.下列操作规范 且能达到实验目的的是
A.用图甲装置配制200 mL 0.1 mol·L-1的盐酸
B.用图乙装置进行酸碱中和滴定
C.用图丙装置分离乙醇和乙酸的混合溶液
D.用图丁装置研究不同催化剂对反应速率的影响
2.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.中性溶液中:NO、Cl-、Ba2+、Fe3+
B.lg>0溶液:CH3COO-、Ba2+、NO、Br-
C.水电离出的c(H+)=1.0×10-12mol·L-1的溶液中:Na+、NH、S2-、Br-
D.在澄清透明溶液中:Cu2+、SO、NO、Na+
3.下列叙述能证明次氯酸是弱酸的是
A.次氯酸易溶于水。
B.次氯酸溶液的导电能力比盐酸弱
C.常温下,的次氯酸溶液
D.等体积、等浓度的次氯酸溶液与溶液恰好完全反应
4.某温度下,重水(D2O)的离子积常数为1.6×10-15,若用定义pH一样来规定pD=-lg c(D+),则在该温度下,下列叙述正确的是
A.纯净的重水中,pD=7
B.0.01 mol DCl溶于重水配成1 L溶液,其pD=2
C.0.01 mol NaOD溶于重水配成1 L溶液,其pD=12
D.0.01 mol DCl溶于重水配成1 L溶液,重水电离的c水(D+)=10-12mol/L
5.常温下,在溶液中加入溶液,所得溶液呈
A.碱性 B.强酸性 C.中性 D.弱酸性
6.测定食醋中总酸度有以下步骤:①将食醋精确稀释到原来的10倍;②用烧碱固体配制100mL浓度约为0.1mol L-1的溶液;③用邻苯二甲酸氢钾固体标定步骤②所得溶液;④用移液管取20.00mL待测液;⑤用已知浓度NaOH溶液滴定。以下对应步骤中的操作及选用仪器正确的是
A.步骤① B.步骤②
C.步骤③ D.步骤⑤
7.若用已知浓度的NaOH溶液滴定一定体积未知浓度的醋酸溶液,指示剂
A.选甲基橙或酚酞 B.只能选石蕊
C.只能选酚酞 D.只能选甲基橙
8.下列实验事实能用平衡移动原理解释的是
A.
t/0C 25 50 100
Kw/10-14 55.0 5.47 1.01
B.
弱 酸 CH3COOH H2CO3
K电离 1.76×10-5 2.95×10-3
C.
D.
二、非选择题
9.已知某温度下,水的离子积常数,请回答下列问题:
(1)此温度_______________(填“>”“<”或“=”),原因是_________________。
(2)对水进行下列操作,能抑制水的电离的是_______________(填标号,双选)。
A.通入适量气体 B.加入适量溶液
C.升温至 D.加入一小块Na
(3)此温度下纯水中的______________________。
10.(1)某温度时,测得0.01mol·L-1 NaOH溶液的pH为11,则该温度下水的离子积常数Kw=_________,该温度________(填“高于”或“低于”)25℃。
(2)在(1)所述温度下,将pH=a的NaOH溶液V1L与pH=b的H2SO4溶液V2L混合(忽略体积变化)。
①若所得混合溶液呈中性,且a=12, b=2,则V1:V2=_________。
②若所得混合溶液的pH=10,且a=12, b=2,则V1:V2=_________。
【参考答案】
一、选择题
1.B
解析:A.配制200mL0.1mol/L的盐酸,需用250mL的容量瓶,故A错误;
B.酸碱中和滴定,常用滴定管和锥形瓶,故B正确;
C.乙醇和乙酸互溶,不能用分液法分离,故C错误;
D.所用过氧化氢质量分数不同,不能比较不同催化剂对反应速率的影响,故D错误;
答案为B。
2.D
解析:A.在中性条件下会水解转化成,不能大量存在,A错误;
B.即是该溶液为酸性,该条件下和不能大量共存,B错误;
C.常温下,水电离出的的溶液既可以为酸性溶液又可以为碱性溶液;酸性溶液中,不能大量存在,碱性溶液中,不能大量存在,C错误;
D.该组离子不会相互反应,在透明澄清溶液中可以共存,D正确;
故选D。
3.C
解析:A.次氯酸易溶于水属于物理性质,与酸性无关,A错误;
B.溶液导电能力与溶液中离子或电荷浓度有关,比较同浓度的次氯酸和盐酸的导电能力才能得出次氯酸酸性强弱结论,B错误;
C.常温下,的次氯酸溶液pH大于2,说明次氯酸没有完全电离,可证明其是弱酸,C正确;
D.次氯酸是一元酸,根据反应方程式:,等体积、等浓度的次氯酸溶液与NaOH溶液恰好完全反应,与次氯酸酸性强弱无关,D错误;
故选C。
4.B
解析:A.c(D+)=mol/L=4×10-8mol/L,所以pD>7,故A错误;
B.c(DCl)=0.01mol÷1L=0.01mol/L,则c(D+)=0.01mol/L,所以pD=2,故B正确;
C.c(NaOD)=0.01mol÷1L=0.01mol/L,则c(D+)=mol/L=1.6×10-13mol/L,则pD>12,故C错误;
D.c(DCl)=0.01mol÷1L=0.01mol/L,则c(D+)=0.01mol/L,重水电离的c水(D+)= c水(OD-)= mol/L =1.6×10-13mol/L,,故D错误;
故选B。
5.C
解析:HCl与KOH按照1:1反应,且n(HCl)=n(KOH)=48mL×0.1mol/L=12mL×0.4mol/L=4.8×10-3mol,因此反应后溶液显中性,故选C。
6.B
解析:A.步骤①:将食醋精确稀释到原来的10倍,应是配制一定物质的量浓度的溶液,因此需要用到仪器是容量瓶等,故A错误;
B.因为需要标定,因此步骤②是粗配溶液,0.4gNaOH的物质的量为0.1mol,100mL蒸馏水约为0.1L,则浓度约为0.1mol/L,故B正确;
C.用邻苯二甲酸氢钾标定NaOH时,滴定终点显碱性,应用酚酞作指示剂,故C错误;
D.步骤⑤是用NaOH溶液进行滴定,滴定管的刻度从上到下逐渐增大,而图中仪器刻度从上到下逐渐减小,故D错误;
答案为B。
7.C
解析:用已知浓度的NaOH溶液滴定未知浓度的醋酸溶液,恰好反应时生成醋酸钠,溶液呈碱性,用甲基橙作指示剂时误差较大,石蕊的变色范围太宽,不适宜用于滴定指示剂,故只能选用酚酞作指示剂,故答案为:C。
8.C
解析:A.水的离子积常数随着温度的升高逐渐变大,表格中数据逐渐减小,不能用平衡移动原理解释,A错误;
B.乙酸和碳酸的电离常数不同,为物质的本身性质,与平衡移动原理无关,B错误;
C.正反应为放热反应,升高温度平衡向逆反应移动,颜色加深,可用平衡移动原理解释,C正确;
D.加入催化剂,平衡不发生移动,不能用平衡移动原理解释,D错误;
故选C。
二、非选择题
9. > 水的电离是吸热过程,升高温度,促进水的电离,水的离子积常数随温度的升高而增大 AB
解析:(1)由于若电解质的电离是个吸热的过程,因为此温度下的大于时的,说明此温度高于,故答案为:>;水的电离是吸热过程,升高温度,促进水的电离,水的离子积常数随温度的升高而增大;
(2)A.通入适量气体,与反应生成,抑制水的电离,A符合题意;
B.加入适量溶液,其电离出的抑制水的电离,符合题意;
C.升温促进水的电离,不合题意;
D.加入Na,Na与电离出的反应,促进了水的电离,不合题意;
故答案为:AB;
(3)纯水中,又有此温度下,所以,故答案为:。
10. 1×10-13mol2·L-2 高于 1∶10 1∶9
解析:(1)某温度时,NaOH溶液中c平(OH-)=0.01mol·L-1,c平(H+)=1×10-11 mol·L-1,则Kw= c平(OH-)·c平(H+)=0.01mol·L-1×1×10-11mol·L-1=1×10-13 mol2·L-2>1×10-14 mol2·L-2,水的离子积常数随温度的升高而增大,故该温度高于25℃;
(2)该温度下水的离子积Kw=1×10-13 mol2·L-2;
①若所得混合溶液呈中性,则10-13+a·V1=10-b·V2,将a=12, b=2代入,得V1:V2=1:10;
②若所得混合溶液的pH=10,呈碱性,则c平(OH-)=1×10-3 mol·L-1,c平(OH-)=mol·L-1,将a=12, b=2代入,得V1:V2=1:9
