人教版(2019)选择性必修1 3.2 水的电离和溶液的ph (含解析)2023年同步练习卷
文档属性
| 名称 | 人教版(2019)选择性必修1 3.2 水的电离和溶液的ph (含解析)2023年同步练习卷 |

|
|
| 格式 | doc | ||
| 文件大小 | 281.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-22 00:00:00 | ||
图片预览




文档简介
人教版(2019)选择性必修1《3.2 水的电离和溶液的pH》2023年同步练习卷
一、选择题
1.已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol L﹣1的一元酸HA与b mol L﹣1一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)= mol L﹣1
D.混合溶液中,c(H+)+c(B+)=c(OH﹣)+c(A﹣)
2.室温下,等体积的酸和碱的溶液混合后,pH一定小于7的是( )
A.pH=3的HNO3溶液和pH=11的KOH溶液
B.pH=3的盐酸和pH=11的氨水
C.pH=3的CH3COOH溶液和pH=11的Ba(OH)2溶液
D.pH=3的H2SO4溶液和pH=11的NaOH溶液
3.常温时,向20.00mL 0.1000mol L﹣1一元酸HX的溶液中滴加0.1000mol L﹣1的NaOH溶液,溶液的pH与加入的NaOH溶液的体积的关系如图所示.下列说法正确的是( )
A.电离常数Ka(HX)=1.0×10﹣6
B.b点存在关系:2c(Na+)=c(HX)+c(X﹣)
C.c点存在关系:c(Na+)<c(X﹣)
D.可选取甲基橙或石蕊作为指示剂
4.25℃时,用0.1000mol L﹣1NaOH溶液分别滴定20.00mL 0.1000mol L﹣1一元强酸甲的溶液和一元弱酸乙的溶液,滴定曲线如图所示.下列有关判断正确的是( )
A.曲线Ⅰ代表的滴定过程最好选用甲基橙作为指示剂
B.曲线Ⅱ为NaOH溶液滴定一元弱酸乙的溶液的滴定曲线
C.电离常数Ka(乙)=1.0×10﹣5
D.图象中的x>20.00
5.常温下,向25.00mL 0.1mol/LNaOH溶液中逐滴滴加0.2mol/L的HN3(叠氮酸)溶液,溶液的pH随加入的HN3溶液体积的变化曲线如图所示(溶液混合后体积的变化忽略不计,叠氮酸的Ka=10﹣4.7).下列说法正确的是( )
A.由水电离出的c(H+):A点大于B点
B.从A点到C点,都存在c(Na+)>c(N3﹣)>c(OH﹣)>c(H+)
C.在C点,c(Na+)=c(N3﹣)
D.在D点,c(Na+)=2c(HN3)+2c(N3﹣)
6.已知:pOH=﹣lgc(OH﹣)。室温下,向浓度为0.1mol L﹣1的氨水中缓缓通入HCl,随pOH的变化曲线如图所示。假设溶液体积没有变化,下列推断正确的是( )
A.NH3 H2O的电离常数的数量级为10﹣4
B.b点溶液中:c()>c(NH3 H2O)
C.c点溶液中:c(Cl﹣)=0.1mol L﹣1
D.pOH=8的溶液中:c(NH3 H2O)+c(Cl﹣)>0.1mol L﹣1
7.下列溶液一定显酸性的是( )
A.溶液中c(OH﹣)>c(H+)
B.滴加紫色石蕊试液后变红色的溶液
C.溶液中c(H+)=10﹣6 mol/L
D.pH<7的溶液
8.常温时,浓度为0.01mol L﹣1的稀盐酸用蒸馏水稀释108倍,则稀释后溶液的pH约为( )
A.2 B.7 C.10 D.12
9.某温度下,HNO2和CH3COOH的电离常数分别为5.0×10﹣4和1.7×10﹣5.将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.从c点到d点,溶液中保持不变(其中HA、A﹣分别代表相应的酸和酸根离子)
D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
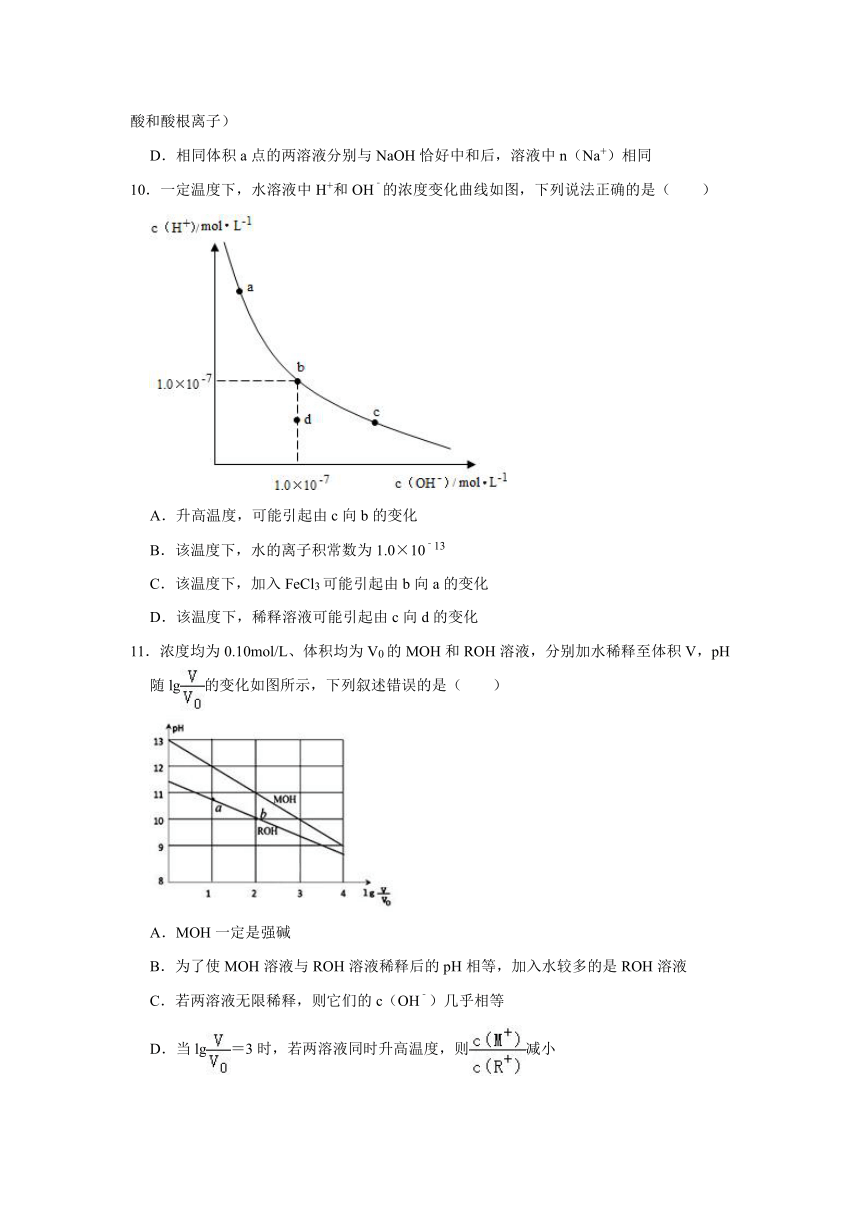
10.一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10﹣13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
11.浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg的变化如图所示,下列叙述错误的是( )
A.MOH一定是强碱
B.为了使MOH溶液与ROH溶液稀释后的pH相等,加入水较多的是ROH溶液
C.若两溶液无限稀释,则它们的c(OH﹣)几乎相等
D.当lg=3时,若两溶液同时升高温度,则减小
12.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10﹣3,Ka2=3.9×10﹣6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2﹣的导电能力之和大于HA﹣的
C.b点的混合溶液pH大于7
D.c点的混合溶液中,c(Na+)>c(OH﹣)>c(K+)
二、填空题
13.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂.请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 .直到加入最后一滴盐酸后,溶液由黄色变为橙色,并半分钟内不变色为止.
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是 .
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.振荡锥形瓶时部分液体溅出
D.读取盐酸体积时,开始俯视读数,滴定结束时仰视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示所用盐酸溶液的体积为 mL.
14.水溶液中的离子平衡是中学学习的一个重要内容。
(1)下列溶液①0.1mol L﹣1盐酸②0.1mol L﹣1H2SO4溶液③0.1mol L﹣1CH3COONa溶液④0.1mol L﹣1NH4Cl溶液⑤0.1mol L﹣1NaOH溶液,按pH由小到大顺序为 (填序号)。
(2)在一定温度下,将一定质量冰醋酸加水稀释过程中溶液的导电能力变化如图所示:
a、b、c三点对应的溶液中,CH3COOH电离程度最大的是 ;
a、b、c三点溶液用1mol L﹣1NaOH溶液中和,消耗NaOH溶液体积大小关系 。
(3)已知25℃时,水解反应的一级平衡常数Kh=2×10﹣4mol L﹣1,写出此Kh的表达式 ;当溶液中c():c()=2:1时,溶液的pH= 。
(4)SOCl2是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有雾形成,并有带刺激性气味气体溢出,该气体可使品红溶液褪色,请根据实验现象写出SOCl2和H2O反应的化学方程式: 。
(5)等浓度的盐酸、氨水中,由水电离出的H+浓度c盐酸(H+) c氨水(H+)(填“>”“<”或“=”)。在25℃下,将amol L﹣1的氨水与0.01mol L﹣1的盐酸等体积混合充分反应后溶液呈中性。则反应后溶液存在的离子浓度由大到小顺序为 ,用含a的代数式表示NH3 H2O的电离常数Kb= 。
三、实验题
15.氯磺酸(HSO3Cl)在糖精、磺胺药的生产中有重要的应用。常温常压下氯磺酸为无色油状液体,沸点约为152℃,吸湿性和腐蚀性极强,在空气中发烟。学习小组在实验室用SO3和HCl来制备HSO3Cl并测定产品纯度设计如下实验(夹持装置略去)。请回答下列问题:
(1)仪器m的名称为 。
(2)已知:HSO3Cl中硫元素为+6价,O原子和Cl原子的最外层均满足8电子稳定结构,则HSO3Cl中的化学键为 (填“离子键”、“极性键”或“非极性键”)。
(3)SO3可由五氧化二磷与浓硫酸共热制备,发生反应的化学方程式为 。
(4)装置B的作用为 。由仪器n可知制备HSO3Cl的反应为 (填“放热反应”或“吸热反应”)。
(5)HSO3Cl纯度的测定(仪器m中得到的HSO3Cl中常溶有少量的SO3):
i.取25.0g产品溶于水中,加入过量的Ba(NO3)2溶液充分反应后,过滤。
ii.向滤液中加入过量的AgNO3溶液,过滤、洗涤、干燥、称量,测量所得沉淀AgCl的质量为28.7g。
①HSO3Cl遇水发生反应的化学方程式为 。
②产品HSO3Cl的纯度为 。
四、解答题
16.已知某温度下,水的离子积常数Kw=1.0×10﹣12,请回答下列问题:
(1)此温度 (填“>”、“<”或“=”)25℃,原因是 。
(2)对水进行下列操作,能抑制水的电离的是 。
A.通入适量SO2气体
B.加入适量Ba(OH)2溶液
C.升温
D.加入NH4Cl溶液
(3)此温度下纯水中的c(H+)= 。
(4)醋酸的下列性质中,可以证明它是弱电解质的是 。
①1mol/L的CH3COOH 溶液中c(H+)=10﹣2mol/L
②CH3COOH可以任意比与H2O互溶
③在相同条件下,CH3COOH溶液的导电性比盐酸弱
④10mL 1mol/L的CH3COOH恰好与10mL 1mol/L的NaOH溶液完全反应
⑤同浓度同体积的醋酸和盐酸与Fe反应时,醋酸溶液中放出H2的速度慢
⑥醋酸溶液中CH3COOH、CH3COO﹣,H+同时存在
17.某温度下水的离子积为KW=1×10﹣13,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a:b= ;
(2)若所得混合液的pH=2,则a:b= ;
(3)若所得混合液的pH=10,则a:b= .
18.温度t℃时,某NaOH稀溶液中c(H+)=10﹣amol/L,c(OH﹣)=10﹣bmol/L,已知:a+b=12,请回答下列问题:
(1)该温度下水的离子积常数KW= .
(2)该NaOH溶液中NaOH的物质的量浓度为 ,该NaOH溶液中由水电离出的c(OH﹣)为 .
(3)给该NaOH溶液加热,pH (填“变大”,“变小”或“不变”).
19.草酸合铁酸钾晶体[KaFeb(C2O4)c xH2O](Fe呈+3价)是一种光敏材料,为测定该晶体中草酸根的含量和结晶水的含量,某实验小组实验步骤为:
(1)称量9.820g草酸合铁酸钾晶体,配制成250mL溶液.
(2)取所配溶液25.00mL于锥形瓶中,滴加酸性KMnO4溶液至C2O42﹣全部转化成CO2,同时MnO4﹣被转化成Mn2+,恰好消耗0.1000mol L﹣1KMnO4溶液24.00mL
(3)另取所配溶液25.00mL,向其中加入过量的NaOH溶液,振荡使其充分反应,待沉淀完全后,过滤,洗涤并灼烧,最终得到红色固体质量0.16g.
(已知:5C2O42﹣+2MnO4﹣+16H+═2Mn2++10CO2↑+8H2O)
则该晶体的化学式为: (写出计算过程)
20.利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度.测定步骤如下:
(a)溶液配制:称取1.3000g硫代硫酸钠试样,用新煮沸并冷却的蒸馏水溶解后,加入少量碳酸钠固体,定容至100mL,避光放置7天.
(b)滴定:取10.00mL浓度为0.01000mol/L的K2Cr2O7标准溶液,加入硫酸酸化后再加过量KI溶液(发生反应:Cr2O72﹣+I﹣→I2+Cr3+).然后加入某指示剂,用硫代硫酸钠滴定至终点(发生的反应为2S2O32﹣+I2═S4O62﹣+2I﹣).记录硫代硫酸钠溶液的用量,平行滴定3次.回答下列问题.
(1)步骤(a)中必须用到的玻璃仪器有烧杯、玻璃棒、
(2)完成并配平步骤(b)中给出的反应
Cr2O72﹣+ I﹣+ ═ + Cr3++ I2
(3)滴定过程中,指示剂应选用 ,判断滴定达到终点的现象是 .
(4)滴定前滴定管尖嘴部分有气泡,滴定结束后气泡消失,将导致硫代硫酸钠试剂的纯度 (填“偏大”、“偏小”或“无影响”).
(5)若Na2S2O3溶液的平均用量为12.00mL,样品的纯度为 (Na2S2O3 5H2O的摩尔质量为248g/mol,结果保留两位有效数字)
人教版(2019)选择性必修1《3.2 水的电离和溶液的pH》2023年同步练习卷
参考答案与试题解析
一、选择题
1.【解答】解:A.因酸碱的强弱未知,a=b,只能说明酸碱恰好完全反应,但如为强酸弱碱盐或强碱弱酸盐,则溶液不呈中性,故A错误;
B.因温度未知,则pH=7不一定为中性,故B错误;
C.混合溶液中,c(H+)=mol/L,根据c(H+) c(OH﹣)=KW,可知溶液中c(H+)=c(OH﹣)═mol/L,溶液呈中性,故C正确;
D.任何溶液都存在电荷守恒,即c(H+)+c(B+)=c(OH﹣)+c(A﹣),不能确定溶液的酸碱性,故D错误。
故选:C。
2.【解答】解:A.pH=3的HNO3溶液与pH=13KOH溶液等体积混合,二者pH之和等于14,恰好反应,溶液呈中性,则pH=7,故A不符合题意;
B.pH=3的盐酸和pH=11的氨水等体积混合,溶液中剩余大量的氨水,溶液呈碱性,则pH>7,故B不符合题意;
C.pH=3的CH3COOH溶液和pH=11的Ba(OH)2溶液等体积混合,溶液中剩余大量的醋酸,溶液呈酸性,则pH<7,故C符合题意;
D.pH=3的H2SO4溶液和pH=11的NaOH溶液等体积混合,二者pH之和等于14,恰好反应,溶液呈中性,则pH=7,故D不符合题意,
故选:C。
3.【解答】解:A..1000mol L﹣1一元酸HX的pH=3,则溶液中c(H+)=0.001mol/L<c(HX),则HX是弱酸,其电离程度较小,则c(X﹣)≈c(H+)=0.001mol/L,c(HX)≈0.1000mol/L,Ka(HX)===10﹣5,故A错误;
B.酸碱浓度相等,加入碱体积是酸的一半,则溶液中溶质为等物质的量浓度的HX、NaX,溶液中存在物料守恒2n(Na)=n(X),根据物料守恒得2c(Na+)=c(HX)+c(X﹣),故B正确;
C.c点酸碱恰好完全反应生成NaX,溶液pH>7,溶液呈碱性,则c(H+)<c(OH﹣),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH﹣)+c(X﹣),所以c(Na+)>c(X﹣),故C错误;
D.强碱滴定弱酸,滴定时pH突变范围在碱性范围内,应该选取碱性范围内变色的指示剂,所以应该选取酚酞作指示剂,故D错误;
故选:B。
4.【解答】解:A.甲基橙变色范围为3.1﹣4.4,甲基橙变色范围在酸性范围内,酚酞变色范围在碱性溶液内,甲和NaOH恰好完全反应点呈中性,所以应该选取酚酞作指示剂,故A错误;
B.甲是一元强酸,乙是一元弱酸,则0.1000mol L﹣1一元强酸甲的pH=1、一元弱酸乙的pH>1,根据图知,曲线I表示NaOH溶液滴定乙溶液曲线,故B错误;
C.0.1000mol L﹣1的一元弱酸乙的pH=3,乙电离程度较小,则溶液中c(乙)≈0.1000mol L﹣1,酸根离子浓度和c(H+)近似相等,Ka==1.0×10﹣5,故C正确;
D.NaOH滴定甲溶液时,酸碱浓度相等,则完全反应时消耗酸碱体积相等,V(NaOH)=20.00mL,则x=20.00,故D错误;
故选:C。
5.【解答】解:A.酸或碱抑制水电离,弱离子促进水电离,溶液中碱浓度越大,水电离出的c(H+)越小,根据图知,加入酸的量:A<B,则混合溶液中碱浓度:A>B,所以水电离程度A<B,则水电离出的c(H+):A点小于B点,故A错误;
B.当加入少量HN3时,溶液中c(N3﹣)较小,则存在c(N3﹣)<c(OH﹣),故C错误;
C.C点pH=7,则c(OH﹣)=c(H+),溶液中存在电荷守恒c(N3﹣)+c(OH﹣)=c(Na+)+c(H+),所以c(Na+)=c(N3﹣),故C正确;
D.D点存在物料守恒2n(Na)=n(N),根据物料守恒得2c(Na+)=c(HN3)+c(N3﹣),故D错误;
故选:C。
6.【解答】解:A.取a点,pOH=4.7,得c(OH﹣)=10﹣4.7mol/L;=0,得c(NH3 H2O)=c(),NH3 H2O的电离常数为=10﹣4.7,数量级为10﹣4.7,故A错误;
B.b点时,=﹣1.85,则=10﹣1.85<1,所以c(NH3 H2O)>c(),故B错误;
C.c点溶液中:pOH=7,得c(H+)=c(OH﹣),根据电荷守恒c()+c(H+)=c(Cl﹣)+c(OH﹣),则有c()=c(Cl﹣),但=2.3,溶液中有NH3 H2O,则c()<0.1mol/L,所以c(Cl﹣)<0.1mol L﹣1,故C错误;
D.pOH=8时,c(OH﹣)=10﹣8mol/L,则c(H+)=10﹣6mol/L,根据电荷守恒c()+c(H+)=c(Cl﹣)+c(OH﹣),和物料守恒c(NH3 H2O)+c()=0.1mol/L,两式相减得:c(H+)﹣c(NH3 H2O)=c(Cl﹣)+c(OH﹣)﹣0.1mol/L,c(NH3 H2O)+c(Cl﹣)=0.1mol/L+c(H+)﹣c(OH﹣)=0.1mol/L+10﹣6mol/L﹣10﹣8mol/L>0.1mol/L,所以c(NH3 H2O)+c(Cl﹣)>0.1mol/L,故D正确。
故选:D。
7.【解答】解:A.溶液中c(OH﹣)>c(H+)溶液一定呈碱性,故A错误;
B.紫色石蕊试液变色范围是pH5.0﹣8.0之间颜色分别为红、紫、蓝,遇酸显红色,遇碱呈蓝色,该溶液滴加紫色石蕊试液后变红色,说明溶液呈酸性,故B正确;
C.100℃时,水的离子积常数是10﹣12,溶液中c(H+)=10﹣6 mol/L溶液呈中性,故C错误;
D.100℃时,水的离子积常数是10﹣12,当pH=6时溶液呈中性,所以pH<7的溶液,也可能是中性溶液,故D错误;
故选:B。
8.【解答】解:根据强酸的稀释规律:将pH=a的强酸加水稀释至原来的10b倍,则pH=a+b(当a+b>7时,让PH=7)可知,0.01mol/L的盐酸溶液的PH=2,稀释至108倍后,由于2+8=10>7,但酸溶液再怎么稀释也不能变为碱性,故PH=7,故选:B。
9.【解答】解:酸的电离平衡常数越大,酸的酸性越强,根据电离平衡常数知,酸性:HNO2>CH3COOH,
A.加水稀释促进弱酸电离,pH相同的这两种酸稀释相同倍数,pH变化大的酸性较强,根据图知,pH变化较大的是II,则II表示较强的酸HNO2,所以曲线I表示CH3COOH,故A错误;
B.酸或碱抑制水电离,酸中c(H+)越大其抑制水电离程度越大,酸中c(H+):b>c,则抑制水电离程度:b>c,所以水电离程度:b<c,故B错误;
C.水解平衡常数只与温度有关,=Kh,从c点到d点,温度不变,水解平衡常数不变,所以溶液中保持不变,故C正确;
D.a点两种溶液的pH相同,但是两种溶液浓度:HNO2<CH3COOH,相同体积的a点两种溶液中溶质物质的量:HNO2<CH3COOH,消耗的碱与酸的物质的量成正比,所以消耗的碱:HNO2<CH3COOH,根据Na原子守恒知溶液中n(Na+):HNO2<CH3COOH,故D错误;
故选:C。
10.【解答】解:A、温度升高,水的离子积常数增大,水溶液中,氢离子和氢氧根离子浓度都增大,将不在曲线上,故A错误;
B、b点c(H+)=c(OH﹣)=1.0×10﹣7,故KW=1.0×10﹣7×1.0×10﹣7=1.0×10﹣14,故B错误;
C、加入FeCl3,氯化铁为强酸弱碱盐,铁离子结合水电离出的氢氧根,促进水的电离平衡右移,即氢离子浓度增大,氢氧根离子浓度减小(由b到a),符合图象变化趋势,故C正确;
D、由c点到d点,水的离子积常数减小,温度不变,K不变,故不能利用稀释使其形成此变化,故D错误,
故选:C。
11.【解答】解:A.通过以上分析知,稀释10倍时,0.10mol/LMOH溶液的pH变化值从13降为12,则MOH一定是强碱,故A正确;
B.稀释倍数相同时,强碱变化程度大,由图像可知为了使MOH溶液与ROH溶液稀释后的pH均为11,加入水较多的是MOH溶液,故B错误;
C.无限稀释时,溶液无限接近于7,则它们的c(OH﹣)几乎相等,故C正确;
D.当lg=3时,若两溶液同时升高温度,MOH完全电离,升高温度促进ROH电离,则升高温度c(M+)不变、c(R+)增大,所以当lg=3时,若两溶液同时升高温度,则减小,故D正确;
故选:B。
12.【解答】解:A.溶液的导电能力取决于电荷浓度的大小,由图象可知a、b、c点的离子种类、浓度不同,可知混合溶液的导电能力与离子浓度和种类有关,故A正确;
B.由图象可知b点钾离子浓度较小,b点导电能量较大,b点存在Na+与A2﹣,可知Na+与A2﹣的导电能力之和大于HA﹣的,故B正确;
C.由题给数据可知H2A为二元弱酸,b点溶质为Na2A、K2A,为强碱弱酸盐,溶液呈碱性,则pH>7,故C正确;
D.c点NaOH过量,则n(NaOH)>n(KHA),溶液呈碱性,可知c(Na+)>c(K+)>c(OH﹣),故D错误。
故选:D。
二、填空题
13.【解答】解:(1)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;
故答案为:锥形瓶中溶液颜色变化;
(2)A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸,标准液浓度偏小,会导致测定标准液体积偏高,测定值偏高,故A错误;
B.锥形瓶水洗后未干燥,待测液的物质的量不变,标准液体积不变,测定值不变,故B错误;
C.振荡锥形瓶时部分液体溅出,会导致测定标准液体积偏小,测定值偏低,故C正确;
D.读取盐酸体积时,开始俯视读数,滴定结束时仰视读数,会导致测定标准液体积偏大,测定值偏高,故D错误;
故选C.
(3)起始读数为0.00mL,终点读数为25.90mL,盐酸溶液的体积为25.90mL;
故答案为:25.90;
14.【解答】解:(1)相同物质的量浓度溶液的pH:碱溶液>强碱弱酸盐溶液>强酸弱碱盐溶液>一元强酸溶液>二元强酸溶液,①为一元强酸、②为二元强酸、③强碱弱酸盐、④为强酸弱碱盐、⑤为碱,所以相同物质的量浓度的这几种溶液的pH由小到大顺序是②①④③⑤,
故答案为:②①④③⑤;
(2)CH3COOH溶液的浓度越小,其电离程度越大,溶液浓度:a>b>c,则醋酸电离程度最大的是c点,a、b、c三点溶液用1mol L 1NaOH溶液中和,消耗NaOH溶液的体积与酸的物质的量成正比,a、b、c三点溶液中醋酸的物质的量相等,则消耗的氢氧化钠溶液体积相等,即Va=Vb=Vc,
故答案为:c;Va=Vb=Vc;
(3)碳酸钠是强碱弱酸盐,能发生两步水解,第一步水解生成碳酸氢根离子和氢氧根离子,水解方程式为:CO32 +H2O=HCO3 +OH ;Kh=,Kh=2×10 4mol/L,则当溶液中c(HCO3 ):c(CO32 )=2:1时,Kh==2×10 4mol/L,则c(OH )=1×10 4 mol/L,因为Kw═1×10 14mol/L,则c(H+ )=1×10 10mol/L,所以溶液的pH=10,
故答案为:Kh=;10;
(4)SOCl2是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有雾形成,并有带刺激性气味气体溢出,该气体可使品红溶液褪色,请根据实验现象可知SOCl2和H2O反应的化学方程式为:SOCl2+H2O=SO2↑+2HCl↑,
故答案为:SOCl2+H2O=SO2↑+2HCl↑;
(5)盐酸是一元强酸,氨水是一元弱碱,若nmol/L的盐酸和氨水,盐酸中电离出的c(H+)=nmol/L,根据Kw=1×10﹣14,可知c水(H+)=c水(OH﹣)==,氨水中电离出的的c(OH﹣)<nmol/L,根据Kw=1×10﹣14,可知c水(H+)=>,所以等浓度的盐酸、氨水中,由水电离出的H+浓度c盐酸(H+)<c氨水(H+),将amol/L的氨水与0.01mol/L的盐酸等体积混合,溶液中存在电荷守恒:c(H+)+c()=c(Cl )+c(OH ),若0.01mol/L氨水与0.01mol/L的盐酸等体积混合,溶液为氯化铵溶液,显酸性,但现在将amol L﹣1的氨水与0.01mol L﹣1的盐酸等体积混合充分反应后溶液呈中性,说明氨水的浓度大,且c()=c(Cl ),则溶液中离子浓度大小为:c()=c(Cl )>c(H+)=c(OH ),电离常数只与温度有关,则此时NH3 H2O的电离常数Kb===mol L 1,
故答案为:<;c()=c(Cl )>c(H+)=c(OH );mol L 1。
三、实验题
15.【解答】解:(1)仪器m的名称为三颈烧瓶,
故答案为:三颈烧瓶;
(2)由已知信息得,HSO3Cl得结构式为,只含极性键,
故答案为:极性键;
(3)五氧化二磷与浓硫酸反应生成三氧化硫和磷酸,反应方程式为:P2O5+3H2SO4(浓)3SO3+2H3PO4,
故答案为:P2O5+3H2SO4(浓)3SO3+2H3PO4;
(4)氯磺酸与水会剧烈反应,由仪器m中逸出得HCl污染空气,故装置B的作用为防止空气中的水蒸气进入装置A中的三颈烧瓶中的氯磺酸反应,并吸收逸出的HCl.仪器n是球形冷凝管,作用为冷凝回流氯磺酸,故该制备反应为放热反应,
故答案为:防止空气中的水蒸气进入反应装置A中,并吸收挥发出的HCl气体;放热反应;
(5)①氯磺酸遇水生成硫酸和氯化氢,反应方程式为:HSO3Cl+H2O=HCl+H2SO4,
故答案为:HSO3Cl+H2O=HCl+H2SO4;
②根据已知信息,HSO3Cl~AgCl,生成HSO3Cl的质量为g,则产品的纯度为×100%=93.2%,
故答案为:93.2%。
四、解答题
16.【解答】解:(1)因为此温度下的Kw=1.0×10﹣12大于25℃时的Kw=1.0×10﹣14,说明此温度高于25℃,
故答案为:>;水的离子积常数随温度的升高而增大;
(2)A.通入适量SO2气体,SO2与H2O反应生成H2SO3,会抑制水的电离,故A正确;
B.加入适量Ba(OH)2溶液,电离出OH﹣,抑制水的电离,故B正确;
C.水的电离是吸热的过程,升温促进水的电离,故C错误;
D.加入NH4Cl溶液中的溶质为强酸弱碱盐,铵根离子水解促进水的电离,故D错误;
所以能抑制水的电离的为A、B.
故答案为:AB;
(3)此温度下纯水中的c(H+)=c(OH﹣)=1×10﹣6mol/L,
故答案为:1×10﹣6mol/L;
(4)①中若CH3COOH完全电离,则c(H+)=1mol/L,现在c(H+)=10﹣2mol/L,CH3COOH部分电离,为弱电解质;
②中CH3COOH以任意比与H2O互溶,体现的是CH3COOH的溶解性,与CH3COOH是强电解质还是弱电解质无必然的联系;
③是在相同条件下,即同温同浓度条件下,CH3COOH溶液的导电性比盐酸弱,说明CH3COOH溶液中离子浓度小,即电离程度小,盐酸中的HCl是完全电离的,故说明CH3COOH为弱电解质;
④中发生的是酸碱中和反应,醋酸与强碱反应能够进行到底,不能说明其电离程度,不能判断醋酸为弱电解质;
⑤中Fe无论是与盐酸还是与CH3COOH溶液反应,其实质都是与溶液中的H+反应,与CH3COOH溶液反应;放出H2的速率慢,说明CH3COOH溶液中c(H+)小,CH3COOH部分电离;
⑥CH3COOH溶液中CH3COOH、CH3COO﹣、H+同时存在,说明CH3COOH不能完全电离,是弱电解质,
综合以上分析可知:①③⑤⑥可以证明它是弱电解质,
故答案为:①③⑤⑥。
17.【解答】解:若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH﹣)=mol/L=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,则
(1)若所得混合液为中性,则有0.01a=0.1b,a:b=10:1,故答案为:10:1;
(2)若所得混合液的pH=2,则有=0.01,解得:a:b=9:2,
故答案为:9:2;
(3)若所得混合液的pH=10,即溶液中的c(OH﹣)=10﹣3mol/L,则有:10﹣3==
解得a:b=101:9,故答案为:101:9.
18.【解答】解:(1)溶液中的离子积Kw=C(H+)×c(OH﹣)=10﹣a×10﹣b=10﹣(a+b)=10﹣12;故答案为:10﹣12;
(2)该NaOH溶液中NaOH的物质的量浓度为C(NaOH)=c(OH﹣)=10﹣bmol/L;依据溶液中的离子积Kw=C(H+)×c(OH﹣)=10﹣12;该NaOH溶液中由水电离出的c(OH﹣)为10﹣a;
故答案为:10﹣bmol/L;10﹣amol/L;
(3)给该NaOH溶液加热,促进水的电离,溶液中存在离子积常数,离子积常数增大,溶液中氢氧根离子浓度是碱的氢氧根离子浓度不变,氢离子浓度增大,所以溶液PH减小;
故答案为:变小;
19.【解答】解:根据5C2O42﹣+2MnO4﹣+16H+═2Mn2++10CO2↑+8H2O可知,25mL溶液中n(C2O42﹣)=n(MnO4﹣)=×0.024L×0.1mol/L=0.006mol,则9.82g草酸合铁酸钾晶体中n(C2O42﹣)=0.006mol×=0.06mol;
溶液加入过量NaOH溶液,得到沉淀为氢氧化铁,灼烧得到氧化铁,根据Fe元素守恒,25mL溶液中n(Fe3+)=
2n(Fe2O3)=2×=0.002mol,9.82g草酸合铁酸钾晶体中n(Fe3+)=0.002mol×=0.02mol,
则b:c=0.02mol:0.06mol=1:3,则c=3b;
由电荷守恒可知,a+3b=2c,则a=3b,则9.82g草酸合铁酸钾晶体中n(K+)=3n(Fe3+)=0.06mol,
则9.82g草酸合铁酸钾晶体中m(H2O)=9.82g﹣0.06mol×39g/mol﹣0.02mol×56g/mol﹣0.06mol×88g/mol=1.08g,则n(H2O)==0.06mol,则x:b=0.06mol:0.02mol=3:1,故x=3b,
故a:b:c:x=3b:b:3b:3b=3:1:3:3,
故该晶体的化学式为K3Fe(C2O4)3 3H2O
故答案为:K3Fe(C2O4)3 3H2O.
20.【解答】解:(1)步骤①是物质的量浓度的配制实验,使用的仪器有:烧杯、玻璃棒、100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
(2)反应中Cr元素化合价由+6价降低到+3价,I元素化合价由﹣1价升高到0价,则根据化合价升降总数相等结合质量守恒可知配平后的方程式应为Cr2O72﹣+6I﹣+14H+=7H2O+2Cr3++3I2,故答案为:1;6;14H+; 7;2;3;
(3)步骤③中,根据反应有碘单质被还原,所以选用淀粉作指示剂,判断滴定达到终点的现象是当滴入最后一滴标准液,溶液的蓝色褪去,且半分钟内不变色,
故答案为:淀粉;当滴入最后一滴标准液,溶液的蓝色褪去,且半分钟内不变色;
(4)若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,则消耗标准溶液体积增大,依据c(待测)=,标准溶液体积增大,100ml溶液中硫代硫酸钠的质量减小,测定结果偏小,
故答案为:偏小;
(5)根据方程式,Cr2O72﹣~3I2~6S2O32﹣
得C(S2O32﹣)==0.05mol/L,
m(Na2S2O3 5H2O)=248g/mol×0.05mol/L×0.1L=1.24g,
质量分数=×100%=95%,
故答案为:95%.
一、选择题
1.已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol L﹣1的一元酸HA与b mol L﹣1一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)= mol L﹣1
D.混合溶液中,c(H+)+c(B+)=c(OH﹣)+c(A﹣)
2.室温下,等体积的酸和碱的溶液混合后,pH一定小于7的是( )
A.pH=3的HNO3溶液和pH=11的KOH溶液
B.pH=3的盐酸和pH=11的氨水
C.pH=3的CH3COOH溶液和pH=11的Ba(OH)2溶液
D.pH=3的H2SO4溶液和pH=11的NaOH溶液
3.常温时,向20.00mL 0.1000mol L﹣1一元酸HX的溶液中滴加0.1000mol L﹣1的NaOH溶液,溶液的pH与加入的NaOH溶液的体积的关系如图所示.下列说法正确的是( )
A.电离常数Ka(HX)=1.0×10﹣6
B.b点存在关系:2c(Na+)=c(HX)+c(X﹣)
C.c点存在关系:c(Na+)<c(X﹣)
D.可选取甲基橙或石蕊作为指示剂
4.25℃时,用0.1000mol L﹣1NaOH溶液分别滴定20.00mL 0.1000mol L﹣1一元强酸甲的溶液和一元弱酸乙的溶液,滴定曲线如图所示.下列有关判断正确的是( )
A.曲线Ⅰ代表的滴定过程最好选用甲基橙作为指示剂
B.曲线Ⅱ为NaOH溶液滴定一元弱酸乙的溶液的滴定曲线
C.电离常数Ka(乙)=1.0×10﹣5
D.图象中的x>20.00
5.常温下,向25.00mL 0.1mol/LNaOH溶液中逐滴滴加0.2mol/L的HN3(叠氮酸)溶液,溶液的pH随加入的HN3溶液体积的变化曲线如图所示(溶液混合后体积的变化忽略不计,叠氮酸的Ka=10﹣4.7).下列说法正确的是( )
A.由水电离出的c(H+):A点大于B点
B.从A点到C点,都存在c(Na+)>c(N3﹣)>c(OH﹣)>c(H+)
C.在C点,c(Na+)=c(N3﹣)
D.在D点,c(Na+)=2c(HN3)+2c(N3﹣)
6.已知:pOH=﹣lgc(OH﹣)。室温下,向浓度为0.1mol L﹣1的氨水中缓缓通入HCl,随pOH的变化曲线如图所示。假设溶液体积没有变化,下列推断正确的是( )
A.NH3 H2O的电离常数的数量级为10﹣4
B.b点溶液中:c()>c(NH3 H2O)
C.c点溶液中:c(Cl﹣)=0.1mol L﹣1
D.pOH=8的溶液中:c(NH3 H2O)+c(Cl﹣)>0.1mol L﹣1
7.下列溶液一定显酸性的是( )
A.溶液中c(OH﹣)>c(H+)
B.滴加紫色石蕊试液后变红色的溶液
C.溶液中c(H+)=10﹣6 mol/L
D.pH<7的溶液
8.常温时,浓度为0.01mol L﹣1的稀盐酸用蒸馏水稀释108倍,则稀释后溶液的pH约为( )
A.2 B.7 C.10 D.12
9.某温度下,HNO2和CH3COOH的电离常数分别为5.0×10﹣4和1.7×10﹣5.将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.从c点到d点,溶液中保持不变(其中HA、A﹣分别代表相应的酸和酸根离子)
D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
10.一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10﹣13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
11.浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg的变化如图所示,下列叙述错误的是( )
A.MOH一定是强碱
B.为了使MOH溶液与ROH溶液稀释后的pH相等,加入水较多的是ROH溶液
C.若两溶液无限稀释,则它们的c(OH﹣)几乎相等
D.当lg=3时,若两溶液同时升高温度,则减小
12.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10﹣3,Ka2=3.9×10﹣6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2﹣的导电能力之和大于HA﹣的
C.b点的混合溶液pH大于7
D.c点的混合溶液中,c(Na+)>c(OH﹣)>c(K+)
二、填空题
13.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂.请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 .直到加入最后一滴盐酸后,溶液由黄色变为橙色,并半分钟内不变色为止.
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是 .
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.振荡锥形瓶时部分液体溅出
D.读取盐酸体积时,开始俯视读数,滴定结束时仰视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示所用盐酸溶液的体积为 mL.
14.水溶液中的离子平衡是中学学习的一个重要内容。
(1)下列溶液①0.1mol L﹣1盐酸②0.1mol L﹣1H2SO4溶液③0.1mol L﹣1CH3COONa溶液④0.1mol L﹣1NH4Cl溶液⑤0.1mol L﹣1NaOH溶液,按pH由小到大顺序为 (填序号)。
(2)在一定温度下,将一定质量冰醋酸加水稀释过程中溶液的导电能力变化如图所示:
a、b、c三点对应的溶液中,CH3COOH电离程度最大的是 ;
a、b、c三点溶液用1mol L﹣1NaOH溶液中和,消耗NaOH溶液体积大小关系 。
(3)已知25℃时,水解反应的一级平衡常数Kh=2×10﹣4mol L﹣1,写出此Kh的表达式 ;当溶液中c():c()=2:1时,溶液的pH= 。
(4)SOCl2是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有雾形成,并有带刺激性气味气体溢出,该气体可使品红溶液褪色,请根据实验现象写出SOCl2和H2O反应的化学方程式: 。
(5)等浓度的盐酸、氨水中,由水电离出的H+浓度c盐酸(H+) c氨水(H+)(填“>”“<”或“=”)。在25℃下,将amol L﹣1的氨水与0.01mol L﹣1的盐酸等体积混合充分反应后溶液呈中性。则反应后溶液存在的离子浓度由大到小顺序为 ,用含a的代数式表示NH3 H2O的电离常数Kb= 。
三、实验题
15.氯磺酸(HSO3Cl)在糖精、磺胺药的生产中有重要的应用。常温常压下氯磺酸为无色油状液体,沸点约为152℃,吸湿性和腐蚀性极强,在空气中发烟。学习小组在实验室用SO3和HCl来制备HSO3Cl并测定产品纯度设计如下实验(夹持装置略去)。请回答下列问题:
(1)仪器m的名称为 。
(2)已知:HSO3Cl中硫元素为+6价,O原子和Cl原子的最外层均满足8电子稳定结构,则HSO3Cl中的化学键为 (填“离子键”、“极性键”或“非极性键”)。
(3)SO3可由五氧化二磷与浓硫酸共热制备,发生反应的化学方程式为 。
(4)装置B的作用为 。由仪器n可知制备HSO3Cl的反应为 (填“放热反应”或“吸热反应”)。
(5)HSO3Cl纯度的测定(仪器m中得到的HSO3Cl中常溶有少量的SO3):
i.取25.0g产品溶于水中,加入过量的Ba(NO3)2溶液充分反应后,过滤。
ii.向滤液中加入过量的AgNO3溶液,过滤、洗涤、干燥、称量,测量所得沉淀AgCl的质量为28.7g。
①HSO3Cl遇水发生反应的化学方程式为 。
②产品HSO3Cl的纯度为 。
四、解答题
16.已知某温度下,水的离子积常数Kw=1.0×10﹣12,请回答下列问题:
(1)此温度 (填“>”、“<”或“=”)25℃,原因是 。
(2)对水进行下列操作,能抑制水的电离的是 。
A.通入适量SO2气体
B.加入适量Ba(OH)2溶液
C.升温
D.加入NH4Cl溶液
(3)此温度下纯水中的c(H+)= 。
(4)醋酸的下列性质中,可以证明它是弱电解质的是 。
①1mol/L的CH3COOH 溶液中c(H+)=10﹣2mol/L
②CH3COOH可以任意比与H2O互溶
③在相同条件下,CH3COOH溶液的导电性比盐酸弱
④10mL 1mol/L的CH3COOH恰好与10mL 1mol/L的NaOH溶液完全反应
⑤同浓度同体积的醋酸和盐酸与Fe反应时,醋酸溶液中放出H2的速度慢
⑥醋酸溶液中CH3COOH、CH3COO﹣,H+同时存在
17.某温度下水的离子积为KW=1×10﹣13,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a:b= ;
(2)若所得混合液的pH=2,则a:b= ;
(3)若所得混合液的pH=10,则a:b= .
18.温度t℃时,某NaOH稀溶液中c(H+)=10﹣amol/L,c(OH﹣)=10﹣bmol/L,已知:a+b=12,请回答下列问题:
(1)该温度下水的离子积常数KW= .
(2)该NaOH溶液中NaOH的物质的量浓度为 ,该NaOH溶液中由水电离出的c(OH﹣)为 .
(3)给该NaOH溶液加热,pH (填“变大”,“变小”或“不变”).
19.草酸合铁酸钾晶体[KaFeb(C2O4)c xH2O](Fe呈+3价)是一种光敏材料,为测定该晶体中草酸根的含量和结晶水的含量,某实验小组实验步骤为:
(1)称量9.820g草酸合铁酸钾晶体,配制成250mL溶液.
(2)取所配溶液25.00mL于锥形瓶中,滴加酸性KMnO4溶液至C2O42﹣全部转化成CO2,同时MnO4﹣被转化成Mn2+,恰好消耗0.1000mol L﹣1KMnO4溶液24.00mL
(3)另取所配溶液25.00mL,向其中加入过量的NaOH溶液,振荡使其充分反应,待沉淀完全后,过滤,洗涤并灼烧,最终得到红色固体质量0.16g.
(已知:5C2O42﹣+2MnO4﹣+16H+═2Mn2++10CO2↑+8H2O)
则该晶体的化学式为: (写出计算过程)
20.利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度.测定步骤如下:
(a)溶液配制:称取1.3000g硫代硫酸钠试样,用新煮沸并冷却的蒸馏水溶解后,加入少量碳酸钠固体,定容至100mL,避光放置7天.
(b)滴定:取10.00mL浓度为0.01000mol/L的K2Cr2O7标准溶液,加入硫酸酸化后再加过量KI溶液(发生反应:Cr2O72﹣+I﹣→I2+Cr3+).然后加入某指示剂,用硫代硫酸钠滴定至终点(发生的反应为2S2O32﹣+I2═S4O62﹣+2I﹣).记录硫代硫酸钠溶液的用量,平行滴定3次.回答下列问题.
(1)步骤(a)中必须用到的玻璃仪器有烧杯、玻璃棒、
(2)完成并配平步骤(b)中给出的反应
Cr2O72﹣+ I﹣+ ═ + Cr3++ I2
(3)滴定过程中,指示剂应选用 ,判断滴定达到终点的现象是 .
(4)滴定前滴定管尖嘴部分有气泡,滴定结束后气泡消失,将导致硫代硫酸钠试剂的纯度 (填“偏大”、“偏小”或“无影响”).
(5)若Na2S2O3溶液的平均用量为12.00mL,样品的纯度为 (Na2S2O3 5H2O的摩尔质量为248g/mol,结果保留两位有效数字)
人教版(2019)选择性必修1《3.2 水的电离和溶液的pH》2023年同步练习卷
参考答案与试题解析
一、选择题
1.【解答】解:A.因酸碱的强弱未知,a=b,只能说明酸碱恰好完全反应,但如为强酸弱碱盐或强碱弱酸盐,则溶液不呈中性,故A错误;
B.因温度未知,则pH=7不一定为中性,故B错误;
C.混合溶液中,c(H+)=mol/L,根据c(H+) c(OH﹣)=KW,可知溶液中c(H+)=c(OH﹣)═mol/L,溶液呈中性,故C正确;
D.任何溶液都存在电荷守恒,即c(H+)+c(B+)=c(OH﹣)+c(A﹣),不能确定溶液的酸碱性,故D错误。
故选:C。
2.【解答】解:A.pH=3的HNO3溶液与pH=13KOH溶液等体积混合,二者pH之和等于14,恰好反应,溶液呈中性,则pH=7,故A不符合题意;
B.pH=3的盐酸和pH=11的氨水等体积混合,溶液中剩余大量的氨水,溶液呈碱性,则pH>7,故B不符合题意;
C.pH=3的CH3COOH溶液和pH=11的Ba(OH)2溶液等体积混合,溶液中剩余大量的醋酸,溶液呈酸性,则pH<7,故C符合题意;
D.pH=3的H2SO4溶液和pH=11的NaOH溶液等体积混合,二者pH之和等于14,恰好反应,溶液呈中性,则pH=7,故D不符合题意,
故选:C。
3.【解答】解:A..1000mol L﹣1一元酸HX的pH=3,则溶液中c(H+)=0.001mol/L<c(HX),则HX是弱酸,其电离程度较小,则c(X﹣)≈c(H+)=0.001mol/L,c(HX)≈0.1000mol/L,Ka(HX)===10﹣5,故A错误;
B.酸碱浓度相等,加入碱体积是酸的一半,则溶液中溶质为等物质的量浓度的HX、NaX,溶液中存在物料守恒2n(Na)=n(X),根据物料守恒得2c(Na+)=c(HX)+c(X﹣),故B正确;
C.c点酸碱恰好完全反应生成NaX,溶液pH>7,溶液呈碱性,则c(H+)<c(OH﹣),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH﹣)+c(X﹣),所以c(Na+)>c(X﹣),故C错误;
D.强碱滴定弱酸,滴定时pH突变范围在碱性范围内,应该选取碱性范围内变色的指示剂,所以应该选取酚酞作指示剂,故D错误;
故选:B。
4.【解答】解:A.甲基橙变色范围为3.1﹣4.4,甲基橙变色范围在酸性范围内,酚酞变色范围在碱性溶液内,甲和NaOH恰好完全反应点呈中性,所以应该选取酚酞作指示剂,故A错误;
B.甲是一元强酸,乙是一元弱酸,则0.1000mol L﹣1一元强酸甲的pH=1、一元弱酸乙的pH>1,根据图知,曲线I表示NaOH溶液滴定乙溶液曲线,故B错误;
C.0.1000mol L﹣1的一元弱酸乙的pH=3,乙电离程度较小,则溶液中c(乙)≈0.1000mol L﹣1,酸根离子浓度和c(H+)近似相等,Ka==1.0×10﹣5,故C正确;
D.NaOH滴定甲溶液时,酸碱浓度相等,则完全反应时消耗酸碱体积相等,V(NaOH)=20.00mL,则x=20.00,故D错误;
故选:C。
5.【解答】解:A.酸或碱抑制水电离,弱离子促进水电离,溶液中碱浓度越大,水电离出的c(H+)越小,根据图知,加入酸的量:A<B,则混合溶液中碱浓度:A>B,所以水电离程度A<B,则水电离出的c(H+):A点小于B点,故A错误;
B.当加入少量HN3时,溶液中c(N3﹣)较小,则存在c(N3﹣)<c(OH﹣),故C错误;
C.C点pH=7,则c(OH﹣)=c(H+),溶液中存在电荷守恒c(N3﹣)+c(OH﹣)=c(Na+)+c(H+),所以c(Na+)=c(N3﹣),故C正确;
D.D点存在物料守恒2n(Na)=n(N),根据物料守恒得2c(Na+)=c(HN3)+c(N3﹣),故D错误;
故选:C。
6.【解答】解:A.取a点,pOH=4.7,得c(OH﹣)=10﹣4.7mol/L;=0,得c(NH3 H2O)=c(),NH3 H2O的电离常数为=10﹣4.7,数量级为10﹣4.7,故A错误;
B.b点时,=﹣1.85,则=10﹣1.85<1,所以c(NH3 H2O)>c(),故B错误;
C.c点溶液中:pOH=7,得c(H+)=c(OH﹣),根据电荷守恒c()+c(H+)=c(Cl﹣)+c(OH﹣),则有c()=c(Cl﹣),但=2.3,溶液中有NH3 H2O,则c()<0.1mol/L,所以c(Cl﹣)<0.1mol L﹣1,故C错误;
D.pOH=8时,c(OH﹣)=10﹣8mol/L,则c(H+)=10﹣6mol/L,根据电荷守恒c()+c(H+)=c(Cl﹣)+c(OH﹣),和物料守恒c(NH3 H2O)+c()=0.1mol/L,两式相减得:c(H+)﹣c(NH3 H2O)=c(Cl﹣)+c(OH﹣)﹣0.1mol/L,c(NH3 H2O)+c(Cl﹣)=0.1mol/L+c(H+)﹣c(OH﹣)=0.1mol/L+10﹣6mol/L﹣10﹣8mol/L>0.1mol/L,所以c(NH3 H2O)+c(Cl﹣)>0.1mol/L,故D正确。
故选:D。
7.【解答】解:A.溶液中c(OH﹣)>c(H+)溶液一定呈碱性,故A错误;
B.紫色石蕊试液变色范围是pH5.0﹣8.0之间颜色分别为红、紫、蓝,遇酸显红色,遇碱呈蓝色,该溶液滴加紫色石蕊试液后变红色,说明溶液呈酸性,故B正确;
C.100℃时,水的离子积常数是10﹣12,溶液中c(H+)=10﹣6 mol/L溶液呈中性,故C错误;
D.100℃时,水的离子积常数是10﹣12,当pH=6时溶液呈中性,所以pH<7的溶液,也可能是中性溶液,故D错误;
故选:B。
8.【解答】解:根据强酸的稀释规律:将pH=a的强酸加水稀释至原来的10b倍,则pH=a+b(当a+b>7时,让PH=7)可知,0.01mol/L的盐酸溶液的PH=2,稀释至108倍后,由于2+8=10>7,但酸溶液再怎么稀释也不能变为碱性,故PH=7,故选:B。
9.【解答】解:酸的电离平衡常数越大,酸的酸性越强,根据电离平衡常数知,酸性:HNO2>CH3COOH,
A.加水稀释促进弱酸电离,pH相同的这两种酸稀释相同倍数,pH变化大的酸性较强,根据图知,pH变化较大的是II,则II表示较强的酸HNO2,所以曲线I表示CH3COOH,故A错误;
B.酸或碱抑制水电离,酸中c(H+)越大其抑制水电离程度越大,酸中c(H+):b>c,则抑制水电离程度:b>c,所以水电离程度:b<c,故B错误;
C.水解平衡常数只与温度有关,=Kh,从c点到d点,温度不变,水解平衡常数不变,所以溶液中保持不变,故C正确;
D.a点两种溶液的pH相同,但是两种溶液浓度:HNO2<CH3COOH,相同体积的a点两种溶液中溶质物质的量:HNO2<CH3COOH,消耗的碱与酸的物质的量成正比,所以消耗的碱:HNO2<CH3COOH,根据Na原子守恒知溶液中n(Na+):HNO2<CH3COOH,故D错误;
故选:C。
10.【解答】解:A、温度升高,水的离子积常数增大,水溶液中,氢离子和氢氧根离子浓度都增大,将不在曲线上,故A错误;
B、b点c(H+)=c(OH﹣)=1.0×10﹣7,故KW=1.0×10﹣7×1.0×10﹣7=1.0×10﹣14,故B错误;
C、加入FeCl3,氯化铁为强酸弱碱盐,铁离子结合水电离出的氢氧根,促进水的电离平衡右移,即氢离子浓度增大,氢氧根离子浓度减小(由b到a),符合图象变化趋势,故C正确;
D、由c点到d点,水的离子积常数减小,温度不变,K不变,故不能利用稀释使其形成此变化,故D错误,
故选:C。
11.【解答】解:A.通过以上分析知,稀释10倍时,0.10mol/LMOH溶液的pH变化值从13降为12,则MOH一定是强碱,故A正确;
B.稀释倍数相同时,强碱变化程度大,由图像可知为了使MOH溶液与ROH溶液稀释后的pH均为11,加入水较多的是MOH溶液,故B错误;
C.无限稀释时,溶液无限接近于7,则它们的c(OH﹣)几乎相等,故C正确;
D.当lg=3时,若两溶液同时升高温度,MOH完全电离,升高温度促进ROH电离,则升高温度c(M+)不变、c(R+)增大,所以当lg=3时,若两溶液同时升高温度,则减小,故D正确;
故选:B。
12.【解答】解:A.溶液的导电能力取决于电荷浓度的大小,由图象可知a、b、c点的离子种类、浓度不同,可知混合溶液的导电能力与离子浓度和种类有关,故A正确;
B.由图象可知b点钾离子浓度较小,b点导电能量较大,b点存在Na+与A2﹣,可知Na+与A2﹣的导电能力之和大于HA﹣的,故B正确;
C.由题给数据可知H2A为二元弱酸,b点溶质为Na2A、K2A,为强碱弱酸盐,溶液呈碱性,则pH>7,故C正确;
D.c点NaOH过量,则n(NaOH)>n(KHA),溶液呈碱性,可知c(Na+)>c(K+)>c(OH﹣),故D错误。
故选:D。
二、填空题
13.【解答】解:(1)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;
故答案为:锥形瓶中溶液颜色变化;
(2)A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸,标准液浓度偏小,会导致测定标准液体积偏高,测定值偏高,故A错误;
B.锥形瓶水洗后未干燥,待测液的物质的量不变,标准液体积不变,测定值不变,故B错误;
C.振荡锥形瓶时部分液体溅出,会导致测定标准液体积偏小,测定值偏低,故C正确;
D.读取盐酸体积时,开始俯视读数,滴定结束时仰视读数,会导致测定标准液体积偏大,测定值偏高,故D错误;
故选C.
(3)起始读数为0.00mL,终点读数为25.90mL,盐酸溶液的体积为25.90mL;
故答案为:25.90;
14.【解答】解:(1)相同物质的量浓度溶液的pH:碱溶液>强碱弱酸盐溶液>强酸弱碱盐溶液>一元强酸溶液>二元强酸溶液,①为一元强酸、②为二元强酸、③强碱弱酸盐、④为强酸弱碱盐、⑤为碱,所以相同物质的量浓度的这几种溶液的pH由小到大顺序是②①④③⑤,
故答案为:②①④③⑤;
(2)CH3COOH溶液的浓度越小,其电离程度越大,溶液浓度:a>b>c,则醋酸电离程度最大的是c点,a、b、c三点溶液用1mol L 1NaOH溶液中和,消耗NaOH溶液的体积与酸的物质的量成正比,a、b、c三点溶液中醋酸的物质的量相等,则消耗的氢氧化钠溶液体积相等,即Va=Vb=Vc,
故答案为:c;Va=Vb=Vc;
(3)碳酸钠是强碱弱酸盐,能发生两步水解,第一步水解生成碳酸氢根离子和氢氧根离子,水解方程式为:CO32 +H2O=HCO3 +OH ;Kh=,Kh=2×10 4mol/L,则当溶液中c(HCO3 ):c(CO32 )=2:1时,Kh==2×10 4mol/L,则c(OH )=1×10 4 mol/L,因为Kw═1×10 14mol/L,则c(H+ )=1×10 10mol/L,所以溶液的pH=10,
故答案为:Kh=;10;
(4)SOCl2是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有雾形成,并有带刺激性气味气体溢出,该气体可使品红溶液褪色,请根据实验现象可知SOCl2和H2O反应的化学方程式为:SOCl2+H2O=SO2↑+2HCl↑,
故答案为:SOCl2+H2O=SO2↑+2HCl↑;
(5)盐酸是一元强酸,氨水是一元弱碱,若nmol/L的盐酸和氨水,盐酸中电离出的c(H+)=nmol/L,根据Kw=1×10﹣14,可知c水(H+)=c水(OH﹣)==,氨水中电离出的的c(OH﹣)<nmol/L,根据Kw=1×10﹣14,可知c水(H+)=>,所以等浓度的盐酸、氨水中,由水电离出的H+浓度c盐酸(H+)<c氨水(H+),将amol/L的氨水与0.01mol/L的盐酸等体积混合,溶液中存在电荷守恒:c(H+)+c()=c(Cl )+c(OH ),若0.01mol/L氨水与0.01mol/L的盐酸等体积混合,溶液为氯化铵溶液,显酸性,但现在将amol L﹣1的氨水与0.01mol L﹣1的盐酸等体积混合充分反应后溶液呈中性,说明氨水的浓度大,且c()=c(Cl ),则溶液中离子浓度大小为:c()=c(Cl )>c(H+)=c(OH ),电离常数只与温度有关,则此时NH3 H2O的电离常数Kb===mol L 1,
故答案为:<;c()=c(Cl )>c(H+)=c(OH );mol L 1。
三、实验题
15.【解答】解:(1)仪器m的名称为三颈烧瓶,
故答案为:三颈烧瓶;
(2)由已知信息得,HSO3Cl得结构式为,只含极性键,
故答案为:极性键;
(3)五氧化二磷与浓硫酸反应生成三氧化硫和磷酸,反应方程式为:P2O5+3H2SO4(浓)3SO3+2H3PO4,
故答案为:P2O5+3H2SO4(浓)3SO3+2H3PO4;
(4)氯磺酸与水会剧烈反应,由仪器m中逸出得HCl污染空气,故装置B的作用为防止空气中的水蒸气进入装置A中的三颈烧瓶中的氯磺酸反应,并吸收逸出的HCl.仪器n是球形冷凝管,作用为冷凝回流氯磺酸,故该制备反应为放热反应,
故答案为:防止空气中的水蒸气进入反应装置A中,并吸收挥发出的HCl气体;放热反应;
(5)①氯磺酸遇水生成硫酸和氯化氢,反应方程式为:HSO3Cl+H2O=HCl+H2SO4,
故答案为:HSO3Cl+H2O=HCl+H2SO4;
②根据已知信息,HSO3Cl~AgCl,生成HSO3Cl的质量为g,则产品的纯度为×100%=93.2%,
故答案为:93.2%。
四、解答题
16.【解答】解:(1)因为此温度下的Kw=1.0×10﹣12大于25℃时的Kw=1.0×10﹣14,说明此温度高于25℃,
故答案为:>;水的离子积常数随温度的升高而增大;
(2)A.通入适量SO2气体,SO2与H2O反应生成H2SO3,会抑制水的电离,故A正确;
B.加入适量Ba(OH)2溶液,电离出OH﹣,抑制水的电离,故B正确;
C.水的电离是吸热的过程,升温促进水的电离,故C错误;
D.加入NH4Cl溶液中的溶质为强酸弱碱盐,铵根离子水解促进水的电离,故D错误;
所以能抑制水的电离的为A、B.
故答案为:AB;
(3)此温度下纯水中的c(H+)=c(OH﹣)=1×10﹣6mol/L,
故答案为:1×10﹣6mol/L;
(4)①中若CH3COOH完全电离,则c(H+)=1mol/L,现在c(H+)=10﹣2mol/L,CH3COOH部分电离,为弱电解质;
②中CH3COOH以任意比与H2O互溶,体现的是CH3COOH的溶解性,与CH3COOH是强电解质还是弱电解质无必然的联系;
③是在相同条件下,即同温同浓度条件下,CH3COOH溶液的导电性比盐酸弱,说明CH3COOH溶液中离子浓度小,即电离程度小,盐酸中的HCl是完全电离的,故说明CH3COOH为弱电解质;
④中发生的是酸碱中和反应,醋酸与强碱反应能够进行到底,不能说明其电离程度,不能判断醋酸为弱电解质;
⑤中Fe无论是与盐酸还是与CH3COOH溶液反应,其实质都是与溶液中的H+反应,与CH3COOH溶液反应;放出H2的速率慢,说明CH3COOH溶液中c(H+)小,CH3COOH部分电离;
⑥CH3COOH溶液中CH3COOH、CH3COO﹣、H+同时存在,说明CH3COOH不能完全电离,是弱电解质,
综合以上分析可知:①③⑤⑥可以证明它是弱电解质,
故答案为:①③⑤⑥。
17.【解答】解:若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH﹣)=mol/L=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,则
(1)若所得混合液为中性,则有0.01a=0.1b,a:b=10:1,故答案为:10:1;
(2)若所得混合液的pH=2,则有=0.01,解得:a:b=9:2,
故答案为:9:2;
(3)若所得混合液的pH=10,即溶液中的c(OH﹣)=10﹣3mol/L,则有:10﹣3==
解得a:b=101:9,故答案为:101:9.
18.【解答】解:(1)溶液中的离子积Kw=C(H+)×c(OH﹣)=10﹣a×10﹣b=10﹣(a+b)=10﹣12;故答案为:10﹣12;
(2)该NaOH溶液中NaOH的物质的量浓度为C(NaOH)=c(OH﹣)=10﹣bmol/L;依据溶液中的离子积Kw=C(H+)×c(OH﹣)=10﹣12;该NaOH溶液中由水电离出的c(OH﹣)为10﹣a;
故答案为:10﹣bmol/L;10﹣amol/L;
(3)给该NaOH溶液加热,促进水的电离,溶液中存在离子积常数,离子积常数增大,溶液中氢氧根离子浓度是碱的氢氧根离子浓度不变,氢离子浓度增大,所以溶液PH减小;
故答案为:变小;
19.【解答】解:根据5C2O42﹣+2MnO4﹣+16H+═2Mn2++10CO2↑+8H2O可知,25mL溶液中n(C2O42﹣)=n(MnO4﹣)=×0.024L×0.1mol/L=0.006mol,则9.82g草酸合铁酸钾晶体中n(C2O42﹣)=0.006mol×=0.06mol;
溶液加入过量NaOH溶液,得到沉淀为氢氧化铁,灼烧得到氧化铁,根据Fe元素守恒,25mL溶液中n(Fe3+)=
2n(Fe2O3)=2×=0.002mol,9.82g草酸合铁酸钾晶体中n(Fe3+)=0.002mol×=0.02mol,
则b:c=0.02mol:0.06mol=1:3,则c=3b;
由电荷守恒可知,a+3b=2c,则a=3b,则9.82g草酸合铁酸钾晶体中n(K+)=3n(Fe3+)=0.06mol,
则9.82g草酸合铁酸钾晶体中m(H2O)=9.82g﹣0.06mol×39g/mol﹣0.02mol×56g/mol﹣0.06mol×88g/mol=1.08g,则n(H2O)==0.06mol,则x:b=0.06mol:0.02mol=3:1,故x=3b,
故a:b:c:x=3b:b:3b:3b=3:1:3:3,
故该晶体的化学式为K3Fe(C2O4)3 3H2O
故答案为:K3Fe(C2O4)3 3H2O.
20.【解答】解:(1)步骤①是物质的量浓度的配制实验,使用的仪器有:烧杯、玻璃棒、100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
(2)反应中Cr元素化合价由+6价降低到+3价,I元素化合价由﹣1价升高到0价,则根据化合价升降总数相等结合质量守恒可知配平后的方程式应为Cr2O72﹣+6I﹣+14H+=7H2O+2Cr3++3I2,故答案为:1;6;14H+; 7;2;3;
(3)步骤③中,根据反应有碘单质被还原,所以选用淀粉作指示剂,判断滴定达到终点的现象是当滴入最后一滴标准液,溶液的蓝色褪去,且半分钟内不变色,
故答案为:淀粉;当滴入最后一滴标准液,溶液的蓝色褪去,且半分钟内不变色;
(4)若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,则消耗标准溶液体积增大,依据c(待测)=,标准溶液体积增大,100ml溶液中硫代硫酸钠的质量减小,测定结果偏小,
故答案为:偏小;
(5)根据方程式,Cr2O72﹣~3I2~6S2O32﹣
得C(S2O32﹣)==0.05mol/L,
m(Na2S2O3 5H2O)=248g/mol×0.05mol/L×0.1L=1.24g,
质量分数=×100%=95%,
故答案为:95%.
