2.2.分子的空间结构 巩固训练(含解析)2023-2024学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.2.分子的空间结构 巩固训练(含解析)2023-2024学年高二下学期化学人教版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 559.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-23 14:50:15 | ||
图片预览



文档简介
2.2.分子的空间结构巩固训练-2023-2024学年高二下学期化学人教版(2019)选择性必修2
一、单选题
1.OF2是良好的氧化剂和氟化剂,可通过反应制备,下列说法正确的是
A.F2的电子式为F∶F B.OF2是直线形分子
C.NaF是共价化合物 D.NaOH含有离子键和极性共价键
2.下列分子构型为正四面体的是
①P4②NH3③CCl4④CH4⑤H2S ⑥CO2
A.①③④⑤
B.①③④⑤⑥
C.①③④
D.④⑤
3.《天工开物》记载:“凡火药以硝石、硫磺为主,草木灰为辅。……而后火药成固”,其中涉及的主要反应为S+2KNO3+3C=K2S+3CO2↑+N2↑。下列表示反应中相关微粒的化学用语正确的是
A.S2-的离子结构示意图:
B.中子数为8的碳原子:C
C.根据价层电子对互斥理论可得S的简单氢化物的VSEPR模型为V形
D.基态N原子2p能级电子轨道表示式:
4.下列化学用语表示不正确的是
A.CCl4的比例模型:
B.sp2杂化轨道模型:
C.羟基的电子式:
D.用原子轨道描述氯化氢分子中化学键的形成:
5.下列有关杂化轨道的说法错误的是
A.由同一能层上的s轨道与p轨道杂化而成
B.所形成的3个杂化轨道的能量相同
C.每个杂化轨道中s能级成分占三分之一
D.杂化轨道最多可形成2个键
6.下列说法不正确的是
A.和轨道均为哑铃形
B.从空间角度看,轨道比轨道大,其空间包含了轨道
C.用光谱仪摄取各种元素原子的吸收光谱即为原子光谱
D.整个原子的能量由核电荷数、电子数和电子状态三个因素共同决定
7.制取H2O2的反应为Na2O2+H2SO4+10H2O=Na2SO4·10H2O+H2O2,下列说法正确的是
A.Na+的结构示意图为
B.的空间结构为正四面体形
C.H2O2的电子式为
D.H2O2中O原子的杂化轨道类型为sp2
8.甲烷分子(CH4)失去一个H+,形成甲基阴离子(),在这个过程中,下列描述不合理的是
A.碳原子的杂化类型发生了改变 B.粒子的形状发生了改变
C.粒子的稳定性发生了改变 D.粒子中的键角发生了改变
9.列关于σ键和π键的说法中,不正确的是
A.σ键由原子轨道“头碰头”重叠形成
B.N2分子中的π键为p-p π键,π键不能绕键轴旋转
C.NH3分子中的σ键为s-s σ键
D.p轨道和p轨道之间既能形成π键,又能形成σ键
10.下列分子或离子的中心原子为sp3杂化,且杂化轨道容纳了1对孤电子对的是
A.CH4、NH3 B.BBr3、SO
C.SO2、BeCl2 D.SOCl2、H3O+
11.制备肼的一种方法为:2NH3+NaClO=N2H4+NaCl+H2O。下列说法正确的是
A.NH3属于弱电解质 B.NaClO的水解ClO-+ H2O=HClO+OH-
C.N2H4中氮原子发生sp3杂化 D.NaCl中阴离子结构示意图为
12.下列分子的空间构型为平面三角形的是
A.NH3 B.BCl3 C.NCl3 D.C2H2
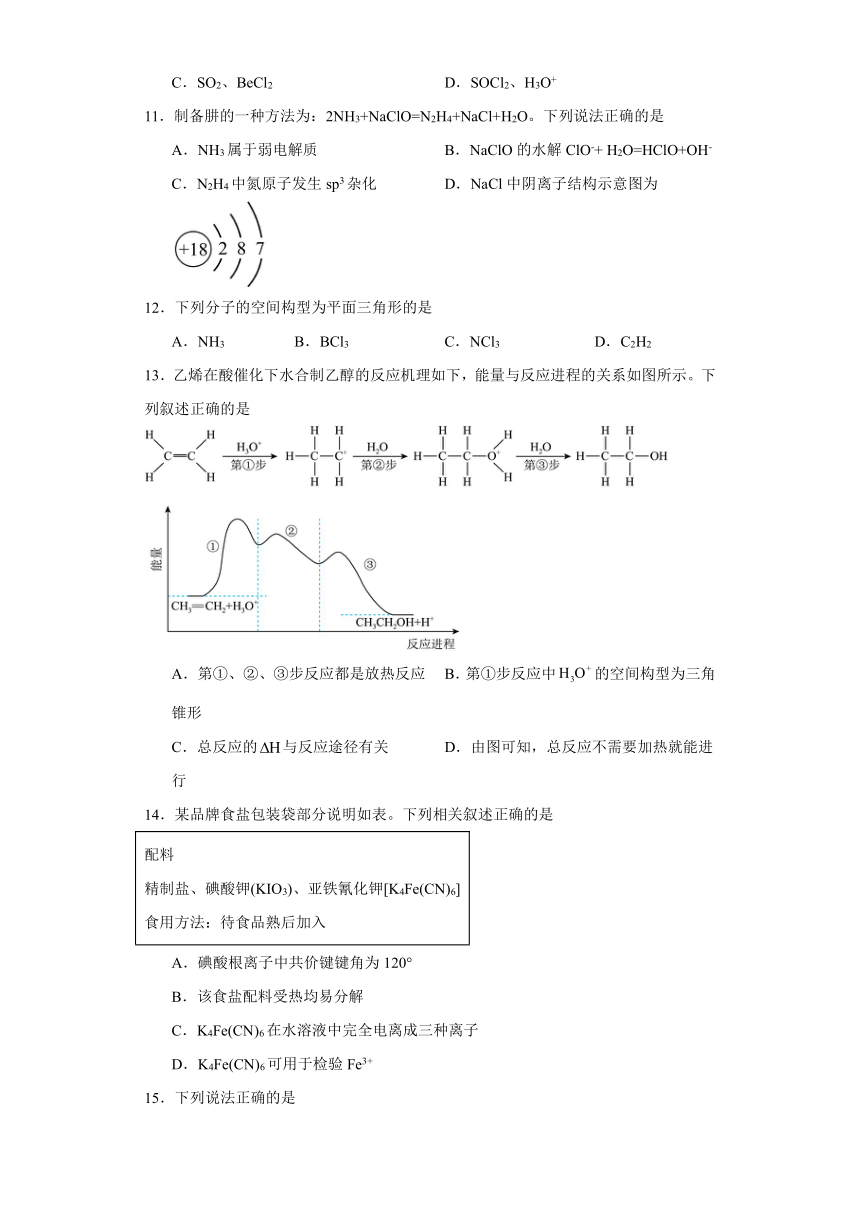
13.乙烯在酸催化下水合制乙醇的反应机理如下,能量与反应进程的关系如图所示。下列叙述正确的是
A.第①、②、③步反应都是放热反应 B.第①步反应中的空间构型为三角锥形
C.总反应的与反应途径有关 D.由图可知,总反应不需要加热就能进行
14.某品牌食盐包装袋部分说明如表。下列相关叙述正确的是
配料 精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6] 食用方法:待食品熟后加入
A.碘酸根离子中共价键键角为120°
B.该食盐配料受热均易分解
C.K4Fe(CN)6在水溶液中完全电离成三种离子
D.K4Fe(CN)6可用于检验Fe3+
15.下列说法正确的是
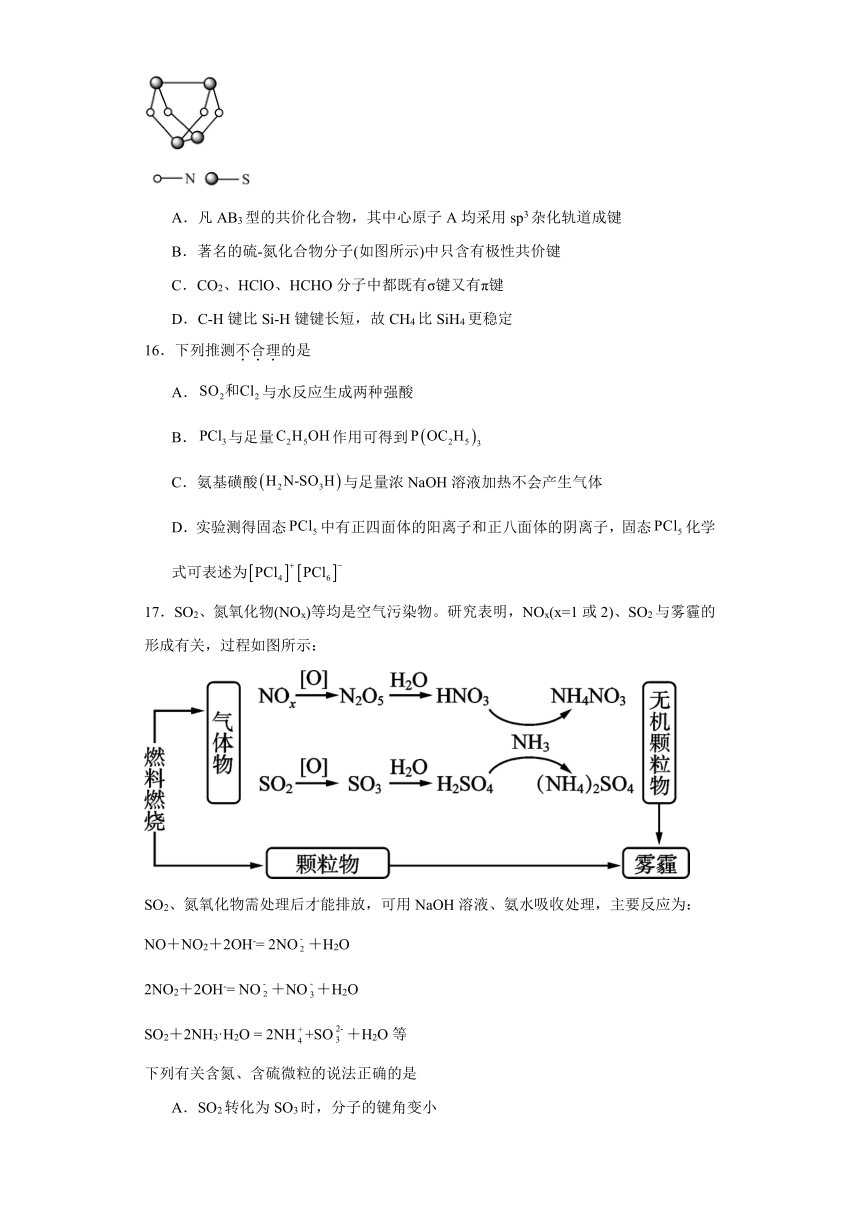
A.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
B.著名的硫-氮化合物分子(如图所示)中只含有极性共价键
C.CO2、HClO、HCHO分子中都既有σ键又有π键
D.C-H键比Si-H键键长短,故CH4比SiH4更稳定
16.下列推测不合理的是
A.与水反应生成两种强酸
B.与足量作用可得到
C.氨基磺酸与足量浓NaOH溶液加热不会产生气体
D.实验测得固态中有正四面体的阳离子和正八面体的阴离子,固态化学式可表述为
17.SO2、氮氧化物(NOx)等均是空气污染物。研究表明,NOx(x=1或2)、SO2与雾霾的形成有关,过程如图所示:
SO2、氮氧化物需处理后才能排放,可用NaOH溶液、氨水吸收处理,主要反应为:
NO+NO2+2OH-= 2NO+H2O
2NO2+2OH-= NO+NO+H2O
SO2+2NH3·H2O = 2NH+SO+H2O等
下列有关含氮、含硫微粒的说法正确的是
A.SO2转化为SO3时,分子的键角变小
B.NO和NO中N原子轨道的杂化类型均为sp3杂化
C.NH和SO的空间构型都是正四面体形
D.SO2、SO3和NO2均为酸性氧化物
18.工业合成尿素的原理:,下列说法正确的是
A.中键比键数目多
B.的分子构型为正四面体形
C.中的所有原子处在同一平面
D.基态氧原子的核外电子轨道表示式:
19.下列有机物分子中的碳原子既有sp3杂化又有sp杂化的是
A.CH3CH=CH2 B.CH3-C≡CH C.CH3CH2OH D.CH≡CH
20.下列化学用语或图示表达正确的是
A.N2的结构式:NN
B.甲基的电子式:
C.CO2的空间填充模型:
D.基态N原子的轨道表示式:
21.已知:,阿伏伽德罗常数的值为NA。若反应物中H2SO4消耗了3mol,则下列说法错误的是
A.转移电子的数目为6NA B.标准状况下,生成H2O27g
C.生成还原产物的分子数为1NA D.产物AsH3为平面三角形
22.甲烷中的碳原子是sp3杂化,下列用*表示碳原子的杂化和甲烷中的碳原子杂化状态一致的是
A.CH≡C*CH3 B.C*H2=CHCH3 C.CH2=C*HCH3 D.CH2=CHC*H3
23.下列化学用语表达正确的是
A.的结构式:H-Cl-O B.中子数为20的氯原子:Cl
C.的VSEPR模型: D.羟基的电子式:
24.中国科学院天津工业生物技术研究所科研团队在实验室里首次实现了以CO2为原料人工合成淀粉,其合成路线如图所示。设NA为阿伏加德罗常数的值,下列说法正确的是
A.1mol DHA中含有σ键数目为7NA
B.1mol DHA中,sp3杂化的原子数为2NA
C.过程②中,1mol CH3OH断裂极性键的数目为2NA
D.CH3OH分子中,碳原子与氧原子之间的共价键为sp3-p σ键
25.奥司他韦对亚型流感病毒引起的流行性感冒有治疗和预防作用,其分子结构如图所示,下列说法正确的是
A.奥司他韦的分子式为C16H26N2O4
B.奥司他韦分子中碳原子均采取sp2杂化
C.奥司他韦分子中含有2个手性碳原子
D.奥司他韦既能与盐酸反应又能与氢氧化钠溶液反应
二、填空题
26.试指出下列分子的空间结构。
(1);
(2);
(3);
(4);
(5);
(6)。
27.a、b、c、d四种短周期元素,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族。请完成下列空白:
(1)a和b形成的共价化合物,分子的空间结构呈三角锥形,该分子的中心原子的杂化轨道类型为;a和c形成的共价化合物,分子中既含有极性共价键,又含有非极性共价键的化合物是(填化学式)。
(2)这些元素可以形成哪些含氧酸?分析每种含氧酸酸根离子的空间结构和中心原子的杂化轨道类型。
28.NH4H2PO4中,P的杂化轨道与O的2p轨道形成键。
29.AB3与AC3,若电负性:B>A>C,则键角:AB3AC3,原因为。
30.根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)某元素原子基态核外电子有14种不同的运动状态,该元素位于第周期第族,属于区,占据最高能级的电子云轮廓图为形。
(2)1~36号元素中基态原子核外电子排布中未成对电子数最多的元素的核外电子排布式是,其价电子轨道表示式为。
(3)价电子排布式为3d54s2的原子,其原子结构示意图为,其最高正价为价。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为,C原子的杂化方式为。
试卷第2页,共7页
参考答案:
1.D
【详解】A.的电子式为 ,A错误;
B.中的O原子为sp3杂化,且存在2对孤对电子,为V形结构,B错误;
C.NaF是钠离子和氟离子形成的离子化合物,C错误;
D.NaOH是钠离子和氢氧根离子构成的离子化合物,氢氧根中存在氢氧极性共价键,故含有离子键和极性共价键,D正确;
故选D。
2.C
【详解】①P4分子构型为正四面体;
②NH3分子中的氮原子sp3杂化,有一个杂化轨道容纳弧对电子对,所以构型为三角锥;
③CCl4分子中碳原子sp3杂化,没有弧对电子对,所以构型为正四面体;
④CH4分子中碳原子sp3杂化,没有弧对电子对,所以构型为正四面体;
⑤H2S分子中硫原子sp3杂化,有两对弧对电子对,所以构型为V型;
⑥CO2分子中碳原子sp杂化,所以构型为直线型,
所以①③④正确,答案选C。
3.D
【详解】A.S是16号元素,故S2-的结构示意图为:,A错误;
B.C为6号元素,故中子数为8的碳原子为:C,B错误;
C.S的简单氢化物为H2S,价层电子对数为=4,所以VSEPR模型正四面体形,C错误;
D.基态N原子的核外电子排布式为:1s22s22p3,根据洪特规则(电子进入能量相同的能级不同轨道时,总是优先单独占据不同的轨道且自旋方向相同)可知,2p能级电子轨道表示式为:,D正确;
综上所述答案为D。
4.A
【详解】A.Cl原子半径应比C原子半径大,A选项错误;
B.sp2杂化轨道模型为平面三角形,B选项正确
C.羟基为不带电原子团,C选项正确;
D.H的s轨道上有一个未成对电子,Cl的3p轨道上有5个电子,其中有一个轨道有一个未成对电子,按照共价键理论,两个自旋方向相反的电子成键时,原子轨道有效重叠,H的s轨道和与Cl的p轨道延键轴方向头碰头形成了一个共价键,即σ键,D选项正确;
答案选A。
5.D
【详解】A.同一能层上的s轨道与p轨道的能量差异不大,杂化轨道是由同一能层上的s轨道与p轨道杂化而成的,A项正确;
B.同种类型的杂化轨道能量相同,B项正确;
C.杂化轨道是由1个s轨道与2个p轨道杂化而成的,C项正确;
D.杂化轨道最多可形成3个键,D项错误。
故选:D。
6.C
【详解】A.p轨道为哑铃形,A正确;
B.从空间角度看,轨道空间包含了轨道,比轨道大,B正确;
C.用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱C错误;
D.整个原子的能量由核电荷数、电子数和电子状态三个因素共同决定,D正确;
答案选C。
7.B
【详解】A.钠离子结构示意图为:,A错误;
B.硫原子的价电子对数为4+(6+2-24)/2=4,硫原子采取sp3杂化,硫酸根离子的空间结构为正四面体形,B正确;
C.过氧化氢的电子式为:,C错误;
D.氧原子的价电子对数为2+(6-21)/2=4,氧原子采取sp3杂化,D错误;
答案选B。
8.A
【详解】CH4中C的价层电子对数=4,C为sp3杂化,无孤电子对,为正四面体结构,而中C的价层电子对数=3+=3+1=4,C为sp3杂化,有一对孤电子,空间结构为三角锥形,形状、键角、稳定性均发生改变,但杂化类型不变,仍是sp3杂化,故答案选A。
9.C
【详解】A.σ键由原子轨道“头碰头”重叠形成,其共价键的电子云图形是轴对称的,A项正确;
B.基态N原子的价电子排布式为2s22p3,N2的结构式为,其分子中的π键为p-p π键,π键的电子云图形是镜面对称的,不能绕键轴旋转,B项正确;
C.NH3分子中N原子采取sp3杂化,故NH3分子中的σ键为sp3-sσ键,C项错误;
D.p轨道和p轨道之间既能形成π键,又能形成σ键,如N2分子中既存在p-pσ键、又存在p-pπ键,D项正确;
答案选C。
10.D
【详解】A.CH4中心原子价层电子对数为,是sp3杂化,没有孤对电子对,NH3中心原子价层电子对数为,是sp3杂化,杂化轨道容纳了1对孤电子对,故A不符合题意;
B.BBr3中心原子价层电子对数为,是sp2杂化,没有孤对电子对,SO中心原子价层电子对数为,是sp3杂化,杂化轨道容纳了1对孤电子对,故B不符合题意;
C.SO2中心原子价层电子对数为,是sp2杂化,杂化轨道容纳了1对孤电子对,BeCl2中心原子价层电子对数为,是sp杂化,没有孤对电子对,故C不符合题意;
D.SOCl2中心原子价层电子对数为,是sp3杂化,杂化轨道容纳了1对孤电子对,H3O+中心原子价层电子对数为,是sp3杂化,杂化轨道容纳了1对孤电子对,故D符合题意。
综上所述,答案为D。
11.C
【详解】A.氨气溶于水形成一水合氨为弱碱,而氨气本身在水溶液中和熔融状态下均不导电,属于非电解质,A错误;
B.NaClO中ClO-为弱酸根离子,其水解过程为可逆反应,B错误;
C.N2H4的结构式为,其中氮原子发生sp3杂化,C正确;
D.NaCl由钠离子和氯离子构成,其阴离子Cl-的结构简式为:,D错误;
故选C。
12.B
【详解】A.NH3分子中N原子为sp3杂化,含一对孤电子对,空间构型为三角锥形,A不符合题意;
B.BCl3中B原子价层电子对数为=3,不含孤电子对,空间构型为平面三角形,B符合题意;
C.NCl3中N原子价层电子对数为=4,含一对孤电子对,空间构型为三角锥形,C不符合题意;
D.C2H2中两个C原子均为sp杂化,不含孤电子对,空间构型为直线形,D不符合题意;
综上所述答案为B。
13.B
【详解】A.由图可知,第②③步反应,反应物的总能量均大于生成物的总能量,则第②③步反应均为放热反应,但第①步反应,生成物的总能量大于反应物的总能量,属于吸热反应,故A错误;
B.中O原子的价层电子对数为3+=4,VSEPR模型为四面体,含有一个孤电子对,因此空间构型为三角锥形,故B正确;
C.由盖斯定律可知,一个反应的焓变仅与反应的起始状态和反应的最终状态有关,而与反应途径无关,故C错误;
D.由图可知,总反应放出能量,属于放热反应,但第①步反应的活化能较大,需要加热反应才能进行,故D错误;
答案选B。
14.D
【详解】A.碘酸根离子中,碘的价层电子对为4、有1对孤电子对,其VSEPR模型为四面体、空间构型为三角锥形,键角不是120°,A错误;
B.配料中氯化钠受热不分解,B错误;
C.K4Fe(CN)6在溶液中只能电离生成钾离子和亚铁氰根离子,C错误;
D.K4Fe(CN)6可用于检验Fe3+,检验时发生的反应为:K4Fe(CN)6+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,D正确;
故选D。
15.D
【详解】A.AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键,比如BF3,B原子的价层电子对数=,B采用sp2杂化,A错误;
B.如图所示还含有同种元素硫之间的非极性共价键,B错误;
C.HClO分子中只有单键,分子中只有σ键而没有π键,C错误;
D.C-H键比Si-H键键长短,故CH4比SiH4更稳定,D正确;
故选D。
16.C
【详解】A.和Cl2与水反应生成硫酸和盐酸两种强酸,反应的化学方程式为+2H2O=H2SO4+2HCl,选项A正确;
B. 与足量作用可得到,发生反应为+3=+3HCl,选项B正确;
C.氨基磺酸与足量浓NaOH溶液加热会产生NH3,反应为H2N-SO3H+2NaOH Na2SO4+NH3↑+H2O,选项C错误;
D.实验测得固态中有正四面体的阳离子和正八面体的阴离子,固态化学式可表述为,选项D正确;
答案选C。
17.C
【详解】A.SO2中S价层电子对数=2+=3,为sp2杂化,孤电子对数为1,SO3中S价层电子对数=3+=3,无孤电子对,为sp2杂化,孤电子斥力大于成键电子对,故SO2的键角小于SO3,SO2转化为SO3时,分子的键角变大,A错误;
B.NO中N的价层电子对数=2+=3,为sp2杂化,NO中N的价层电子对数=3+=3,为sp2杂化,即NO和NO中N原子轨道的杂化类型均为sp2杂化,B错误;
C.NH中N的价层电子对数=4+=4,为sp3杂化,无孤电子对,空间构型是正四面体形,SO中S价层电子对数=4+=4,为sp3杂化,无孤电子对,空间构型是正四面体形,C正确;
D.SO2、SO3分别与碱反应生成亚硫酸盐、硫酸盐和水,二者均是酸性氧化物,NO2与碱发生氧化还原反应,不属于酸性氧化物,D错误;
答案选C。
18.D
【详解】A. 中含2个键、2个键,数目相同,故A错误;
B. 氨分子中N原子价层电子对数为3+=4,有一个孤电子对,的分子构型为三角锥形,故B错误;
C. 中的N原子价层电子对数为3+=4,N以及与N相连的三个原子呈三角锥形,所有原子不可能处在同一平面,故C错误;
D. O核外有8个电子,基态氧原子的核外电子轨道表示式:,故D正确;
故选D。
19.B
【详解】A.CH3CH=CH2中双键碳为sp2、单键碳为sp3,故不选A;
B.CH3-C≡CH中三键碳为sp、单键碳为sp3,故选B;
C.CH3CH2OH中碳原子均为sp3杂化,故不选C;
D.CH≡CH中碳原子只有sp杂化,故不选D;
选B。
20.A
【详解】A.结构式是指用一根短线表示一对共用电子对的式子,则N2的结构式为N≡N,A正确;
B.甲基(CH3-)的电子式为,B错误;
C.CO2是直线形分子,故CO2的空间填充模型为,C错误;
D.基态N原子的轨道表示式为,D错误;
故答案为A。
21.D
【分析】As的化合价由+3降低到-3,Zn化合价由0升高到+2,则,以此分析;
【详解】A.若反应物中H2SO4消耗了3mol,转移电子的数目为6NA,A正确;
B.若反应物中H2SO4消耗了3mol,生成1.5molH2O,,B正确;
C.2AsH3为还原产物,若反应物中H2SO4消耗了3mol,生成1molAsH3,C正确;
D.As与N为同族元素,故AsH3为三角锥形,D错误;
故答案为:D。
22.D
【详解】A.CH≡C*CH3中,带“ ”碳原子的价层电子对数为2,发生sp杂化,A不符合题意;
B.C*H2=CHCH3中,带“ ”碳原子的价层电子对数为3,发生sp2杂化,B不符合题意;
C.CH2=C*HCH3中,带“ ”碳原子的价层电子对数为3,发生sp2杂化,C不符合题意;
D.CH2=CHC*H3中,带“ ”碳原子的价层电子对数为4,发生sp3杂化,D符合题意;
故选D。
23.C
【详解】A.HClO的结构式为H-O-Cl,A错误;
B.中子数为20的氯原子可表示为,B错误;
C.NH3中N的价层电子对数为3+=4,含有一对孤电子对,其VSEPR模型正确,C正确;
D.羟基的电子式为 ,D错误;
故答案选C。
24.C
【详解】A.1个单键即1个σ键,1个双键含有1个σ键和1个π键,根据DHA的结构式,含有σ键数目为11NA,A错误;
B.DHA中sp3杂化的原子为2个亚甲基中的C,2个羟基中的O,共四个原子,即4NA,B错误;
C.根据图示转化,过程②中1mol甲醇氧化为甲醛,断裂1mol C-H键和1mol O-H键,共2mol极性共价键,即2NA,故C正确
D.CH3OH分子中,以碳为中心的结构为四面体结构,碳原子,氧原子均采取sp3杂化,其之间的共价键为sp3-sp3 σ键,D错误;
故答案选C。
25.D
【详解】A.根据奥司他韦的结构简式,该有机物分子式为C16H28N2O4,A错误;
B.由结构简式可知,奥司他韦分子中饱和碳原子的杂化方式为sp3杂化,B错误;
C.奥司他韦分子中六元环不对称,环上含有3个手性碳原子,C错误;
D.奥司他韦含有氨基所以能与盐酸反应又含有酯基所以能与氢氧化钠溶液反应,D正确;
故选D。
26.(1)平面三角形
(2)三角锥形
(3)直线形分子
(4)V形分子
(5)正四面体形结构
(6)直线形分子
【详解】(1)分子中中心原子价层电子对数为3+=3,B原子采用sp2杂化,所以分子是平面三角形;
(2)分子中中心原子价层电子对数为3+=4,P原子采用sp3杂化,P原子上含有1对孤电子对,所以分子是三角锥形;
(3)分子中中心原子价层电子对数为2+=2,O原子采用sp杂化,所以是直线形分子;
(4)H2O分子中中心原子价层电子对数为2+=4,O原子采用sp3杂化,O原子上含有2对孤电子对,所以H2O分子是V形分子;
(5)分子中中心原子价层电子对数为4+=4,Si原子采用sp3杂化,所以是正四面体形结构;
(6)乙炔分子中含有碳碳叁键,结构式为 ,分子中碳原子形成2个σ键2个π键,为sp杂化;分子为直线形分子。
27.(1) sp3 H2O2
(2) HNO2、HNO3、H2SO3、H2SO4 V形、平面三角形、三角锥形、正四面体形,sp2、sp2、sp3、sp3
【分析】由题干信息可知,a、b、c、d四种短周期元素,原子序数依次增大,a的核外电子总数与其周期数相同,故a为H, c的最外层电子数为其内层电子数的3倍,故c为O,b的价电子层中的未成对电子有3个则b为N,d与c同族,故d为S,据此分析解题。
(1)
由分析可知,a为H,b为N,故a和b形成的共价化合物,分子的空间结构呈三角锥形,该分子为NH3,该分子的中心原子的价层电子对数为:3+=4,故其杂化轨道类型为sp3,极性共价键是指不同种非金属元素之间形成的共价键,非极性共价键是指同种非金属元素之间形成的共价键,已知c为O,故a和c形成的共价化合物,分子中既含有极性共价键,又含有非极性共价键的化合物是H2O2,故答案为:sp3;H2O2;
(2)
由分析可知,a、b、c、d四种短周期元素分别为H、N、O、S,故这些元素形成的含氧酸有:HNO2、HNO3、H2SO3、H2SO4,它们对应的酸根离子分别为:、、、,这些酸根离子的中心原子周围价层电子数分别为:2+=3、3+=3、3+=4、4+=4,故每种含氧酸酸根离子的空间结构分别为V形、平面三角形、三角锥形、正四面体形,它们中心原子的杂化轨道类型分别为:sp2、sp2、sp3、sp3,故答案为:HNO2、HNO3、H2SO3、H2SO4;V形、平面三角形、三角锥形、正四面体形,sp2、sp2、sp3、sp3。
28. sp3 σ
【详解】中P的价层电子对数为4+=4,NH4H2PO4中P的杂化方式与中P的杂化方式相同,则NH4H2PO4中P原子采取sp3杂化,杂化轨道用于形成σ键或容纳孤电子对,NH4H2PO4中P的sp3杂化轨道和O的2p轨道形成σ键。
29. < 电负性:B>A>C,在AB3中成键电子对离中心原子较远,斥力较小,因而键角较小
【详解】由于电负性B>A>C,在AB3中成键电子对靠近B,离中心原子较远,之间的斥力较小,因而键角较小。
30.(1) 3 ⅣA p 哑铃
(2) 1s22s22p63s23p63d54s1
(3) +7
(4) 三角形 sp2
【详解】(1)某元素原子基态核外电子有14种不同的运动状态,说明核外有14个电子,该元素位于第3周期第ⅣA族,属于p区,占据最高能级是3p,电子云轮廓图为哑铃形。
(2)1~36号元素中基态原子核外电子排布中未成对电子数最多的是24号Cr元素,核外有6个未成对电子,核外电子排布式是1s22s22p63s23p63d54s1,其价电子轨道表示式为;
(3)价电子排布式为3d54s2的原子,原子序数为25,其原子结构示意图为,核外有7个价电子,其最高正价为+7价。
(4)ZnCO3中阴离子是,C原子的价电子对数是,无孤电子对,空间构型为平面三角形,C原子的杂化方式为sp2
一、单选题
1.OF2是良好的氧化剂和氟化剂,可通过反应制备,下列说法正确的是
A.F2的电子式为F∶F B.OF2是直线形分子
C.NaF是共价化合物 D.NaOH含有离子键和极性共价键
2.下列分子构型为正四面体的是
①P4②NH3③CCl4④CH4⑤H2S ⑥CO2
A.①③④⑤
B.①③④⑤⑥
C.①③④
D.④⑤
3.《天工开物》记载:“凡火药以硝石、硫磺为主,草木灰为辅。……而后火药成固”,其中涉及的主要反应为S+2KNO3+3C=K2S+3CO2↑+N2↑。下列表示反应中相关微粒的化学用语正确的是
A.S2-的离子结构示意图:
B.中子数为8的碳原子:C
C.根据价层电子对互斥理论可得S的简单氢化物的VSEPR模型为V形
D.基态N原子2p能级电子轨道表示式:
4.下列化学用语表示不正确的是
A.CCl4的比例模型:
B.sp2杂化轨道模型:
C.羟基的电子式:
D.用原子轨道描述氯化氢分子中化学键的形成:
5.下列有关杂化轨道的说法错误的是
A.由同一能层上的s轨道与p轨道杂化而成
B.所形成的3个杂化轨道的能量相同
C.每个杂化轨道中s能级成分占三分之一
D.杂化轨道最多可形成2个键
6.下列说法不正确的是
A.和轨道均为哑铃形
B.从空间角度看,轨道比轨道大,其空间包含了轨道
C.用光谱仪摄取各种元素原子的吸收光谱即为原子光谱
D.整个原子的能量由核电荷数、电子数和电子状态三个因素共同决定
7.制取H2O2的反应为Na2O2+H2SO4+10H2O=Na2SO4·10H2O+H2O2,下列说法正确的是
A.Na+的结构示意图为
B.的空间结构为正四面体形
C.H2O2的电子式为
D.H2O2中O原子的杂化轨道类型为sp2
8.甲烷分子(CH4)失去一个H+,形成甲基阴离子(),在这个过程中,下列描述不合理的是
A.碳原子的杂化类型发生了改变 B.粒子的形状发生了改变
C.粒子的稳定性发生了改变 D.粒子中的键角发生了改变
9.列关于σ键和π键的说法中,不正确的是
A.σ键由原子轨道“头碰头”重叠形成
B.N2分子中的π键为p-p π键,π键不能绕键轴旋转
C.NH3分子中的σ键为s-s σ键
D.p轨道和p轨道之间既能形成π键,又能形成σ键
10.下列分子或离子的中心原子为sp3杂化,且杂化轨道容纳了1对孤电子对的是
A.CH4、NH3 B.BBr3、SO
C.SO2、BeCl2 D.SOCl2、H3O+
11.制备肼的一种方法为:2NH3+NaClO=N2H4+NaCl+H2O。下列说法正确的是
A.NH3属于弱电解质 B.NaClO的水解ClO-+ H2O=HClO+OH-
C.N2H4中氮原子发生sp3杂化 D.NaCl中阴离子结构示意图为
12.下列分子的空间构型为平面三角形的是
A.NH3 B.BCl3 C.NCl3 D.C2H2
13.乙烯在酸催化下水合制乙醇的反应机理如下,能量与反应进程的关系如图所示。下列叙述正确的是
A.第①、②、③步反应都是放热反应 B.第①步反应中的空间构型为三角锥形
C.总反应的与反应途径有关 D.由图可知,总反应不需要加热就能进行
14.某品牌食盐包装袋部分说明如表。下列相关叙述正确的是
配料 精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6] 食用方法:待食品熟后加入
A.碘酸根离子中共价键键角为120°
B.该食盐配料受热均易分解
C.K4Fe(CN)6在水溶液中完全电离成三种离子
D.K4Fe(CN)6可用于检验Fe3+
15.下列说法正确的是
A.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
B.著名的硫-氮化合物分子(如图所示)中只含有极性共价键
C.CO2、HClO、HCHO分子中都既有σ键又有π键
D.C-H键比Si-H键键长短,故CH4比SiH4更稳定
16.下列推测不合理的是
A.与水反应生成两种强酸
B.与足量作用可得到
C.氨基磺酸与足量浓NaOH溶液加热不会产生气体
D.实验测得固态中有正四面体的阳离子和正八面体的阴离子,固态化学式可表述为
17.SO2、氮氧化物(NOx)等均是空气污染物。研究表明,NOx(x=1或2)、SO2与雾霾的形成有关,过程如图所示:
SO2、氮氧化物需处理后才能排放,可用NaOH溶液、氨水吸收处理,主要反应为:
NO+NO2+2OH-= 2NO+H2O
2NO2+2OH-= NO+NO+H2O
SO2+2NH3·H2O = 2NH+SO+H2O等
下列有关含氮、含硫微粒的说法正确的是
A.SO2转化为SO3时,分子的键角变小
B.NO和NO中N原子轨道的杂化类型均为sp3杂化
C.NH和SO的空间构型都是正四面体形
D.SO2、SO3和NO2均为酸性氧化物
18.工业合成尿素的原理:,下列说法正确的是
A.中键比键数目多
B.的分子构型为正四面体形
C.中的所有原子处在同一平面
D.基态氧原子的核外电子轨道表示式:
19.下列有机物分子中的碳原子既有sp3杂化又有sp杂化的是
A.CH3CH=CH2 B.CH3-C≡CH C.CH3CH2OH D.CH≡CH
20.下列化学用语或图示表达正确的是
A.N2的结构式:NN
B.甲基的电子式:
C.CO2的空间填充模型:
D.基态N原子的轨道表示式:
21.已知:,阿伏伽德罗常数的值为NA。若反应物中H2SO4消耗了3mol,则下列说法错误的是
A.转移电子的数目为6NA B.标准状况下,生成H2O27g
C.生成还原产物的分子数为1NA D.产物AsH3为平面三角形
22.甲烷中的碳原子是sp3杂化,下列用*表示碳原子的杂化和甲烷中的碳原子杂化状态一致的是
A.CH≡C*CH3 B.C*H2=CHCH3 C.CH2=C*HCH3 D.CH2=CHC*H3
23.下列化学用语表达正确的是
A.的结构式:H-Cl-O B.中子数为20的氯原子:Cl
C.的VSEPR模型: D.羟基的电子式:
24.中国科学院天津工业生物技术研究所科研团队在实验室里首次实现了以CO2为原料人工合成淀粉,其合成路线如图所示。设NA为阿伏加德罗常数的值,下列说法正确的是
A.1mol DHA中含有σ键数目为7NA
B.1mol DHA中,sp3杂化的原子数为2NA
C.过程②中,1mol CH3OH断裂极性键的数目为2NA
D.CH3OH分子中,碳原子与氧原子之间的共价键为sp3-p σ键
25.奥司他韦对亚型流感病毒引起的流行性感冒有治疗和预防作用,其分子结构如图所示,下列说法正确的是
A.奥司他韦的分子式为C16H26N2O4
B.奥司他韦分子中碳原子均采取sp2杂化
C.奥司他韦分子中含有2个手性碳原子
D.奥司他韦既能与盐酸反应又能与氢氧化钠溶液反应
二、填空题
26.试指出下列分子的空间结构。
(1);
(2);
(3);
(4);
(5);
(6)。
27.a、b、c、d四种短周期元素,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族。请完成下列空白:
(1)a和b形成的共价化合物,分子的空间结构呈三角锥形,该分子的中心原子的杂化轨道类型为;a和c形成的共价化合物,分子中既含有极性共价键,又含有非极性共价键的化合物是(填化学式)。
(2)这些元素可以形成哪些含氧酸?分析每种含氧酸酸根离子的空间结构和中心原子的杂化轨道类型。
28.NH4H2PO4中,P的杂化轨道与O的2p轨道形成键。
29.AB3与AC3,若电负性:B>A>C,则键角:AB3AC3,原因为。
30.根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)某元素原子基态核外电子有14种不同的运动状态,该元素位于第周期第族,属于区,占据最高能级的电子云轮廓图为形。
(2)1~36号元素中基态原子核外电子排布中未成对电子数最多的元素的核外电子排布式是,其价电子轨道表示式为。
(3)价电子排布式为3d54s2的原子,其原子结构示意图为,其最高正价为价。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为,C原子的杂化方式为。
试卷第2页,共7页
参考答案:
1.D
【详解】A.的电子式为 ,A错误;
B.中的O原子为sp3杂化,且存在2对孤对电子,为V形结构,B错误;
C.NaF是钠离子和氟离子形成的离子化合物,C错误;
D.NaOH是钠离子和氢氧根离子构成的离子化合物,氢氧根中存在氢氧极性共价键,故含有离子键和极性共价键,D正确;
故选D。
2.C
【详解】①P4分子构型为正四面体;
②NH3分子中的氮原子sp3杂化,有一个杂化轨道容纳弧对电子对,所以构型为三角锥;
③CCl4分子中碳原子sp3杂化,没有弧对电子对,所以构型为正四面体;
④CH4分子中碳原子sp3杂化,没有弧对电子对,所以构型为正四面体;
⑤H2S分子中硫原子sp3杂化,有两对弧对电子对,所以构型为V型;
⑥CO2分子中碳原子sp杂化,所以构型为直线型,
所以①③④正确,答案选C。
3.D
【详解】A.S是16号元素,故S2-的结构示意图为:,A错误;
B.C为6号元素,故中子数为8的碳原子为:C,B错误;
C.S的简单氢化物为H2S,价层电子对数为=4,所以VSEPR模型正四面体形,C错误;
D.基态N原子的核外电子排布式为:1s22s22p3,根据洪特规则(电子进入能量相同的能级不同轨道时,总是优先单独占据不同的轨道且自旋方向相同)可知,2p能级电子轨道表示式为:,D正确;
综上所述答案为D。
4.A
【详解】A.Cl原子半径应比C原子半径大,A选项错误;
B.sp2杂化轨道模型为平面三角形,B选项正确
C.羟基为不带电原子团,C选项正确;
D.H的s轨道上有一个未成对电子,Cl的3p轨道上有5个电子,其中有一个轨道有一个未成对电子,按照共价键理论,两个自旋方向相反的电子成键时,原子轨道有效重叠,H的s轨道和与Cl的p轨道延键轴方向头碰头形成了一个共价键,即σ键,D选项正确;
答案选A。
5.D
【详解】A.同一能层上的s轨道与p轨道的能量差异不大,杂化轨道是由同一能层上的s轨道与p轨道杂化而成的,A项正确;
B.同种类型的杂化轨道能量相同,B项正确;
C.杂化轨道是由1个s轨道与2个p轨道杂化而成的,C项正确;
D.杂化轨道最多可形成3个键,D项错误。
故选:D。
6.C
【详解】A.p轨道为哑铃形,A正确;
B.从空间角度看,轨道空间包含了轨道,比轨道大,B正确;
C.用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱C错误;
D.整个原子的能量由核电荷数、电子数和电子状态三个因素共同决定,D正确;
答案选C。
7.B
【详解】A.钠离子结构示意图为:,A错误;
B.硫原子的价电子对数为4+(6+2-24)/2=4,硫原子采取sp3杂化,硫酸根离子的空间结构为正四面体形,B正确;
C.过氧化氢的电子式为:,C错误;
D.氧原子的价电子对数为2+(6-21)/2=4,氧原子采取sp3杂化,D错误;
答案选B。
8.A
【详解】CH4中C的价层电子对数=4,C为sp3杂化,无孤电子对,为正四面体结构,而中C的价层电子对数=3+=3+1=4,C为sp3杂化,有一对孤电子,空间结构为三角锥形,形状、键角、稳定性均发生改变,但杂化类型不变,仍是sp3杂化,故答案选A。
9.C
【详解】A.σ键由原子轨道“头碰头”重叠形成,其共价键的电子云图形是轴对称的,A项正确;
B.基态N原子的价电子排布式为2s22p3,N2的结构式为,其分子中的π键为p-p π键,π键的电子云图形是镜面对称的,不能绕键轴旋转,B项正确;
C.NH3分子中N原子采取sp3杂化,故NH3分子中的σ键为sp3-sσ键,C项错误;
D.p轨道和p轨道之间既能形成π键,又能形成σ键,如N2分子中既存在p-pσ键、又存在p-pπ键,D项正确;
答案选C。
10.D
【详解】A.CH4中心原子价层电子对数为,是sp3杂化,没有孤对电子对,NH3中心原子价层电子对数为,是sp3杂化,杂化轨道容纳了1对孤电子对,故A不符合题意;
B.BBr3中心原子价层电子对数为,是sp2杂化,没有孤对电子对,SO中心原子价层电子对数为,是sp3杂化,杂化轨道容纳了1对孤电子对,故B不符合题意;
C.SO2中心原子价层电子对数为,是sp2杂化,杂化轨道容纳了1对孤电子对,BeCl2中心原子价层电子对数为,是sp杂化,没有孤对电子对,故C不符合题意;
D.SOCl2中心原子价层电子对数为,是sp3杂化,杂化轨道容纳了1对孤电子对,H3O+中心原子价层电子对数为,是sp3杂化,杂化轨道容纳了1对孤电子对,故D符合题意。
综上所述,答案为D。
11.C
【详解】A.氨气溶于水形成一水合氨为弱碱,而氨气本身在水溶液中和熔融状态下均不导电,属于非电解质,A错误;
B.NaClO中ClO-为弱酸根离子,其水解过程为可逆反应,B错误;
C.N2H4的结构式为,其中氮原子发生sp3杂化,C正确;
D.NaCl由钠离子和氯离子构成,其阴离子Cl-的结构简式为:,D错误;
故选C。
12.B
【详解】A.NH3分子中N原子为sp3杂化,含一对孤电子对,空间构型为三角锥形,A不符合题意;
B.BCl3中B原子价层电子对数为=3,不含孤电子对,空间构型为平面三角形,B符合题意;
C.NCl3中N原子价层电子对数为=4,含一对孤电子对,空间构型为三角锥形,C不符合题意;
D.C2H2中两个C原子均为sp杂化,不含孤电子对,空间构型为直线形,D不符合题意;
综上所述答案为B。
13.B
【详解】A.由图可知,第②③步反应,反应物的总能量均大于生成物的总能量,则第②③步反应均为放热反应,但第①步反应,生成物的总能量大于反应物的总能量,属于吸热反应,故A错误;
B.中O原子的价层电子对数为3+=4,VSEPR模型为四面体,含有一个孤电子对,因此空间构型为三角锥形,故B正确;
C.由盖斯定律可知,一个反应的焓变仅与反应的起始状态和反应的最终状态有关,而与反应途径无关,故C错误;
D.由图可知,总反应放出能量,属于放热反应,但第①步反应的活化能较大,需要加热反应才能进行,故D错误;
答案选B。
14.D
【详解】A.碘酸根离子中,碘的价层电子对为4、有1对孤电子对,其VSEPR模型为四面体、空间构型为三角锥形,键角不是120°,A错误;
B.配料中氯化钠受热不分解,B错误;
C.K4Fe(CN)6在溶液中只能电离生成钾离子和亚铁氰根离子,C错误;
D.K4Fe(CN)6可用于检验Fe3+,检验时发生的反应为:K4Fe(CN)6+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,D正确;
故选D。
15.D
【详解】A.AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键,比如BF3,B原子的价层电子对数=,B采用sp2杂化,A错误;
B.如图所示还含有同种元素硫之间的非极性共价键,B错误;
C.HClO分子中只有单键,分子中只有σ键而没有π键,C错误;
D.C-H键比Si-H键键长短,故CH4比SiH4更稳定,D正确;
故选D。
16.C
【详解】A.和Cl2与水反应生成硫酸和盐酸两种强酸,反应的化学方程式为+2H2O=H2SO4+2HCl,选项A正确;
B. 与足量作用可得到,发生反应为+3=+3HCl,选项B正确;
C.氨基磺酸与足量浓NaOH溶液加热会产生NH3,反应为H2N-SO3H+2NaOH Na2SO4+NH3↑+H2O,选项C错误;
D.实验测得固态中有正四面体的阳离子和正八面体的阴离子,固态化学式可表述为,选项D正确;
答案选C。
17.C
【详解】A.SO2中S价层电子对数=2+=3,为sp2杂化,孤电子对数为1,SO3中S价层电子对数=3+=3,无孤电子对,为sp2杂化,孤电子斥力大于成键电子对,故SO2的键角小于SO3,SO2转化为SO3时,分子的键角变大,A错误;
B.NO中N的价层电子对数=2+=3,为sp2杂化,NO中N的价层电子对数=3+=3,为sp2杂化,即NO和NO中N原子轨道的杂化类型均为sp2杂化,B错误;
C.NH中N的价层电子对数=4+=4,为sp3杂化,无孤电子对,空间构型是正四面体形,SO中S价层电子对数=4+=4,为sp3杂化,无孤电子对,空间构型是正四面体形,C正确;
D.SO2、SO3分别与碱反应生成亚硫酸盐、硫酸盐和水,二者均是酸性氧化物,NO2与碱发生氧化还原反应,不属于酸性氧化物,D错误;
答案选C。
18.D
【详解】A. 中含2个键、2个键,数目相同,故A错误;
B. 氨分子中N原子价层电子对数为3+=4,有一个孤电子对,的分子构型为三角锥形,故B错误;
C. 中的N原子价层电子对数为3+=4,N以及与N相连的三个原子呈三角锥形,所有原子不可能处在同一平面,故C错误;
D. O核外有8个电子,基态氧原子的核外电子轨道表示式:,故D正确;
故选D。
19.B
【详解】A.CH3CH=CH2中双键碳为sp2、单键碳为sp3,故不选A;
B.CH3-C≡CH中三键碳为sp、单键碳为sp3,故选B;
C.CH3CH2OH中碳原子均为sp3杂化,故不选C;
D.CH≡CH中碳原子只有sp杂化,故不选D;
选B。
20.A
【详解】A.结构式是指用一根短线表示一对共用电子对的式子,则N2的结构式为N≡N,A正确;
B.甲基(CH3-)的电子式为,B错误;
C.CO2是直线形分子,故CO2的空间填充模型为,C错误;
D.基态N原子的轨道表示式为,D错误;
故答案为A。
21.D
【分析】As的化合价由+3降低到-3,Zn化合价由0升高到+2,则,以此分析;
【详解】A.若反应物中H2SO4消耗了3mol,转移电子的数目为6NA,A正确;
B.若反应物中H2SO4消耗了3mol,生成1.5molH2O,,B正确;
C.2AsH3为还原产物,若反应物中H2SO4消耗了3mol,生成1molAsH3,C正确;
D.As与N为同族元素,故AsH3为三角锥形,D错误;
故答案为:D。
22.D
【详解】A.CH≡C*CH3中,带“ ”碳原子的价层电子对数为2,发生sp杂化,A不符合题意;
B.C*H2=CHCH3中,带“ ”碳原子的价层电子对数为3,发生sp2杂化,B不符合题意;
C.CH2=C*HCH3中,带“ ”碳原子的价层电子对数为3,发生sp2杂化,C不符合题意;
D.CH2=CHC*H3中,带“ ”碳原子的价层电子对数为4,发生sp3杂化,D符合题意;
故选D。
23.C
【详解】A.HClO的结构式为H-O-Cl,A错误;
B.中子数为20的氯原子可表示为,B错误;
C.NH3中N的价层电子对数为3+=4,含有一对孤电子对,其VSEPR模型正确,C正确;
D.羟基的电子式为 ,D错误;
故答案选C。
24.C
【详解】A.1个单键即1个σ键,1个双键含有1个σ键和1个π键,根据DHA的结构式,含有σ键数目为11NA,A错误;
B.DHA中sp3杂化的原子为2个亚甲基中的C,2个羟基中的O,共四个原子,即4NA,B错误;
C.根据图示转化,过程②中1mol甲醇氧化为甲醛,断裂1mol C-H键和1mol O-H键,共2mol极性共价键,即2NA,故C正确
D.CH3OH分子中,以碳为中心的结构为四面体结构,碳原子,氧原子均采取sp3杂化,其之间的共价键为sp3-sp3 σ键,D错误;
故答案选C。
25.D
【详解】A.根据奥司他韦的结构简式,该有机物分子式为C16H28N2O4,A错误;
B.由结构简式可知,奥司他韦分子中饱和碳原子的杂化方式为sp3杂化,B错误;
C.奥司他韦分子中六元环不对称,环上含有3个手性碳原子,C错误;
D.奥司他韦含有氨基所以能与盐酸反应又含有酯基所以能与氢氧化钠溶液反应,D正确;
故选D。
26.(1)平面三角形
(2)三角锥形
(3)直线形分子
(4)V形分子
(5)正四面体形结构
(6)直线形分子
【详解】(1)分子中中心原子价层电子对数为3+=3,B原子采用sp2杂化,所以分子是平面三角形;
(2)分子中中心原子价层电子对数为3+=4,P原子采用sp3杂化,P原子上含有1对孤电子对,所以分子是三角锥形;
(3)分子中中心原子价层电子对数为2+=2,O原子采用sp杂化,所以是直线形分子;
(4)H2O分子中中心原子价层电子对数为2+=4,O原子采用sp3杂化,O原子上含有2对孤电子对,所以H2O分子是V形分子;
(5)分子中中心原子价层电子对数为4+=4,Si原子采用sp3杂化,所以是正四面体形结构;
(6)乙炔分子中含有碳碳叁键,结构式为 ,分子中碳原子形成2个σ键2个π键,为sp杂化;分子为直线形分子。
27.(1) sp3 H2O2
(2) HNO2、HNO3、H2SO3、H2SO4 V形、平面三角形、三角锥形、正四面体形,sp2、sp2、sp3、sp3
【分析】由题干信息可知,a、b、c、d四种短周期元素,原子序数依次增大,a的核外电子总数与其周期数相同,故a为H, c的最外层电子数为其内层电子数的3倍,故c为O,b的价电子层中的未成对电子有3个则b为N,d与c同族,故d为S,据此分析解题。
(1)
由分析可知,a为H,b为N,故a和b形成的共价化合物,分子的空间结构呈三角锥形,该分子为NH3,该分子的中心原子的价层电子对数为:3+=4,故其杂化轨道类型为sp3,极性共价键是指不同种非金属元素之间形成的共价键,非极性共价键是指同种非金属元素之间形成的共价键,已知c为O,故a和c形成的共价化合物,分子中既含有极性共价键,又含有非极性共价键的化合物是H2O2,故答案为:sp3;H2O2;
(2)
由分析可知,a、b、c、d四种短周期元素分别为H、N、O、S,故这些元素形成的含氧酸有:HNO2、HNO3、H2SO3、H2SO4,它们对应的酸根离子分别为:、、、,这些酸根离子的中心原子周围价层电子数分别为:2+=3、3+=3、3+=4、4+=4,故每种含氧酸酸根离子的空间结构分别为V形、平面三角形、三角锥形、正四面体形,它们中心原子的杂化轨道类型分别为:sp2、sp2、sp3、sp3,故答案为:HNO2、HNO3、H2SO3、H2SO4;V形、平面三角形、三角锥形、正四面体形,sp2、sp2、sp3、sp3。
28. sp3 σ
【详解】中P的价层电子对数为4+=4,NH4H2PO4中P的杂化方式与中P的杂化方式相同,则NH4H2PO4中P原子采取sp3杂化,杂化轨道用于形成σ键或容纳孤电子对,NH4H2PO4中P的sp3杂化轨道和O的2p轨道形成σ键。
29. < 电负性:B>A>C,在AB3中成键电子对离中心原子较远,斥力较小,因而键角较小
【详解】由于电负性B>A>C,在AB3中成键电子对靠近B,离中心原子较远,之间的斥力较小,因而键角较小。
30.(1) 3 ⅣA p 哑铃
(2) 1s22s22p63s23p63d54s1
(3) +7
(4) 三角形 sp2
【详解】(1)某元素原子基态核外电子有14种不同的运动状态,说明核外有14个电子,该元素位于第3周期第ⅣA族,属于p区,占据最高能级是3p,电子云轮廓图为哑铃形。
(2)1~36号元素中基态原子核外电子排布中未成对电子数最多的是24号Cr元素,核外有6个未成对电子,核外电子排布式是1s22s22p63s23p63d54s1,其价电子轨道表示式为;
(3)价电子排布式为3d54s2的原子,原子序数为25,其原子结构示意图为,核外有7个价电子,其最高正价为+7价。
(4)ZnCO3中阴离子是,C原子的价电子对数是,无孤电子对,空间构型为平面三角形,C原子的杂化方式为sp2
