广东省江门市第一中学2023-2024学年高二上学期10月第一次段考化学试题(含答案)
文档属性
| 名称 | 广东省江门市第一中学2023-2024学年高二上学期10月第一次段考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 383.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-23 18:00:46 | ||
图片预览



文档简介
江门市第一中学2023-2024学年高二上学期10月第一次段考
化学
本试卷共8页,20小题,满分100分,考试时间75分钟。
相对原子质量:H:1 C:12 N:14
注意事项:
1.答题前,考生务必用黑色笔迹的钢笔或签字笔将自己的姓名、考号填写在答题卷上。
2.每小题选出答案后,用2B铅笔把答题卷上对应题目选项的答案信息点涂黑;非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卷各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效。
3.作答选做题时,请先用2B铅笔填涂选做题的题组号对应的信息点,再作答。漏涂、错涂、多涂的,答案无效。
第一部分选择题(共44分)
一、单项选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。每小题只有一个选项符合题意。
1.中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示。下列说法不正确的是
A.整个过程实现了光能向化学能的转换
B.过程II有O-O单键生成并放出能量
C.过程III发生的化学反应为:
D.整个过程的总反应方程式为:
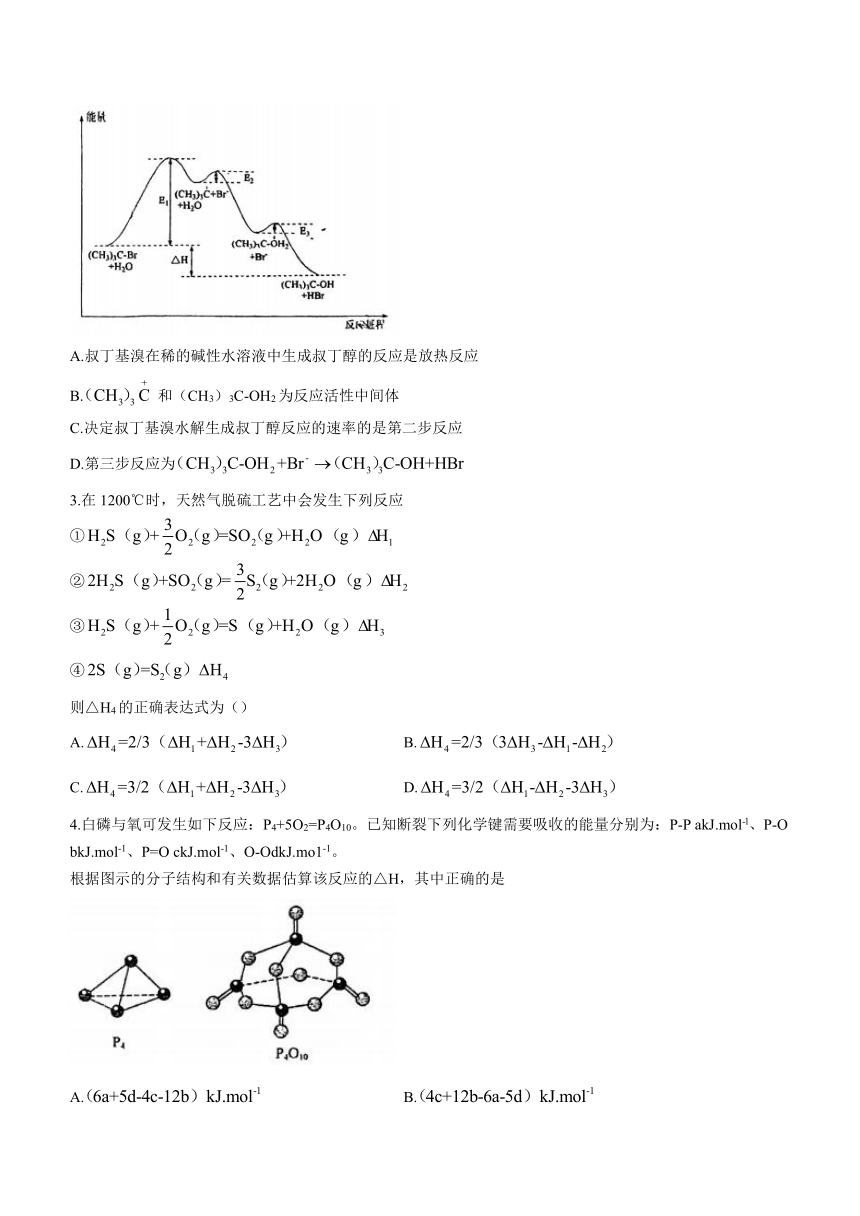
2.叔丁基溴在稀的碱性水溶液中水解生成叔丁醇的反应分三步进行,反应中每一步的能量变化曲线如图所示,下列有关说法不正确的是
A.叔丁基溴在稀的碱性水溶液中生成叔丁醇的反应是放热反应
B. 和(CH3)3C-OH2为反应活性中间体
C.决定叔丁基溴水解生成叔丁醇反应的速率的是第二步反应
D.第三步反应为
3.在1200℃时,天然气脱硫工艺中会发生下列反应
①
②
③
④
则△H4的正确表达式为()
A. B.
C. D.
4.白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P akJ.mol-l、P-O bkJ.mol-1、P=O ckJ.mol-1、O-OdkJ.mo1-1。
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
A. B.
C. D.
5.下列说法正确的是
A.可以利用质谱仪测得某未知物的结构
B.Cl、Br、Se(硒)的电负性依次减小
C.可燃冰(CH4·8H2O)中甲烷分子和水分子间形成了氢键
D.臭氧分子是非极性分子
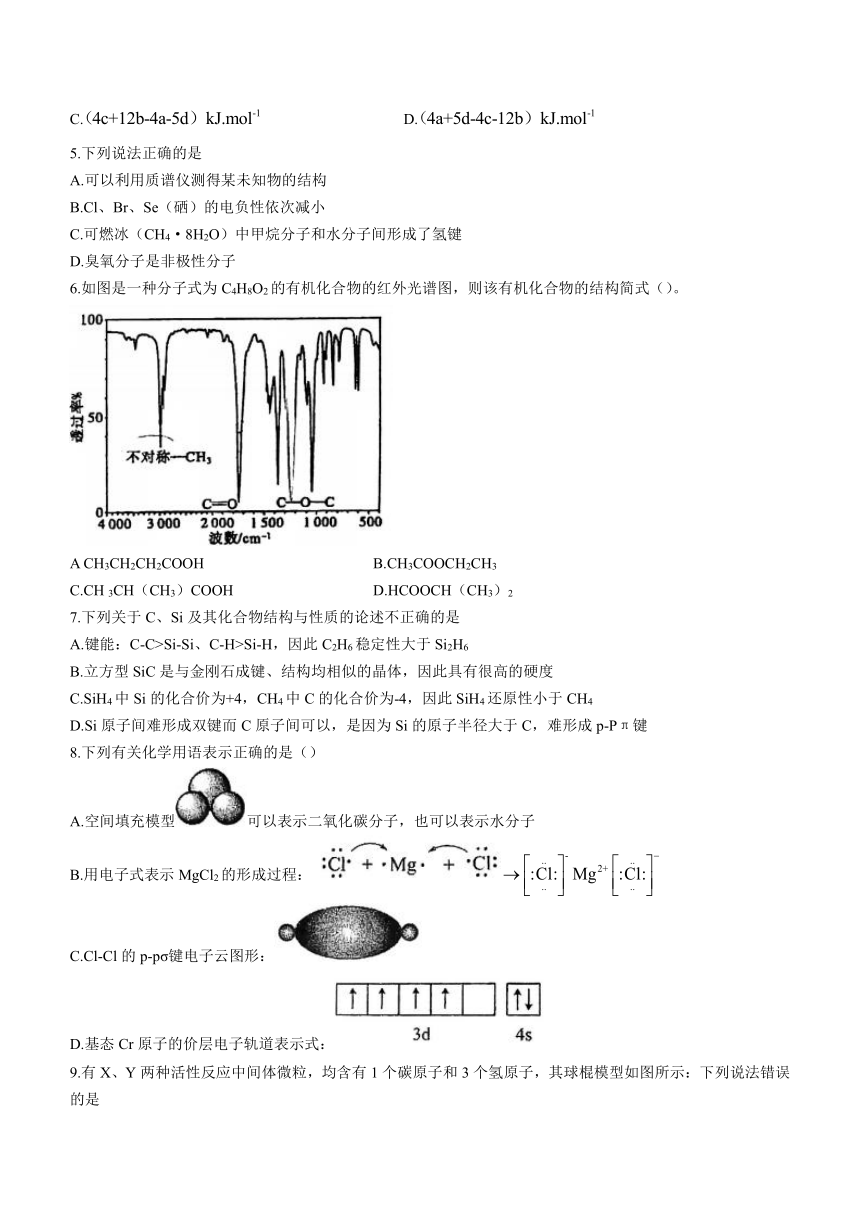
6.如图是一种分子式为C4H8O2的有机化合物的红外光谱图,则该有机化合物的结构简式()。
A CH3CH2CH2COOH B.CH3COOCH2CH3
C.CH 3CH(CH3)COOH D.HCOOCH(CH3)2
7.下列关于C、Si及其化合物结构与性质的论述不正确的是
A.键能:C-C>Si-Si、C-H>Si-H,因此C2H6稳定性大于Si2H6
B.立方型SiC是与金刚石成键、结构均相似的晶体,因此具有很高的硬度
C.SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4还原性小于CH4
D.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成p-Pπ键
8.下列有关化学用语表示正确的是()
A.空间填充模型可以表示二氧化碳分子,也可以表示水分子
B.用电子式表示MgCl2的形成过程:
C.Cl-Cl的p-pσ键电子云图形:
D.基态Cr原子的价层电子轨道表示式:
9.有X、Y两种活性反应中间体微粒,均含有1个碳原子和3个氢原子,其球棍模型如图所示:下列说法错误的是
A.X的组成为CH3+ B.Y的组成为CH3-
C.X的价层电子对数为3 D.Y中键角大于120°
10.动力电池赛道又跳出来一个竞争者“锑电池”。锑(51Sb)与砷(33As)属于同主族元素,下列关于锑元素说法正确的是
A.可能是半导体材料 B.属于第四周期元素
C.最高正化合价为+3 D.得电子能力比As的强
11.关于下表所列四种粒子的各项描述完全正确的选项是()
选项 A B C D
分子或离子的化学式 ClO3 NO2- H2F+ BH4-
中心原子的杂化轨道类型 sp3 sp2 sp sp3
VSEPR模型名称 四面体形 平面三角形 直线形 正四面体形
分子或离子的空间结构名称 三角锥形 平面三角形 V形 三角维形
12.己知某些元素在周期表中的位置如图所示,下列说法错误的是
A.元素②和⑤位于同一区
B.元素③的基态原子中,未成对电子数为5
C.与元素④具有相同最外层电子数的元素只可能处于s区
D.s区(除元素①外)、d区和ds区的元素都是金属元素
13.现有三种元素的基态原子的电子排布式如下
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p63s23p5,下列排序正确的是
A.第一电离能:③>①>② B.原子半径:③>②>①
C.含氧酸的酸性:③>①>② D.电负性:③>②>①
14.化合物XYZ4ME4可作肥料,所含的5种元素位于主族在每个短周期均有分布,仅有Y和M同挨。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为nsn-1,X与M同周期,E在地壳中含量最多。下列说法正确的是
A.元素电负性:E>Y>Z B.氢化物沸点:M>Y>E
C.第一电离能:X>E>Y D.YZ3和YE3-的空间结构均为三角锥形
15.LiAlH4是重要的还原剂与储氢材料,。在120°C下的干燥空气中相对稳定,其合成方法为:下列说法正确的是
A.该反应可以在水溶液中进行
B.基态锂原子的电子排布式为1s22s1,核外电子的空间运动状态有2种
C.LiAlH4中A1原子采用sp3杂化,AlH4-离子的空间构型为正方形
D.上述所有物质中电负性最大的元素与电负性最小的元素形成的化合物,其电子式为Na+[:H]-
16.通过以下反应均可获取H2。下列有关说法正确的是()
①太阳光催化分解水制氢:
②焦炭与水反应制氢:
③甲烷与水反应制氢:
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,△H3减小
D.反应的△H=+74.8kJ.mol-1
第二部分非选择题(56分)
17.(12分)根据物质结构和性质的知识,回答下列问题:
(1)下列物质中既有极性键,又有非极性键的极性分子是_______________。(填选项ABCD)
A.SO2 B.SO C.H2O2 D.C2H4
(2)某同学画出基态碳原子的核外电子排布图:,该电子排布图违背了_______________。
(3)BCl3在四氯化碳中的溶解度远大于HC1,原因是_______________。
④NH4H2PO4中,电负性最高的元素是_______________;P的_______________杂化轨道与O的2p轨道形成______________(填“σ”或“π”)键。
(5)有机物中,有_______________个手性碳,1mol该有机物含σ键的物质的量为_______________mol。
(6)可以用pKa(pKa=-1gKa)来衡量酸性的强弱,下表是部分酸的pKa数据:
ClCH2COOH Cl2CHCOOH CCl3COOH H2SO3
pKa(室温) 2.86 1.29 0.65 pKa1=1.9、pKa2=7.5
从表中数据可知,酸性:ClCH2COOH18.(18分)2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2=CH2)与四氟乙(CF2=CF2)的共聚物(ETFE)制成。回答下列问题:
(I)基态F原子的价电子排布图(轨道表示式)为_______________。
(2)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是______________(填标号);第三电离能的变化图是_______________(填标号)。
图a图b图c
(3)固态氟化氢中存在(HF)n形式,每个HF键相连。画出(HF)3的链状结构_______________。
(4)N2F2(二氟氮烯)分子中,氮原子的杂化类型为sp2,则N2F2的结构式为_______________。
(5)NaHF2熔点为160°C(分解生成HF),电解可制得氟气,推测NaHF2中所含作用力的类型有_______________。
(6)BiOC1是一种性能优良的光催化剂,可催化降解有机污染物对硝基苯酚()等。对硝基苯酚的熔点高于邻硝基苯酚()的熔点,其原因是_______________。
(7)V元素在元素周期表_______________区;基态钛原子的核外价层电子排布式是_______________。
(8)在周期表中,与A1化学性质最相似的邻族元素是______________。基态A1原子核外电子云轮廓图呈哑铃形的能级上电子数为_______________。在下列状态的铝元素中,电离最外层一个电子所需能量出高到低的顺序是_______________。(填标号)
A. B. C. D.
(9)CF2=CF2和ETFE分子中C的杂化轨道类型分别为______________和_______________;聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因_______________。
19.(10分)回答下列问题:
(1)Ag的核外电子排布式是[Kr]4d105s1,则Ag在元素周期表中的位置是_______________。下列属于基态Ag+的电子排布式的是_______________。(填标号)
A. [Kr]4d95s2 B. [Kr]4d10 C. [Kr]4d95s1
(2)硒所在的主族中,简单气态氢化物沸点最低的是_____________(填化学式);硒的某种氧化物为链状聚合结构(如下图所示),该氧化物的化学式为______________。
(3)固体三氧化硫中存在如下图所示的三聚分子,该分子中S原子的杂化轨道类型为______________,该结构中S-O键长有两类,一类键长约140pm,另一类键长约160pm,较短的键为_____________(填图I中字母)。
(4)FeSO4·H2O结构如图所示。
Fe2+价层电子排布式为______________。
比较SO42-和H2O分子中的键角大小并给出相应解释:______________。
20.(14分)
I.作为国之重器,火箭的发射牵动了亿万人民的心。就像汽车、飞机需要添加汽油、航空煤油一样,火箭专用燃料被称为“推进剂”。在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式______________。
(2)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是______________。
Ⅱ.化学反应常伴随热效应。某些反应(如:中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cpV总·△T计算获得。
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(3)仪器a的名称为______________,实验中除图1-3所示的仪器外还需要用到的玻璃仪器是______________。
(4)取50 mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
温度 实验次数 起始温度t1/℃ 终止温度/℃ 温度差平均值(t2-t1)/℃
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 30.1 _
2 27.0 27.4 27.2 33.3
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,反应后生成的溶液的比热容c=4.18J/(g.°C)。则中和热△H=______________(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是______________(填字母)。
a.实验装置保温、隔热效果差
b.配制0.50mol/LNaOH溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
e.用量筒量取NaOH溶液的体积时仰视读数
(5)实验中改用30mL0.50mol/L的硫酸跟50mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量______________(填“相等”或“不相等”),所求中和热的数值会______________(填“相等”或 “不相等”)。
江门市第一中学2023-2024学年高二上学期10月第一次段考
化学答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
C C A A B B C C D A A C A A B D
17.(12分)
(1)C(1分)
(2)洪特规则(1分)
(3)BC13和四氯化碳均为非极性分子,而HCl属于极性分子,相似相溶(2分)
(4)O(1分) sp3(1分)σ(1分)
(5)2(1分)27((2分)
(6)C原子电负性大,使羟基的极性增强,羟基H原子更容易电离,物质分子中烃基中C原子数目越多,羟基H就越容易电离,其相应的氯代乙酸的酸性就越强,故三氯乙酸最容易电离出氢离子,其酸性最强(2分)
18.(20分,除(3)、(4)、(6)2分外,其余每个答案1分,)
(1)(1分)
(2)图a(1分)图b(1分)
(3)(2分)
(4)F-N=N-F(2分)(5)离子键、(1分)共价键(1分)、氢键(1分)
(6)对硝基苯酚存在分子间氢键,而邻硝基苯酚更易形成分子内氢键,导致对硝基苯酚分子间的作用力比邻硝基苯酚分子之间的作用力更强(2分)
(7)d;(1分)3d24s2(1分)
(8)Be(或铍)(1分) 7(1分) D>C>A>B(1分)
(9)sp2(1分) sp3(1分)
C-F键的键能大于聚乙烯中C-H的键能,键能越大,化学性质越稳定(1分)
19.(共10分)
(1)第五周期B族;(1分) B(1分)
(2)H2S(1分) (SeO2)n(1分)
(3)sp3 a(各1分)
(4)3d6(1分) SO42-的键角大于H2O,(1分)SO42-中S原子的价层电子对数为4、孤对电子对数为0,离子的空间构型为正四面体形,H2O分子中O原子的价层电子对数为4、孤对电子对数为2,分子的空间构型为V形(2分)
20.(14分)(除标注外,每空2分)I.(1)
(2)反应生成的物质是N2和H2O,对环境无污染
(3)玻璃搅拌器(1分) 量筒(1分)
(4)①4.0 ②-53.5kJ/mol ③acd
(5)不相等(1分) 相等(1分)
化学
本试卷共8页,20小题,满分100分,考试时间75分钟。
相对原子质量:H:1 C:12 N:14
注意事项:
1.答题前,考生务必用黑色笔迹的钢笔或签字笔将自己的姓名、考号填写在答题卷上。
2.每小题选出答案后,用2B铅笔把答题卷上对应题目选项的答案信息点涂黑;非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卷各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效。
3.作答选做题时,请先用2B铅笔填涂选做题的题组号对应的信息点,再作答。漏涂、错涂、多涂的,答案无效。
第一部分选择题(共44分)
一、单项选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。每小题只有一个选项符合题意。
1.中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示。下列说法不正确的是
A.整个过程实现了光能向化学能的转换
B.过程II有O-O单键生成并放出能量
C.过程III发生的化学反应为:
D.整个过程的总反应方程式为:
2.叔丁基溴在稀的碱性水溶液中水解生成叔丁醇的反应分三步进行,反应中每一步的能量变化曲线如图所示,下列有关说法不正确的是
A.叔丁基溴在稀的碱性水溶液中生成叔丁醇的反应是放热反应
B. 和(CH3)3C-OH2为反应活性中间体
C.决定叔丁基溴水解生成叔丁醇反应的速率的是第二步反应
D.第三步反应为
3.在1200℃时,天然气脱硫工艺中会发生下列反应
①
②
③
④
则△H4的正确表达式为()
A. B.
C. D.
4.白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P akJ.mol-l、P-O bkJ.mol-1、P=O ckJ.mol-1、O-OdkJ.mo1-1。
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
A. B.
C. D.
5.下列说法正确的是
A.可以利用质谱仪测得某未知物的结构
B.Cl、Br、Se(硒)的电负性依次减小
C.可燃冰(CH4·8H2O)中甲烷分子和水分子间形成了氢键
D.臭氧分子是非极性分子
6.如图是一种分子式为C4H8O2的有机化合物的红外光谱图,则该有机化合物的结构简式()。
A CH3CH2CH2COOH B.CH3COOCH2CH3
C.CH 3CH(CH3)COOH D.HCOOCH(CH3)2
7.下列关于C、Si及其化合物结构与性质的论述不正确的是
A.键能:C-C>Si-Si、C-H>Si-H,因此C2H6稳定性大于Si2H6
B.立方型SiC是与金刚石成键、结构均相似的晶体,因此具有很高的硬度
C.SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4还原性小于CH4
D.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成p-Pπ键
8.下列有关化学用语表示正确的是()
A.空间填充模型可以表示二氧化碳分子,也可以表示水分子
B.用电子式表示MgCl2的形成过程:
C.Cl-Cl的p-pσ键电子云图形:
D.基态Cr原子的价层电子轨道表示式:
9.有X、Y两种活性反应中间体微粒,均含有1个碳原子和3个氢原子,其球棍模型如图所示:下列说法错误的是
A.X的组成为CH3+ B.Y的组成为CH3-
C.X的价层电子对数为3 D.Y中键角大于120°
10.动力电池赛道又跳出来一个竞争者“锑电池”。锑(51Sb)与砷(33As)属于同主族元素,下列关于锑元素说法正确的是
A.可能是半导体材料 B.属于第四周期元素
C.最高正化合价为+3 D.得电子能力比As的强
11.关于下表所列四种粒子的各项描述完全正确的选项是()
选项 A B C D
分子或离子的化学式 ClO3 NO2- H2F+ BH4-
中心原子的杂化轨道类型 sp3 sp2 sp sp3
VSEPR模型名称 四面体形 平面三角形 直线形 正四面体形
分子或离子的空间结构名称 三角锥形 平面三角形 V形 三角维形
12.己知某些元素在周期表中的位置如图所示,下列说法错误的是
A.元素②和⑤位于同一区
B.元素③的基态原子中,未成对电子数为5
C.与元素④具有相同最外层电子数的元素只可能处于s区
D.s区(除元素①外)、d区和ds区的元素都是金属元素
13.现有三种元素的基态原子的电子排布式如下
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p63s23p5,下列排序正确的是
A.第一电离能:③>①>② B.原子半径:③>②>①
C.含氧酸的酸性:③>①>② D.电负性:③>②>①
14.化合物XYZ4ME4可作肥料,所含的5种元素位于主族在每个短周期均有分布,仅有Y和M同挨。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为nsn-1,X与M同周期,E在地壳中含量最多。下列说法正确的是
A.元素电负性:E>Y>Z B.氢化物沸点:M>Y>E
C.第一电离能:X>E>Y D.YZ3和YE3-的空间结构均为三角锥形
15.LiAlH4是重要的还原剂与储氢材料,。在120°C下的干燥空气中相对稳定,其合成方法为:下列说法正确的是
A.该反应可以在水溶液中进行
B.基态锂原子的电子排布式为1s22s1,核外电子的空间运动状态有2种
C.LiAlH4中A1原子采用sp3杂化,AlH4-离子的空间构型为正方形
D.上述所有物质中电负性最大的元素与电负性最小的元素形成的化合物,其电子式为Na+[:H]-
16.通过以下反应均可获取H2。下列有关说法正确的是()
①太阳光催化分解水制氢:
②焦炭与水反应制氢:
③甲烷与水反应制氢:
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,△H3减小
D.反应的△H=+74.8kJ.mol-1
第二部分非选择题(56分)
17.(12分)根据物质结构和性质的知识,回答下列问题:
(1)下列物质中既有极性键,又有非极性键的极性分子是_______________。(填选项ABCD)
A.SO2 B.SO C.H2O2 D.C2H4
(2)某同学画出基态碳原子的核外电子排布图:,该电子排布图违背了_______________。
(3)BCl3在四氯化碳中的溶解度远大于HC1,原因是_______________。
④NH4H2PO4中,电负性最高的元素是_______________;P的_______________杂化轨道与O的2p轨道形成______________(填“σ”或“π”)键。
(5)有机物中,有_______________个手性碳,1mol该有机物含σ键的物质的量为_______________mol。
(6)可以用pKa(pKa=-1gKa)来衡量酸性的强弱,下表是部分酸的pKa数据:
ClCH2COOH Cl2CHCOOH CCl3COOH H2SO3
pKa(室温) 2.86 1.29 0.65 pKa1=1.9、pKa2=7.5
从表中数据可知,酸性:ClCH2COOH
(I)基态F原子的价电子排布图(轨道表示式)为_______________。
(2)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是______________(填标号);第三电离能的变化图是_______________(填标号)。
图a图b图c
(3)固态氟化氢中存在(HF)n形式,每个HF键相连。画出(HF)3的链状结构_______________。
(4)N2F2(二氟氮烯)分子中,氮原子的杂化类型为sp2,则N2F2的结构式为_______________。
(5)NaHF2熔点为160°C(分解生成HF),电解可制得氟气,推测NaHF2中所含作用力的类型有_______________。
(6)BiOC1是一种性能优良的光催化剂,可催化降解有机污染物对硝基苯酚()等。对硝基苯酚的熔点高于邻硝基苯酚()的熔点,其原因是_______________。
(7)V元素在元素周期表_______________区;基态钛原子的核外价层电子排布式是_______________。
(8)在周期表中,与A1化学性质最相似的邻族元素是______________。基态A1原子核外电子云轮廓图呈哑铃形的能级上电子数为_______________。在下列状态的铝元素中,电离最外层一个电子所需能量出高到低的顺序是_______________。(填标号)
A. B. C. D.
(9)CF2=CF2和ETFE分子中C的杂化轨道类型分别为______________和_______________;聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因_______________。
19.(10分)回答下列问题:
(1)Ag的核外电子排布式是[Kr]4d105s1,则Ag在元素周期表中的位置是_______________。下列属于基态Ag+的电子排布式的是_______________。(填标号)
A. [Kr]4d95s2 B. [Kr]4d10 C. [Kr]4d95s1
(2)硒所在的主族中,简单气态氢化物沸点最低的是_____________(填化学式);硒的某种氧化物为链状聚合结构(如下图所示),该氧化物的化学式为______________。
(3)固体三氧化硫中存在如下图所示的三聚分子,该分子中S原子的杂化轨道类型为______________,该结构中S-O键长有两类,一类键长约140pm,另一类键长约160pm,较短的键为_____________(填图I中字母)。
(4)FeSO4·H2O结构如图所示。
Fe2+价层电子排布式为______________。
比较SO42-和H2O分子中的键角大小并给出相应解释:______________。
20.(14分)
I.作为国之重器,火箭的发射牵动了亿万人民的心。就像汽车、飞机需要添加汽油、航空煤油一样,火箭专用燃料被称为“推进剂”。在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式______________。
(2)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是______________。
Ⅱ.化学反应常伴随热效应。某些反应(如:中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cpV总·△T计算获得。
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(3)仪器a的名称为______________,实验中除图1-3所示的仪器外还需要用到的玻璃仪器是______________。
(4)取50 mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
温度 实验次数 起始温度t1/℃ 终止温度/℃ 温度差平均值(t2-t1)/℃
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 30.1 _
2 27.0 27.4 27.2 33.3
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,反应后生成的溶液的比热容c=4.18J/(g.°C)。则中和热△H=______________(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是______________(填字母)。
a.实验装置保温、隔热效果差
b.配制0.50mol/LNaOH溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
e.用量筒量取NaOH溶液的体积时仰视读数
(5)实验中改用30mL0.50mol/L的硫酸跟50mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量______________(填“相等”或“不相等”),所求中和热的数值会______________(填“相等”或 “不相等”)。
江门市第一中学2023-2024学年高二上学期10月第一次段考
化学答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
C C A A B B C C D A A C A A B D
17.(12分)
(1)C(1分)
(2)洪特规则(1分)
(3)BC13和四氯化碳均为非极性分子,而HCl属于极性分子,相似相溶(2分)
(4)O(1分) sp3(1分)σ(1分)
(5)2(1分)27((2分)
(6)C原子电负性大,使羟基的极性增强,羟基H原子更容易电离,物质分子中烃基中C原子数目越多,羟基H就越容易电离,其相应的氯代乙酸的酸性就越强,故三氯乙酸最容易电离出氢离子,其酸性最强(2分)
18.(20分,除(3)、(4)、(6)2分外,其余每个答案1分,)
(1)(1分)
(2)图a(1分)图b(1分)
(3)(2分)
(4)F-N=N-F(2分)(5)离子键、(1分)共价键(1分)、氢键(1分)
(6)对硝基苯酚存在分子间氢键,而邻硝基苯酚更易形成分子内氢键,导致对硝基苯酚分子间的作用力比邻硝基苯酚分子之间的作用力更强(2分)
(7)d;(1分)3d24s2(1分)
(8)Be(或铍)(1分) 7(1分) D>C>A>B(1分)
(9)sp2(1分) sp3(1分)
C-F键的键能大于聚乙烯中C-H的键能,键能越大,化学性质越稳定(1分)
19.(共10分)
(1)第五周期B族;(1分) B(1分)
(2)H2S(1分) (SeO2)n(1分)
(3)sp3 a(各1分)
(4)3d6(1分) SO42-的键角大于H2O,(1分)SO42-中S原子的价层电子对数为4、孤对电子对数为0,离子的空间构型为正四面体形,H2O分子中O原子的价层电子对数为4、孤对电子对数为2,分子的空间构型为V形(2分)
20.(14分)(除标注外,每空2分)I.(1)
(2)反应生成的物质是N2和H2O,对环境无污染
(3)玻璃搅拌器(1分) 量筒(1分)
(4)①4.0 ②-53.5kJ/mol ③acd
(5)不相等(1分) 相等(1分)
同课章节目录
