黑龙江省牡丹江市第二高级中学2023-2024学年高二上学期10月月考化学试题(含答案)
文档属性
| 名称 | 黑龙江省牡丹江市第二高级中学2023-2024学年高二上学期10月月考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 559.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-23 18:18:37 | ||
图片预览



文档简介
牡丹江市第二高级中学2023-2024学年高二上学期10月月考
化学
考生注意:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间75分钟。
2.答题前,考生务必将密封线内项目填写清楚。考生作答时,请将答案答在答题卡上。必须在题号所指示的答题区域作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
3.本试卷主要命题范围:选择性必修1第一、二章、第三章第1节。
4.可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32
第Ⅰ卷(选择题 共54分)
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
1.下列属于强电解质的是( )
A.硫酸钡 B.食盐水 C.二氧化硅 D.醋酸
2.在室温下,的醋酸溶液中,欲使其溶液的减小,但又要使醋酸电离程度减少,应采取( )
A.加入少量固体 B.通入少量气体
C.升高温度 D.加入水
3.已知室温时,某一元酸在水中有发生电离,下列叙述错误的是( )
A.该溶液中
B.升高温度,溶液的减小
C.此酸的电离平衡常数约为
D.加入氢氧化钠溶液,HA的电离程度增大
4.被称为人体冷冻学之父的罗伯特·埃廷格在1962年写出《不朽的前景》一书。他在书中列举了大量事实,证明了冷冻复活的可能。比如,许多昆虫和低等生物冬天都冻僵起来,春天又自动复活。下列结论中与上述信息相关的是( )
A.化学反应前后质量守恒 B.低温下分子无法运动
C.温度降低,化学反应停止 D.温度越低,化学反应越慢
5.进行中和热的测定中,下列操作错误的是( )
A.反应前酸、碱溶液的温度要相同
B.测量溶液的温度计要一直插在溶液中
C.为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸)
D.为了使反应更完全,可以使酸或碱适当过量
6.下列反应的反应热的是( )
A.与稀盐酸的反应 B.与稀硫酸的反应
C.焦炭在高温下与水蒸气的反应 D.硫单质在氧气中燃烧
7.在密闭容器内,某气体反应物在内由变为,则用该气体表示该反应的平均反应速率为( )
A. B. C. D.
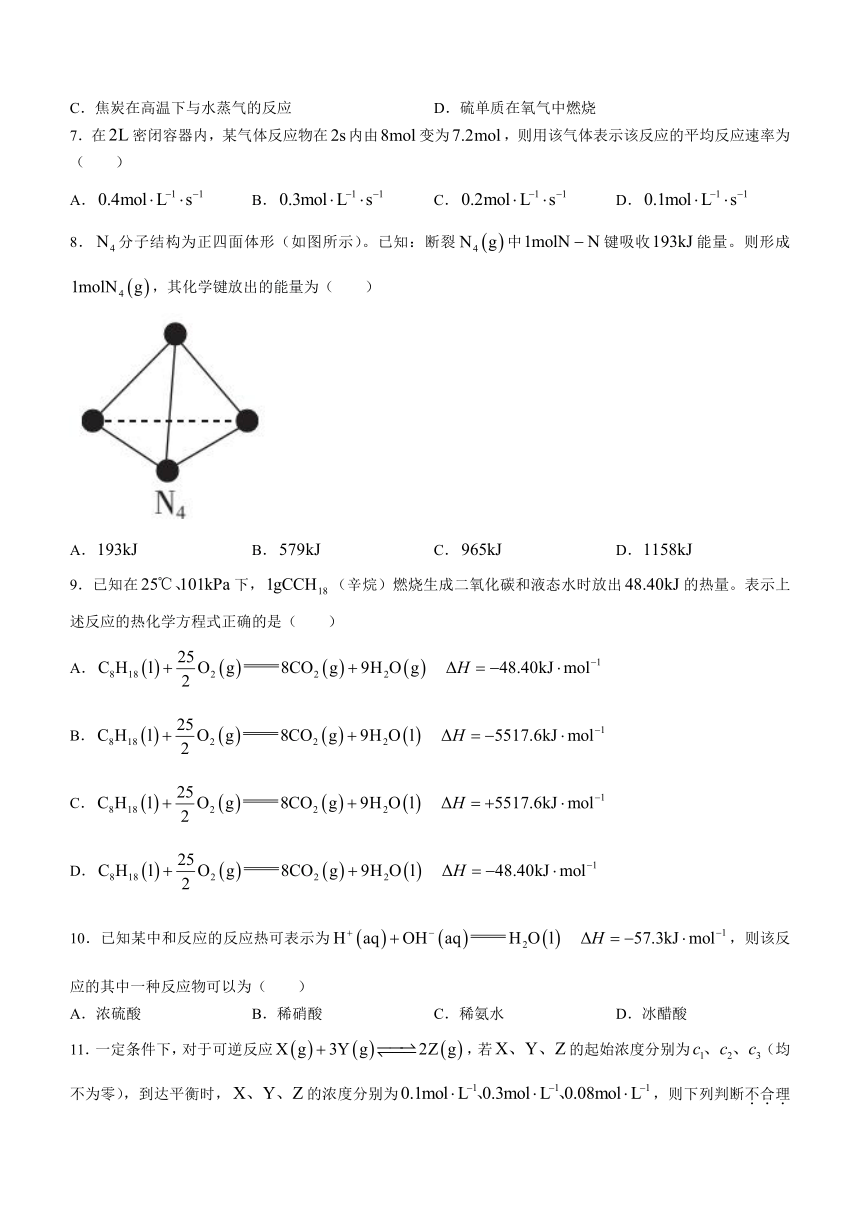
8.分子结构为正四面体形(如图所示)。已知:断裂中键吸收能量。则形成,其化学键放出的能量为( )
A. B. C. D.
9.已知在下,(辛烷)燃烧生成二氧化碳和液态水时放出的热量。表示上述反应的热化学方程式正确的是( )
A.
B.
C.
D.
10.已知某中和反应的反应热可表示为,则该反应的其中一种反应物可以为( )
A.浓硫酸 B.稀硝酸 C.稀氨水 D.冰醋酸
11.一定条件下,对于可逆反应,若的起始浓度分别为(均不为零),到达平衡时,的浓度分别为,则下列判断不合理的是( )
A.
B.X、Y的转化率相等
C.平衡时,和的生成速率之比为
D.的取值范围为
12.已知反应的能量情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
A.该反应的
B.加入催化剂,该反应的变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态,则增大
13.已知:,。碳不完全燃烧所得产物中,与的体积比为,则与碳完全燃烧相比,损失的热量为( )
A. B. C. D.
14.在下,反应达到平衡。恒容时,温度升高,浓度减小。下列说法正确的是( )
A.该反应的焓变为正值 B.恒温下增大压强,反应体系的颜色加深
C.升高温度,逆反应速率减小 D.该反应平衡常数为
15.乙醇的燃烧热为,甲醇的燃烧热为,且,若乙醇和甲醇的混合物完全燃烧,反应热为,则乙醇和甲醇的物质的量之比为( )
A. B. C. D.
16.已知中和热的数值是。下列物质反应时产生热量为的是( )
A.稀盐酸和稀溶液
B.稀盐酸和溶液
C.稀盐酸和溶液
D.溶液和溶液
17.在密闭容器发生下列反应,反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,的浓度为原平衡的1.8倍,下列叙述正确的是( )
A. B.平衡向正反应方向移动
C.D的体积分数变大 D.A的转化率变大
18.工业上以为原料制备的原理为。在一定条件下向两个恒温恒容密闭容器中均通入和,测得两容器中的物质的量随时间的变化曲线分别为a和b(如图所示)。已知容器a、b的体积均为,容器的温度为,容器的温度为,下列说法不正确的是( )
A.容器a中从反应开始到恰好平衡时的平均反应速率为
B.a、b两容器的温度可能相同
C.在达到平衡前,容器的压强逐渐增大
D.该反应在温度下的平衡常数为27
第Ⅱ卷(非选择题 共46分)
二、非选择题(本题包括3小题,共46分)
19.(14分)雾 已经成为部分城市发展的障碍。雾 形成的最主要原因是人为排放,其中汽车尾气污染对雾霾的“贡献”逐年增加。回答下列问题:
(1)汽车尾气中含有与生成的过程如下:
①与的总能量比的总能量________(填“高”或“低”)。
②的________.
③与反应的热化学方程式可以表示为;,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的与转化成无害物质排出。上述反应在使用“催化转化器”后,值________(填“增大”、“减小”或“不变”)。
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:。如图是该反应的能量变化图:
①通过图中信息可判断反应的________(填“>”、“=”或“<”)0。
②图中途径(Ⅱ)的条件是________,途径(Ⅰ)的反应热________(填“>”、“=”或“<”)途径(Ⅱ)的反应热。
③已知下列两个热化学方程式:
三者的关系式为:________.
20.(18分)氨是重要的氮肥,合成原理为:
回答下列问题:
(1)写出平衡常数的表达式________________.
如果降低温度,该反应值________,化学反应速率________,的转化率________(填“增大”、“减小”或“不变”)
(2)在时,将置于一个容积为的密闭容器中发生反应,反应过程中各种物质的物质的量随时间的变化如图所示,回答下列问题:
①内以表示的平均反应速率为________.
②在内,浓度变化的原因可能是________.
A.使用了催化剂 B.缩小容器体积
C.降低温度 D.增加物质的量
③第一次平衡:平衡常数________(带数据的表达式)。
④在反应进行至时,曲线发生变化的原因是________________,达第二次平衡时,新平衡的平衡常数________(填“大于”、“小于”或“等于”)。
21.(14分)和是常见的环境污染气体。
(1)对于反应来说,“”可作为此反应的催化剂。其总反应分两步进行:
第一步为;则第二步为________________(写化学方程式)。
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能________(填“大于”、“小于”或“等于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:,容器Ⅰ、Ⅱ、Ⅲ中的平衡转化率如图乙所示:
①该反应的________0(填“>”或“<”)。
②若容器Ⅰ的体积为,反应在下进行,后达到平衡,则内容器Ⅰ中用表示的反应速率为________。点对应的平衡常数________(保留两位有效数字)。
(3)图中A、C、D三点容器内气体密度由大到小的顺序是________.
(4)若容器Ⅳ体积为,反应在下进行,则起始时反应________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
牡丹江市第二高级中学2023-2024学年高二上学期10月月考
化学
参考答案、提示及评分细则
1.A 2.В 3.A 4.D 5.C 6.С 7.С 8.D 9.В 10.В 11.С 12.С 13.A 14.В 15.В 16.С 17.A 18.B
19.(每空2分)
(1)①低 ② ③不变
(2)①> ②使用催化剂 = ③
20.(每空2分)
(1) 增大 减小 增大
(2)① ②A ③ ④移走 等于
21.(每空2分)
(1) 大于
(2)①> ② 0.004 ③ ④向逆反应方向
化学
考生注意:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间75分钟。
2.答题前,考生务必将密封线内项目填写清楚。考生作答时,请将答案答在答题卡上。必须在题号所指示的答题区域作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
3.本试卷主要命题范围:选择性必修1第一、二章、第三章第1节。
4.可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32
第Ⅰ卷(选择题 共54分)
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
1.下列属于强电解质的是( )
A.硫酸钡 B.食盐水 C.二氧化硅 D.醋酸
2.在室温下,的醋酸溶液中,欲使其溶液的减小,但又要使醋酸电离程度减少,应采取( )
A.加入少量固体 B.通入少量气体
C.升高温度 D.加入水
3.已知室温时,某一元酸在水中有发生电离,下列叙述错误的是( )
A.该溶液中
B.升高温度,溶液的减小
C.此酸的电离平衡常数约为
D.加入氢氧化钠溶液,HA的电离程度增大
4.被称为人体冷冻学之父的罗伯特·埃廷格在1962年写出《不朽的前景》一书。他在书中列举了大量事实,证明了冷冻复活的可能。比如,许多昆虫和低等生物冬天都冻僵起来,春天又自动复活。下列结论中与上述信息相关的是( )
A.化学反应前后质量守恒 B.低温下分子无法运动
C.温度降低,化学反应停止 D.温度越低,化学反应越慢
5.进行中和热的测定中,下列操作错误的是( )
A.反应前酸、碱溶液的温度要相同
B.测量溶液的温度计要一直插在溶液中
C.为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸)
D.为了使反应更完全,可以使酸或碱适当过量
6.下列反应的反应热的是( )
A.与稀盐酸的反应 B.与稀硫酸的反应
C.焦炭在高温下与水蒸气的反应 D.硫单质在氧气中燃烧
7.在密闭容器内,某气体反应物在内由变为,则用该气体表示该反应的平均反应速率为( )
A. B. C. D.
8.分子结构为正四面体形(如图所示)。已知:断裂中键吸收能量。则形成,其化学键放出的能量为( )
A. B. C. D.
9.已知在下,(辛烷)燃烧生成二氧化碳和液态水时放出的热量。表示上述反应的热化学方程式正确的是( )
A.
B.
C.
D.
10.已知某中和反应的反应热可表示为,则该反应的其中一种反应物可以为( )
A.浓硫酸 B.稀硝酸 C.稀氨水 D.冰醋酸
11.一定条件下,对于可逆反应,若的起始浓度分别为(均不为零),到达平衡时,的浓度分别为,则下列判断不合理的是( )
A.
B.X、Y的转化率相等
C.平衡时,和的生成速率之比为
D.的取值范围为
12.已知反应的能量情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
A.该反应的
B.加入催化剂,该反应的变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态,则增大
13.已知:,。碳不完全燃烧所得产物中,与的体积比为,则与碳完全燃烧相比,损失的热量为( )
A. B. C. D.
14.在下,反应达到平衡。恒容时,温度升高,浓度减小。下列说法正确的是( )
A.该反应的焓变为正值 B.恒温下增大压强,反应体系的颜色加深
C.升高温度,逆反应速率减小 D.该反应平衡常数为
15.乙醇的燃烧热为,甲醇的燃烧热为,且,若乙醇和甲醇的混合物完全燃烧,反应热为,则乙醇和甲醇的物质的量之比为( )
A. B. C. D.
16.已知中和热的数值是。下列物质反应时产生热量为的是( )
A.稀盐酸和稀溶液
B.稀盐酸和溶液
C.稀盐酸和溶液
D.溶液和溶液
17.在密闭容器发生下列反应,反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,的浓度为原平衡的1.8倍,下列叙述正确的是( )
A. B.平衡向正反应方向移动
C.D的体积分数变大 D.A的转化率变大
18.工业上以为原料制备的原理为。在一定条件下向两个恒温恒容密闭容器中均通入和,测得两容器中的物质的量随时间的变化曲线分别为a和b(如图所示)。已知容器a、b的体积均为,容器的温度为,容器的温度为,下列说法不正确的是( )
A.容器a中从反应开始到恰好平衡时的平均反应速率为
B.a、b两容器的温度可能相同
C.在达到平衡前,容器的压强逐渐增大
D.该反应在温度下的平衡常数为27
第Ⅱ卷(非选择题 共46分)
二、非选择题(本题包括3小题,共46分)
19.(14分)雾 已经成为部分城市发展的障碍。雾 形成的最主要原因是人为排放,其中汽车尾气污染对雾霾的“贡献”逐年增加。回答下列问题:
(1)汽车尾气中含有与生成的过程如下:
①与的总能量比的总能量________(填“高”或“低”)。
②的________.
③与反应的热化学方程式可以表示为;,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的与转化成无害物质排出。上述反应在使用“催化转化器”后,值________(填“增大”、“减小”或“不变”)。
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:。如图是该反应的能量变化图:
①通过图中信息可判断反应的________(填“>”、“=”或“<”)0。
②图中途径(Ⅱ)的条件是________,途径(Ⅰ)的反应热________(填“>”、“=”或“<”)途径(Ⅱ)的反应热。
③已知下列两个热化学方程式:
三者的关系式为:________.
20.(18分)氨是重要的氮肥,合成原理为:
回答下列问题:
(1)写出平衡常数的表达式________________.
如果降低温度,该反应值________,化学反应速率________,的转化率________(填“增大”、“减小”或“不变”)
(2)在时,将置于一个容积为的密闭容器中发生反应,反应过程中各种物质的物质的量随时间的变化如图所示,回答下列问题:
①内以表示的平均反应速率为________.
②在内,浓度变化的原因可能是________.
A.使用了催化剂 B.缩小容器体积
C.降低温度 D.增加物质的量
③第一次平衡:平衡常数________(带数据的表达式)。
④在反应进行至时,曲线发生变化的原因是________________,达第二次平衡时,新平衡的平衡常数________(填“大于”、“小于”或“等于”)。
21.(14分)和是常见的环境污染气体。
(1)对于反应来说,“”可作为此反应的催化剂。其总反应分两步进行:
第一步为;则第二步为________________(写化学方程式)。
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能________(填“大于”、“小于”或“等于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:,容器Ⅰ、Ⅱ、Ⅲ中的平衡转化率如图乙所示:
①该反应的________0(填“>”或“<”)。
②若容器Ⅰ的体积为,反应在下进行,后达到平衡,则内容器Ⅰ中用表示的反应速率为________。点对应的平衡常数________(保留两位有效数字)。
(3)图中A、C、D三点容器内气体密度由大到小的顺序是________.
(4)若容器Ⅳ体积为,反应在下进行,则起始时反应________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
牡丹江市第二高级中学2023-2024学年高二上学期10月月考
化学
参考答案、提示及评分细则
1.A 2.В 3.A 4.D 5.C 6.С 7.С 8.D 9.В 10.В 11.С 12.С 13.A 14.В 15.В 16.С 17.A 18.B
19.(每空2分)
(1)①低 ② ③不变
(2)①> ②使用催化剂 = ③
20.(每空2分)
(1) 增大 减小 增大
(2)① ②A ③ ④移走 等于
21.(每空2分)
(1) 大于
(2)①> ② 0.004 ③ ④向逆反应方向
同课章节目录
