3.1.2电离平衡 课件(共19张PPT) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.1.2电离平衡 课件(共19张PPT) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-23 21:50:33 | ||
图片预览



文档简介
(共19张PPT)
第三章 水溶液中的离子反应与平衡
第一节 电离平衡
第2课时 弱电解质的电离平衡
弱电解质电离平衡的影响因素 。
弱电解质电离平衡的影响因素。
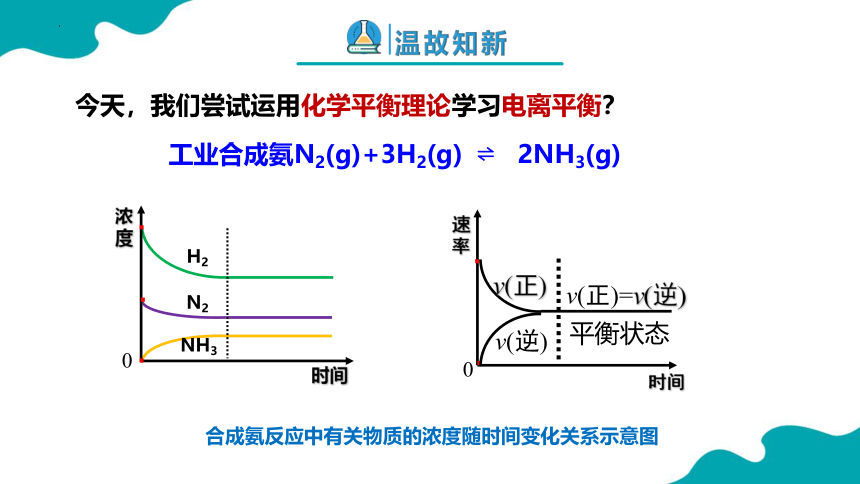
时间
浓度
0
NH3
H2
N2
工业合成氨N2(g)+3H2(g) 2NH3(g)
今天,我们尝试运用化学平衡理论学习电离平衡?
合成氨反应中有关物质的浓度随时间变化关系示意图
v(逆)
v(正)=v(逆)
时间
v(正)
速率
平衡状态
0
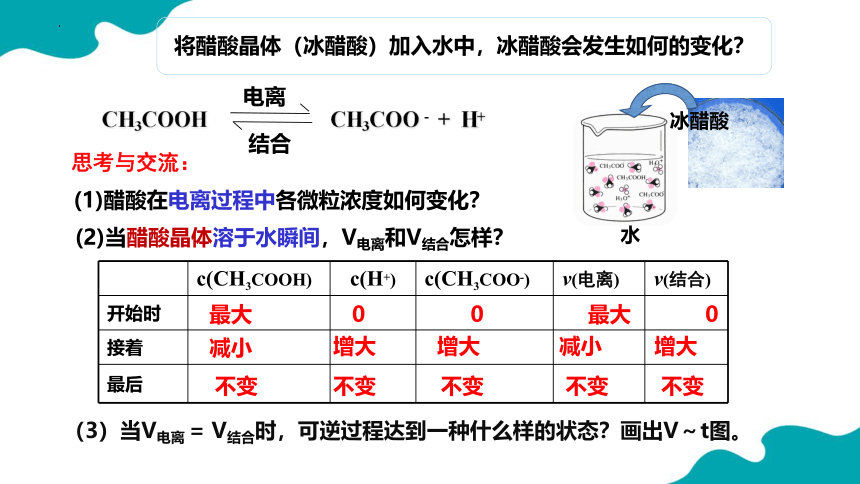
将醋酸晶体(冰醋酸)加入水中,冰醋酸会发生如何的变化?
CH3COOH CH3COO - + H+
电离
结合
水
冰醋酸
(1)醋酸在电离过程中各微粒浓度如何变化?
(2)当醋酸晶体溶于水瞬间,V电离和V结合怎样?
思考与交流:
c(CH3COOH) c(H+) c(CH3COO-) v(电离) v(结合)
开始时
接着
最后
0
0
最大
最大
0
增大
增大
减小
减小
增大
不变
不变
不变
不变
不变
(3)当V电离 = V结合时,可逆过程达到一种什么样的状态?画出V~t图。
meiyangyang8602
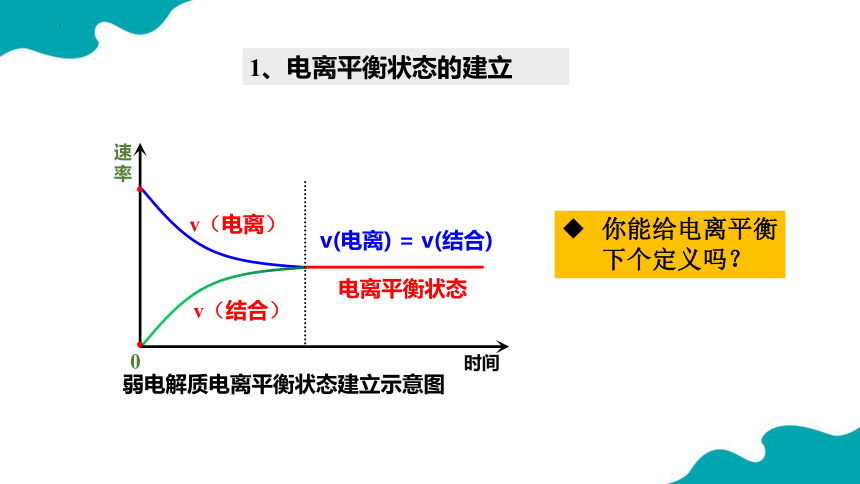
1、电离平衡状态的建立
v(电离)
v(结合)
速率
弱电解质电离平衡状态建立示意图
时间
v(电离) = v(结合)
电离平衡状态
0
你能给电离平衡下个定义吗?
meiyangyang8602
1、弱电解质的电离平衡
定义
在一定条件下,当弱电解质分子电离成离子的速率和离子重新结合生成分子的速率相等时,电离过程就达到了电离平衡状态
2、电离平衡的特征
弱:研究对象是弱电解质的电离
等:V电离 = V结合
动:电离平衡是一种动态平衡,V电离 = V结合≠0
定:平衡时分子、离子的浓度不再变化
变:条件改变时,电离平衡发生移动
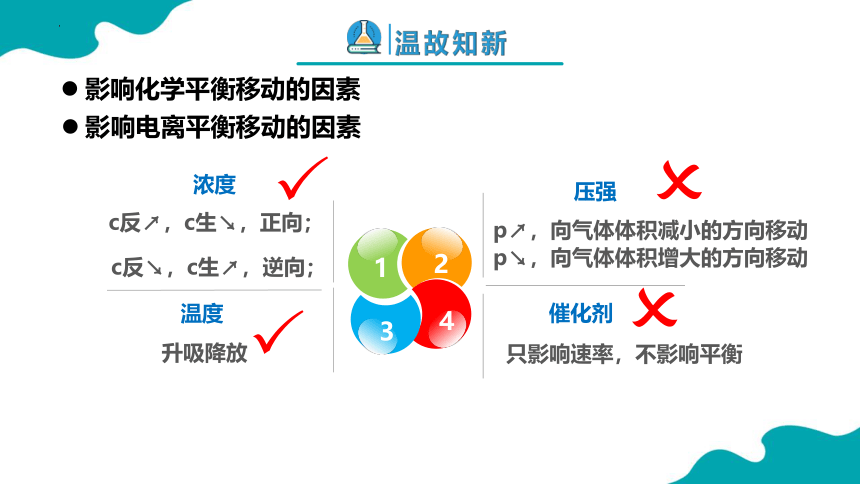
平衡移动规律—勒夏特列原理
1
2
4
3
浓度
温度
压强
催化剂
升吸降放
c反↗,c生↘,正向;
c反↘,c生↗,逆向;
p↗,向气体体积减小的方向移动
p↘,向气体体积增大的方向移动
只影响速率,不影响平衡
影响化学平衡移动的因素
影响电离平衡移动的因素
---表示了弱电解质的电离程度的相对强弱。
Ⅰ.内因:电解质的本身性质。
电解质越弱电离程度越小
例如,电离程度:盐酸 > 醋酸 > 碳酸
电离度(α) =
n(已电离的电解质分子)
n(起始的电解质分子总量)
---类似“反应物的转化率”
电离度:
3、影响电离平衡移动的因素
Ⅱ.外因:
温度、浓度、加入其它电解质等
1、温度的影响
当温度变化时候,电离平衡会如何移动?
讨论
pH计测定不同温度下0.05 mol/L 醋酸的pH,实验结果如下表所示:
温度 20 ℃ 24 ℃
pH 3.05 3.03
(已知pH越小,c(H+)越大)
ΔH >0
温度升高,电离平衡正向移动
温度升高,溶液pH下降,c(H+)增大
CH3COOH CH3COO + H+
升温促进电离 “越热越电离”
请判断醋酸的电离过程是吸热过程还是放热过程?
CH3COOH CH3COO + H+
平衡移动方向 n(HAc) n(H+) n(Ac-) c(HAc) c(H+) c(Ac-) 导电能力 电离程度
升高温度
正向
减小
增大
增大
减小
增大
增大
增强
增大
(升温促电离) 越热越电离
1、温度的影响
平衡移动方向 n(HAc) n(H+) n(Ac-) c(HAc) c(H+) c(Ac-) 导电能力 电离程度ɑ
加水稀释
CH3COOH CH3COO + H+
正向
减小
增大
增大
减小
减小
减小
减弱
增大
“越稀越电离”
对同一弱电解质,通常溶液中弱电解质的浓度越小,离子间通过碰撞结合成分子的机会越少,电离程度越大。
2、浓度的影响
本质
讨论
试分析为什么同一弱电解质,通常溶液中弱电解质的浓度越小,电离程度越大 浓度越小,离子间通过碰撞结合成分子的机会越少
改变 条件 电离平衡移动方向 C(H+) C(Ac-) C(HAc) 导电能力 电离程度
(电离度)
加H2O
加冰醋酸
通HCl气体
加NaAc(s)
加NaOH(s)
加Na2CO3
正向
增大
增大
逆向
增大
减小
增大
逆向
减小
增大
减小
增大
减小
减小
减小
增大
增大
增大
正向
减小
思维延伸
分析改变下列条件对醋酸电离平衡的影响,填写下表:
正向
减小
减小
增强
增大
增大
增强
增强
增强
增强
正向
减小
减小
减小
减弱
增大
改变 条件 电离平衡移动方向 C(H+) C(Ac-) C(HAc) 导电能力 电离程度
(电离度)
加H2O
加冰醋酸
通HCl气体
加NaAc(s)
加NaOH(s)
加Na2CO3
正向
增大
增大
逆向
增大
减小
增大
逆向
减小
增大
减小
增大
减小
减小
减小
增大
增大
增大
正向
减小
思维延伸
分析改变下列条件对醋酸电离平衡的影响,填写下表:
正向
减小
减小
增强
增大
增大
增强
增强
增强
增强
正向
减小
减小
减小
减弱
增大
浓度越小,电离程度 。
越大
同离子效应
化学反应
①浓度:
②同离子效应:
③化学反应:
2、浓度的影响
浓度越小,电离程度越大
(越稀越电离)
增大(电离产生的)离子浓度,电离平衡向 逆向 移动,电离程度减小
(同离子效应,抑制电离)
加入会与(电离产生的)离子反应的物质,电离平衡向 正向移动 , 电离程度增大
(化学反应,促进电离)
1、正误判断(1)电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大( )(2)电离平衡向右移动,弱电解质的电离程度一定增大( )(3)盐酸的导电能力一定比醋酸溶液的强( )
(4)向醋酸溶液中滴加等浓度NaOH溶液,混合溶液的导电能力不变( )
2、氨水中存在着下列平衡:NH3 H2O NH4+ +OH-。进行下列操作后叙述正确的是( )
A.加水后,溶液中n(OH-)增大
B.加入少量浓盐酸,溶液中c(OH-)增大
C.加入少量浓氢氧化钠溶液,电离平衡正向移动
D.加入少量氯化铵固体,溶液中c(NH4+)减少
减少
逆向移动
增大
加水促进电离
A
课本P62 2
3、冰醋酸加水溶解并不断稀释过程中,溶液导电能力与加入水的体积有如下变化关系:试回答:
⑴加水前导电能力为0的理由是:_________________
⑵a、b、c三点对应溶液的 C(H+)值由小到大的顺序是 _
⑶a、b、c三点中电离程度最大的是 。
⑷若使c点溶液中c(CH3COO-)增大、c(H+)减小可采取的措施有:
冰醋酸中没有自由移动的离子
cC
①加碱②加碳酸钠③加镁或锌
离子浓度
课本P62 4
影响弱电解质电离平衡移动的因素
温度
电离过程是吸热的,升高温度, 电离
浓度
1、加水稀释 , 电离
2、加入与弱电解质具有相同离子的
强电解质会 电离
3、加入能与弱电解质电离产生的某种
离子反应的物质可 电离
越稀越电离
同离子效应 抑制电离
化学反应 促进电离
内因:电解质本身的性质。
通常电解质越弱电离程度越小。
外
因
促进
抑制
促进
越热越电离
促进
①向溶液中加入CuSO4 溶液时,电离平衡向 移动,
c(H+) ,c(S2-) ;
②向溶液中加入NaOH固体时,电离平衡向 移动,
c(H+) ,c(S2-) ;
③若将H2S稀溶液微热,c(H2S) ;
④若要同时增大H2S溶液中c(S2-)、c(H+),
可以采取的措施 .
正方向
增大
增大
减小
减小
减小
适当升温,或通入H2S气体等
1、已知在水溶液中:
正方向
Cu2+ +S2- =CuS↓
第三章 水溶液中的离子反应与平衡
第一节 电离平衡
第2课时 弱电解质的电离平衡
弱电解质电离平衡的影响因素 。
弱电解质电离平衡的影响因素。
时间
浓度
0
NH3
H2
N2
工业合成氨N2(g)+3H2(g) 2NH3(g)
今天,我们尝试运用化学平衡理论学习电离平衡?
合成氨反应中有关物质的浓度随时间变化关系示意图
v(逆)
v(正)=v(逆)
时间
v(正)
速率
平衡状态
0
将醋酸晶体(冰醋酸)加入水中,冰醋酸会发生如何的变化?
CH3COOH CH3COO - + H+
电离
结合
水
冰醋酸
(1)醋酸在电离过程中各微粒浓度如何变化?
(2)当醋酸晶体溶于水瞬间,V电离和V结合怎样?
思考与交流:
c(CH3COOH) c(H+) c(CH3COO-) v(电离) v(结合)
开始时
接着
最后
0
0
最大
最大
0
增大
增大
减小
减小
增大
不变
不变
不变
不变
不变
(3)当V电离 = V结合时,可逆过程达到一种什么样的状态?画出V~t图。
meiyangyang8602
1、电离平衡状态的建立
v(电离)
v(结合)
速率
弱电解质电离平衡状态建立示意图
时间
v(电离) = v(结合)
电离平衡状态
0
你能给电离平衡下个定义吗?
meiyangyang8602
1、弱电解质的电离平衡
定义
在一定条件下,当弱电解质分子电离成离子的速率和离子重新结合生成分子的速率相等时,电离过程就达到了电离平衡状态
2、电离平衡的特征
弱:研究对象是弱电解质的电离
等:V电离 = V结合
动:电离平衡是一种动态平衡,V电离 = V结合≠0
定:平衡时分子、离子的浓度不再变化
变:条件改变时,电离平衡发生移动
平衡移动规律—勒夏特列原理
1
2
4
3
浓度
温度
压强
催化剂
升吸降放
c反↗,c生↘,正向;
c反↘,c生↗,逆向;
p↗,向气体体积减小的方向移动
p↘,向气体体积增大的方向移动
只影响速率,不影响平衡
影响化学平衡移动的因素
影响电离平衡移动的因素
---表示了弱电解质的电离程度的相对强弱。
Ⅰ.内因:电解质的本身性质。
电解质越弱电离程度越小
例如,电离程度:盐酸 > 醋酸 > 碳酸
电离度(α) =
n(已电离的电解质分子)
n(起始的电解质分子总量)
---类似“反应物的转化率”
电离度:
3、影响电离平衡移动的因素
Ⅱ.外因:
温度、浓度、加入其它电解质等
1、温度的影响
当温度变化时候,电离平衡会如何移动?
讨论
pH计测定不同温度下0.05 mol/L 醋酸的pH,实验结果如下表所示:
温度 20 ℃ 24 ℃
pH 3.05 3.03
(已知pH越小,c(H+)越大)
ΔH >0
温度升高,电离平衡正向移动
温度升高,溶液pH下降,c(H+)增大
CH3COOH CH3COO + H+
升温促进电离 “越热越电离”
请判断醋酸的电离过程是吸热过程还是放热过程?
CH3COOH CH3COO + H+
平衡移动方向 n(HAc) n(H+) n(Ac-) c(HAc) c(H+) c(Ac-) 导电能力 电离程度
升高温度
正向
减小
增大
增大
减小
增大
增大
增强
增大
(升温促电离) 越热越电离
1、温度的影响
平衡移动方向 n(HAc) n(H+) n(Ac-) c(HAc) c(H+) c(Ac-) 导电能力 电离程度ɑ
加水稀释
CH3COOH CH3COO + H+
正向
减小
增大
增大
减小
减小
减小
减弱
增大
“越稀越电离”
对同一弱电解质,通常溶液中弱电解质的浓度越小,离子间通过碰撞结合成分子的机会越少,电离程度越大。
2、浓度的影响
本质
讨论
试分析为什么同一弱电解质,通常溶液中弱电解质的浓度越小,电离程度越大 浓度越小,离子间通过碰撞结合成分子的机会越少
改变 条件 电离平衡移动方向 C(H+) C(Ac-) C(HAc) 导电能力 电离程度
(电离度)
加H2O
加冰醋酸
通HCl气体
加NaAc(s)
加NaOH(s)
加Na2CO3
正向
增大
增大
逆向
增大
减小
增大
逆向
减小
增大
减小
增大
减小
减小
减小
增大
增大
增大
正向
减小
思维延伸
分析改变下列条件对醋酸电离平衡的影响,填写下表:
正向
减小
减小
增强
增大
增大
增强
增强
增强
增强
正向
减小
减小
减小
减弱
增大
改变 条件 电离平衡移动方向 C(H+) C(Ac-) C(HAc) 导电能力 电离程度
(电离度)
加H2O
加冰醋酸
通HCl气体
加NaAc(s)
加NaOH(s)
加Na2CO3
正向
增大
增大
逆向
增大
减小
增大
逆向
减小
增大
减小
增大
减小
减小
减小
增大
增大
增大
正向
减小
思维延伸
分析改变下列条件对醋酸电离平衡的影响,填写下表:
正向
减小
减小
增强
增大
增大
增强
增强
增强
增强
正向
减小
减小
减小
减弱
增大
浓度越小,电离程度 。
越大
同离子效应
化学反应
①浓度:
②同离子效应:
③化学反应:
2、浓度的影响
浓度越小,电离程度越大
(越稀越电离)
增大(电离产生的)离子浓度,电离平衡向 逆向 移动,电离程度减小
(同离子效应,抑制电离)
加入会与(电离产生的)离子反应的物质,电离平衡向 正向移动 , 电离程度增大
(化学反应,促进电离)
1、正误判断(1)电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大( )(2)电离平衡向右移动,弱电解质的电离程度一定增大( )(3)盐酸的导电能力一定比醋酸溶液的强( )
(4)向醋酸溶液中滴加等浓度NaOH溶液,混合溶液的导电能力不变( )
2、氨水中存在着下列平衡:NH3 H2O NH4+ +OH-。进行下列操作后叙述正确的是( )
A.加水后,溶液中n(OH-)增大
B.加入少量浓盐酸,溶液中c(OH-)增大
C.加入少量浓氢氧化钠溶液,电离平衡正向移动
D.加入少量氯化铵固体,溶液中c(NH4+)减少
减少
逆向移动
增大
加水促进电离
A
课本P62 2
3、冰醋酸加水溶解并不断稀释过程中,溶液导电能力与加入水的体积有如下变化关系:试回答:
⑴加水前导电能力为0的理由是:_________________
⑵a、b、c三点对应溶液的 C(H+)值由小到大的顺序是 _
⑶a、b、c三点中电离程度最大的是 。
⑷若使c点溶液中c(CH3COO-)增大、c(H+)减小可采取的措施有:
冰醋酸中没有自由移动的离子
c
①加碱②加碳酸钠③加镁或锌
离子浓度
课本P62 4
影响弱电解质电离平衡移动的因素
温度
电离过程是吸热的,升高温度, 电离
浓度
1、加水稀释 , 电离
2、加入与弱电解质具有相同离子的
强电解质会 电离
3、加入能与弱电解质电离产生的某种
离子反应的物质可 电离
越稀越电离
同离子效应 抑制电离
化学反应 促进电离
内因:电解质本身的性质。
通常电解质越弱电离程度越小。
外
因
促进
抑制
促进
越热越电离
促进
①向溶液中加入CuSO4 溶液时,电离平衡向 移动,
c(H+) ,c(S2-) ;
②向溶液中加入NaOH固体时,电离平衡向 移动,
c(H+) ,c(S2-) ;
③若将H2S稀溶液微热,c(H2S) ;
④若要同时增大H2S溶液中c(S2-)、c(H+),
可以采取的措施 .
正方向
增大
增大
减小
减小
减小
适当升温,或通入H2S气体等
1、已知在水溶液中:
正方向
Cu2+ +S2- =CuS↓
