福建省永安市第三中学2023-2024学年高二上学期10月第一次月考化学试题(PDF版含答案)
文档属性
| 名称 | 福建省永安市第三中学2023-2024学年高二上学期10月第一次月考化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-24 07:00:30 | ||
图片预览


文档简介
永安三中高中校2023-2024 学年高二(上)10 月月考
化学试卷
考试范围:选择性必修 1第一章至第二章化学反应限度
考试时间:75 分钟 总分:100 分
可能用到的相对原子质量:H:1 N:14 O:16 Ag:108
第 I 卷
一、选择题(包括 15 小题,每题 3 分,共 45 分。每题只有一个选项符合题意)
1.下列过程属于放热反应的是:( )
A.用石灰石烧制石灰 B.在锌粒中加稀硫酸
C.浓硫酸的稀释 D.硫酸铵与氢氧化钙的反应
2.关于反应 CaSO4(g)=CaO(g)+SO2(g) △H>0,△S>0。下列说法正确的是:( )
A.低温下能自发进行 B.任意温度下都不能自发进行
C.高温下能自发进行 D.任意温度下都能自发进行
3.下列叙述正确的是:( )
A.化学平衡发生移动,平衡常数不一定发生变化
B.使用高效催化剂可以提高原料的转化率
C. - 3+钢铁发生电化学腐蚀的负极反应式:Fe-3e ===Fe
D.化学反应的平衡常数越大,其反应速率就越快
4.埋在地下的铸铁输油管道,在下列各种情况下,被腐蚀速率最慢的是:( )
A.在含铁元素较多的酸性土壤中 B.在潮湿疏松的碱性土壤中
C.在干燥致密不透气的土壤中
D.在含碳粒较多,潮湿透气的中性土壤中
5.用石墨作电极电解 CuCl2和 KCl的混合溶液,电解初期阴极和阳极析出的物质
分别是:( )
A.H2、Cl2 B.Cu、Cl2
C.H2、O2 D.Cu、O2
6.科学家用 X射线激光技术观察到吸附在催化剂表
面的 CO与 O形成化学键的过程,反应过程能量变化
及历程如图所示,下列说法正确的是:( )
A.CO和 O生成 CO2是吸热过程
B.状态Ⅰ→Ⅱ吸收能量用于断裂化学键
C.状态Ⅰ→Ⅲ表示的是 CO与 O2反应的过程
D.CO和 CO2中 C与 O之间化学键并不相同
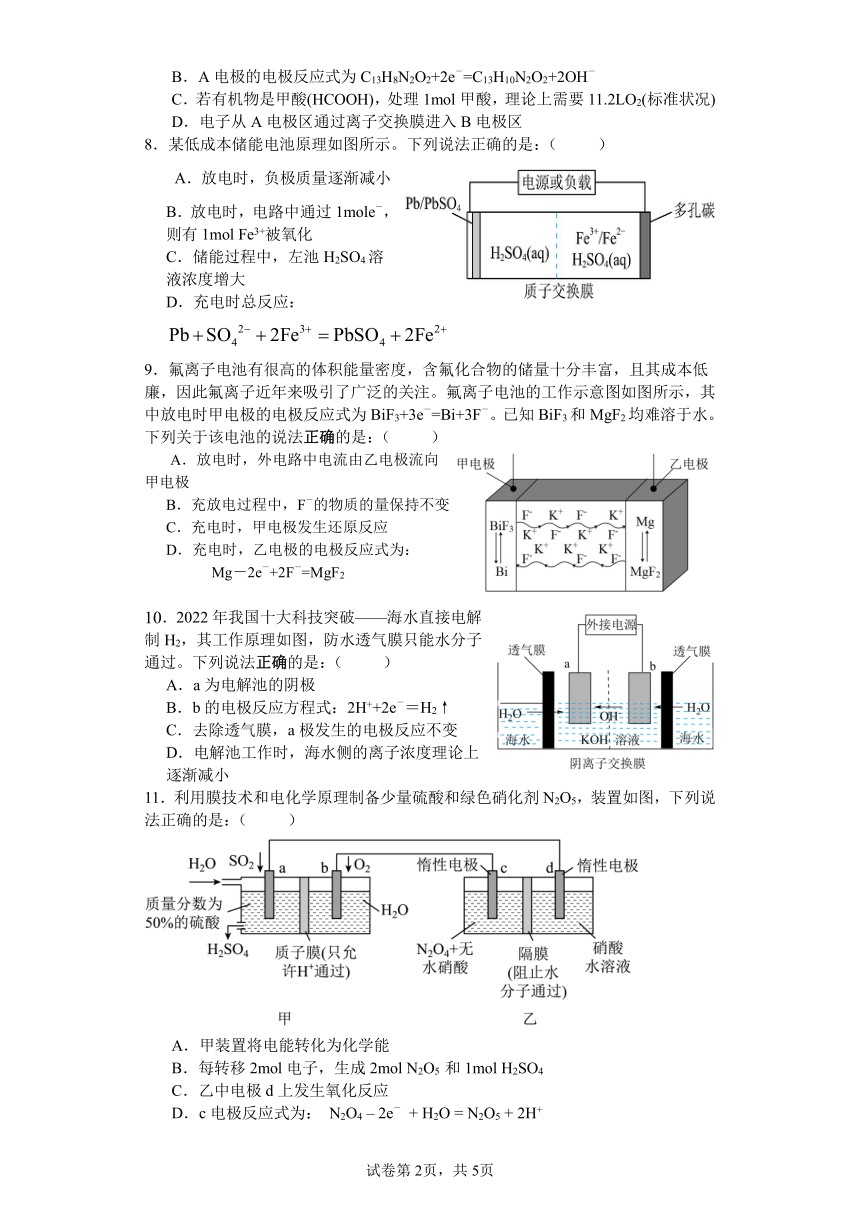
7.在触媒作用下,利用电化学原理处理酸性溶液中有机物的原理如图所示。下列
分析正确的是:( )
A.B电极是负极
试卷第 1页,共 5页
{#{QQABLYKUoggAAgAAAQgCQwHgCkKQkBEAAAoOQEAEoAIAAQFABAA=}#}
B.A电极的电极反应式为 C - -13H8N2O2+2e =C13H10N2O2+2OH
C.若有机物是甲酸(HCOOH),处理 1mol甲酸,理论上需要 11.2LO2(标准状况)
D.电子从 A电极区通过离子交换膜进入 B电极区
8.某低成本储能电池原理如图所示。下列说法正确的是:( )
A.放电时,负极质量逐渐减小
B.放电时,电路中通过 1mole-,
则有 1mol Fe3+被氧化
C.储能过程中,左池 H2SO4溶
液浓度增大
D.充电时总反应:
Pb SO 2 2Fe3 4 PbSO4 2Fe
2
9.氟离子电池有很高的体积能量密度,含氟化合物的储量十分丰富,且其成本低
廉,因此氟离子近年来吸引了广泛的关注。氟离子电池的工作示意图如图所示,其
中放电时甲电极的电极反应式为 BiF3+3e-=Bi+3F-。已知 BiF3和MgF2均难溶于水。
下列关于该电池的说法正确的是:( )
A.放电时,外电路中电流由乙电极流向
甲电极
B -.充放电过程中,F 的物质的量保持不变
C.充电时,甲电极发生还原反应
D.充电时,乙电极的电极反应式为:
Mg 2e-+2F-- =MgF2
10.2022年我国十大科技突破——海水直接电解
制 H2,其工作原理如图,防水透气膜只能水分子
通过。下列说法正确的是:( )
A.a为电解池的阴极
B.b的电极反应方程式:2H++2e-=H2↑
C.去除透气膜,a极发生的电极反应不变
D.电解池工作时,海水侧的离子浓度理论上
逐渐减小
11.利用膜技术和电化学原理制备少量硫酸和绿色硝化剂 N2O5,装置如图,下列说
法正确的是:( )
A.甲装置将电能转化为化学能
B.每转移 2mol电子,生成 2mol N2O5 和 1mol H2SO4
C.乙中电极 d上发生氧化反应
D.c电极反应式为: N2O – 2e-4 + H2O = N2O5 + 2H+
试卷第 2页,共 5页
{#{QQABLYKUoggAAgAAAQgCQwHgCkKQkBEAAAoOQEAEoAIAAQFABAA=}#}
12 -.以 Fe3O4/Pd为催化材料,利用电化学原理实现用 H2消除酸性废水中 NO2 的目的,
其反应过程如图所示[已知 Fe3O4中 Fe元素化合价为+2、+3价,分别表示为 Fe(Ⅱ)、Fe(Ⅲ)]。
下列说法错误的是:( )
A.Fe(Ⅱ)与 Fe(Ⅲ)的相互转化起传递电子的作用
B.处理 NO -2 的电极反应式为:
2 NO -2 +6e-+4H -2O=N2↑+8OH
C.用该法处理后,水体的 pH升高
D.消耗标准状况下 6.72 L H2,理论上可处理含
NO -2 4.6 mg·L-1的废水 2m3
13.在一定体积的密闭容器中,进行如下化学反应:
CO2 (g) H2 (g) CO(g) H2O(l),其化学平衡常
t /℃ 70 80 83 100 120
数K 和温度 t的关系如下表所示:
下列说法正确的是:( ) K 0.6 0.9 1.0 1.7 2.6
A.70℃ 时该反应的化学平衡常数表达式为
c(CO) c H O
K 2
c CO2 c H2
B.该反应为放热反应
C.83℃ 时,若各物质的浓度符合如下关系:3c CO2 c H2 5c(CO),则此时
正 逆
D.83℃ 时,容器中的化学反应已达到平衡。在其他条件不变的情况下,扩大
容器的体积 c H2 将增大
14. 氢气和氟气反应生成氟化氢的过程中能量变化如图所
示。由图可知:( )
A.生成 1molHF 气体要吸收的热量为 270kJ
B.热化学方程式为:H2 + F2= 2HF H=-270 kJ/mol
C.该反应是放热反应
D.反应物的总能量小于生成物的总能量
15.一定温度下的恒容密闭容器中发生可逆反应N 2 g +3H2 g 2NH3 g ,不
能说明该反应一定达到平衡状态的是:( )
A.压强保持不变 B.N2的消耗速率和 H2的生成速率之比为1:3
C.N2、H2、NH3的物质的量之比为 1:3:2
D.NH3的百分含量保持不变
第 II 卷
二、非选择题(包括 3 大题,共 55 分)
16.(一)氨在国民经济中占有重要地位。已知:合成氨工业中,合成塔中每产生
2molNH3,放出 92.2 kJ热量。
(1)若起始时向容器内放入 2mol N2和 6mol H2,达平衡后放出的热量为 Q,则 Q(填
“>”、“<”或“=”)______184.4kJ.
(2)1molN-H 键断裂吸收的能量约等
于 kJ。
(二) (1)肼(N2H4)又称联氨,在常温下
试卷第 3页,共 5页
{#{QQABLYKUoggAAgAAAQgCQwHgCkKQkBEAAAoOQEAEoAIAAQFABAA=}#}
是一种可燃性的液体,可用作火箭燃料。已知在 101 kPa 时,32.0 g N2H4在氧气中
完全燃烧生成氮气和液态水,放出热量 624 kJ(25℃时),N2H4完全燃烧的热化学方
程式是
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是 20%~30%的 KOH 溶液。
该电池放电时:正极的电极反应式: ;负极的电极
反应式: 。
(3)右图是一个电解过程示意图。
①锌片上发生的电极反应式是: 。
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质
量变化为 128 g,则肼-空气燃料电池理论上消耗标准状况下的
空气 L(假设空气中氧气体积分数为 20%)。
17.铝作为一种应用广泛的金属,在电化学领域发挥着举足轻重的作用。回答下列
问题:
(1)某同学根据氧化还原反应:
2Al(s) 3Cu2 (aq)=2Al3 (aq) 3Cu(s)设计如
图所示的原电池:
① 电极 X的化学式为 ,电极 Y
的化学式为 。
②盐桥中的阴离子向 (填化学式)溶液中移
动。
(2)新型电池中的铝电池类型较多。
①Li Al/FeS是一种二次电池,可用于车载电源,其电池总反应为
2Li FeS Li2S Fe。放电时的正极反应式为 ,充电时,阴极的电极
反应式为 。
② Al 空气燃料电池可用作电动汽车的电源,该电池多使用NaOH溶液为电解液。
电池工作过程中电解液的pH (填“增大”“减小”或“不变”)。
③ 图为Al AgO电池的原理结构示意图,这种电池可用作水下动力电源。该电池
反应的化学方程式为2Al 3AgO 2NaOH 3H2O 2Na Al(OH)4 3Ag,当电极上析
出1.08 g Ag时,电路中转移的电子为 mol。
18.(一)羧基硫(COS)是一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。
在容积不变的密闭容器中,将 CO和 H2S混合加热并达到下列平衡:
CO(g)+H S(g) 2 COS(g)+H2 (g)
(1)若反应前 CO的物质的量为 10mol,达到平衡时 CO的物质的量为 8mol,且化学
平衡常数为 0.1,下列说法正确的是 (填字母)。
a.升高温度,H2S的浓度增大,表明该反应是吸热反应
b.通入 CO后,正反应速率逐渐增大
试卷第 4页,共 5页
{#{QQABLYKUoggAAgAAAQgCQwHgCkKQkBEAAAoOQEAEoAIAAQFABAA=}#}
c.反应前 H2S的物质的量为 7mol
d.达到平衡时 CO的转化率为 80%
(2)在不同温度下达到化学平衡时,H2S的转
化率如图所示,则该反应是 反应
(填“吸热”或“放热”)。
(3)在某温度下,向 1L的密闭容器中通入
10molCO和 10molH2S,平衡时测得 CO的转
化率为 40%,则该温度下反应的平衡常数
为 。
(二)实验室测定中和热的步骤如下(如图)
第一步:量取 40.0mL0.25mol/LH2SO4溶液倒入小烧杯中,测
量温度;
第二步:量取 40.0mL0.55mol/LNaOH 溶液,测量温度;
第三步:将 NaOH溶液倒入小烧杯中,混合均匀后测量混合
液温度。
请回答:
(1)图中仪器 A的名称是 。
(2)若实验中若改用 60mL 0.50mol/L的盐酸与 50mL 0.55mol/L的氢氧化钠溶液进行反应,
与上述实验相比,所放出的热量 (填“相等”“不相等”),若实验操作均正确,则所
求中和热 (填“相等”“不相等”)。
(三)电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛.
(1)图 1 中,为了减缓海水对钢闸门 A的腐蚀,材料 B 可以选择 (填字母序号).
a.碳棒 b.锌板 c.铜板
该电化学保护方法的名称是 。
(2)图 2 中,钢闸门 C为 极,用氯化钠溶液模拟海水进行实验,D为石墨块,
总反应的离子方程式为_________________________.
(3)有关上述实验,下列说法正确的是 。
A.溶液中 Na+向 D 极移动
B.从 D 极处逸出的气体能使湿润的 KI 淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
试卷第 5页,共 5页
{#{QQABLYKUoggAAgAAAQgCQwHgCkKQkBEAAAoOQEAEoAIAAQFABAA=}#}
永安三中高中校2023-2024 学年高二(上)10 月月考
化学试卷参考答案
1.B 2.C 3.A 4.C 5.B 6.D 7.C 8.C 9.B 10.B
11.B 12.B 13.C 14.C 15.C
16.共 18 分
(一)(1)< (2)391(每空两分,共 4分)
-1
(二) (1)N2H4(l)+O2(g)===N2(g)+2H2O(l) ΔH = -624 kJ·mol ;
- - - -
(2)O2 + 2H2O + 4e ===4OH N2H4+4OH -4e ═4H2O+N2↑
2+ -
(3)Cu +2e =Cu 112(本空两分)
(热化学方程每空 3分,电极式每空 3分)
17. 共 16 分(每空两分,电极式每空 3分)
Cu Al Al 2 SO4 3 2Li FeS 2e =Li2S Fe 2Li 2e =2Li 减小 0.02
18.共 21 分
4
(一)(1)c (2)放热 (3) (每空两分,共 6分)
9
(二)(1)环形玻璃搅拌棒 (2)不相等 相等(每空两分,共4分)
(三)(1)b;牺牲阳极的阴极保护法;
- -
(2)阴极 2Cl +2H2O H2↑+Cl2↑+2OH (3)B
(每空两分,电极式每空 3分,共 11 分)
答案第 1页,共 1页
{#{QQABLYKUoggAAgAAAQgCQwHgCkKQkBEAAAoOQEAEoAIAAQFABAA=}#}
化学试卷
考试范围:选择性必修 1第一章至第二章化学反应限度
考试时间:75 分钟 总分:100 分
可能用到的相对原子质量:H:1 N:14 O:16 Ag:108
第 I 卷
一、选择题(包括 15 小题,每题 3 分,共 45 分。每题只有一个选项符合题意)
1.下列过程属于放热反应的是:( )
A.用石灰石烧制石灰 B.在锌粒中加稀硫酸
C.浓硫酸的稀释 D.硫酸铵与氢氧化钙的反应
2.关于反应 CaSO4(g)=CaO(g)+SO2(g) △H>0,△S>0。下列说法正确的是:( )
A.低温下能自发进行 B.任意温度下都不能自发进行
C.高温下能自发进行 D.任意温度下都能自发进行
3.下列叙述正确的是:( )
A.化学平衡发生移动,平衡常数不一定发生变化
B.使用高效催化剂可以提高原料的转化率
C. - 3+钢铁发生电化学腐蚀的负极反应式:Fe-3e ===Fe
D.化学反应的平衡常数越大,其反应速率就越快
4.埋在地下的铸铁输油管道,在下列各种情况下,被腐蚀速率最慢的是:( )
A.在含铁元素较多的酸性土壤中 B.在潮湿疏松的碱性土壤中
C.在干燥致密不透气的土壤中
D.在含碳粒较多,潮湿透气的中性土壤中
5.用石墨作电极电解 CuCl2和 KCl的混合溶液,电解初期阴极和阳极析出的物质
分别是:( )
A.H2、Cl2 B.Cu、Cl2
C.H2、O2 D.Cu、O2
6.科学家用 X射线激光技术观察到吸附在催化剂表
面的 CO与 O形成化学键的过程,反应过程能量变化
及历程如图所示,下列说法正确的是:( )
A.CO和 O生成 CO2是吸热过程
B.状态Ⅰ→Ⅱ吸收能量用于断裂化学键
C.状态Ⅰ→Ⅲ表示的是 CO与 O2反应的过程
D.CO和 CO2中 C与 O之间化学键并不相同
7.在触媒作用下,利用电化学原理处理酸性溶液中有机物的原理如图所示。下列
分析正确的是:( )
A.B电极是负极
试卷第 1页,共 5页
{#{QQABLYKUoggAAgAAAQgCQwHgCkKQkBEAAAoOQEAEoAIAAQFABAA=}#}
B.A电极的电极反应式为 C - -13H8N2O2+2e =C13H10N2O2+2OH
C.若有机物是甲酸(HCOOH),处理 1mol甲酸,理论上需要 11.2LO2(标准状况)
D.电子从 A电极区通过离子交换膜进入 B电极区
8.某低成本储能电池原理如图所示。下列说法正确的是:( )
A.放电时,负极质量逐渐减小
B.放电时,电路中通过 1mole-,
则有 1mol Fe3+被氧化
C.储能过程中,左池 H2SO4溶
液浓度增大
D.充电时总反应:
Pb SO 2 2Fe3 4 PbSO4 2Fe
2
9.氟离子电池有很高的体积能量密度,含氟化合物的储量十分丰富,且其成本低
廉,因此氟离子近年来吸引了广泛的关注。氟离子电池的工作示意图如图所示,其
中放电时甲电极的电极反应式为 BiF3+3e-=Bi+3F-。已知 BiF3和MgF2均难溶于水。
下列关于该电池的说法正确的是:( )
A.放电时,外电路中电流由乙电极流向
甲电极
B -.充放电过程中,F 的物质的量保持不变
C.充电时,甲电极发生还原反应
D.充电时,乙电极的电极反应式为:
Mg 2e-+2F-- =MgF2
10.2022年我国十大科技突破——海水直接电解
制 H2,其工作原理如图,防水透气膜只能水分子
通过。下列说法正确的是:( )
A.a为电解池的阴极
B.b的电极反应方程式:2H++2e-=H2↑
C.去除透气膜,a极发生的电极反应不变
D.电解池工作时,海水侧的离子浓度理论上
逐渐减小
11.利用膜技术和电化学原理制备少量硫酸和绿色硝化剂 N2O5,装置如图,下列说
法正确的是:( )
A.甲装置将电能转化为化学能
B.每转移 2mol电子,生成 2mol N2O5 和 1mol H2SO4
C.乙中电极 d上发生氧化反应
D.c电极反应式为: N2O – 2e-4 + H2O = N2O5 + 2H+
试卷第 2页,共 5页
{#{QQABLYKUoggAAgAAAQgCQwHgCkKQkBEAAAoOQEAEoAIAAQFABAA=}#}
12 -.以 Fe3O4/Pd为催化材料,利用电化学原理实现用 H2消除酸性废水中 NO2 的目的,
其反应过程如图所示[已知 Fe3O4中 Fe元素化合价为+2、+3价,分别表示为 Fe(Ⅱ)、Fe(Ⅲ)]。
下列说法错误的是:( )
A.Fe(Ⅱ)与 Fe(Ⅲ)的相互转化起传递电子的作用
B.处理 NO -2 的电极反应式为:
2 NO -2 +6e-+4H -2O=N2↑+8OH
C.用该法处理后,水体的 pH升高
D.消耗标准状况下 6.72 L H2,理论上可处理含
NO -2 4.6 mg·L-1的废水 2m3
13.在一定体积的密闭容器中,进行如下化学反应:
CO2 (g) H2 (g) CO(g) H2O(l),其化学平衡常
t /℃ 70 80 83 100 120
数K 和温度 t的关系如下表所示:
下列说法正确的是:( ) K 0.6 0.9 1.0 1.7 2.6
A.70℃ 时该反应的化学平衡常数表达式为
c(CO) c H O
K 2
c CO2 c H2
B.该反应为放热反应
C.83℃ 时,若各物质的浓度符合如下关系:3c CO2 c H2 5c(CO),则此时
正 逆
D.83℃ 时,容器中的化学反应已达到平衡。在其他条件不变的情况下,扩大
容器的体积 c H2 将增大
14. 氢气和氟气反应生成氟化氢的过程中能量变化如图所
示。由图可知:( )
A.生成 1molHF 气体要吸收的热量为 270kJ
B.热化学方程式为:H2 + F2= 2HF H=-270 kJ/mol
C.该反应是放热反应
D.反应物的总能量小于生成物的总能量
15.一定温度下的恒容密闭容器中发生可逆反应N 2 g +3H2 g 2NH3 g ,不
能说明该反应一定达到平衡状态的是:( )
A.压强保持不变 B.N2的消耗速率和 H2的生成速率之比为1:3
C.N2、H2、NH3的物质的量之比为 1:3:2
D.NH3的百分含量保持不变
第 II 卷
二、非选择题(包括 3 大题,共 55 分)
16.(一)氨在国民经济中占有重要地位。已知:合成氨工业中,合成塔中每产生
2molNH3,放出 92.2 kJ热量。
(1)若起始时向容器内放入 2mol N2和 6mol H2,达平衡后放出的热量为 Q,则 Q(填
“>”、“<”或“=”)______184.4kJ.
(2)1molN-H 键断裂吸收的能量约等
于 kJ。
(二) (1)肼(N2H4)又称联氨,在常温下
试卷第 3页,共 5页
{#{QQABLYKUoggAAgAAAQgCQwHgCkKQkBEAAAoOQEAEoAIAAQFABAA=}#}
是一种可燃性的液体,可用作火箭燃料。已知在 101 kPa 时,32.0 g N2H4在氧气中
完全燃烧生成氮气和液态水,放出热量 624 kJ(25℃时),N2H4完全燃烧的热化学方
程式是
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是 20%~30%的 KOH 溶液。
该电池放电时:正极的电极反应式: ;负极的电极
反应式: 。
(3)右图是一个电解过程示意图。
①锌片上发生的电极反应式是: 。
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质
量变化为 128 g,则肼-空气燃料电池理论上消耗标准状况下的
空气 L(假设空气中氧气体积分数为 20%)。
17.铝作为一种应用广泛的金属,在电化学领域发挥着举足轻重的作用。回答下列
问题:
(1)某同学根据氧化还原反应:
2Al(s) 3Cu2 (aq)=2Al3 (aq) 3Cu(s)设计如
图所示的原电池:
① 电极 X的化学式为 ,电极 Y
的化学式为 。
②盐桥中的阴离子向 (填化学式)溶液中移
动。
(2)新型电池中的铝电池类型较多。
①Li Al/FeS是一种二次电池,可用于车载电源,其电池总反应为
2Li FeS Li2S Fe。放电时的正极反应式为 ,充电时,阴极的电极
反应式为 。
② Al 空气燃料电池可用作电动汽车的电源,该电池多使用NaOH溶液为电解液。
电池工作过程中电解液的pH (填“增大”“减小”或“不变”)。
③ 图为Al AgO电池的原理结构示意图,这种电池可用作水下动力电源。该电池
反应的化学方程式为2Al 3AgO 2NaOH 3H2O 2Na Al(OH)4 3Ag,当电极上析
出1.08 g Ag时,电路中转移的电子为 mol。
18.(一)羧基硫(COS)是一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。
在容积不变的密闭容器中,将 CO和 H2S混合加热并达到下列平衡:
CO(g)+H S(g) 2 COS(g)+H2 (g)
(1)若反应前 CO的物质的量为 10mol,达到平衡时 CO的物质的量为 8mol,且化学
平衡常数为 0.1,下列说法正确的是 (填字母)。
a.升高温度,H2S的浓度增大,表明该反应是吸热反应
b.通入 CO后,正反应速率逐渐增大
试卷第 4页,共 5页
{#{QQABLYKUoggAAgAAAQgCQwHgCkKQkBEAAAoOQEAEoAIAAQFABAA=}#}
c.反应前 H2S的物质的量为 7mol
d.达到平衡时 CO的转化率为 80%
(2)在不同温度下达到化学平衡时,H2S的转
化率如图所示,则该反应是 反应
(填“吸热”或“放热”)。
(3)在某温度下,向 1L的密闭容器中通入
10molCO和 10molH2S,平衡时测得 CO的转
化率为 40%,则该温度下反应的平衡常数
为 。
(二)实验室测定中和热的步骤如下(如图)
第一步:量取 40.0mL0.25mol/LH2SO4溶液倒入小烧杯中,测
量温度;
第二步:量取 40.0mL0.55mol/LNaOH 溶液,测量温度;
第三步:将 NaOH溶液倒入小烧杯中,混合均匀后测量混合
液温度。
请回答:
(1)图中仪器 A的名称是 。
(2)若实验中若改用 60mL 0.50mol/L的盐酸与 50mL 0.55mol/L的氢氧化钠溶液进行反应,
与上述实验相比,所放出的热量 (填“相等”“不相等”),若实验操作均正确,则所
求中和热 (填“相等”“不相等”)。
(三)电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛.
(1)图 1 中,为了减缓海水对钢闸门 A的腐蚀,材料 B 可以选择 (填字母序号).
a.碳棒 b.锌板 c.铜板
该电化学保护方法的名称是 。
(2)图 2 中,钢闸门 C为 极,用氯化钠溶液模拟海水进行实验,D为石墨块,
总反应的离子方程式为_________________________.
(3)有关上述实验,下列说法正确的是 。
A.溶液中 Na+向 D 极移动
B.从 D 极处逸出的气体能使湿润的 KI 淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
试卷第 5页,共 5页
{#{QQABLYKUoggAAgAAAQgCQwHgCkKQkBEAAAoOQEAEoAIAAQFABAA=}#}
永安三中高中校2023-2024 学年高二(上)10 月月考
化学试卷参考答案
1.B 2.C 3.A 4.C 5.B 6.D 7.C 8.C 9.B 10.B
11.B 12.B 13.C 14.C 15.C
16.共 18 分
(一)(1)< (2)391(每空两分,共 4分)
-1
(二) (1)N2H4(l)+O2(g)===N2(g)+2H2O(l) ΔH = -624 kJ·mol ;
- - - -
(2)O2 + 2H2O + 4e ===4OH N2H4+4OH -4e ═4H2O+N2↑
2+ -
(3)Cu +2e =Cu 112(本空两分)
(热化学方程每空 3分,电极式每空 3分)
17. 共 16 分(每空两分,电极式每空 3分)
Cu Al Al 2 SO4 3 2Li FeS 2e =Li2S Fe 2Li 2e =2Li 减小 0.02
18.共 21 分
4
(一)(1)c (2)放热 (3) (每空两分,共 6分)
9
(二)(1)环形玻璃搅拌棒 (2)不相等 相等(每空两分,共4分)
(三)(1)b;牺牲阳极的阴极保护法;
- -
(2)阴极 2Cl +2H2O H2↑+Cl2↑+2OH (3)B
(每空两分,电极式每空 3分,共 11 分)
答案第 1页,共 1页
{#{QQABLYKUoggAAgAAAQgCQwHgCkKQkBEAAAoOQEAEoAIAAQFABAA=}#}
同课章节目录
