3.2水的电离和溶液的PH (含解析)同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2水的电离和溶液的PH (含解析)同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |
|
|
| 格式 | docx | ||
| 文件大小 | 251.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-24 14:08:58 | ||
图片预览

文档简介
3.2水的电离和溶液的PH同步练习题
一、选择题
1.常温下,下列各组离子在指定条件下可能大量共存的是
A.含有的溶液中:、、、
B.的溶液中:、、、
C.水电离出的的溶液中:、、、
D.的溶液中:、、、
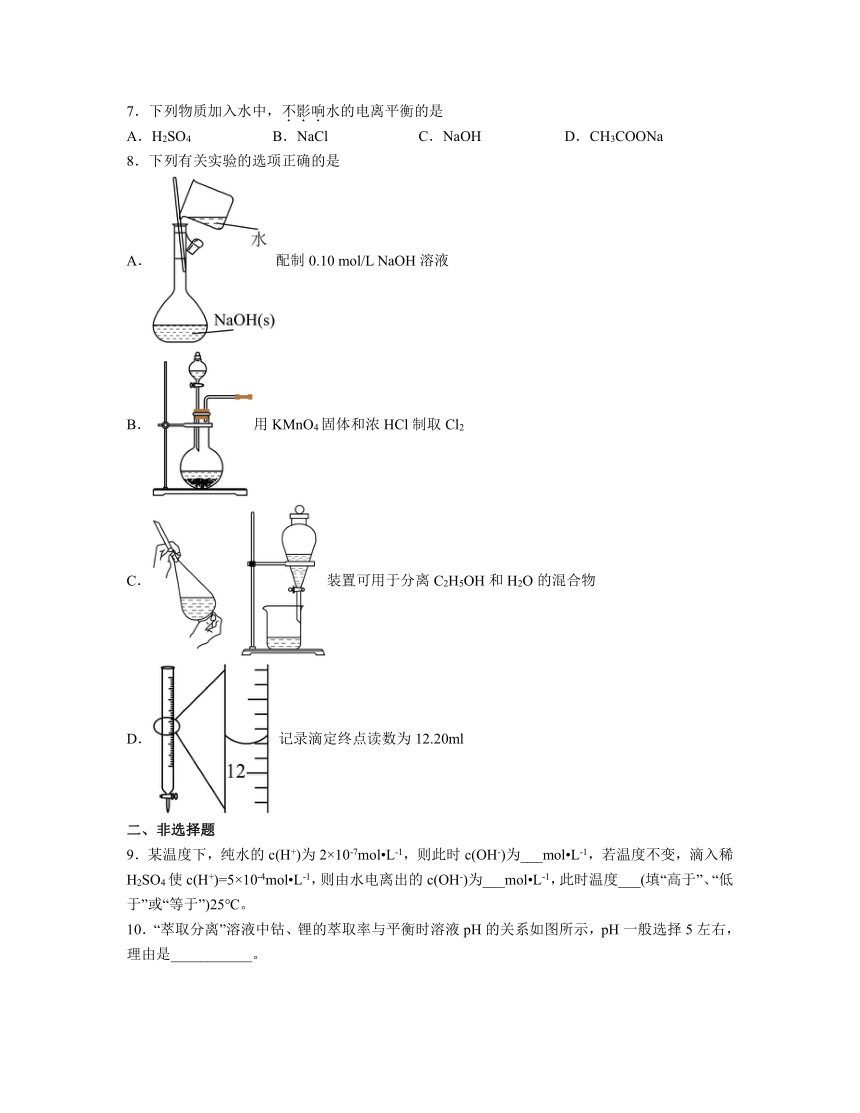
2.中和热测定实验中不使用的仪器是
A.温度计 B.环形玻璃搅拌棒 C.量筒 D.容量瓶
3.常温下,将pH=3的CH3COOH溶液与pH=11的NaOH溶液按一定体积混合,混合后溶液pH=7,混合后溶液体积等于酸碱体积之和,则CH3COOH溶液体积与NaOH溶液体积的关系为
A.小于 B.等于 C.大于 D.无法判断
4.下列实验操作设计正确且能达到实验目的的是
A.演示喷泉实验 B.滴定实验中用标准碱液滴定盐酸接近滴定终点的操作 C.测稀硫酸的 D.制备氨水
A.A B.B C.C D.D
5.关于pH的测定下列说法正确的是
A.pH试纸在使用之前应用蒸馏水润湿
B.用广泛pH试纸测得某盐酸的pH=2.3
C.利用酸碱指示剂可以测溶液的pH
D.pH计是精确测定溶液pH的仪器
6.下列仪器使用前不需检验是否漏水的有
A.锥形瓶 B.分液漏斗 C.滴定管 D.容量瓶
7.下列物质加入水中,不影响水的电离平衡的是
A.H2SO4 B.NaCl C.NaOH D.CH3COONa
8.下列有关实验的选项正确的是
A.配制0.10 mol/L NaOH溶液
B.用KMnO4固体和浓HCl制取Cl2
C.装置可用于分离C2H5OH和H2O的混合物
D. 记录滴定终点读数为12.20ml
二、非选择题
9.某温度下,纯水的c(H+)为2×10-7mol L-1,则此时c(OH-)为___mol L-1,若温度不变,滴入稀H2SO4使c(H+)=5×10-4mol L-1,则由水电离出的c(OH-)为___mol L-1,此时温度___(填“高于”、“低于”或“等于”)25℃。
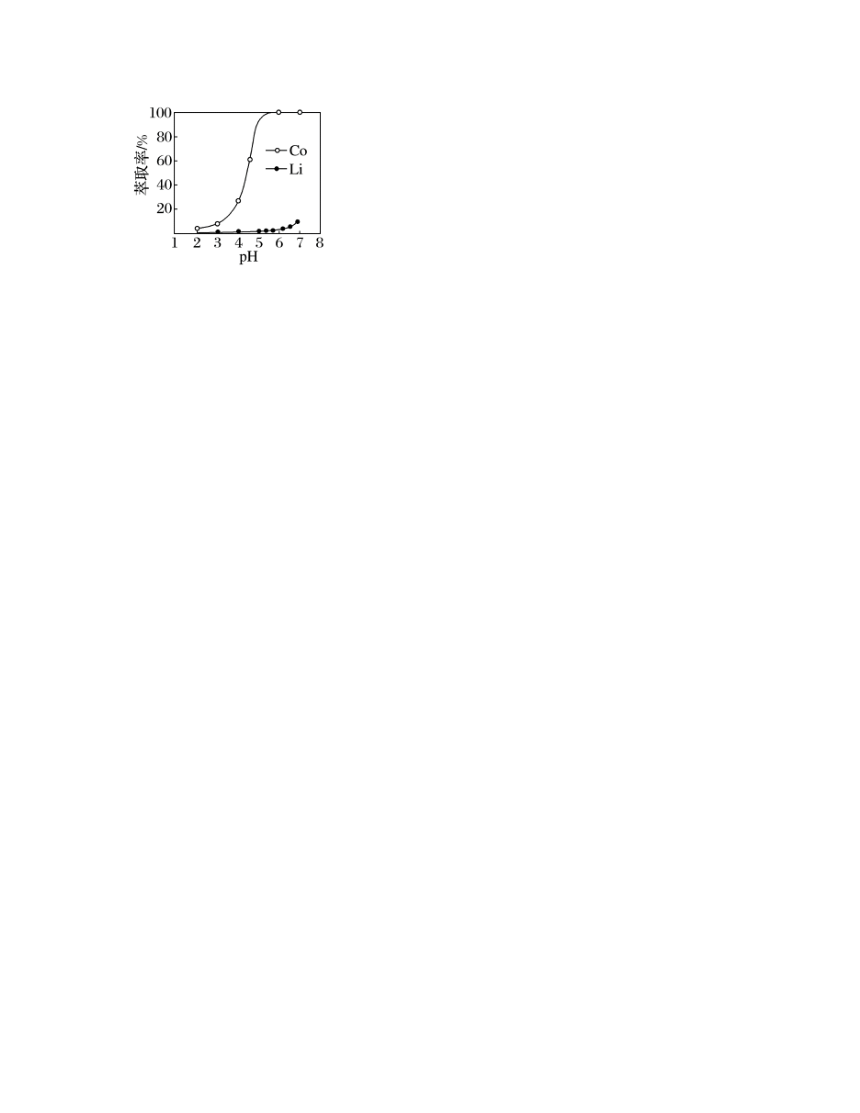
10.“萃取分离”溶液中钴、锂的萃取率与平衡时溶液pH的关系如图所示,pH一般选择5左右,理由是___________。
【参考答案】
一、选择题
1.B
解析:A.Al3+为弱碱的阳离子,能发生水解:,使溶液呈酸性,也能发生水解:,使溶液呈碱性,两个水解过程能相互促进,因此溶液中有时,不能大量共存,A错误;
B.pH=6.5,溶液为酸性,选项中离子均能大量共存,B正确;
C.常温下,水电离出的时,表示水的电离被抑制,溶液显酸性或碱性,酸性时,不能大量共存,碱性时,不能大量共存,C错误;
D.,表明,溶液显酸性。酸性条件下,能氧化,两者不能大量共存,D错误;
故选B。
2.D
解析:中和热测定实验中需使用的仪器包括温度计、烧杯、量筒、环形玻璃搅拌器\隔热器材等,而不需要使用容量瓶,容量瓶是准确配制一定体积、一定物质的量浓度溶液的仪器,故合理选项是D。
3.A
解析:CH3COOH为弱酸部分电离,pH=3的CH3COOH溶液与pH=11的NaOH溶液,CH3COOH溶液的浓度远远大于NaOH溶液的浓度,若等体积混合,所得溶液显酸性;若想让混合后溶液pH=7,则醋酸溶液的体积应小于氢氧化钠溶液的体积,故选A。
4.B
解析:A.NO不溶于水,也不与氢氧化钠溶液反应,不能形成喷泉,A项不符合题意;
B.标准碱液滴定盐酸,用适量蒸馏水冲洗锥形瓶内壁可以保证酸碱完全中和,操作正确,B项符合题意;
C.用试纸测溶液的方法为将试纸放在干燥洁净的玻璃片上,用干燥洁净的玻璃棒蘸取溶液点在试纸上,与标准比色卡对比,C项不符合题意;
D.由于氨气极易溶于水,导管直接伸入水中容易发生倒吸,D项不符合题意;
答案选B。
5.D
解析:A、pH试纸在使用之前用蒸馏水润湿,测定溶液pH会稀释溶液浓度,测定结果可能会产生误差,选项A错误;
B、广泛pH试纸是粗略测定溶液酸碱性,测定数值为整数,不能为小数,选项B错误;
C、酸碱指示剂只能测定溶液酸碱性和溶液pH范围,不能测定溶液pH,选项C错误;
D、pH计是精确测定溶液pH的仪器,用于测定溶液pH,选项D正确。
答案选D。
6.A
解析:在高中阶段常见仪器需要检漏的有:分液漏斗、容量瓶、酸式滴定管和碱式滴定管,综上所述,A符合题意。
故选A。
7.B
解析:A.H2SO4相当于增大氢离子浓度,抑制水的电离,A不选;
B.NaCl对水的电离不影响,B选;
C.NaOH相当于增大氢氧根离子浓度,抑制水的电离,C不选;
D.CH3COONa电离的CH3COO-与水电离的H+结合,促进水的电离,D不选;
故选:B。
8.B
解析:A. 不能用容量瓶直接溶解氢氧化钠固体,应先在烧杯中溶解,并冷却至室温后,再转移至容量瓶中,A项错误;
B. 可以用KMnO4固体和浓HCl制取Cl2,该反应为固液不加热制取气体,该装置正确,B项正确;
C. 乙醇与水互溶,不能用分液的方法进行分离,应用蒸馏的方法,C项错误;
D. 滴定管的刻度为上小下大,该刻度应为11.80mL,D项错误;
答案选B。
二、非选择题
9. 2×10-7 8×10-11 高于
解析:某温度下,纯水的c(H+)为2×10-7mol L-1,由于纯水显中性,氢离子浓度等于氢氧根离子浓度,则此时c(OH-)为2×10-7mol L-1,该温度下水的离子积常数是2×10-7×2×10-7=4×10-14>1×10-14,所以此时温度高于25℃。若温度不变,滴入稀H2SO4使c(H+)=5×10-4mol L-1,则溶液中氢氧根离子浓度是,硫酸抑制水的电离,因此由水电离出的c(OH-)就是溶液中的氢氧根离子,为8×10-11mol L-1。
10.pH在5左右时,钴、锂的分离效率高
解析:由题干图示信息可知,pH2~5,随pH得增加,萃取率在增加,当pH达到5左右时,萃取率很高了,接近100%,而若pH再增加,萃取锂的含量将增加,萃取的钴纯度下降,故pH一般选择5左右进行萃取实验,故答案为:pH在5左右时,钴、锂的分离效率高
一、选择题
1.常温下,下列各组离子在指定条件下可能大量共存的是
A.含有的溶液中:、、、
B.的溶液中:、、、
C.水电离出的的溶液中:、、、
D.的溶液中:、、、
2.中和热测定实验中不使用的仪器是
A.温度计 B.环形玻璃搅拌棒 C.量筒 D.容量瓶
3.常温下,将pH=3的CH3COOH溶液与pH=11的NaOH溶液按一定体积混合,混合后溶液pH=7,混合后溶液体积等于酸碱体积之和,则CH3COOH溶液体积与NaOH溶液体积的关系为
A.小于 B.等于 C.大于 D.无法判断
4.下列实验操作设计正确且能达到实验目的的是
A.演示喷泉实验 B.滴定实验中用标准碱液滴定盐酸接近滴定终点的操作 C.测稀硫酸的 D.制备氨水
A.A B.B C.C D.D
5.关于pH的测定下列说法正确的是
A.pH试纸在使用之前应用蒸馏水润湿
B.用广泛pH试纸测得某盐酸的pH=2.3
C.利用酸碱指示剂可以测溶液的pH
D.pH计是精确测定溶液pH的仪器
6.下列仪器使用前不需检验是否漏水的有
A.锥形瓶 B.分液漏斗 C.滴定管 D.容量瓶
7.下列物质加入水中,不影响水的电离平衡的是
A.H2SO4 B.NaCl C.NaOH D.CH3COONa
8.下列有关实验的选项正确的是
A.配制0.10 mol/L NaOH溶液
B.用KMnO4固体和浓HCl制取Cl2
C.装置可用于分离C2H5OH和H2O的混合物
D. 记录滴定终点读数为12.20ml
二、非选择题
9.某温度下,纯水的c(H+)为2×10-7mol L-1,则此时c(OH-)为___mol L-1,若温度不变,滴入稀H2SO4使c(H+)=5×10-4mol L-1,则由水电离出的c(OH-)为___mol L-1,此时温度___(填“高于”、“低于”或“等于”)25℃。
10.“萃取分离”溶液中钴、锂的萃取率与平衡时溶液pH的关系如图所示,pH一般选择5左右,理由是___________。
【参考答案】
一、选择题
1.B
解析:A.Al3+为弱碱的阳离子,能发生水解:,使溶液呈酸性,也能发生水解:,使溶液呈碱性,两个水解过程能相互促进,因此溶液中有时,不能大量共存,A错误;
B.pH=6.5,溶液为酸性,选项中离子均能大量共存,B正确;
C.常温下,水电离出的时,表示水的电离被抑制,溶液显酸性或碱性,酸性时,不能大量共存,碱性时,不能大量共存,C错误;
D.,表明,溶液显酸性。酸性条件下,能氧化,两者不能大量共存,D错误;
故选B。
2.D
解析:中和热测定实验中需使用的仪器包括温度计、烧杯、量筒、环形玻璃搅拌器\隔热器材等,而不需要使用容量瓶,容量瓶是准确配制一定体积、一定物质的量浓度溶液的仪器,故合理选项是D。
3.A
解析:CH3COOH为弱酸部分电离,pH=3的CH3COOH溶液与pH=11的NaOH溶液,CH3COOH溶液的浓度远远大于NaOH溶液的浓度,若等体积混合,所得溶液显酸性;若想让混合后溶液pH=7,则醋酸溶液的体积应小于氢氧化钠溶液的体积,故选A。
4.B
解析:A.NO不溶于水,也不与氢氧化钠溶液反应,不能形成喷泉,A项不符合题意;
B.标准碱液滴定盐酸,用适量蒸馏水冲洗锥形瓶内壁可以保证酸碱完全中和,操作正确,B项符合题意;
C.用试纸测溶液的方法为将试纸放在干燥洁净的玻璃片上,用干燥洁净的玻璃棒蘸取溶液点在试纸上,与标准比色卡对比,C项不符合题意;
D.由于氨气极易溶于水,导管直接伸入水中容易发生倒吸,D项不符合题意;
答案选B。
5.D
解析:A、pH试纸在使用之前用蒸馏水润湿,测定溶液pH会稀释溶液浓度,测定结果可能会产生误差,选项A错误;
B、广泛pH试纸是粗略测定溶液酸碱性,测定数值为整数,不能为小数,选项B错误;
C、酸碱指示剂只能测定溶液酸碱性和溶液pH范围,不能测定溶液pH,选项C错误;
D、pH计是精确测定溶液pH的仪器,用于测定溶液pH,选项D正确。
答案选D。
6.A
解析:在高中阶段常见仪器需要检漏的有:分液漏斗、容量瓶、酸式滴定管和碱式滴定管,综上所述,A符合题意。
故选A。
7.B
解析:A.H2SO4相当于增大氢离子浓度,抑制水的电离,A不选;
B.NaCl对水的电离不影响,B选;
C.NaOH相当于增大氢氧根离子浓度,抑制水的电离,C不选;
D.CH3COONa电离的CH3COO-与水电离的H+结合,促进水的电离,D不选;
故选:B。
8.B
解析:A. 不能用容量瓶直接溶解氢氧化钠固体,应先在烧杯中溶解,并冷却至室温后,再转移至容量瓶中,A项错误;
B. 可以用KMnO4固体和浓HCl制取Cl2,该反应为固液不加热制取气体,该装置正确,B项正确;
C. 乙醇与水互溶,不能用分液的方法进行分离,应用蒸馏的方法,C项错误;
D. 滴定管的刻度为上小下大,该刻度应为11.80mL,D项错误;
答案选B。
二、非选择题
9. 2×10-7 8×10-11 高于
解析:某温度下,纯水的c(H+)为2×10-7mol L-1,由于纯水显中性,氢离子浓度等于氢氧根离子浓度,则此时c(OH-)为2×10-7mol L-1,该温度下水的离子积常数是2×10-7×2×10-7=4×10-14>1×10-14,所以此时温度高于25℃。若温度不变,滴入稀H2SO4使c(H+)=5×10-4mol L-1,则溶液中氢氧根离子浓度是,硫酸抑制水的电离,因此由水电离出的c(OH-)就是溶液中的氢氧根离子,为8×10-11mol L-1。
10.pH在5左右时,钴、锂的分离效率高
解析:由题干图示信息可知,pH2~5,随pH得增加,萃取率在增加,当pH达到5左右时,萃取率很高了,接近100%,而若pH再增加,萃取锂的含量将增加,萃取的钴纯度下降,故pH一般选择5左右进行萃取实验,故答案为:pH在5左右时,钴、锂的分离效率高
