4.2 元素周期律(含解析) 同步练习题 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.2 元素周期律(含解析) 同步练习题 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 263.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-24 14:12:03 | ||
图片预览



文档简介
4.2 元素周期律 同步练习题
一、选择题
1.X、Y、Z都是短周期元素,其中X、Y两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,Z元素原子K层和M层电子数之和与L层的电子数相同。下列判断正确的是
A.元素Y可分别与X、Z各形成两种常见二元化合物
B.元素Z在自然界中只有化合态,没有游离态
C.非金属性:
D.Z元素最高价氧化物对应水化物的化学式为
2.一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是
A.该化合物中,W、X、Y之间均为极性共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高价氧化物的水化物与Y的氢化物可发生反应
D.X的氟化物XF3中X原子不是8电子稳定结构
3.下列说法正确的是
A.1H2和2H2互为同素异形体 B.H、D、T是同种元素的三种核素
C.C60和C70互为同位素 D.X和X是同种元素的不同原子
4.下列有关物质性质的比较,错误的是
A.金属性:Mg>Al B.稳定性:HF>HCl
C.氧化性:O2>S D.酸性:H2SO4>HClO4
5.某元素原子的M层电子数是K层电子数的3倍,则该元素在元素周期表中的位置为
A.第二周期VIA族 B.第二周期VA族
C.第三周期VIA族 D.第三周期VIIA族
6.下列比较正确的是
A.原子半径: Cl > S B.碱性:Mg(OH)2>Ca(OH)2
C.稳定性:AsH3 > PH3 D.非金属性:O>P
7.下列说法正确的是
A.有单质生成的化学反应一定是氧化还原反应
B.溶于水,在通电条件下电离成Na+和Cl-
C.和由相同种类的元素组成,互为同素异形体
D.随着原子序数递增,碱金属单质的熔点、沸点依次降低
8.下列粒子半径大小的比较正确的是
A.r(Na+)<r(Mg2+)<r(Al3+)<r(O2-) B.r(S2-)>r(Cl-)>r(Na+)>r(Al3+)
C.r(Na)<r(Mg)<r(Al)<r(S) D.r(Cs)<r(Rb)<r(K)<r(Na)
二、非选择题
9.指出下列反应的氧化剂和还原剂
(1)2H2+O2=2H2O:氧化剂 ;还原剂 。
(2)4P+5O2=2P2O5:氧化剂 ;还原剂 。
(3)Fe+H2SO4=FeSO4+H2:氧化剂 ;还原剂 。
(4)WO3+3H2=W+3H2O:氧化剂 ;还原剂 。
(5)已知与属于两性氢氧化物,写出分别溶于溶液、盐酸的化学方程式: 、 。
10.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。
族 周期 IA IIA IIIA IVA VA VIA VIIA 0
2 ⑤ ⑥
3 ① ③ ④ ⑦ ⑨
4 ② ⑧
请回答:
(1)这九种元素分别是① (填元素符号,下同)、② 、③ 、④ 、⑤ 、⑥ 其中化学性质最不活泼的是 。
(2)在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是 (填化学式)。
(3)①、②、③三种元素按原子半径由大到小的顺序依次为 (填元素符号)。
(4)⑥元素的氢化物是 (填化学式),该氢化物在常温下与②发生反应的化学方程式为 ,所得溶液呈 性。
11.W、X、Y、Z是短周期元素,其部分性质如表:
W 单质是淡黄色固体
X 在地壳中的含量居第二位
Y 原子最外层电子数是电子总数的
Z 第三周期简单离子半径最小
(1)X的简单氢化物的结构式 ,Y和W形成的化合物YW2的电子式 。
(2)元素Z在周期表中的位置 。
(3)比较X、Y最高价氧化物对应的水化物的酸性: > (填化学式)。
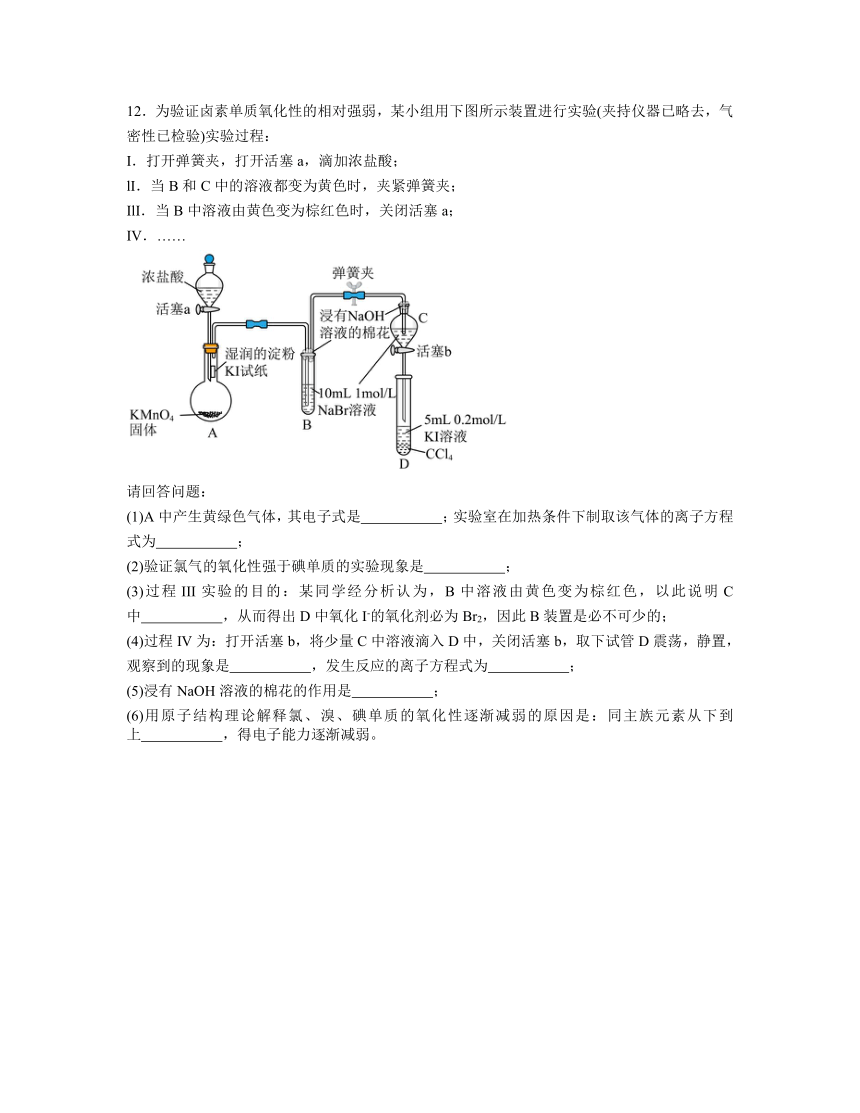
12.为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸;
lI.当B和C中的溶液都变为黄色时,夹紧弹簧夹;
IlI.当B中溶液由黄色变为棕红色时,关闭活塞a;
IV.……
请回答问题:
(1)A中产生黄绿色气体,其电子式是 ;实验室在加热条件下制取该气体的离子方程式为 ;
(2)验证氯气的氧化性强于碘单质的实验现象是 ;
(3)过程III实验的目的:某同学经分析认为,B中溶液由黄色变为棕红色,以此说明C中 ,从而得出D中氧化I-的氧化剂必为Br2,因此B装置是必不可少的;
(4)过程IV为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下试管D震荡,静置,观察到的现象是 ,发生反应的离子方程式为 ;
(5)浸有NaOH溶液的棉花的作用是 ;
(6)用原子结构理论解释氯、溴、碘单质的氧化性逐渐减弱的原因是:同主族元素从下到上 ,得电子能力逐渐减弱。
【参考答案】
一、选择题
1.A
【分析】X、Y属于短周期元素,两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,推出X为碳,Y为氧,Z元素原子K层和M层电子数之和与L层的电子数相同,推出Z为硫元素。
解析:A.氧元素与碳元素可形成、,氧元素与硫元素可形成、,故A正确;
B.自然界中的硫元素既有游离态,又有化合态,故B错误;
C.同周期元素从左到右非金属性增强,同主族元素从上到下非金属性减弱,非金属性:,故C错误;
D.硫元素的最高价含氧酸的化学式为,故D错误;
选A。
2.A
【分析】根据结构可得,Z可能为Li或Na,W为H或F或Cl,Y为N或P,W、X、Y、Z的原子序数依次增大,故W为H,Y为N,Z为Na,结合题给信息“W、X、Y、Z的原子序数依次增大、且总和为24”可推知,X为B,综上,W为H,X为B,Y为N,Z为Na,以此分析;
解析:A.Y与Y之间形成的化学键均为非极性共价键,A错误;
B.Na既可以与水反应,也可以和甲醇反应,B正确;
C.N的最高价氧化物对应的水化物为硝酸,氢化物是NH3,C正确;
D.三氟化硼中硼原子最外层有3个电子,与氟原子之间形成3个共价键,即最外层共6个电子,不满足8电子稳定结构,D正确;
故答案为:A。
3.B
解析:A.同种元素构成的不同单质是同素异形体,1H2和2H2都是氢气,是同种物质,A项错误;
B.H、D、T分别是氕、氘、氚,是氢的三种核素,B项正确;
C.含有相同质子数的原子互为同位素,C60和C70是两种不同的分子,是同素异形体,C项错误;
D.X和X的质子数不同,是不同元素,D项错误。
答案为B。
4.D
解析:A.同周期元素,从左到右元素的金属性依次减弱,则镁元素的金属性强于铝元素,故A正确;
B.同主族元素,从上到下元素的非金属性依次减弱,氢化物的稳定性依次减弱,则氟化氢的稳定性强于氯化氢,故B正确;
C.同主族元素,从上到下元素的非金属性依次减弱,单质的氧化性依次减弱,则氧气的氧化性强于硫单质,故C正确;
D.同周期元素,从左到右元素的非金属性依次增强,则硫酸的酸性弱于高氯酸,故D错误;
故选D。
5.C
解析:某元素原子的M层电子数是K层电子数的3倍,其核外电子排布应为K层为2个电子,L层为8个电子,M层为6个电子,应为硫元素,在周期表中位置第三周期VIA族。
故选C。
6.D
解析:A.同一周期从左到右,元素原子半径逐渐减小,则半径:ClB.金属性:Ca>Mg,元素的金属性越强,对应最高价氧化物的水化物的碱性越强,则碱性:Ca(OH)2> Mg(OH)2,B错误;
C.非金属性:P>As,元素的非金属性越强,对应的氢化物稳定性越强,则稳定性:PH3> AsH3,C错误;
D.同周期从左到右,金属性减弱,非金属性变强;同主族由上而下,金属性增强,非金属性变弱;非金属性:O>P,故D正确;
故选D。
7.D
解析:A.有单质生成的化学反应不一定是氧化还原反应,如同素异形体之间的转化有单质生成,不是氧化还原反应,故A错误;
B.溶于水,在水分子作用下电离出Na+和Cl-,不需要通电,故B错误;
C.同素异形体是同种元素组成的不同单质之间的关系,和不是单质,故C错误;
D.碱金属单质随着原子序数递增,半径增大,金属键减弱,熔沸点依次降低,故D正确;
答案D。
8.B
解析:A.电子层数相同,原子序数越大,半径越小,所以r(Al3+)<r(Mg2+)<r(Na+)<r(O2-),A错误;
B.电子层数相同,原子序数越大,半径越小,所以:r(S2-)>r(Cl-),r(Na+)>r(Al3+),电子层数不相同,电子层数越多,半径越大,所以微粒半径大小关系为:r(S2-)>r(Cl-)>r(Na+)>r(Al3+),B正确;
C.同周期随着原子序数的增大半径减小,所以:r(S)<r(Al)<r(Mg)<r(Na),C错误;
D.同主族随着原子序数的增大半径增大:r(Cs)>r(Rb)>r(K)>r(Na),D错误;
答案为B。
二、非选择题
9.(1) O2 H2
(2) O2 P
(3) H2SO4 Fe
(4) WO3 H2
(5)
解析:(1)2H2+O2=2H2O中,O元素化合价降低,O2作氧化剂;H元素化合价升高,H2作还原剂。
(2)4P+5O2=2P2O5中,O元素化合价降低,O2作氧化剂;P元素化合价升高,P作还原剂。
(3)Fe+H2SO4=FeSO4+H2中,H元素化合价降低,H2SO4作氧化剂;Fe元素化合价升高,Fe作还原剂。
(4)WO3+3H2=W+3H2O中,W元素化合价降低,WO3作氧化剂;H元素化合价升高,H2作还原剂。
(5)与属于两性氢氧化物,则和溶液反应生成和水,反应的化学方程式为;和盐酸发生酸碱中和反应,反应的化学方程式为。
10.(1) Na K Mg Al C O Ar
(2)KOH
(3)K>Na>Mg
(4) H2O 2K+2H2O=2KOH+H2↑ 碱性
【分析】根据元素在周期表中的位置,①是Na元素;②是K元素;③是Mg元素;④是Al元素;⑤是C元素;⑥是O元素;⑦是Cl元素;⑧是Br元素;⑨是Ar元素;
解析:(1)根据以上分析,这九种元素中①是Na元素;②是K元素;③是Mg元素;④是Al元素;⑤是C元素;⑥是O元素;其中Ar原子最外层有8个电子,结构稳定,化学性质最不活泼的是Ar。
(2)同主族元素从上到下金属性增强,同周期元素从左到右金属性减弱,Na、K、Mg三种元素中K的金属性最强,所以氧化物对应的水化物中,碱性最强的是KOH。
(3)同主族元素从上到下半径依次增大,同周期元素从左到右半径依次减小,Na、K、Mg三种元素按原子半径由大到小的顺序依次为K>Na>Mg。
(4)⑥是O元素,其氢化物是H2O,H2O在常温下与K发生反应生成氢氧化钾和氢气,化学方程式为2K+2H2O=2KOH+H2↑,所得溶液呈碱性。
11.(1)
(2)第三周期ⅢA族
(3) H2CO3 H2SiO3(或H4SiO4)
【分析】根据题给信息知,W单质是淡黄色固体,则W为S元素;X在地壳中的含量居第二位,则X为Si元素;Y原子最外层电子数是电子总数的2/3,则Y为C元素;Z是第三周期原子半径最小的金属,则Z为Al元素。
解析:(1)X为Si,简单氢化物的结构式,Y和W形成的化合物YW2为CS2,电子式;
(2)元素Z为Al,在周期表中的位置为第三周期ⅢA族;
(3)X、Y最高价氧化物对应的水化物分别为H2CO3、H2SiO3,酸性H2CO3>H2SiO3。
12.(1) MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
(2)湿润的淀粉KI试纸变蓝
(3)Br-过量,溶液中没有Cl2
(4) CC14层溶液变为紫(或紫红)色 Br2+2I-=I2+2Br-
(5)吸收Cl2,防止污染空气
(6)电子层数依次增多,原子半径逐渐增大,元素的非金属性逐渐减弱
【分析】A中滴加浓盐酸后,发生反应:2KMnO4+16HC1(浓)=2KC1+2MnCl2+5Cl2↑+8H2O,生成黄绿色气体Cl2,在B、C、D中分别发生反应:Cl2+2NaBr=2NaCl+Br2,Cl2+2NaOH=NaCl+NaClO、Br2+2NaOH=NaCl+NaBrO,NaBrO+2KI+H2O=NaVr+I2+2KOH、NaClO+2KI+H2O=NaCl+I2+2KOH,由于B、C中生成了Br2而使溶液变为黄色,打开活塞b,C中生成的Br2,在D中发生反应:Br2+2KI=2KBr+I2,过程II实验,当B中黄色溶液继续通入过量C12时,溶液变为红棕色,以此为对照,说明C中黄色溶液无Cl2,从而排除Cl2对溴置换碘实验的干扰,据此答题。
解析:(1)A中产生黄绿色气体为氯气,氯原子间形成1对共用电子对,电子式为: ;实验室用二氧化锰和浓盐酸在加热条件下制取氯气的离子方程式为:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O。
(2)因C12的氧化性大于I2的氧化性,可发生反应:C12+2I-=I2+2C1-,I2能使淀粉变蓝,故答案为:湿润的淀粉KI试纸变蓝。
(3)B中溶液由黄色变为棕红色,说明生成了Br2,发生反应的化学方程式为Cl2+2NaBr=2NaCl+Br2,以此说明C中Br-过量,溶液中没有Cl2,从而得出D中氧化I-的氧化剂必为Br2。
(4)打开活塞b,将少量C中溶液滴入D中,发生反应:Br2+2I-=I2+2Br-,关闭活塞b,取下D震荡,静至后CC14层溶液变为紫(或紫红)色。
(5)Cl2有毒,浸有NaOH溶液的棉花的作用是:吸收Cl2,防止污染空气。
(6)因同一主族元素,从上到下,电子层数依次增多,原子半径逐渐增大,元素的非金属性逐渐减弱,得电子能力逐渐减弱
一、选择题
1.X、Y、Z都是短周期元素,其中X、Y两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,Z元素原子K层和M层电子数之和与L层的电子数相同。下列判断正确的是
A.元素Y可分别与X、Z各形成两种常见二元化合物
B.元素Z在自然界中只有化合态,没有游离态
C.非金属性:
D.Z元素最高价氧化物对应水化物的化学式为
2.一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是
A.该化合物中,W、X、Y之间均为极性共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高价氧化物的水化物与Y的氢化物可发生反应
D.X的氟化物XF3中X原子不是8电子稳定结构
3.下列说法正确的是
A.1H2和2H2互为同素异形体 B.H、D、T是同种元素的三种核素
C.C60和C70互为同位素 D.X和X是同种元素的不同原子
4.下列有关物质性质的比较,错误的是
A.金属性:Mg>Al B.稳定性:HF>HCl
C.氧化性:O2>S D.酸性:H2SO4>HClO4
5.某元素原子的M层电子数是K层电子数的3倍,则该元素在元素周期表中的位置为
A.第二周期VIA族 B.第二周期VA族
C.第三周期VIA族 D.第三周期VIIA族
6.下列比较正确的是
A.原子半径: Cl > S B.碱性:Mg(OH)2>Ca(OH)2
C.稳定性:AsH3 > PH3 D.非金属性:O>P
7.下列说法正确的是
A.有单质生成的化学反应一定是氧化还原反应
B.溶于水,在通电条件下电离成Na+和Cl-
C.和由相同种类的元素组成,互为同素异形体
D.随着原子序数递增,碱金属单质的熔点、沸点依次降低
8.下列粒子半径大小的比较正确的是
A.r(Na+)<r(Mg2+)<r(Al3+)<r(O2-) B.r(S2-)>r(Cl-)>r(Na+)>r(Al3+)
C.r(Na)<r(Mg)<r(Al)<r(S) D.r(Cs)<r(Rb)<r(K)<r(Na)
二、非选择题
9.指出下列反应的氧化剂和还原剂
(1)2H2+O2=2H2O:氧化剂 ;还原剂 。
(2)4P+5O2=2P2O5:氧化剂 ;还原剂 。
(3)Fe+H2SO4=FeSO4+H2:氧化剂 ;还原剂 。
(4)WO3+3H2=W+3H2O:氧化剂 ;还原剂 。
(5)已知与属于两性氢氧化物,写出分别溶于溶液、盐酸的化学方程式: 、 。
10.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。
族 周期 IA IIA IIIA IVA VA VIA VIIA 0
2 ⑤ ⑥
3 ① ③ ④ ⑦ ⑨
4 ② ⑧
请回答:
(1)这九种元素分别是① (填元素符号,下同)、② 、③ 、④ 、⑤ 、⑥ 其中化学性质最不活泼的是 。
(2)在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是 (填化学式)。
(3)①、②、③三种元素按原子半径由大到小的顺序依次为 (填元素符号)。
(4)⑥元素的氢化物是 (填化学式),该氢化物在常温下与②发生反应的化学方程式为 ,所得溶液呈 性。
11.W、X、Y、Z是短周期元素,其部分性质如表:
W 单质是淡黄色固体
X 在地壳中的含量居第二位
Y 原子最外层电子数是电子总数的
Z 第三周期简单离子半径最小
(1)X的简单氢化物的结构式 ,Y和W形成的化合物YW2的电子式 。
(2)元素Z在周期表中的位置 。
(3)比较X、Y最高价氧化物对应的水化物的酸性: > (填化学式)。
12.为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸;
lI.当B和C中的溶液都变为黄色时,夹紧弹簧夹;
IlI.当B中溶液由黄色变为棕红色时,关闭活塞a;
IV.……
请回答问题:
(1)A中产生黄绿色气体,其电子式是 ;实验室在加热条件下制取该气体的离子方程式为 ;
(2)验证氯气的氧化性强于碘单质的实验现象是 ;
(3)过程III实验的目的:某同学经分析认为,B中溶液由黄色变为棕红色,以此说明C中 ,从而得出D中氧化I-的氧化剂必为Br2,因此B装置是必不可少的;
(4)过程IV为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下试管D震荡,静置,观察到的现象是 ,发生反应的离子方程式为 ;
(5)浸有NaOH溶液的棉花的作用是 ;
(6)用原子结构理论解释氯、溴、碘单质的氧化性逐渐减弱的原因是:同主族元素从下到上 ,得电子能力逐渐减弱。
【参考答案】
一、选择题
1.A
【分析】X、Y属于短周期元素,两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,推出X为碳,Y为氧,Z元素原子K层和M层电子数之和与L层的电子数相同,推出Z为硫元素。
解析:A.氧元素与碳元素可形成、,氧元素与硫元素可形成、,故A正确;
B.自然界中的硫元素既有游离态,又有化合态,故B错误;
C.同周期元素从左到右非金属性增强,同主族元素从上到下非金属性减弱,非金属性:,故C错误;
D.硫元素的最高价含氧酸的化学式为,故D错误;
选A。
2.A
【分析】根据结构可得,Z可能为Li或Na,W为H或F或Cl,Y为N或P,W、X、Y、Z的原子序数依次增大,故W为H,Y为N,Z为Na,结合题给信息“W、X、Y、Z的原子序数依次增大、且总和为24”可推知,X为B,综上,W为H,X为B,Y为N,Z为Na,以此分析;
解析:A.Y与Y之间形成的化学键均为非极性共价键,A错误;
B.Na既可以与水反应,也可以和甲醇反应,B正确;
C.N的最高价氧化物对应的水化物为硝酸,氢化物是NH3,C正确;
D.三氟化硼中硼原子最外层有3个电子,与氟原子之间形成3个共价键,即最外层共6个电子,不满足8电子稳定结构,D正确;
故答案为:A。
3.B
解析:A.同种元素构成的不同单质是同素异形体,1H2和2H2都是氢气,是同种物质,A项错误;
B.H、D、T分别是氕、氘、氚,是氢的三种核素,B项正确;
C.含有相同质子数的原子互为同位素,C60和C70是两种不同的分子,是同素异形体,C项错误;
D.X和X的质子数不同,是不同元素,D项错误。
答案为B。
4.D
解析:A.同周期元素,从左到右元素的金属性依次减弱,则镁元素的金属性强于铝元素,故A正确;
B.同主族元素,从上到下元素的非金属性依次减弱,氢化物的稳定性依次减弱,则氟化氢的稳定性强于氯化氢,故B正确;
C.同主族元素,从上到下元素的非金属性依次减弱,单质的氧化性依次减弱,则氧气的氧化性强于硫单质,故C正确;
D.同周期元素,从左到右元素的非金属性依次增强,则硫酸的酸性弱于高氯酸,故D错误;
故选D。
5.C
解析:某元素原子的M层电子数是K层电子数的3倍,其核外电子排布应为K层为2个电子,L层为8个电子,M层为6个电子,应为硫元素,在周期表中位置第三周期VIA族。
故选C。
6.D
解析:A.同一周期从左到右,元素原子半径逐渐减小,则半径:Cl
C.非金属性:P>As,元素的非金属性越强,对应的氢化物稳定性越强,则稳定性:PH3> AsH3,C错误;
D.同周期从左到右,金属性减弱,非金属性变强;同主族由上而下,金属性增强,非金属性变弱;非金属性:O>P,故D正确;
故选D。
7.D
解析:A.有单质生成的化学反应不一定是氧化还原反应,如同素异形体之间的转化有单质生成,不是氧化还原反应,故A错误;
B.溶于水,在水分子作用下电离出Na+和Cl-,不需要通电,故B错误;
C.同素异形体是同种元素组成的不同单质之间的关系,和不是单质,故C错误;
D.碱金属单质随着原子序数递增,半径增大,金属键减弱,熔沸点依次降低,故D正确;
答案D。
8.B
解析:A.电子层数相同,原子序数越大,半径越小,所以r(Al3+)<r(Mg2+)<r(Na+)<r(O2-),A错误;
B.电子层数相同,原子序数越大,半径越小,所以:r(S2-)>r(Cl-),r(Na+)>r(Al3+),电子层数不相同,电子层数越多,半径越大,所以微粒半径大小关系为:r(S2-)>r(Cl-)>r(Na+)>r(Al3+),B正确;
C.同周期随着原子序数的增大半径减小,所以:r(S)<r(Al)<r(Mg)<r(Na),C错误;
D.同主族随着原子序数的增大半径增大:r(Cs)>r(Rb)>r(K)>r(Na),D错误;
答案为B。
二、非选择题
9.(1) O2 H2
(2) O2 P
(3) H2SO4 Fe
(4) WO3 H2
(5)
解析:(1)2H2+O2=2H2O中,O元素化合价降低,O2作氧化剂;H元素化合价升高,H2作还原剂。
(2)4P+5O2=2P2O5中,O元素化合价降低,O2作氧化剂;P元素化合价升高,P作还原剂。
(3)Fe+H2SO4=FeSO4+H2中,H元素化合价降低,H2SO4作氧化剂;Fe元素化合价升高,Fe作还原剂。
(4)WO3+3H2=W+3H2O中,W元素化合价降低,WO3作氧化剂;H元素化合价升高,H2作还原剂。
(5)与属于两性氢氧化物,则和溶液反应生成和水,反应的化学方程式为;和盐酸发生酸碱中和反应,反应的化学方程式为。
10.(1) Na K Mg Al C O Ar
(2)KOH
(3)K>Na>Mg
(4) H2O 2K+2H2O=2KOH+H2↑ 碱性
【分析】根据元素在周期表中的位置,①是Na元素;②是K元素;③是Mg元素;④是Al元素;⑤是C元素;⑥是O元素;⑦是Cl元素;⑧是Br元素;⑨是Ar元素;
解析:(1)根据以上分析,这九种元素中①是Na元素;②是K元素;③是Mg元素;④是Al元素;⑤是C元素;⑥是O元素;其中Ar原子最外层有8个电子,结构稳定,化学性质最不活泼的是Ar。
(2)同主族元素从上到下金属性增强,同周期元素从左到右金属性减弱,Na、K、Mg三种元素中K的金属性最强,所以氧化物对应的水化物中,碱性最强的是KOH。
(3)同主族元素从上到下半径依次增大,同周期元素从左到右半径依次减小,Na、K、Mg三种元素按原子半径由大到小的顺序依次为K>Na>Mg。
(4)⑥是O元素,其氢化物是H2O,H2O在常温下与K发生反应生成氢氧化钾和氢气,化学方程式为2K+2H2O=2KOH+H2↑,所得溶液呈碱性。
11.(1)
(2)第三周期ⅢA族
(3) H2CO3 H2SiO3(或H4SiO4)
【分析】根据题给信息知,W单质是淡黄色固体,则W为S元素;X在地壳中的含量居第二位,则X为Si元素;Y原子最外层电子数是电子总数的2/3,则Y为C元素;Z是第三周期原子半径最小的金属,则Z为Al元素。
解析:(1)X为Si,简单氢化物的结构式,Y和W形成的化合物YW2为CS2,电子式;
(2)元素Z为Al,在周期表中的位置为第三周期ⅢA族;
(3)X、Y最高价氧化物对应的水化物分别为H2CO3、H2SiO3,酸性H2CO3>H2SiO3。
12.(1) MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
(2)湿润的淀粉KI试纸变蓝
(3)Br-过量,溶液中没有Cl2
(4) CC14层溶液变为紫(或紫红)色 Br2+2I-=I2+2Br-
(5)吸收Cl2,防止污染空气
(6)电子层数依次增多,原子半径逐渐增大,元素的非金属性逐渐减弱
【分析】A中滴加浓盐酸后,发生反应:2KMnO4+16HC1(浓)=2KC1+2MnCl2+5Cl2↑+8H2O,生成黄绿色气体Cl2,在B、C、D中分别发生反应:Cl2+2NaBr=2NaCl+Br2,Cl2+2NaOH=NaCl+NaClO、Br2+2NaOH=NaCl+NaBrO,NaBrO+2KI+H2O=NaVr+I2+2KOH、NaClO+2KI+H2O=NaCl+I2+2KOH,由于B、C中生成了Br2而使溶液变为黄色,打开活塞b,C中生成的Br2,在D中发生反应:Br2+2KI=2KBr+I2,过程II实验,当B中黄色溶液继续通入过量C12时,溶液变为红棕色,以此为对照,说明C中黄色溶液无Cl2,从而排除Cl2对溴置换碘实验的干扰,据此答题。
解析:(1)A中产生黄绿色气体为氯气,氯原子间形成1对共用电子对,电子式为: ;实验室用二氧化锰和浓盐酸在加热条件下制取氯气的离子方程式为:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O。
(2)因C12的氧化性大于I2的氧化性,可发生反应:C12+2I-=I2+2C1-,I2能使淀粉变蓝,故答案为:湿润的淀粉KI试纸变蓝。
(3)B中溶液由黄色变为棕红色,说明生成了Br2,发生反应的化学方程式为Cl2+2NaBr=2NaCl+Br2,以此说明C中Br-过量,溶液中没有Cl2,从而得出D中氧化I-的氧化剂必为Br2。
(4)打开活塞b,将少量C中溶液滴入D中,发生反应:Br2+2I-=I2+2Br-,关闭活塞b,取下D震荡,静至后CC14层溶液变为紫(或紫红)色。
(5)Cl2有毒,浸有NaOH溶液的棉花的作用是:吸收Cl2,防止污染空气。
(6)因同一主族元素,从上到下,电子层数依次增多,原子半径逐渐增大,元素的非金属性逐渐减弱,得电子能力逐渐减弱
