新人教版九年级下册 第9单元 溶液 2023年单元测试卷(含解析)
文档属性
| 名称 | 新人教版九年级下册 第9单元 溶液 2023年单元测试卷(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 190.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-24 20:40:47 | ||
图片预览



文档简介
新人教版九年级下册《第9单元 溶液》2023年单元测试卷
一、选择题
1.(3分)溶液在我们生活中有着广泛的用途。下列物质不属于溶液的是( )
A.白酒 B.蒸馏水 C.碘酒 D.矿泉水
2.(3分)通过简单的家庭实验,可以帮助我们对知识进一步巩固、理解。某同学进行了如图所示的家庭实验,试管中盛有某种液体,将气球中的某种固体小心地倒入试管中,能观察到气球先变大后复原的一组物质是( )
A.蔗糖和水
B.铁粉和稀硫酸
C.氢氧化钠和水
D.二氧化锰和过氧化氢溶液
3.(3分)下列洗涤或除污过程应用乳化原理的是( )
A.用汽油除去衣服上的油污
B.用酒精除去衣服上的碘
C.用刷子刷除杯子上的污垢
D.用洗洁精洗去餐具上的油脂
4.(3分)实验室欲配制溶质质量分数4%的NaOH溶液200g,需水的质量为( )
A.8g B.192g C.196g D.200g
5.(3分)某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是( )
A.②中溶液是饱和溶液
B.③中溶液一定是不饱和溶液
C.③中溶液的浓度大于②
D.③中溶液的溶质质量大于②中溶液的溶质质量
6.(3分)“天气瓶”是一个瓶内晶体可发生变化的装饰品。“天气瓶”内的液体主要成分是:
①硝酸钾、氯化铵和水的混合溶液
②溶质质量分数为24%的樟脑的酒精溶液
下列说法中,不正确的是( )
A.溶液中的溶质可以为多种
B.樟脑的酒精溶液中酒精是溶剂
C.溶质质量分数为24%的含义是指每100g的溶剂中,溶质是24g
D.“天气瓶”中晶体量变化的原因可能是物质的溶解度随温度改变而变化
7.(3分)在如图所示的大烧杯中加入一定量的硝酸铵,溶解后甲试管内出现的现象以及乙试管内的溶液分别是( )
A.无明显现象;不饱和溶液
B.无明显现象;饱和溶液
C.有晶体析出;不饱和溶液
D.有晶体析出;饱和溶液
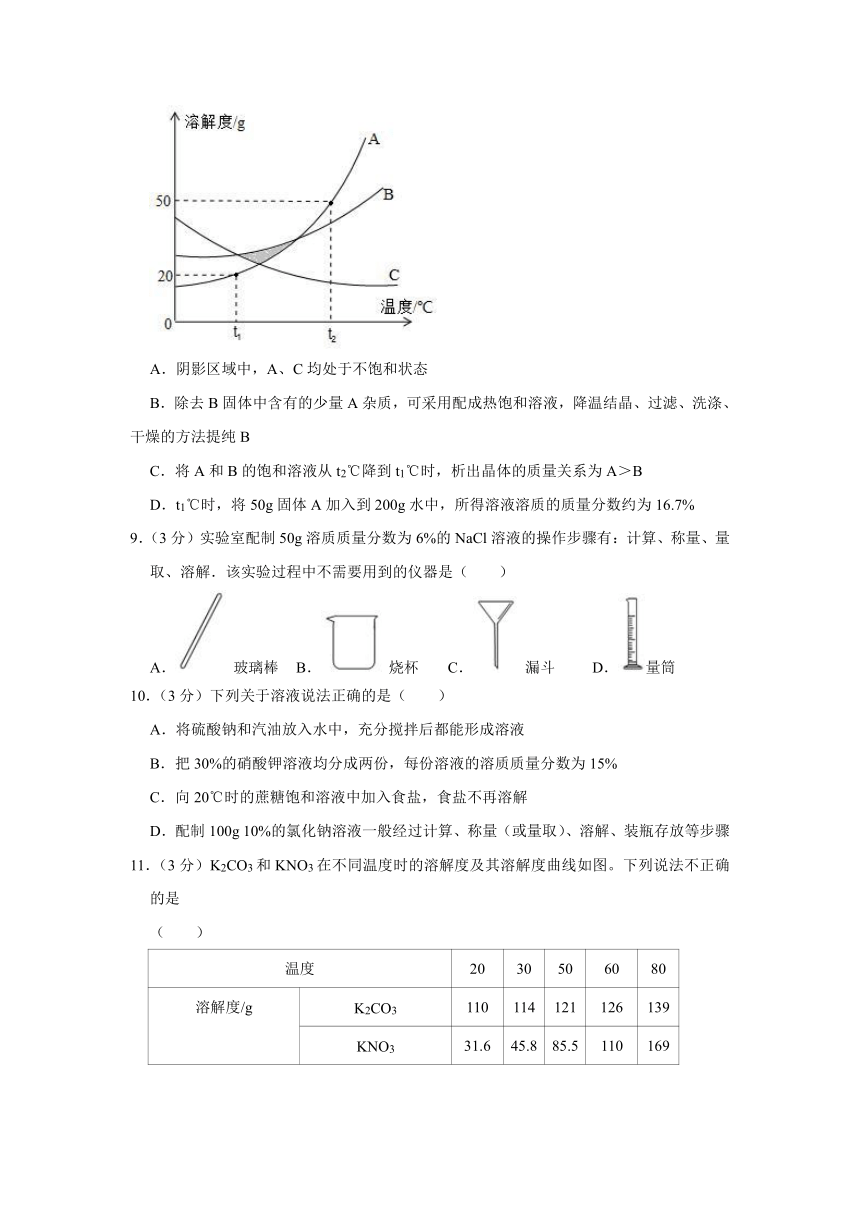
8.(3分)A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是( )
A.阴影区域中,A、C均处于不饱和状态
B.除去B固体中含有的少量A杂质,可采用配成热饱和溶液,降温结晶、过滤、洗涤、干燥的方法提纯B
C.将A和B的饱和溶液从t2℃降到t1℃时,析出晶体的质量关系为A>B
D.t1℃时,将50g固体A加入到200g水中,所得溶液溶质的质量分数约为16.7%
9.(3分)实验室配制50g溶质质量分数为6%的NaCl溶液的操作步骤有:计算、称量、量取、溶解.该实验过程中不需要用到的仪器是( )
A. 玻璃棒 B. 烧杯 C. 漏斗 D.量筒
10.(3分)下列关于溶液说法正确的是( )
A.将硫酸钠和汽油放入水中,充分搅拌后都能形成溶液
B.把30%的硝酸钾溶液均分成两份,每份溶液的溶质质量分数为15%
C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D.配制100g 10%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤
11.(3分)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图。下列说法不正确的是
( )
温度 20 30 50 60 80
溶解度/g K2CO3 110 114 121 126 139
KNO3 31.6 45.8 85.5 110 169
A.碳酸钾溶液中的溶剂是水
B.甲是硝酸钾的溶解度曲线
C.t1℃时,两种物质的溶解度相等
D.t1℃应在50℃~60℃之间
二、填空题
12.(10分)甲、乙两种固体物质的溶解度曲线如图所示。
(1)将接近饱和的甲溶液变为饱和溶液,既可以向溶液中加入甲物质,也可以 (填“升高”或“降低”)温度。
(2)t2℃时,将50g甲物质放入50g水中充分溶解所得溶液中溶质和溶液的质量比为 。
(3)将乙的饱和溶液从t2℃降温到t1℃,此时所得溶液溶质的质量分数为 (精确到0.1%)。
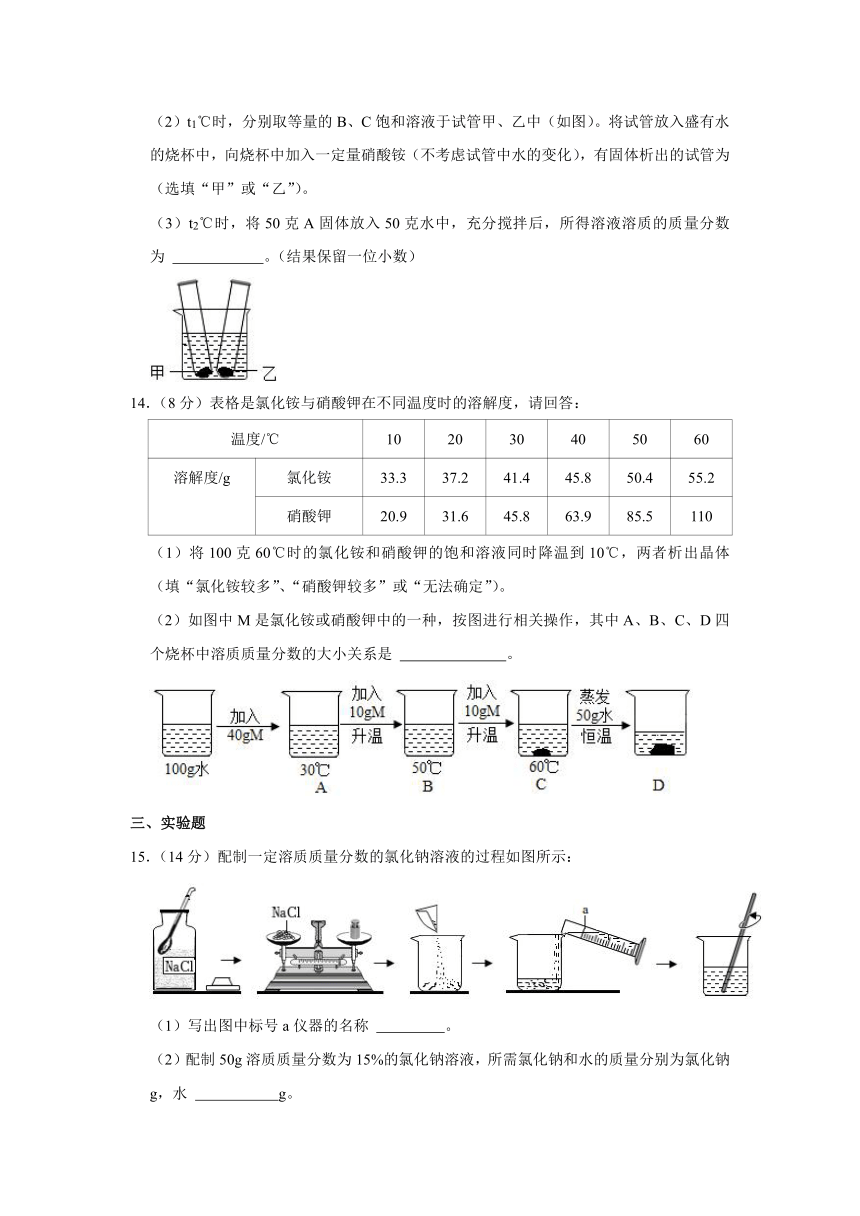
13.(6分)下表是A、B、C三种固体物质在不同温度下(t1<t2<t3)的溶解度,请回答:
温度(℃) t1 t2 t3
物质A(克) 36.0 36.2 37.3
物质B(克) 31.6 36.2 110.0
物质C(克) 0.165 0.135 0.076
(1) ℃时,A、B两种物质的溶解度相同。
(2)t1℃时,分别取等量的B、C饱和溶液于试管甲、乙中(如图)。将试管放入盛有水的烧杯中,向烧杯中加入一定量硝酸铵(不考虑试管中水的变化),有固体析出的试管为 (选填“甲”或“乙”)。
(3)t2℃时,将50克A固体放入50克水中,充分搅拌后,所得溶液溶质的质量分数为 。(结果保留一位小数)
14.(8分)表格是氯化铵与硝酸钾在不同温度时的溶解度,请回答:
温度/℃ 10 20 30 40 50 60
溶解度/g 氯化铵 33.3 37.2 41.4 45.8 50.4 55.2
硝酸钾 20.9 31.6 45.8 63.9 85.5 110
(1)将100克60℃时的氯化铵和硝酸钾的饱和溶液同时降温到10℃,两者析出晶体 (填“氯化铵较多”、“硝酸钾较多”或“无法确定”)。
(2)如图中M是氯化铵或硝酸钾中的一种,按图进行相关操作,其中A、B、C、D四个烧杯中溶质质量分数的大小关系是 。
三、实验题
15.(14分)配制一定溶质质量分数的氯化钠溶液的过程如图所示:
(1)写出图中标号a仪器的名称 。
(2)配制50g溶质质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为氯化钠 g,水 g。
(3)称量氯化钠时,氯化钠应放在托盘天平的 (填“左”或“右”)盘。
(4)溶解过程中玻璃棒的作用是 。
(5)对配制的溶液进行检测发现溶质质量分数偏大,其原因可能有 (填字母)。
A.称量时,药品与砝码放反了
B.量取水的体积时,俯视读数
C.将称取好的氯化钠倒入烧杯中时有少量留在纸上
(6)把50g溶质质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是 。
四、计算题
16.(9分)某种铁合金中含有不溶于酸的杂质。取该合金样品粉末11.4g,分四次向其中加入稀硫酸共200g。反应过程的有关数据记录如下表。
次序 第1次 第2次 第3次 第4次
加入稀硫酸的质量/g 50 50 50 50
剩余固体的质量/g 8.6 a 3 0.5
请回答下列问题。
(1)a= ,合计样品中铁的质量为 。
(2)原稀硫酸中溶质的质量分数为多少?(请写出计算过程)
五、解答题
17.(8分)溶液在生产和科研中具有广泛的用途,与人们的生活密不可分。
(1)衣服上沾有的油污,可用汽油洗去,是因为汽油能 (填“溶解”或“乳化”)油污。
(2)喝了冰镇汽水以后,常常会打嗝,这种现象说明气体的溶解度与 (填“温度”或“压强”)有关。
(3)大理石与稀盐酸完全反应后的溶质是 ,碘酒有杀菌消毒功效,碘酒中的溶剂是 。
18.(12分)溶液在生产、生活中起着十分重要的作用。请回答下列问题:
(1)可以作为溶质的是 。
A.只有固体 B.只有液体 C.只有气体 D.气体、液体、固体都可以
(2)配制100g质量分数为的16%氯化钠溶液,所需氯化钠的质量为 。
(3)甲、乙两种不含结晶水的固体物质的溶解度曲线如图,t1℃时,甲物质的溶解度是 。t1℃时,50g 甲物质放入100g水中所得溶液中溶质与溶剂的质量比是 (填最简整数比)。
(4)t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是 (填“甲”“或“乙”)物质的饱和溶液。
新人教版九年级下册《第9单元 溶液》2023年单元测试卷
参考答案与试题解析
一、选择题
1.【分析】本题考查溶液的概念,在一定条件下溶质分散到溶剂中形成的是均一稳定的混合物。
【解答】解:A、白酒是均一、稳定的混合物,属于溶液,故A错;
B、蒸馏水是由一种物质组成,属于纯净物,不属于溶液,溶液属于混合物,故B正确;
C、碘酒是均一、稳定的混合物,属于溶液,故C错;
D、矿泉水是均一、稳定的混合物,属于溶液,故D错。
故选:B。
2.【分析】试管中盛有某种液体,将气球中的某种固体小心地倒入试管中,观察到气球变大,说明药品接触生成了气体或放出了大量的热;一段时间后又复原,说明是药品接触放出热量,进行分析解答。
【解答】解:A、蔗糖溶于水水温度几乎无变化,气球不会膨胀,故选项错误。
B、铁粉和稀硫酸反应生成氢气,观察到气球鼓起;一段时间后,气球不会恢复原状,故选项错误。
C、氢氧化钠固体溶于水放出大量的热,使装置内空气受热膨胀,观察到气球鼓起;一段时间后,温度恢复至常温,又恢复原状,故选项正确。
D、过氧化氢在二氧化锰的催化作用下生成水和氧气,观察到气球鼓起;一段时间后,气球不会恢复原状,故选项错误。
故选:C。
3.【分析】根据乳化作用的定义分析:洗洁精或洗衣粉等物质使植物油分散成无数细小的液滴,而不聚成大的油珠,这些细小的液滴能随着水冲走,这种现象属于乳化作用.
【解答】解:A、用汽油洗去油污,是利用汽油能溶解油污来达到目的,利用的是溶解原理,不是利用了乳化作用,故选项错误。
B、用酒精除去衣服上的碘,是利用酒精能溶解碘污来达到目的,利用的是溶解原理,不是利用了乳化作用,故选项错误。
C、用刷子刷除杯子上的污垢,是利用了刷子的摩擦作用,不是利用了乳化作用,故选项错误。
D、洗洁精是洗涤剂,有乳化作用,能将大的油滴分散成细小的油滴随水冲走,是利用乳化作用,故选项正确。
故选:D。
4.【分析】利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量;再根据溶剂质量=溶液质量﹣溶质质量即可求得水的质量.
【解答】解:溶质质量=溶液质量×溶质的质量分数,实验室欲配制溶质质量分数4%的NaOH溶液200g,需氢氧化钠的质量=200g×4%=8g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=200g﹣8g=192g。
故选:B。
5.【分析】结合某次蔗糖溶解实验过程图示,不考虑水分蒸发,①→②充分溶解后固体有剩余,②中溶液是饱和溶液,②加热形成③中没有剩余固体,③中溶液有可能是饱和溶液,也有可能是不饱和溶液,②③中溶剂质量相同,溶质质量不同,②③中溶液的溶质质量分数一定是不相同的,有图直观看出:③中蔗糖全部溶解,②中蔗糖部分溶解,③中溶液的溶质质量大于②中溶液的溶质质量。
【解答】解:结合某次蔗糖溶解实验过程图示,不考虑水分蒸发,①→②充分溶解后固体有剩余,②中溶液是饱和溶液,②加热形成③中没有剩余固体,③中溶液有可能是饱和溶液,也有可能是不饱和溶液,②③中溶剂质量相同,溶质质量不同,②③中溶液的溶质质量分数一定是不相同的,有图直观看出:③中蔗糖全部溶解,②中蔗糖部分溶解,③中溶液的溶质质量大于②中溶液的溶质质量;
故选:B。
6.【分析】A、根据“天气瓶”内的液体是硝酸钾、氯化铵和水的混合溶液,进行分析判断。
B、根据樟脑的酒精溶液,是樟脑溶于酒精形成的,进行分析判断。
C、根据溶质质量分数的含义,进行分析判断。
D、根据温度降低,有晶体析出,进行分析判断。
【解答】解:A、“天气瓶”内的液体是硝酸钾、氯化铵和水的混合溶液,说明溶液中的溶质可以为多种,故选项说法正确。
B、樟脑的酒精溶液,是樟脑溶于酒精形成的,酒精是溶剂,故选项说法正确。
C、溶质质量分数为24%的含义是指每100g的溶液中,溶质是24g,故选项说法错误。
D、温度降低,有晶体析出,晶体质量增加;“天气瓶”中晶体量变化的原因可能是物质的溶解度随温度改变而变化,故选项说法正确。
故选:C。
7.【分析】根据硝酸铵溶于水吸热,温度降低;硝酸钾的溶解度随着温度的降低而减小,氢氧化钙的溶解度随着温度的降低而增大,进行分析判断.
【解答】解:在如图所示的大烧杯中加入一定量的硝酸铵,硝酸铵溶于水吸热,温度降低;硝酸钾的溶解度随着温度的降低而减小,温度降低后,有晶体析出,所得溶液仍为饱和溶液;氢氧化钙的溶解度随着温度的降低而增大,温度降低后,氢氧化钙的溶解度增大,无明显现象,溶液变为不饱和溶液。
A、溶解后甲试管内出现的现象以及乙试管内的溶液分别是有晶体析出、不饱和溶液,故选项错误。
B、溶解后甲试管内出现的现象以及乙试管内的溶液分别是有晶体析出、不饱和溶液,故选项错误。
C、溶解后甲试管内出现的现象以及乙试管内的溶液分别是有晶体析出、不饱和溶液,故选项正确。
D、溶解后甲试管内出现的现象以及乙试管内的溶液分别是有晶体析出、不饱和溶液,故选项错误。
故选:C。
8.【分析】某一点在溶解度曲线上,是饱和溶液,在溶解度曲线下方是不饱和溶液,在溶解度曲线上方是饱和溶液;
一种物质的溶解度受温度变化影响较大,一种物质的溶解度受温度变化影响较小,可以用降温结晶或蒸发结晶的方法分离;
如果不知道溶液质量,则不能比较温度变化时析出晶体质量的大小;
溶液中溶质质量分数=×100%。
【解答】解:A、阴影区域中,A、C均处于饱和状态,该选项说法不正确;
B、A溶解度受温度变化影响较大,B溶解度受温度变化影响较小,除去B固体中含有的少量A杂质,可采用蒸发结晶的方法提纯B,该选项说法不正确;
C、将A和B的饱和溶液从t2℃降到t1℃时,不能比较析出晶体的质量大小,是因为不知道饱和溶液的质量,该选项说法不正确;
D、t1℃时A溶解度是20g,将50g固体A加入到200g水中,能够溶解40g,所得溶液溶质的质量分数约为:×100%=16.7%,该选项说法正确。
故选:D。
9.【分析】实验室用氯化钠固体配制一定质量分数的氯化钠溶液的操作步骤分别是:计算、称量、量取、溶解,根据各操作所需要使用的仪器,判断所列仪器是否需要.
【解答】解:A、溶解过程需要用玻璃棒进行搅拌,故选项错误。
B、溶解需要在烧杯中进行,故选项错误。
C、配制溶液的过程中不需要进行过滤,则不需要使用漏斗,该仪器不需要,故选项正确。
D、配制溶液的过程中量筒用于准确量取水,该仪器需要,故选项错误。
故选:C。
10.【分析】A、根据汽油难溶于水,进行分析判断。
B、根据溶液具有均一性,进行分析判断。
C、根据一种物质的饱和溶液还能溶解其它的溶质,进行分析判断。
D、根据配制溶质质量分数一定的溶液的基本步骤,进行分析判断。
【解答】解:A、汽油难溶于水,将汽油放入水中,充分搅拌后不能形成溶液,故选项说法错误。
B、溶液具有均一性,把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数均为30%,故选项说法错误。
C、一种物质的饱和溶液还能溶解其它的溶质,向20℃时的蔗糖饱和溶液中加入食盐,食盐能继续溶解,故选项说法错误。
D、配制100g 10%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解、装瓶存放,故选项说法正确。
故选:D。
11.【分析】如果不指明溶剂,通常指的是水;
根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较;
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
【解答】解:A、碳酸钾溶液中的溶剂是水,该选项说法正确;
B、由表中数据可知,硝酸钾的溶解度受温度变化影响较大,因此甲是硝酸钾的溶解度曲线,该选项说法正确;
C、t1℃时,两种物质的溶解度相等,该选项说法正确;
D、t1℃应在60℃~80℃之间,该选项说法不正确。
故选:D。
二、填空题
12.【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【解答】解:(1)甲物质的溶解度随温度的降低而减小,所以将接近饱和的甲溶液变为饱和溶液,既可以向溶液中加入甲物质,也可以降低温度;
(2)t2℃时,甲物质的溶解度是50g,所以将50g甲物质放入50g水中充分溶解所得溶液中溶质和溶液的质量比为25g:75g=1:3;
(3)t1℃时,甲物质的溶解度是30g,将乙的饱和溶液从t2℃降温到t1℃,此时所得溶液溶质的质量分数为:×100%=23.1%。
故答案为:(1)降低;
(2)1:3;
(3)23.1%。
13.【分析】根据物质的溶解度表可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度表可以判断随着温度的变化,物质的溶解度变化情况。
硝酸铵溶于水吸热。
溶液中溶质质量分数=×100%。
【解答】解:(1)t2℃时,A、B两种物质的溶解度相同。
(2)t3℃时,分别取等量的B、C饱和溶液于试管甲、乙中(如图)将试管放入盛有水的烧杯中,向烧杯中加入一定量硝酸铵,硝酸铵溶于水吸热,温度降低,有固体析出的试管为甲,是因为甲的溶解度随着温度降低而减小。
(3)t2℃时A的溶解度是36.2g,将50克A固体放入50克水中,充分搅拌后,只能够溶解18.1g,所得溶液中溶质的质量分数为×100%≈26.6%。
故答案为:
(1)t2;
(2)甲;
(3)26.6%。
14.【分析】(1)根据溶解度受温度影响的大小分析。
(2)根据不同温度下物质的溶解度、溶液的状态来分析解答。
【解答】解:(1)由表中的数据可知,硝酸钾的溶解度受温度的影响比氯化铵的大,将100克60℃时的氯化铵和硝酸钾的饱和溶液同时降温到10℃,两者析出晶体硝酸钾较多。
(2)因为在60℃时,100g水中没有全部溶解60gM,由表中的数据可知,M物质是氯化铵。氯化铵的溶解度随着温度升高而增大。因为A和B均为不饱和溶液(均含水100g),且B中的溶质多,所以A的溶质质量分数小于B;C是60℃时,氯化铵的饱和溶液,所以C中溶质的质量分数一定大于B(50℃时的不饱和溶液)中溶质的质量分数;而CD均为60℃时氯化铵的饱和溶液,所以二者溶质质量分数相等,即溶质质量分数关系为A<B<C=D。
故答案为:(1)硝酸钾较多;
(2)A<B<C=D。
三、实验题
15.【分析】(1)根据仪器名称和用途分析。
(2)根据溶质的质量=溶液的质量×溶质的质量分数来分析。
(3)根据托盘天平的使用方法分析。
(4)根据玻璃棒作用分析。
(5)根据误差产生的原因来分析。
(6)根据溶液稀释前后溶质的质量不变来分析。
【解答】解:(1)根据题中仪器,图中标号a仪器的名称量筒;
(2)配制50g质量分数为15%的氯化钠溶液,所需氯化钠的质量50g×15%=7.5g,则需要水的质量为50g﹣7.5g=42.5g;
(3)称量氯化钠时,先在右盘中放好砝码,并把游码移动到合适位置,然后再向左盘添加氯化钠,直到天平平衡为止;
(4)溶解过程中玻璃棒的作用是搅拌,加速溶解;
(5)A.称量时,药品与砝码放反了,药品的质量比实际的小,溶质的质量分数会偏小;
B.量取水的体积时,俯视读数,量取的水偏少,会使溶质质量分数偏大;
C.将称取好的氯化钠倒入烧杯中时有少量留在纸上,溶质偏少,会使溶质质量分数偏小。
故选:B;
(6)设要加水的质量为x,
根据溶液稀释前后溶质的质量不变,则50g×15%=(50g+x)×5%
解得x=100g。
故答案为:(1)量筒;
(2)7.5;42.5;
(3)左;
(4)搅拌,加速溶解;
(5)B;
(6)100g。
四、计算题
16.【分析】(1)根据实验数据中第一次中铁与稀硫酸的质量关系,判断样品中铁反应时消耗稀硫酸溶质的质量;根据剩余固体的质量求出合金中铁的质量;
(2)利用稀硫酸溶质的质量和溶液的质量即可求得稀硫酸溶液中溶质的质量分数。
【解答】解:(1)由图表可知,每消耗50g稀硫酸固体减少11.4g﹣8.6g=2.8g,所以a=8.6g﹣2.8g=5.8g;当第四次加入稀硫酸时,合金中铁完全反应,剩余不溶于酸的杂质质量为0.5g,则合金中铁的质量为11.4g﹣0.5g=10.9g;故填:5.8;10.9g
(2)设第一次参加反应的稀硫酸溶质的质量为x,
Fe+H2SO4═FeSO4+H2↑
56 98
2.8g x
=
解得:x=4.9g;
则稀硫酸溶液中溶质的质量分数=×100%=9.8%;
答:所加入的稀硫酸的溶质质量分数9.8%。
五、解答题
17.【分析】(1)根据除油污的原理来分析;
(2)根据影响气体溶解度的因素来分析;
(3)根据反应的原理以及溶液的组成来分析。
【解答】解:(1)衣服上沾有的油污,可用汽油洗去,是因为汽油能溶解油污;故答案为:溶解;
(2)喝了冰镇汽水以后,常常会打嗝,这种现象说明气体的溶解度与温度有关,温度升高,气体的溶解度减小;故答案为:温度;
(3)大理石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳气体,因此大理石与稀盐酸完全反应后的溶质是氯化钙,碘酒是碘的酒精溶液,碘酒中的溶剂是酒精;故答案为:氯化钙;酒精。
18.【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【解答】解:(1)气体、液体、固体都可以作为溶质,故选:D;
(2)配制100g质量分数为的16%氯化钠溶液,所需氯化钠的质量为100g×16%=16g;
(3)通过分析溶解度曲线可知,t1℃时,甲物质的溶解度是:40g,t1℃时,50g 甲物质放入100g水中所得溶液中溶质与溶剂的质量比是40g:100g=2:5;
(4)t2℃时,甲物质的溶解度大于乙物质的溶解度,所以若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是乙物质的饱和溶液。
故答案为:(1)D;
(2)16g;
(3)40g,2:5;
(4)乙。
一、选择题
1.(3分)溶液在我们生活中有着广泛的用途。下列物质不属于溶液的是( )
A.白酒 B.蒸馏水 C.碘酒 D.矿泉水
2.(3分)通过简单的家庭实验,可以帮助我们对知识进一步巩固、理解。某同学进行了如图所示的家庭实验,试管中盛有某种液体,将气球中的某种固体小心地倒入试管中,能观察到气球先变大后复原的一组物质是( )
A.蔗糖和水
B.铁粉和稀硫酸
C.氢氧化钠和水
D.二氧化锰和过氧化氢溶液
3.(3分)下列洗涤或除污过程应用乳化原理的是( )
A.用汽油除去衣服上的油污
B.用酒精除去衣服上的碘
C.用刷子刷除杯子上的污垢
D.用洗洁精洗去餐具上的油脂
4.(3分)实验室欲配制溶质质量分数4%的NaOH溶液200g,需水的质量为( )
A.8g B.192g C.196g D.200g
5.(3分)某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是( )
A.②中溶液是饱和溶液
B.③中溶液一定是不饱和溶液
C.③中溶液的浓度大于②
D.③中溶液的溶质质量大于②中溶液的溶质质量
6.(3分)“天气瓶”是一个瓶内晶体可发生变化的装饰品。“天气瓶”内的液体主要成分是:
①硝酸钾、氯化铵和水的混合溶液
②溶质质量分数为24%的樟脑的酒精溶液
下列说法中,不正确的是( )
A.溶液中的溶质可以为多种
B.樟脑的酒精溶液中酒精是溶剂
C.溶质质量分数为24%的含义是指每100g的溶剂中,溶质是24g
D.“天气瓶”中晶体量变化的原因可能是物质的溶解度随温度改变而变化
7.(3分)在如图所示的大烧杯中加入一定量的硝酸铵,溶解后甲试管内出现的现象以及乙试管内的溶液分别是( )
A.无明显现象;不饱和溶液
B.无明显现象;饱和溶液
C.有晶体析出;不饱和溶液
D.有晶体析出;饱和溶液
8.(3分)A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是( )
A.阴影区域中,A、C均处于不饱和状态
B.除去B固体中含有的少量A杂质,可采用配成热饱和溶液,降温结晶、过滤、洗涤、干燥的方法提纯B
C.将A和B的饱和溶液从t2℃降到t1℃时,析出晶体的质量关系为A>B
D.t1℃时,将50g固体A加入到200g水中,所得溶液溶质的质量分数约为16.7%
9.(3分)实验室配制50g溶质质量分数为6%的NaCl溶液的操作步骤有:计算、称量、量取、溶解.该实验过程中不需要用到的仪器是( )
A. 玻璃棒 B. 烧杯 C. 漏斗 D.量筒
10.(3分)下列关于溶液说法正确的是( )
A.将硫酸钠和汽油放入水中,充分搅拌后都能形成溶液
B.把30%的硝酸钾溶液均分成两份,每份溶液的溶质质量分数为15%
C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D.配制100g 10%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤
11.(3分)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图。下列说法不正确的是
( )
温度 20 30 50 60 80
溶解度/g K2CO3 110 114 121 126 139
KNO3 31.6 45.8 85.5 110 169
A.碳酸钾溶液中的溶剂是水
B.甲是硝酸钾的溶解度曲线
C.t1℃时,两种物质的溶解度相等
D.t1℃应在50℃~60℃之间
二、填空题
12.(10分)甲、乙两种固体物质的溶解度曲线如图所示。
(1)将接近饱和的甲溶液变为饱和溶液,既可以向溶液中加入甲物质,也可以 (填“升高”或“降低”)温度。
(2)t2℃时,将50g甲物质放入50g水中充分溶解所得溶液中溶质和溶液的质量比为 。
(3)将乙的饱和溶液从t2℃降温到t1℃,此时所得溶液溶质的质量分数为 (精确到0.1%)。
13.(6分)下表是A、B、C三种固体物质在不同温度下(t1<t2<t3)的溶解度,请回答:
温度(℃) t1 t2 t3
物质A(克) 36.0 36.2 37.3
物质B(克) 31.6 36.2 110.0
物质C(克) 0.165 0.135 0.076
(1) ℃时,A、B两种物质的溶解度相同。
(2)t1℃时,分别取等量的B、C饱和溶液于试管甲、乙中(如图)。将试管放入盛有水的烧杯中,向烧杯中加入一定量硝酸铵(不考虑试管中水的变化),有固体析出的试管为 (选填“甲”或“乙”)。
(3)t2℃时,将50克A固体放入50克水中,充分搅拌后,所得溶液溶质的质量分数为 。(结果保留一位小数)
14.(8分)表格是氯化铵与硝酸钾在不同温度时的溶解度,请回答:
温度/℃ 10 20 30 40 50 60
溶解度/g 氯化铵 33.3 37.2 41.4 45.8 50.4 55.2
硝酸钾 20.9 31.6 45.8 63.9 85.5 110
(1)将100克60℃时的氯化铵和硝酸钾的饱和溶液同时降温到10℃,两者析出晶体 (填“氯化铵较多”、“硝酸钾较多”或“无法确定”)。
(2)如图中M是氯化铵或硝酸钾中的一种,按图进行相关操作,其中A、B、C、D四个烧杯中溶质质量分数的大小关系是 。
三、实验题
15.(14分)配制一定溶质质量分数的氯化钠溶液的过程如图所示:
(1)写出图中标号a仪器的名称 。
(2)配制50g溶质质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为氯化钠 g,水 g。
(3)称量氯化钠时,氯化钠应放在托盘天平的 (填“左”或“右”)盘。
(4)溶解过程中玻璃棒的作用是 。
(5)对配制的溶液进行检测发现溶质质量分数偏大,其原因可能有 (填字母)。
A.称量时,药品与砝码放反了
B.量取水的体积时,俯视读数
C.将称取好的氯化钠倒入烧杯中时有少量留在纸上
(6)把50g溶质质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是 。
四、计算题
16.(9分)某种铁合金中含有不溶于酸的杂质。取该合金样品粉末11.4g,分四次向其中加入稀硫酸共200g。反应过程的有关数据记录如下表。
次序 第1次 第2次 第3次 第4次
加入稀硫酸的质量/g 50 50 50 50
剩余固体的质量/g 8.6 a 3 0.5
请回答下列问题。
(1)a= ,合计样品中铁的质量为 。
(2)原稀硫酸中溶质的质量分数为多少?(请写出计算过程)
五、解答题
17.(8分)溶液在生产和科研中具有广泛的用途,与人们的生活密不可分。
(1)衣服上沾有的油污,可用汽油洗去,是因为汽油能 (填“溶解”或“乳化”)油污。
(2)喝了冰镇汽水以后,常常会打嗝,这种现象说明气体的溶解度与 (填“温度”或“压强”)有关。
(3)大理石与稀盐酸完全反应后的溶质是 ,碘酒有杀菌消毒功效,碘酒中的溶剂是 。
18.(12分)溶液在生产、生活中起着十分重要的作用。请回答下列问题:
(1)可以作为溶质的是 。
A.只有固体 B.只有液体 C.只有气体 D.气体、液体、固体都可以
(2)配制100g质量分数为的16%氯化钠溶液,所需氯化钠的质量为 。
(3)甲、乙两种不含结晶水的固体物质的溶解度曲线如图,t1℃时,甲物质的溶解度是 。t1℃时,50g 甲物质放入100g水中所得溶液中溶质与溶剂的质量比是 (填最简整数比)。
(4)t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是 (填“甲”“或“乙”)物质的饱和溶液。
新人教版九年级下册《第9单元 溶液》2023年单元测试卷
参考答案与试题解析
一、选择题
1.【分析】本题考查溶液的概念,在一定条件下溶质分散到溶剂中形成的是均一稳定的混合物。
【解答】解:A、白酒是均一、稳定的混合物,属于溶液,故A错;
B、蒸馏水是由一种物质组成,属于纯净物,不属于溶液,溶液属于混合物,故B正确;
C、碘酒是均一、稳定的混合物,属于溶液,故C错;
D、矿泉水是均一、稳定的混合物,属于溶液,故D错。
故选:B。
2.【分析】试管中盛有某种液体,将气球中的某种固体小心地倒入试管中,观察到气球变大,说明药品接触生成了气体或放出了大量的热;一段时间后又复原,说明是药品接触放出热量,进行分析解答。
【解答】解:A、蔗糖溶于水水温度几乎无变化,气球不会膨胀,故选项错误。
B、铁粉和稀硫酸反应生成氢气,观察到气球鼓起;一段时间后,气球不会恢复原状,故选项错误。
C、氢氧化钠固体溶于水放出大量的热,使装置内空气受热膨胀,观察到气球鼓起;一段时间后,温度恢复至常温,又恢复原状,故选项正确。
D、过氧化氢在二氧化锰的催化作用下生成水和氧气,观察到气球鼓起;一段时间后,气球不会恢复原状,故选项错误。
故选:C。
3.【分析】根据乳化作用的定义分析:洗洁精或洗衣粉等物质使植物油分散成无数细小的液滴,而不聚成大的油珠,这些细小的液滴能随着水冲走,这种现象属于乳化作用.
【解答】解:A、用汽油洗去油污,是利用汽油能溶解油污来达到目的,利用的是溶解原理,不是利用了乳化作用,故选项错误。
B、用酒精除去衣服上的碘,是利用酒精能溶解碘污来达到目的,利用的是溶解原理,不是利用了乳化作用,故选项错误。
C、用刷子刷除杯子上的污垢,是利用了刷子的摩擦作用,不是利用了乳化作用,故选项错误。
D、洗洁精是洗涤剂,有乳化作用,能将大的油滴分散成细小的油滴随水冲走,是利用乳化作用,故选项正确。
故选:D。
4.【分析】利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量;再根据溶剂质量=溶液质量﹣溶质质量即可求得水的质量.
【解答】解:溶质质量=溶液质量×溶质的质量分数,实验室欲配制溶质质量分数4%的NaOH溶液200g,需氢氧化钠的质量=200g×4%=8g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=200g﹣8g=192g。
故选:B。
5.【分析】结合某次蔗糖溶解实验过程图示,不考虑水分蒸发,①→②充分溶解后固体有剩余,②中溶液是饱和溶液,②加热形成③中没有剩余固体,③中溶液有可能是饱和溶液,也有可能是不饱和溶液,②③中溶剂质量相同,溶质质量不同,②③中溶液的溶质质量分数一定是不相同的,有图直观看出:③中蔗糖全部溶解,②中蔗糖部分溶解,③中溶液的溶质质量大于②中溶液的溶质质量。
【解答】解:结合某次蔗糖溶解实验过程图示,不考虑水分蒸发,①→②充分溶解后固体有剩余,②中溶液是饱和溶液,②加热形成③中没有剩余固体,③中溶液有可能是饱和溶液,也有可能是不饱和溶液,②③中溶剂质量相同,溶质质量不同,②③中溶液的溶质质量分数一定是不相同的,有图直观看出:③中蔗糖全部溶解,②中蔗糖部分溶解,③中溶液的溶质质量大于②中溶液的溶质质量;
故选:B。
6.【分析】A、根据“天气瓶”内的液体是硝酸钾、氯化铵和水的混合溶液,进行分析判断。
B、根据樟脑的酒精溶液,是樟脑溶于酒精形成的,进行分析判断。
C、根据溶质质量分数的含义,进行分析判断。
D、根据温度降低,有晶体析出,进行分析判断。
【解答】解:A、“天气瓶”内的液体是硝酸钾、氯化铵和水的混合溶液,说明溶液中的溶质可以为多种,故选项说法正确。
B、樟脑的酒精溶液,是樟脑溶于酒精形成的,酒精是溶剂,故选项说法正确。
C、溶质质量分数为24%的含义是指每100g的溶液中,溶质是24g,故选项说法错误。
D、温度降低,有晶体析出,晶体质量增加;“天气瓶”中晶体量变化的原因可能是物质的溶解度随温度改变而变化,故选项说法正确。
故选:C。
7.【分析】根据硝酸铵溶于水吸热,温度降低;硝酸钾的溶解度随着温度的降低而减小,氢氧化钙的溶解度随着温度的降低而增大,进行分析判断.
【解答】解:在如图所示的大烧杯中加入一定量的硝酸铵,硝酸铵溶于水吸热,温度降低;硝酸钾的溶解度随着温度的降低而减小,温度降低后,有晶体析出,所得溶液仍为饱和溶液;氢氧化钙的溶解度随着温度的降低而增大,温度降低后,氢氧化钙的溶解度增大,无明显现象,溶液变为不饱和溶液。
A、溶解后甲试管内出现的现象以及乙试管内的溶液分别是有晶体析出、不饱和溶液,故选项错误。
B、溶解后甲试管内出现的现象以及乙试管内的溶液分别是有晶体析出、不饱和溶液,故选项错误。
C、溶解后甲试管内出现的现象以及乙试管内的溶液分别是有晶体析出、不饱和溶液,故选项正确。
D、溶解后甲试管内出现的现象以及乙试管内的溶液分别是有晶体析出、不饱和溶液,故选项错误。
故选:C。
8.【分析】某一点在溶解度曲线上,是饱和溶液,在溶解度曲线下方是不饱和溶液,在溶解度曲线上方是饱和溶液;
一种物质的溶解度受温度变化影响较大,一种物质的溶解度受温度变化影响较小,可以用降温结晶或蒸发结晶的方法分离;
如果不知道溶液质量,则不能比较温度变化时析出晶体质量的大小;
溶液中溶质质量分数=×100%。
【解答】解:A、阴影区域中,A、C均处于饱和状态,该选项说法不正确;
B、A溶解度受温度变化影响较大,B溶解度受温度变化影响较小,除去B固体中含有的少量A杂质,可采用蒸发结晶的方法提纯B,该选项说法不正确;
C、将A和B的饱和溶液从t2℃降到t1℃时,不能比较析出晶体的质量大小,是因为不知道饱和溶液的质量,该选项说法不正确;
D、t1℃时A溶解度是20g,将50g固体A加入到200g水中,能够溶解40g,所得溶液溶质的质量分数约为:×100%=16.7%,该选项说法正确。
故选:D。
9.【分析】实验室用氯化钠固体配制一定质量分数的氯化钠溶液的操作步骤分别是:计算、称量、量取、溶解,根据各操作所需要使用的仪器,判断所列仪器是否需要.
【解答】解:A、溶解过程需要用玻璃棒进行搅拌,故选项错误。
B、溶解需要在烧杯中进行,故选项错误。
C、配制溶液的过程中不需要进行过滤,则不需要使用漏斗,该仪器不需要,故选项正确。
D、配制溶液的过程中量筒用于准确量取水,该仪器需要,故选项错误。
故选:C。
10.【分析】A、根据汽油难溶于水,进行分析判断。
B、根据溶液具有均一性,进行分析判断。
C、根据一种物质的饱和溶液还能溶解其它的溶质,进行分析判断。
D、根据配制溶质质量分数一定的溶液的基本步骤,进行分析判断。
【解答】解:A、汽油难溶于水,将汽油放入水中,充分搅拌后不能形成溶液,故选项说法错误。
B、溶液具有均一性,把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数均为30%,故选项说法错误。
C、一种物质的饱和溶液还能溶解其它的溶质,向20℃时的蔗糖饱和溶液中加入食盐,食盐能继续溶解,故选项说法错误。
D、配制100g 10%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解、装瓶存放,故选项说法正确。
故选:D。
11.【分析】如果不指明溶剂,通常指的是水;
根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较;
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况。
【解答】解:A、碳酸钾溶液中的溶剂是水,该选项说法正确;
B、由表中数据可知,硝酸钾的溶解度受温度变化影响较大,因此甲是硝酸钾的溶解度曲线,该选项说法正确;
C、t1℃时,两种物质的溶解度相等,该选项说法正确;
D、t1℃应在60℃~80℃之间,该选项说法不正确。
故选:D。
二、填空题
12.【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【解答】解:(1)甲物质的溶解度随温度的降低而减小,所以将接近饱和的甲溶液变为饱和溶液,既可以向溶液中加入甲物质,也可以降低温度;
(2)t2℃时,甲物质的溶解度是50g,所以将50g甲物质放入50g水中充分溶解所得溶液中溶质和溶液的质量比为25g:75g=1:3;
(3)t1℃时,甲物质的溶解度是30g,将乙的饱和溶液从t2℃降温到t1℃,此时所得溶液溶质的质量分数为:×100%=23.1%。
故答案为:(1)降低;
(2)1:3;
(3)23.1%。
13.【分析】根据物质的溶解度表可以判断某一温度时物质的溶解度大小比较。
根据物质的溶解度表可以判断随着温度的变化,物质的溶解度变化情况。
硝酸铵溶于水吸热。
溶液中溶质质量分数=×100%。
【解答】解:(1)t2℃时,A、B两种物质的溶解度相同。
(2)t3℃时,分别取等量的B、C饱和溶液于试管甲、乙中(如图)将试管放入盛有水的烧杯中,向烧杯中加入一定量硝酸铵,硝酸铵溶于水吸热,温度降低,有固体析出的试管为甲,是因为甲的溶解度随着温度降低而减小。
(3)t2℃时A的溶解度是36.2g,将50克A固体放入50克水中,充分搅拌后,只能够溶解18.1g,所得溶液中溶质的质量分数为×100%≈26.6%。
故答案为:
(1)t2;
(2)甲;
(3)26.6%。
14.【分析】(1)根据溶解度受温度影响的大小分析。
(2)根据不同温度下物质的溶解度、溶液的状态来分析解答。
【解答】解:(1)由表中的数据可知,硝酸钾的溶解度受温度的影响比氯化铵的大,将100克60℃时的氯化铵和硝酸钾的饱和溶液同时降温到10℃,两者析出晶体硝酸钾较多。
(2)因为在60℃时,100g水中没有全部溶解60gM,由表中的数据可知,M物质是氯化铵。氯化铵的溶解度随着温度升高而增大。因为A和B均为不饱和溶液(均含水100g),且B中的溶质多,所以A的溶质质量分数小于B;C是60℃时,氯化铵的饱和溶液,所以C中溶质的质量分数一定大于B(50℃时的不饱和溶液)中溶质的质量分数;而CD均为60℃时氯化铵的饱和溶液,所以二者溶质质量分数相等,即溶质质量分数关系为A<B<C=D。
故答案为:(1)硝酸钾较多;
(2)A<B<C=D。
三、实验题
15.【分析】(1)根据仪器名称和用途分析。
(2)根据溶质的质量=溶液的质量×溶质的质量分数来分析。
(3)根据托盘天平的使用方法分析。
(4)根据玻璃棒作用分析。
(5)根据误差产生的原因来分析。
(6)根据溶液稀释前后溶质的质量不变来分析。
【解答】解:(1)根据题中仪器,图中标号a仪器的名称量筒;
(2)配制50g质量分数为15%的氯化钠溶液,所需氯化钠的质量50g×15%=7.5g,则需要水的质量为50g﹣7.5g=42.5g;
(3)称量氯化钠时,先在右盘中放好砝码,并把游码移动到合适位置,然后再向左盘添加氯化钠,直到天平平衡为止;
(4)溶解过程中玻璃棒的作用是搅拌,加速溶解;
(5)A.称量时,药品与砝码放反了,药品的质量比实际的小,溶质的质量分数会偏小;
B.量取水的体积时,俯视读数,量取的水偏少,会使溶质质量分数偏大;
C.将称取好的氯化钠倒入烧杯中时有少量留在纸上,溶质偏少,会使溶质质量分数偏小。
故选:B;
(6)设要加水的质量为x,
根据溶液稀释前后溶质的质量不变,则50g×15%=(50g+x)×5%
解得x=100g。
故答案为:(1)量筒;
(2)7.5;42.5;
(3)左;
(4)搅拌,加速溶解;
(5)B;
(6)100g。
四、计算题
16.【分析】(1)根据实验数据中第一次中铁与稀硫酸的质量关系,判断样品中铁反应时消耗稀硫酸溶质的质量;根据剩余固体的质量求出合金中铁的质量;
(2)利用稀硫酸溶质的质量和溶液的质量即可求得稀硫酸溶液中溶质的质量分数。
【解答】解:(1)由图表可知,每消耗50g稀硫酸固体减少11.4g﹣8.6g=2.8g,所以a=8.6g﹣2.8g=5.8g;当第四次加入稀硫酸时,合金中铁完全反应,剩余不溶于酸的杂质质量为0.5g,则合金中铁的质量为11.4g﹣0.5g=10.9g;故填:5.8;10.9g
(2)设第一次参加反应的稀硫酸溶质的质量为x,
Fe+H2SO4═FeSO4+H2↑
56 98
2.8g x
=
解得:x=4.9g;
则稀硫酸溶液中溶质的质量分数=×100%=9.8%;
答:所加入的稀硫酸的溶质质量分数9.8%。
五、解答题
17.【分析】(1)根据除油污的原理来分析;
(2)根据影响气体溶解度的因素来分析;
(3)根据反应的原理以及溶液的组成来分析。
【解答】解:(1)衣服上沾有的油污,可用汽油洗去,是因为汽油能溶解油污;故答案为:溶解;
(2)喝了冰镇汽水以后,常常会打嗝,这种现象说明气体的溶解度与温度有关,温度升高,气体的溶解度减小;故答案为:温度;
(3)大理石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳气体,因此大理石与稀盐酸完全反应后的溶质是氯化钙,碘酒是碘的酒精溶液,碘酒中的溶剂是酒精;故答案为:氯化钙;酒精。
18.【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【解答】解:(1)气体、液体、固体都可以作为溶质,故选:D;
(2)配制100g质量分数为的16%氯化钠溶液,所需氯化钠的质量为100g×16%=16g;
(3)通过分析溶解度曲线可知,t1℃时,甲物质的溶解度是:40g,t1℃时,50g 甲物质放入100g水中所得溶液中溶质与溶剂的质量比是40g:100g=2:5;
(4)t2℃时,甲物质的溶解度大于乙物质的溶解度,所以若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是乙物质的饱和溶液。
故答案为:(1)D;
(2)16g;
(3)40g,2:5;
(4)乙。
同课章节目录
