新人教版九年级上册第3章 物质构成的奥秘2023年单元测试卷(含解析)
文档属性
| 名称 | 新人教版九年级上册第3章 物质构成的奥秘2023年单元测试卷(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 223.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-24 20:45:51 | ||
图片预览



文档简介
新人教版九年级上册《第3章 物质构成的奥秘》2023年单元测试卷
一、选择题
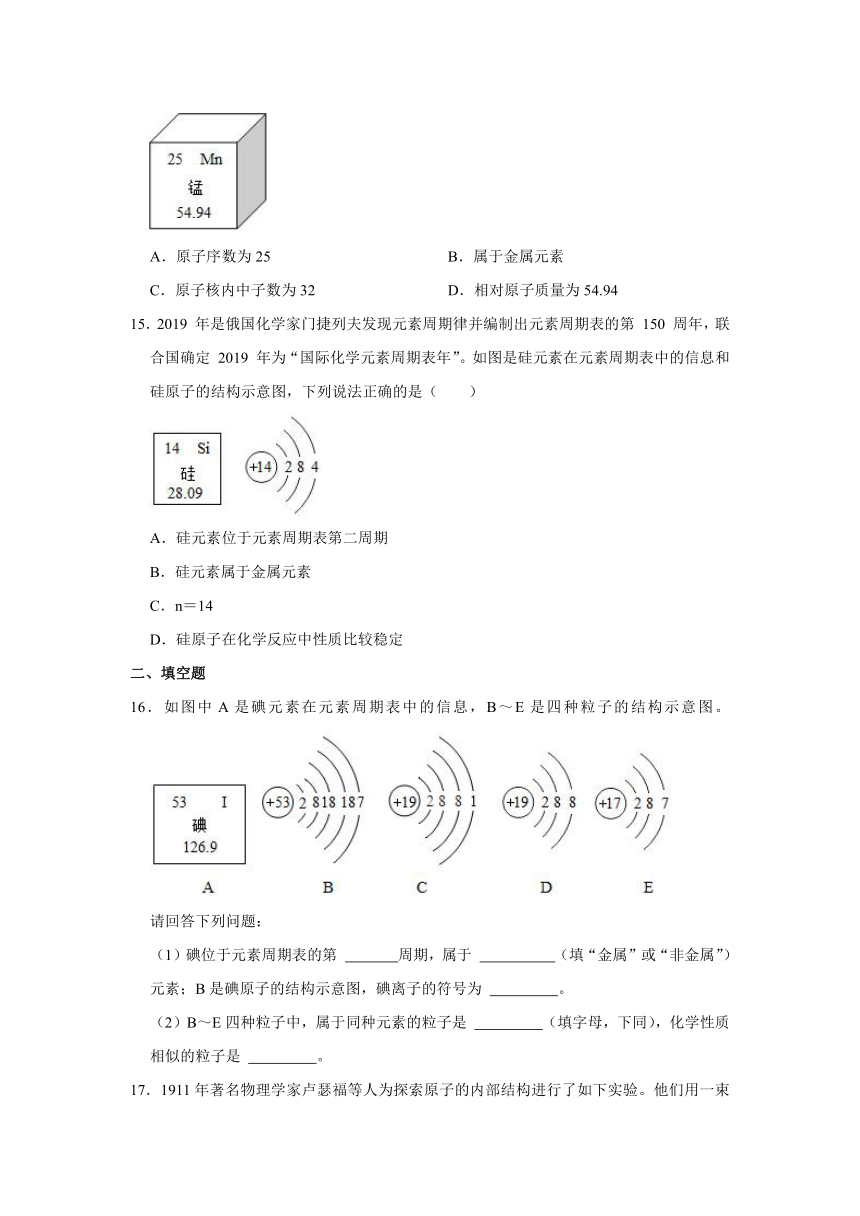
1.从如图图片中不能获取的信息是( )
A.微粒之间有间隔
B.原子是由原子核和电子构成的
C.水分子受热运动速率加快
D.构成物质的粒子有分子、原子和离子
2.宏微结合是研究化学的重要思想。如图所示,提起压在水面上方的活塞,容器中的水发生气化,则相同微小空间内微粒的变化最可能是( )
A. B. C. D.
3.科学家用单个分子制成了“纳米车”(如图),它能在人工操纵下运输药物分子到病源处释放以杀死癌细胞。下列有关“纳米车”的说法正确的是( )
A.“纳米车”的研制成功说明分子要在人为外力作用下才能运动
B.“纳米车”分子不是由原子构成的
C.“纳米车”运输药物分子的过程是肉眼可以直接看见的
D.“纳米车”研制成功说明在一定条件下人可以控制分子运动
4.将密封良好的方便面从平原带到高原后,包装袋会鼓起来,这是因为袋内气体分子的( )
A.体积增大 B.质量增大 C.间隔增大 D.个数增多
5.中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝.已知一种原子的中子数为173,下列关于该原子的说法错误的是( )
A.质子数为116 B.核电荷数为116
C.核外电子数为173 D.相对原子质量为289
6.元素X的核电荷数为a,它的阳离子Xm+与元素Y的阴离子Yn﹣的电子层结构相同,则元素Y的核内质子数是( )
A.a+m+n B.a﹣m+n C.a﹣m﹣n D.a+m﹣n
7.两种不同的微粒M和N,它们的质子数和电子数均相等,则下列描述不正确的是( )
A.M和N 可能是两种不同的离子
B.M和N 可能是两种不同的分子
C.M和N 可能是一种分子和一种离子
D.M和N的中子数也可能相同
8.如图是某原子的结构示意图,以下说法正确的是( )
A.该原子的元素符号为X
B.该原子核外电子总数为4
C.该原子最外层电子数为4
D.该种元素属于金属元素
9.南京理工大学胡炳成团队用新方法制得了NaN5 3H2O.该化合物中含有等微粒。已知N为7号元素,则下列有关说法正确的是( )
A.是一种单质
B.1个带1个单位的正电荷
C.1个中共含有35个质子
D.1个中共含有35个电子
10.法国科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”,它与天体中的中子星构成类似。有关该粒子的说法不正确的是( )
A.不显电性
B.失去一个中子后显+1价
C.相当于一个氦原子的质量
D.周期表中没有该“元素”的位置
11.生物体死亡后,体内含有的碳﹣14会逐渐减少(称为衰变)。因此科学家可通过测量生物体遗骸中碳﹣14的含量,来计算它存活的年代,这种方法称之为放射性碳测年法。碳﹣14原子核中含6个质子与8个中子,在衰变时,有一个中子变成一个质子,形成新的原子核。下列关于新原子核的说法正确的是( )
A.碳原子核,含7个质子,7个中子
B.氮原子核,含7个质子,7个中子
C.碳原子核,含6个质子,7个中子
D.氧原子核,含7个质子,8个中子
12.反物质与自然界的正物质一旦接触,就会相互抵消而湮灭,并释放巨大能量.最近,欧洲核子研究中心的科学家成功制造出数十个反氢原子,并利用特制的“磁瓶”(瓶中存在特殊磁场)成功地使这些具有一定磁性的反氢原子保存了较长时间,这是人类首次捕获到反物质.反物质是由反粒子构成的,反粒子与正粒子的质量相等,电性相反.下列有关说法错误的是( )
A.反氢原子是由一个带负电荷的质子和一个带正电荷的电子构成的
B.“磁瓶”中的特殊磁场可防止反氢原子撞上磁瓶中的正物质发生湮灭现象
C.物质与反物质相遇而湮灭所发生的变化属于化学变化
D.反物质在能源研究领域中前景可观,可能成为未来世界的新能源
13.下列符号中,既能表示一个原子,又能表示一种元素,还能表示一种物质是( )
A.H2 B.O C.2H D.Cu
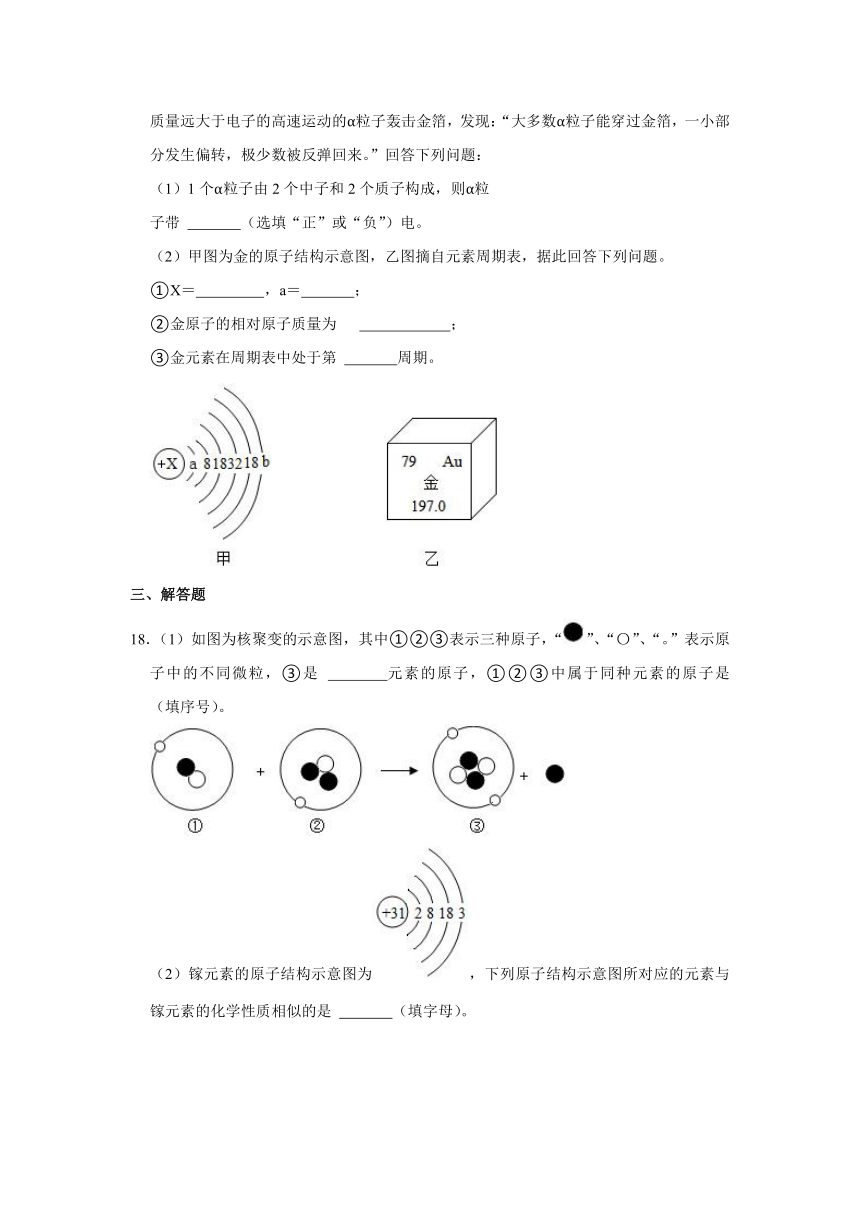
14.北京大学生命科学学院蒋争凡教授研究组发现,锰离子是细胞内天然免疫激活剂和警报素。在元素周期表中锰元素的某些信息如图所示,下列有关锰的说法不正确的是( )
A.原子序数为25 B.属于金属元素
C.原子核内中子数为32 D.相对原子质量为54.94
15.2019 年是俄国化学家门捷列夫发现元素周期律并编制出元素周期表的第 150 周年,联合国确定 2019 年为“国际化学元素周期表年”。如图是硅元素在元素周期表中的信息和硅原子的结构示意图,下列说法正确的是( )
A.硅元素位于元素周期表第二周期
B.硅元素属于金属元素
C.n=14
D.硅原子在化学反应中性质比较稳定
二、填空题
16.如图中A是碘元素在元素周期表中的信息,B~E是四种粒子的结构示意图。
请回答下列问题:
(1)碘位于元素周期表的第 周期,属于 (填“金属”或“非金属”)元素;B是碘原子的结构示意图,碘离子的符号为 。
(2)B~E四种粒子中,属于同种元素的粒子是 (填字母,下同),化学性质相似的粒子是 。
17.1911年著名物理学家卢瑟福等人为探索原子的内部结构进行了如下实验。他们用一束质量远大于电子的高速运动的α粒子轰击金箔,发现:“大多数α粒子能穿过金箔,一小部分发生偏转,极少数被反弹回来。”回答下列问题:
(1)1个α粒子由2个中子和2个质子构成,则α粒
子带 (选填“正”或“负”)电。
(2)甲图为金的原子结构示意图,乙图摘自元素周期表,据此回答下列问题。
①X= ,a= ;
②金原子的相对原子质量为 ;
③金元素在周期表中处于第 周期。
三、解答题
18.(1)如图为核聚变的示意图,其中①②③表示三种原子,“”、“〇”、“。”表示原子中的不同微粒,③是 元素的原子,①②③中属于同种元素的原子是 (填序号)。
(2)镓元素的原子结构示意图为,下列原子结构示意图所对应的元素与镓元素的化学性质相似的是 (填字母)。
新人教版九年级上册《第3章 物质构成的奥秘》2023年单元测试卷(1)
参考答案与试题解析
一、选择题
1.【分析】观察图片进行分析:微粒之间有间隔,微粒的运动,物质的微观构成等。
【解答】解:A、通过观察图片可知,构成物质微粒之间有间隔;故A正确;
B、通过移走硅原子构成文字的图片中的文字是移走原子后所形成的,此图表示由原子构成的物质中原子可以进行移动但却不能说明原子的内部构成;故B不正确;
C、水受热蒸发前后相比,加热后扩散入空气中的水分子明显增加,可说明受热能使水分子运动速率加快,故C正确;
D、从四幅图片可以看出一氧化碳和水由分子构成,氯化钠由离子构成,硅由原子构成,所以构成物质的微粒有:分子、原子、离子。故D正确
故选:B。
2.【分析】根据水汽化属于物理变化,分子组成不变,当物质有液态变为气态时,分子间隔增大进行解答。
【解答】解:分子之间的间隔决定物质的状态,当由液态变为气态时,分子之间的间隔增大,单位空间内的分子个数减少。
故选:C。
3.【分析】A、根据纳米车的作用考虑;B、根据分子和原子的联系考虑;C、根据分子的大小考虑;D、由题给信息来回答本题。
【解答】解:A、“纳米车”的研制成功说明分子要在人为外力作用下能按照人规定的线路运动,并不是说必须在外力作用下才能运动,故A错误;
B、分子和原子的联系是分子都是由原子构成的,故B错误;
C、分子的质量和体积都很小,用肉眼是看不到的,故C错误;
D、“纳米车”的研制成功说明分子在外力作用下能按照人规定的线路运动,说明了人可以控制分子运动,故D正确。
故选:D。
4.【分析】根据分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种物质的分子性质相同,不同物质的分子性质不同,结合事实进行分析判断即可.
【解答】解:A、将密封良好的方便面从平原带到高原时,包装会鼓起,是因为压强减小,分子间的间隔变大,而不是体积增大,故选项错误。
B、将密封良好的方便面从平原带到高原时,包装会鼓起,是因为压强减小,分子间的间隔变大,而不是质量增大,故选项错误。
C、将密封良好的方便面从平原带到高原时,包装会鼓起,是因为压强减小,分子间的间隔变大,故选项正确。
D、将密封良好的方便面从平原带到高原时,包装会鼓起,是因为压强减小,分子间的间隔变大,而不是个数增加,故选项错误。
故选:C。
5.【分析】根据在原子中:原子序数=质子数=核外电子数=核电荷数,相对原子质量=质子数+中子数,进行解答.
【解答】解:A.第116号元素Lv的质子数为116,故A正确;
B.原子序数=质子数=核外电子数=核电荷数=116,故B正确;
C.原子序数=质子数=核外电子数=核电荷数,可知核外电子数为116,故C错误;
D.相对原子质量=质子数+中子数=116+173=289,故D正确。
故选:C。
6.【分析】根据题意,元素X的核电荷数为a,其原子的核内质子数和有外电子数为a,它的阳离子Xm+与元素Y的阴离子Yn﹣的电子层结构相同,进行分析解答。
【解答】解:元素X的核电荷数为a,其原子的核内质子数和有外电子数为a,它的阳离子Xm+与元素Y的阴离子Yn﹣的电子层结构相同,设元素Y的核电荷数是x,原子中核电荷数=核内质子数=核外电子数,则a﹣m=x+n,x=a﹣m﹣n。
故选:C。
7.【分析】根据构成物质的基本粒子有:分子、原子、离子,在分子和原子中质子数等于电子数,对于离子来说质子数与核外电子数是不相同的进行解答。
【解答】解:A、两种不同的离子是可能的,例如:OH﹣和F﹣都含有9个质子,10个电子,故A正确;
B、两种不同的分子是可能的,例如:H2O分子和NH3分子都含有10个质子,10个电子,故B正确;
C、一种分子和一种离子是不可能的,因为对于分子来说质子数和电子数是相等的,对于离子来说质子数和电子数是不相等的,所以一种分子和一种离子要么质子数相等,要么电子数相等,不可能质子数和电子数都相等,故C错误;
D、M和N的中子数也可能相同,例如:HF分子和氖原子都是有10个质子、10个电子、10个中子,故D正确。
故选:C。
8.【分析】根据当质子数=核外电子数,为原子,由某原子的结构示意图确定其核内质子数,进而结合题意进行分析判断即可。
【解答】A.当质子数=核外电子数,为原子,则3x=2+2x,x=2,则该原子的核内质子数为3×2=6,为碳元素的原子,其元素符号为C,故选项说法错误;
B.该原子核外电子总数为2+2×2=6,故选项说法错误;
C.该原子的最外层电子数为2×2=4,故选项说法正确;
D.该元素为碳元素,带“石”字旁,属于固态非金属元素,故选项说法错误;
故选:C。
9.【分析】根据信息可知,高能微粒是一种离子,带一个单位的负电荷,是N5得到一个电子得到的微粒,据此进行分析解答。
【解答】解:氮原子的质子数和电子数均为7,N5的质子数和电子数均为7×5=35;中是N5得到一个电子得到的微粒,所以每个中含有35个质子和36个电子。
A、是一种离子,带一个单位的负电荷,故错误;
B、1个带1个单位的负电荷,故错误;
C、每个中含有35个质子,故正确;
D、每个中含有36个电子,故错误。
故选:C。
10.【分析】根据题意,科学家最近发现一种只由四个中子组成的微粒,这种微粒称为“四中子”,也有人称之为“零号元素”,进行分析判断。
【解答】解:A、由题意,该粒子由四个中子构成,中子不带电,则该粒子不显电性,故选项说法正确。
B、中子不带电,失去一个中子后仍然不显电性,仍显0价,故选项说法错误。
C、根据1个质子和1个中子的质量大约相等,1个质子的相对质量为1,氦的相对原子质量为4,则其质量相当于一个氦(He) 原子的质量,故选项说法正确。
D、元素周期表是按原子序数递增的顺序排列的,由于该粒子没有质子,在现有的周期表中不可能有它的位置,故选项说法正确。
故选:B。
11.【分析】根据题意,碳﹣14原子核中含6个质子与8个中子,在衰变时,一个中子变成质子,形成新的原子核,进行分析解答。
【解答】解:碳﹣14原子核中含6个质子与8个中子,在衰变时,一个中子变成质子,形成新的原子核,则于衰变后生成的新原子核中质子数为6+1=7,中子数为8﹣1=7,即衰变后生成的新原子核含7个质子,7个中子,为氮原子核。
故选:B。
12.【分析】A、根据题意分析反氢原子的构成;
B、根据题意分析“磁瓶”中的特殊磁场的作;
C、根据化学反应的特征分析;
D、根据反应能放出大的能量分析.
【解答】解:A、由题意可知,反氢原子是由一个带负电的质子和一个带正电的电子构成的,故A正确;
B、由题意可知,“磁瓶”中的特殊磁场可防止反氢原子撞上瓶壁而与瓶壁中的正物质发生湮灭现象,故B正确;
C、由于反物质与自然界的正物质一旦接触,就会相互抵消而湮灭,没有新物质生成,不属于化学变化,故C错误;
D、反物质与自然界的正物质一旦接触,就会相互抵消而湮灭,并发生爆炸同时放出巨大能量,可能成为未来世界的新能源,故D正确。
故选:C。
13.【分析】根据化学式与元素符号的含义进行分析解答,金属、大多数固体非金属等都是由原子直接构成的,故它们的元素符号,既能表示一个原子,又能表示一种元素,还能表示一种物质。
【解答】解:元素符号能表示一种元素,还能表示该元素的一个原子;化学式能表示一种物质,当元素符号又是化学式时,就同时具备了上述三层意义。
A、该符号是氢气的化学式,不是元素符号,故选项不符合题意。
B、O属于气态非金属元素,可表示氧元素,表示一个氧原子,但不能表示一种物质,故选项不符合题意。
C、该符号表示2个氢原子,故选项不符合题意。
D、Cu属于金属元素,可表示铜元素,表示一个铜原子,还能表示铜这一纯净物,故选项符合题意。
故选:D。
14.【分析】根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量,进行分析判断即可。
【解答】解:A、根据元素周期表中的一格可知,左上角的数字表示原子序数,该元素的原子序数为25,故选项说法正确。
B、根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称是锰,带“钅”字旁,属于金属元素,故选项说法正确。
C、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为54.94≈55;左上角的数字表示原子序数,该元素的原子序数为25;根据原子中原子序数=核电荷数=质子数=核外电子数,则该元素的原子核内质子数为25;相对原子质量=质子数+中子数,则中子数=55﹣25=30;故选项说法错误。
D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为54.94,故选项说法正确。
故选:C。
15.【分析】元素周期表中,方格中左上角是原子序数,右上角是元素符号,中间是元素名称,下面是相对原子质量;
原子中,核电荷数=核内质子数=核外电子数=原子序数;
除汞外,金属元素的名称都带金字旁,非金属元素的名称不带金字旁;
原子核外电子层数是几,所处周期就是几;
一般情况下,最外层电子数小于4的,反应中容易失去电子,大于4的反应中容易得到电子,等于4的,既不容易得到电子,也不容易失去电子,因此最外层电子数相等的元素化学性质相似,最外层电子数是8的是一种稳定结构,第一层也是最外层时,达到2个电子也是一种稳定结构。
【解答】解:A、硅元素原子核外电子层数是3,元素周期表第三周期,该选项说法不正确;
B、硅元素属于非金属元素,该选项说法不正确;
C、n=14﹣2﹣8=4,该选项说法不正确;
D、硅原子最外层电子数是4,不容易得失电子,化学性质比较稳定,该选项说法正确。
故选:D。
二、填空题
16.【分析】(1)原子核外电子层数与周期数相同;根据碘原子得到1个电子形成碘离子分析。
(2)元素是具有相同质子数的一类原子的总称;最外层电子数相同的原子具有相似的化学性质。
【解答】解:(1)碘原子核外有五个电子层,碘位于元素周期表的第五周期,碘名称是“石”旁,属于非金属元素,碘原子得到1个电子形成碘离子,表示为I﹣。
(2)元素是具有相同质子数的一类原子的总称,同种元素质子数相同,C、D质子数都是19,属于同种元素;B、E化学性质相似,因为它们最外层电子数相同。
故答案为:(1)五;非金属;I﹣;
(2)CD;BE。
17.【分析】(1)中子不带电,质子带正电荷;
(2)原子中,核电荷数=核内质子数=核外电子数=原子序数;
相对原子质量是原子的相对质量;
元素的原子核外电子层数是几,所处周期就是几。
【解答】解:(1)1个α粒子由2个中子和2个质子构成,中子不带电,质子带正电荷,则α粒子带正电。
故答案为:正。
(2)①原子中,核电荷数=核内质子数=核外电子数=原子序数,X=79,第一层最多排2个电子,a=2。
故答案为:79;2。
②金原子的相对原子质量是197.0。
故答案为:197.0。
③金元素的原子核外电子层数是6,在周期表中处于第六周期。
故答案为:六。
三、解答题
18.【分析】根据核内质子数=核外电子数,元素的化学性质决定于原子的最外层电子数进行分析解答即可。
【解答】解:(1)据图可以看出,③的核外电子数是2,故核内质子数为2,是氦元素的原子,①②原子的核外电子数都是1个,故核内质子数都是1个,属于同种元素的原子,故填:氦;①②;
(2)元素的化学性质决定于原子的最外层电子数,镓原子的最外层电子数为3,故与镓元素的化学性质相似的是B,故填:B。
一、选择题
1.从如图图片中不能获取的信息是( )
A.微粒之间有间隔
B.原子是由原子核和电子构成的
C.水分子受热运动速率加快
D.构成物质的粒子有分子、原子和离子
2.宏微结合是研究化学的重要思想。如图所示,提起压在水面上方的活塞,容器中的水发生气化,则相同微小空间内微粒的变化最可能是( )
A. B. C. D.
3.科学家用单个分子制成了“纳米车”(如图),它能在人工操纵下运输药物分子到病源处释放以杀死癌细胞。下列有关“纳米车”的说法正确的是( )
A.“纳米车”的研制成功说明分子要在人为外力作用下才能运动
B.“纳米车”分子不是由原子构成的
C.“纳米车”运输药物分子的过程是肉眼可以直接看见的
D.“纳米车”研制成功说明在一定条件下人可以控制分子运动
4.将密封良好的方便面从平原带到高原后,包装袋会鼓起来,这是因为袋内气体分子的( )
A.体积增大 B.质量增大 C.间隔增大 D.个数增多
5.中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝.已知一种原子的中子数为173,下列关于该原子的说法错误的是( )
A.质子数为116 B.核电荷数为116
C.核外电子数为173 D.相对原子质量为289
6.元素X的核电荷数为a,它的阳离子Xm+与元素Y的阴离子Yn﹣的电子层结构相同,则元素Y的核内质子数是( )
A.a+m+n B.a﹣m+n C.a﹣m﹣n D.a+m﹣n
7.两种不同的微粒M和N,它们的质子数和电子数均相等,则下列描述不正确的是( )
A.M和N 可能是两种不同的离子
B.M和N 可能是两种不同的分子
C.M和N 可能是一种分子和一种离子
D.M和N的中子数也可能相同
8.如图是某原子的结构示意图,以下说法正确的是( )
A.该原子的元素符号为X
B.该原子核外电子总数为4
C.该原子最外层电子数为4
D.该种元素属于金属元素
9.南京理工大学胡炳成团队用新方法制得了NaN5 3H2O.该化合物中含有等微粒。已知N为7号元素,则下列有关说法正确的是( )
A.是一种单质
B.1个带1个单位的正电荷
C.1个中共含有35个质子
D.1个中共含有35个电子
10.法国科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”,它与天体中的中子星构成类似。有关该粒子的说法不正确的是( )
A.不显电性
B.失去一个中子后显+1价
C.相当于一个氦原子的质量
D.周期表中没有该“元素”的位置
11.生物体死亡后,体内含有的碳﹣14会逐渐减少(称为衰变)。因此科学家可通过测量生物体遗骸中碳﹣14的含量,来计算它存活的年代,这种方法称之为放射性碳测年法。碳﹣14原子核中含6个质子与8个中子,在衰变时,有一个中子变成一个质子,形成新的原子核。下列关于新原子核的说法正确的是( )
A.碳原子核,含7个质子,7个中子
B.氮原子核,含7个质子,7个中子
C.碳原子核,含6个质子,7个中子
D.氧原子核,含7个质子,8个中子
12.反物质与自然界的正物质一旦接触,就会相互抵消而湮灭,并释放巨大能量.最近,欧洲核子研究中心的科学家成功制造出数十个反氢原子,并利用特制的“磁瓶”(瓶中存在特殊磁场)成功地使这些具有一定磁性的反氢原子保存了较长时间,这是人类首次捕获到反物质.反物质是由反粒子构成的,反粒子与正粒子的质量相等,电性相反.下列有关说法错误的是( )
A.反氢原子是由一个带负电荷的质子和一个带正电荷的电子构成的
B.“磁瓶”中的特殊磁场可防止反氢原子撞上磁瓶中的正物质发生湮灭现象
C.物质与反物质相遇而湮灭所发生的变化属于化学变化
D.反物质在能源研究领域中前景可观,可能成为未来世界的新能源
13.下列符号中,既能表示一个原子,又能表示一种元素,还能表示一种物质是( )
A.H2 B.O C.2H D.Cu
14.北京大学生命科学学院蒋争凡教授研究组发现,锰离子是细胞内天然免疫激活剂和警报素。在元素周期表中锰元素的某些信息如图所示,下列有关锰的说法不正确的是( )
A.原子序数为25 B.属于金属元素
C.原子核内中子数为32 D.相对原子质量为54.94
15.2019 年是俄国化学家门捷列夫发现元素周期律并编制出元素周期表的第 150 周年,联合国确定 2019 年为“国际化学元素周期表年”。如图是硅元素在元素周期表中的信息和硅原子的结构示意图,下列说法正确的是( )
A.硅元素位于元素周期表第二周期
B.硅元素属于金属元素
C.n=14
D.硅原子在化学反应中性质比较稳定
二、填空题
16.如图中A是碘元素在元素周期表中的信息,B~E是四种粒子的结构示意图。
请回答下列问题:
(1)碘位于元素周期表的第 周期,属于 (填“金属”或“非金属”)元素;B是碘原子的结构示意图,碘离子的符号为 。
(2)B~E四种粒子中,属于同种元素的粒子是 (填字母,下同),化学性质相似的粒子是 。
17.1911年著名物理学家卢瑟福等人为探索原子的内部结构进行了如下实验。他们用一束质量远大于电子的高速运动的α粒子轰击金箔,发现:“大多数α粒子能穿过金箔,一小部分发生偏转,极少数被反弹回来。”回答下列问题:
(1)1个α粒子由2个中子和2个质子构成,则α粒
子带 (选填“正”或“负”)电。
(2)甲图为金的原子结构示意图,乙图摘自元素周期表,据此回答下列问题。
①X= ,a= ;
②金原子的相对原子质量为 ;
③金元素在周期表中处于第 周期。
三、解答题
18.(1)如图为核聚变的示意图,其中①②③表示三种原子,“”、“〇”、“。”表示原子中的不同微粒,③是 元素的原子,①②③中属于同种元素的原子是 (填序号)。
(2)镓元素的原子结构示意图为,下列原子结构示意图所对应的元素与镓元素的化学性质相似的是 (填字母)。
新人教版九年级上册《第3章 物质构成的奥秘》2023年单元测试卷(1)
参考答案与试题解析
一、选择题
1.【分析】观察图片进行分析:微粒之间有间隔,微粒的运动,物质的微观构成等。
【解答】解:A、通过观察图片可知,构成物质微粒之间有间隔;故A正确;
B、通过移走硅原子构成文字的图片中的文字是移走原子后所形成的,此图表示由原子构成的物质中原子可以进行移动但却不能说明原子的内部构成;故B不正确;
C、水受热蒸发前后相比,加热后扩散入空气中的水分子明显增加,可说明受热能使水分子运动速率加快,故C正确;
D、从四幅图片可以看出一氧化碳和水由分子构成,氯化钠由离子构成,硅由原子构成,所以构成物质的微粒有:分子、原子、离子。故D正确
故选:B。
2.【分析】根据水汽化属于物理变化,分子组成不变,当物质有液态变为气态时,分子间隔增大进行解答。
【解答】解:分子之间的间隔决定物质的状态,当由液态变为气态时,分子之间的间隔增大,单位空间内的分子个数减少。
故选:C。
3.【分析】A、根据纳米车的作用考虑;B、根据分子和原子的联系考虑;C、根据分子的大小考虑;D、由题给信息来回答本题。
【解答】解:A、“纳米车”的研制成功说明分子要在人为外力作用下能按照人规定的线路运动,并不是说必须在外力作用下才能运动,故A错误;
B、分子和原子的联系是分子都是由原子构成的,故B错误;
C、分子的质量和体积都很小,用肉眼是看不到的,故C错误;
D、“纳米车”的研制成功说明分子在外力作用下能按照人规定的线路运动,说明了人可以控制分子运动,故D正确。
故选:D。
4.【分析】根据分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种物质的分子性质相同,不同物质的分子性质不同,结合事实进行分析判断即可.
【解答】解:A、将密封良好的方便面从平原带到高原时,包装会鼓起,是因为压强减小,分子间的间隔变大,而不是体积增大,故选项错误。
B、将密封良好的方便面从平原带到高原时,包装会鼓起,是因为压强减小,分子间的间隔变大,而不是质量增大,故选项错误。
C、将密封良好的方便面从平原带到高原时,包装会鼓起,是因为压强减小,分子间的间隔变大,故选项正确。
D、将密封良好的方便面从平原带到高原时,包装会鼓起,是因为压强减小,分子间的间隔变大,而不是个数增加,故选项错误。
故选:C。
5.【分析】根据在原子中:原子序数=质子数=核外电子数=核电荷数,相对原子质量=质子数+中子数,进行解答.
【解答】解:A.第116号元素Lv的质子数为116,故A正确;
B.原子序数=质子数=核外电子数=核电荷数=116,故B正确;
C.原子序数=质子数=核外电子数=核电荷数,可知核外电子数为116,故C错误;
D.相对原子质量=质子数+中子数=116+173=289,故D正确。
故选:C。
6.【分析】根据题意,元素X的核电荷数为a,其原子的核内质子数和有外电子数为a,它的阳离子Xm+与元素Y的阴离子Yn﹣的电子层结构相同,进行分析解答。
【解答】解:元素X的核电荷数为a,其原子的核内质子数和有外电子数为a,它的阳离子Xm+与元素Y的阴离子Yn﹣的电子层结构相同,设元素Y的核电荷数是x,原子中核电荷数=核内质子数=核外电子数,则a﹣m=x+n,x=a﹣m﹣n。
故选:C。
7.【分析】根据构成物质的基本粒子有:分子、原子、离子,在分子和原子中质子数等于电子数,对于离子来说质子数与核外电子数是不相同的进行解答。
【解答】解:A、两种不同的离子是可能的,例如:OH﹣和F﹣都含有9个质子,10个电子,故A正确;
B、两种不同的分子是可能的,例如:H2O分子和NH3分子都含有10个质子,10个电子,故B正确;
C、一种分子和一种离子是不可能的,因为对于分子来说质子数和电子数是相等的,对于离子来说质子数和电子数是不相等的,所以一种分子和一种离子要么质子数相等,要么电子数相等,不可能质子数和电子数都相等,故C错误;
D、M和N的中子数也可能相同,例如:HF分子和氖原子都是有10个质子、10个电子、10个中子,故D正确。
故选:C。
8.【分析】根据当质子数=核外电子数,为原子,由某原子的结构示意图确定其核内质子数,进而结合题意进行分析判断即可。
【解答】A.当质子数=核外电子数,为原子,则3x=2+2x,x=2,则该原子的核内质子数为3×2=6,为碳元素的原子,其元素符号为C,故选项说法错误;
B.该原子核外电子总数为2+2×2=6,故选项说法错误;
C.该原子的最外层电子数为2×2=4,故选项说法正确;
D.该元素为碳元素,带“石”字旁,属于固态非金属元素,故选项说法错误;
故选:C。
9.【分析】根据信息可知,高能微粒是一种离子,带一个单位的负电荷,是N5得到一个电子得到的微粒,据此进行分析解答。
【解答】解:氮原子的质子数和电子数均为7,N5的质子数和电子数均为7×5=35;中是N5得到一个电子得到的微粒,所以每个中含有35个质子和36个电子。
A、是一种离子,带一个单位的负电荷,故错误;
B、1个带1个单位的负电荷,故错误;
C、每个中含有35个质子,故正确;
D、每个中含有36个电子,故错误。
故选:C。
10.【分析】根据题意,科学家最近发现一种只由四个中子组成的微粒,这种微粒称为“四中子”,也有人称之为“零号元素”,进行分析判断。
【解答】解:A、由题意,该粒子由四个中子构成,中子不带电,则该粒子不显电性,故选项说法正确。
B、中子不带电,失去一个中子后仍然不显电性,仍显0价,故选项说法错误。
C、根据1个质子和1个中子的质量大约相等,1个质子的相对质量为1,氦的相对原子质量为4,则其质量相当于一个氦(He) 原子的质量,故选项说法正确。
D、元素周期表是按原子序数递增的顺序排列的,由于该粒子没有质子,在现有的周期表中不可能有它的位置,故选项说法正确。
故选:B。
11.【分析】根据题意,碳﹣14原子核中含6个质子与8个中子,在衰变时,一个中子变成质子,形成新的原子核,进行分析解答。
【解答】解:碳﹣14原子核中含6个质子与8个中子,在衰变时,一个中子变成质子,形成新的原子核,则于衰变后生成的新原子核中质子数为6+1=7,中子数为8﹣1=7,即衰变后生成的新原子核含7个质子,7个中子,为氮原子核。
故选:B。
12.【分析】A、根据题意分析反氢原子的构成;
B、根据题意分析“磁瓶”中的特殊磁场的作;
C、根据化学反应的特征分析;
D、根据反应能放出大的能量分析.
【解答】解:A、由题意可知,反氢原子是由一个带负电的质子和一个带正电的电子构成的,故A正确;
B、由题意可知,“磁瓶”中的特殊磁场可防止反氢原子撞上瓶壁而与瓶壁中的正物质发生湮灭现象,故B正确;
C、由于反物质与自然界的正物质一旦接触,就会相互抵消而湮灭,没有新物质生成,不属于化学变化,故C错误;
D、反物质与自然界的正物质一旦接触,就会相互抵消而湮灭,并发生爆炸同时放出巨大能量,可能成为未来世界的新能源,故D正确。
故选:C。
13.【分析】根据化学式与元素符号的含义进行分析解答,金属、大多数固体非金属等都是由原子直接构成的,故它们的元素符号,既能表示一个原子,又能表示一种元素,还能表示一种物质。
【解答】解:元素符号能表示一种元素,还能表示该元素的一个原子;化学式能表示一种物质,当元素符号又是化学式时,就同时具备了上述三层意义。
A、该符号是氢气的化学式,不是元素符号,故选项不符合题意。
B、O属于气态非金属元素,可表示氧元素,表示一个氧原子,但不能表示一种物质,故选项不符合题意。
C、该符号表示2个氢原子,故选项不符合题意。
D、Cu属于金属元素,可表示铜元素,表示一个铜原子,还能表示铜这一纯净物,故选项符合题意。
故选:D。
14.【分析】根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量,进行分析判断即可。
【解答】解:A、根据元素周期表中的一格可知,左上角的数字表示原子序数,该元素的原子序数为25,故选项说法正确。
B、根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称是锰,带“钅”字旁,属于金属元素,故选项说法正确。
C、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为54.94≈55;左上角的数字表示原子序数,该元素的原子序数为25;根据原子中原子序数=核电荷数=质子数=核外电子数,则该元素的原子核内质子数为25;相对原子质量=质子数+中子数,则中子数=55﹣25=30;故选项说法错误。
D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为54.94,故选项说法正确。
故选:C。
15.【分析】元素周期表中,方格中左上角是原子序数,右上角是元素符号,中间是元素名称,下面是相对原子质量;
原子中,核电荷数=核内质子数=核外电子数=原子序数;
除汞外,金属元素的名称都带金字旁,非金属元素的名称不带金字旁;
原子核外电子层数是几,所处周期就是几;
一般情况下,最外层电子数小于4的,反应中容易失去电子,大于4的反应中容易得到电子,等于4的,既不容易得到电子,也不容易失去电子,因此最外层电子数相等的元素化学性质相似,最外层电子数是8的是一种稳定结构,第一层也是最外层时,达到2个电子也是一种稳定结构。
【解答】解:A、硅元素原子核外电子层数是3,元素周期表第三周期,该选项说法不正确;
B、硅元素属于非金属元素,该选项说法不正确;
C、n=14﹣2﹣8=4,该选项说法不正确;
D、硅原子最外层电子数是4,不容易得失电子,化学性质比较稳定,该选项说法正确。
故选:D。
二、填空题
16.【分析】(1)原子核外电子层数与周期数相同;根据碘原子得到1个电子形成碘离子分析。
(2)元素是具有相同质子数的一类原子的总称;最外层电子数相同的原子具有相似的化学性质。
【解答】解:(1)碘原子核外有五个电子层,碘位于元素周期表的第五周期,碘名称是“石”旁,属于非金属元素,碘原子得到1个电子形成碘离子,表示为I﹣。
(2)元素是具有相同质子数的一类原子的总称,同种元素质子数相同,C、D质子数都是19,属于同种元素;B、E化学性质相似,因为它们最外层电子数相同。
故答案为:(1)五;非金属;I﹣;
(2)CD;BE。
17.【分析】(1)中子不带电,质子带正电荷;
(2)原子中,核电荷数=核内质子数=核外电子数=原子序数;
相对原子质量是原子的相对质量;
元素的原子核外电子层数是几,所处周期就是几。
【解答】解:(1)1个α粒子由2个中子和2个质子构成,中子不带电,质子带正电荷,则α粒子带正电。
故答案为:正。
(2)①原子中,核电荷数=核内质子数=核外电子数=原子序数,X=79,第一层最多排2个电子,a=2。
故答案为:79;2。
②金原子的相对原子质量是197.0。
故答案为:197.0。
③金元素的原子核外电子层数是6,在周期表中处于第六周期。
故答案为:六。
三、解答题
18.【分析】根据核内质子数=核外电子数,元素的化学性质决定于原子的最外层电子数进行分析解答即可。
【解答】解:(1)据图可以看出,③的核外电子数是2,故核内质子数为2,是氦元素的原子,①②原子的核外电子数都是1个,故核内质子数都是1个,属于同种元素的原子,故填:氦;①②;
(2)元素的化学性质决定于原子的最外层电子数,镓原子的最外层电子数为3,故与镓元素的化学性质相似的是B,故填:B。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
