3.1.1氯气的发现与制备 课件(共17张PPT) 2023-2024学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 3.1.1氯气的发现与制备 课件(共17张PPT) 2023-2024学年高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-24 19:42:26 | ||
图片预览





文档简介
(共17张PPT)
专题3 从海水中获得的化学物质
第一单元 氯气及氯的化合物
第一课时 氯气的发现与制备
[学习目标]
1.知道海水中的丰富资源和氯化钠作为重要工业原料的主要用途。
2.学会实验室制取氯气的方法,通过分析、推理、设计实验并完成实验。
3.初步认识工业上电解饱和食盐水制取氯气的反应原理。
一、氯气的发现
1774年瑞典化学家舍勒发现了氯气
1810年,英国化学戴维研究后得出这种气体只有一种元素组成。早年,我国曾命名为“绿气”,后改为“氯气”。
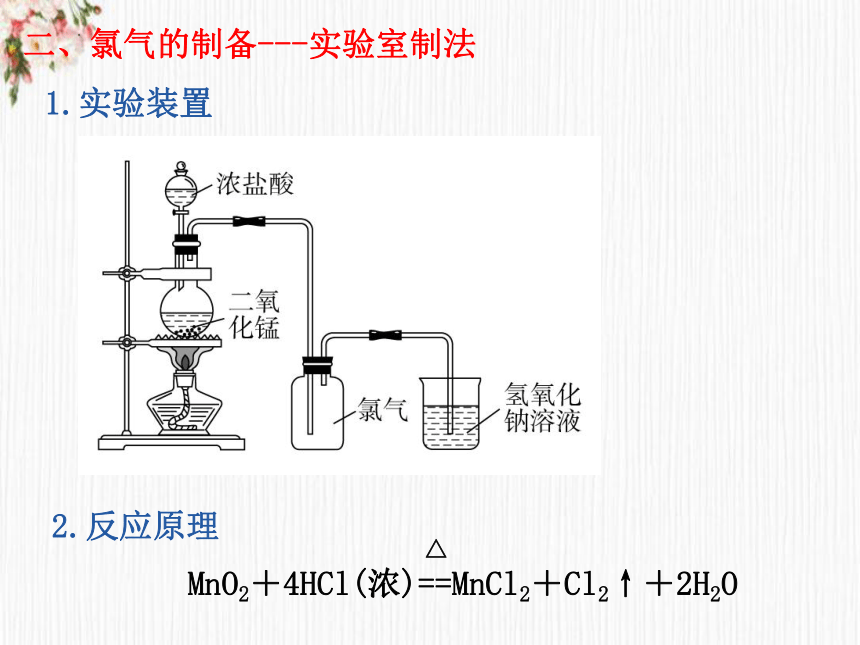
二、氯气的制备---实验室制法
1.实验装置
2.反应原理
MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O
△
注意:
(1)必须用浓盐酸与MnO2反应制Cl2,MnO2与稀盐酸不反应。随着反应的进行,浓盐酸变为稀盐酸时,反应停止,故盐酸中的HCl不可能全部参加反应。
(2)此反应必须加热,加热温度不宜过高,减少HCl的挥发。
(3)制取的氯气有毒,且在加热时易逸出,所以应选用分液漏斗,而不用长颈漏斗。
MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O
△
讨论:氯元素的化合价的变化情况?
(4)实验结束后,先使反应停止并排出装置中残留的Cl2,再拆卸装置,避免污染空气。
(5)Cl2有毒,必须有尾气吸收,尾气处理溶液不能用澄清石灰水吸收Cl2,因为澄清石灰水中Ca(OH)2浓度小,吸收不完全。
思考:
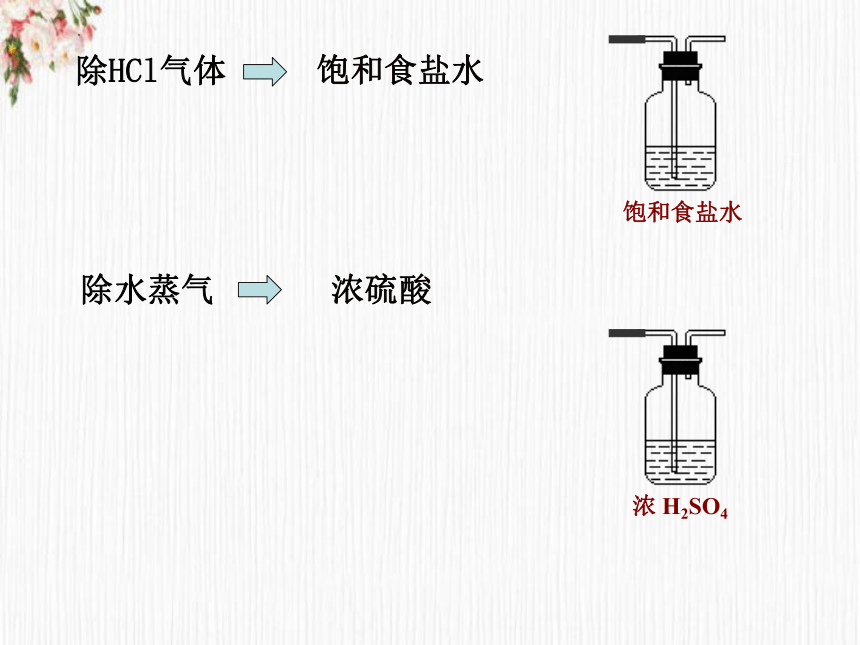
是否收集到纯净的氯气?含有哪些杂质?如何除去?
?
HCl气体和水蒸气
除水蒸气
浓 H2SO4
除HCl气体
饱和食盐水
饱和食盐水
浓硫酸
结合上面的讨论,得出制取氯气的完整装置图。
小结:氯气的实验室制备
1.某学生设计如下实验装置用于制备纯净的Cl2。
(1)装置中有五处错误,请指出:①_______________________________________________________________;②_______________________________________________________________;③_______________________________________________________________;④_______________________________________________________________;⑤_______________________________________________________________。(2)在更正后的装置图中,分析饱和食盐水、浓硫酸、NaOH溶液的作用。①饱和食盐水:____________________________________________________;②浓硫酸:________________________________________________________;③NaOH溶液:____________________________________________________。
答案 (1)①不能用长颈漏斗,应用分液漏斗 ②不能用稀盐酸,应用浓盐酸 ③没有酒精灯,应用酒精灯加热 ④C和D位置颠倒,应互换位置 ⑤D中的进气导管未插入液面下,出气导管不应插入液面下,应“长进短出”(2)①除去混在氯气中的HCl ②除去混在氯气中的水蒸气 ③吸收多余的氯气,防止污染环境
三、氯气的制备---工业制法
观察思考:
(1)接通电源,观察铁棒和石墨棒上发生的变化。通电一段时间后,将小试管套在a管上,收集U形管左端产生的气体。2 min后,提起小试管,并迅速用拇指堵住试管口,移近点燃的酒精灯,松开拇指,听到尖锐的爆鸣声。
(2)取一支小试管,用向上排空气法收集从b管导出的气体,收集到的气体的颜色为黄绿色。 (3)关闭电源,打开U形管左端的橡皮塞,向溶液中滴加1~2滴酚酞溶液,溶液的颜色变红。
阴极
阳极
电解饱和食盐水的产物
(1)阳极:
(2)阴极:
(3)化学方程式:
Cl2
H2和NaOH
根据反应的产物,我们将其命名为什么工业呢?
氯碱工业
2NaCl+2H2O====2NaOH+H2↑+Cl2↑
通电
注意:
1.在氯碱工业中,必须通电才能实现生成H2、Cl2和NaOH,所以在书写方程式时一定要注明反应条件。 2.H2在阴极(与电源负极相连的一极)上产生,Cl2在阳极(与电源正极相连的一极)上产生,NaOH在产生H2的一侧产生。相同状况下,阴、阳两极上产生气体的体积比为1∶1。 3.用U形管电解饱和食盐水,将产生的H2与Cl2分离,防止混合而发生爆炸。 4.检验Cl2的反应为Cl2+2KI===2KCl+I2,淀粉遇I2变蓝。
学科提炼-----技术应用促进化学科学发展
200多年前,科学家运用电解方法成功制备了一系列新物质,提高了反应的选择性,将原本不能进行的化学反应,通过外加电流迫使电子转移使之发生氧化还原反应。这一方法成为人类利用化学反应制备新物质的重要里程碑,电解也促进了化学分支科学-电化学的发展。电解将廉价海水中的氯化钠转化为生产、生活和科学实验中用途广泛的氢氧化钠、氯气和氢气,并应用隔膜电解槽的技术将产物分离出来,这充分说明了技术手段的创新,可以生产出更多人类发展所需要的新物质。
1.下列关于氯气制取方法的说法中,不正确的是( ) A.电解饱和食盐水制氯气时,与电源正极相连的石墨棒上方充满黄绿色气体 B.工业上用电解饱和食盐水的方法制取氯气的同时得到烧碱 C.实验室制氯气和电解饱和食盐水制氯气反应原理不同 D.实验室制取氯气时最好大火加热使温度迅速升高
随堂检测
D
2.工业上用电解法制备烧碱和金属钠,化学反应原理如下:反应1:2NaCl+2H2O通电(=====)2NaOH+H2↑+Cl2↑反应2:2NaCl(熔融)通电(=====)2Na+Cl2↑下列有关说法错误的是( ) A.制备烧碱的副产物可用于制盐酸 B.电解2 L 0.5 mol·L-1 NaCl溶液最多生成40 g NaOH C.反应1、反应2产生的气体均可以直接排入空气中 D.电解58.5 g NaCl(熔融)最多生成11.2 L(标准状况下)Cl2
C
谢谢观看
专题3 从海水中获得的化学物质
第一单元 氯气及氯的化合物
第一课时 氯气的发现与制备
[学习目标]
1.知道海水中的丰富资源和氯化钠作为重要工业原料的主要用途。
2.学会实验室制取氯气的方法,通过分析、推理、设计实验并完成实验。
3.初步认识工业上电解饱和食盐水制取氯气的反应原理。
一、氯气的发现
1774年瑞典化学家舍勒发现了氯气
1810年,英国化学戴维研究后得出这种气体只有一种元素组成。早年,我国曾命名为“绿气”,后改为“氯气”。
二、氯气的制备---实验室制法
1.实验装置
2.反应原理
MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O
△
注意:
(1)必须用浓盐酸与MnO2反应制Cl2,MnO2与稀盐酸不反应。随着反应的进行,浓盐酸变为稀盐酸时,反应停止,故盐酸中的HCl不可能全部参加反应。
(2)此反应必须加热,加热温度不宜过高,减少HCl的挥发。
(3)制取的氯气有毒,且在加热时易逸出,所以应选用分液漏斗,而不用长颈漏斗。
MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O
△
讨论:氯元素的化合价的变化情况?
(4)实验结束后,先使反应停止并排出装置中残留的Cl2,再拆卸装置,避免污染空气。
(5)Cl2有毒,必须有尾气吸收,尾气处理溶液不能用澄清石灰水吸收Cl2,因为澄清石灰水中Ca(OH)2浓度小,吸收不完全。
思考:
是否收集到纯净的氯气?含有哪些杂质?如何除去?
?
HCl气体和水蒸气
除水蒸气
浓 H2SO4
除HCl气体
饱和食盐水
饱和食盐水
浓硫酸
结合上面的讨论,得出制取氯气的完整装置图。
小结:氯气的实验室制备
1.某学生设计如下实验装置用于制备纯净的Cl2。
(1)装置中有五处错误,请指出:①_______________________________________________________________;②_______________________________________________________________;③_______________________________________________________________;④_______________________________________________________________;⑤_______________________________________________________________。(2)在更正后的装置图中,分析饱和食盐水、浓硫酸、NaOH溶液的作用。①饱和食盐水:____________________________________________________;②浓硫酸:________________________________________________________;③NaOH溶液:____________________________________________________。
答案 (1)①不能用长颈漏斗,应用分液漏斗 ②不能用稀盐酸,应用浓盐酸 ③没有酒精灯,应用酒精灯加热 ④C和D位置颠倒,应互换位置 ⑤D中的进气导管未插入液面下,出气导管不应插入液面下,应“长进短出”(2)①除去混在氯气中的HCl ②除去混在氯气中的水蒸气 ③吸收多余的氯气,防止污染环境
三、氯气的制备---工业制法
观察思考:
(1)接通电源,观察铁棒和石墨棒上发生的变化。通电一段时间后,将小试管套在a管上,收集U形管左端产生的气体。2 min后,提起小试管,并迅速用拇指堵住试管口,移近点燃的酒精灯,松开拇指,听到尖锐的爆鸣声。
(2)取一支小试管,用向上排空气法收集从b管导出的气体,收集到的气体的颜色为黄绿色。 (3)关闭电源,打开U形管左端的橡皮塞,向溶液中滴加1~2滴酚酞溶液,溶液的颜色变红。
阴极
阳极
电解饱和食盐水的产物
(1)阳极:
(2)阴极:
(3)化学方程式:
Cl2
H2和NaOH
根据反应的产物,我们将其命名为什么工业呢?
氯碱工业
2NaCl+2H2O====2NaOH+H2↑+Cl2↑
通电
注意:
1.在氯碱工业中,必须通电才能实现生成H2、Cl2和NaOH,所以在书写方程式时一定要注明反应条件。 2.H2在阴极(与电源负极相连的一极)上产生,Cl2在阳极(与电源正极相连的一极)上产生,NaOH在产生H2的一侧产生。相同状况下,阴、阳两极上产生气体的体积比为1∶1。 3.用U形管电解饱和食盐水,将产生的H2与Cl2分离,防止混合而发生爆炸。 4.检验Cl2的反应为Cl2+2KI===2KCl+I2,淀粉遇I2变蓝。
学科提炼-----技术应用促进化学科学发展
200多年前,科学家运用电解方法成功制备了一系列新物质,提高了反应的选择性,将原本不能进行的化学反应,通过外加电流迫使电子转移使之发生氧化还原反应。这一方法成为人类利用化学反应制备新物质的重要里程碑,电解也促进了化学分支科学-电化学的发展。电解将廉价海水中的氯化钠转化为生产、生活和科学实验中用途广泛的氢氧化钠、氯气和氢气,并应用隔膜电解槽的技术将产物分离出来,这充分说明了技术手段的创新,可以生产出更多人类发展所需要的新物质。
1.下列关于氯气制取方法的说法中,不正确的是( ) A.电解饱和食盐水制氯气时,与电源正极相连的石墨棒上方充满黄绿色气体 B.工业上用电解饱和食盐水的方法制取氯气的同时得到烧碱 C.实验室制氯气和电解饱和食盐水制氯气反应原理不同 D.实验室制取氯气时最好大火加热使温度迅速升高
随堂检测
D
2.工业上用电解法制备烧碱和金属钠,化学反应原理如下:反应1:2NaCl+2H2O通电(=====)2NaOH+H2↑+Cl2↑反应2:2NaCl(熔融)通电(=====)2Na+Cl2↑下列有关说法错误的是( ) A.制备烧碱的副产物可用于制盐酸 B.电解2 L 0.5 mol·L-1 NaCl溶液最多生成40 g NaOH C.反应1、反应2产生的气体均可以直接排入空气中 D.电解58.5 g NaCl(熔融)最多生成11.2 L(标准状况下)Cl2
C
谢谢观看
