4.3金属的腐蚀与防护 (含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.3金属的腐蚀与防护 (含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 365.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-24 19:45:00 | ||
图片预览

文档简介
4.3金属的腐蚀与防护同步练习题
一、选择题
1.为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入硫酸酸化的3%NaCl溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是
A.加入酸性KMnO4溶液紫红色不褪去 B.加入淀粉碘化钾溶液无蓝色出现
C.加入KSCN溶液无红色出现 D.加入AgNO3溶液产生沉淀
2.普通锌锰干电池的简图如图所示,该电池工作时的总反应为。下列关于锌锰干电池的说法中正确的是
A.电池工作时,移向石墨电极
B.电池工作时电子从石墨电极流向锌筒
C.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
D.电池负极反应式为
3.化学与生活密切相关,下列叙述错误的是
A.用飞机播撒AgI是实现人工增雨的方法之一
B.节日燃放的烟花能够呈现各种艳丽的色彩,与焰色试验有关
C.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极法
D.高纯硅可用于制作光导纤维
4.下列说法错误的是
A.纯铁比生铁易生锈 B.煤的干馏是化学变化
C.臭氧可用于自来水消毒 D.高纯硅可用于制芯片
5.下列有关说法正确的是
A.室温下不能自发进行,说明该反应的ΔH<0
B.一个化学反应的ΔH与实际参加化学反应的物质的多少无关,而与热化学方程式的计量系数有关
C.中和热测定实验中,将碱溶液分多次缓慢加入酸溶液中可减小实验误差
D.在海轮外壳连接锌块保护外壳不受腐蚀采用的是牺牲阳极的阴极保护法,属于电解原理
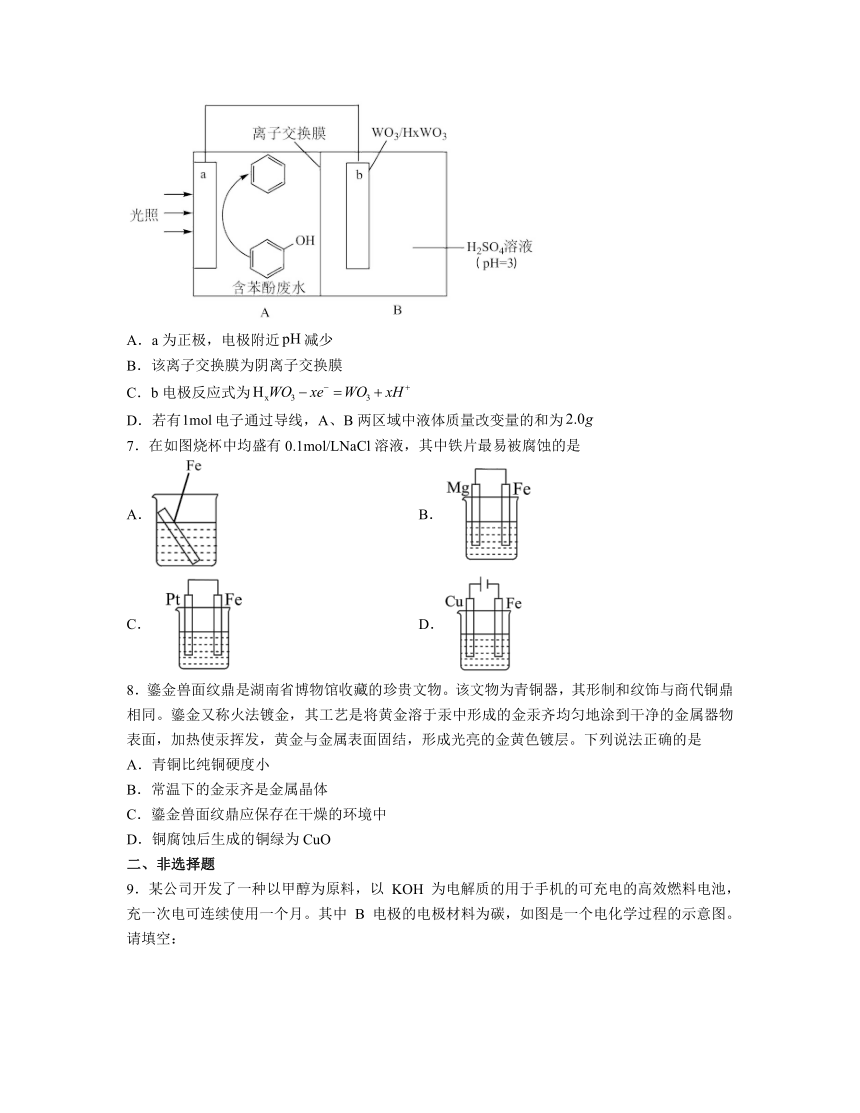
6.如图是处理废水中苯酚的装置,回收利用苯后再排放。下列有关说法正确的是
A.a为正极,电极附近减少
B.该离子交换膜为阴离子交换膜
C.b电极反应式为
D.若有电子通过导线,A、B两区域中液体质量改变量的和为
7.在如图烧杯中均盛有0.1mol/LNaCl溶液,其中铁片最易被腐蚀的是
A. B.
C. D.
8.鎏金兽面纹鼎是湖南省博物馆收藏的珍贵文物。该文物为青铜器,其形制和纹饰与商代铜鼎相同。鎏金又称火法镀金,其工艺是将黄金溶于汞中形成的金汞齐均匀地涂到干净的金属器物表面,加热使汞挥发,黄金与金属表面固结,形成光亮的金黄色镀层。下列说法正确的是
A.青铜比纯铜硬度小
B.常温下的金汞齐是金属晶体
C.鎏金兽面纹鼎应保存在干燥的环境中
D.铜腐蚀后生成的铜绿为CuO
二、非选择题
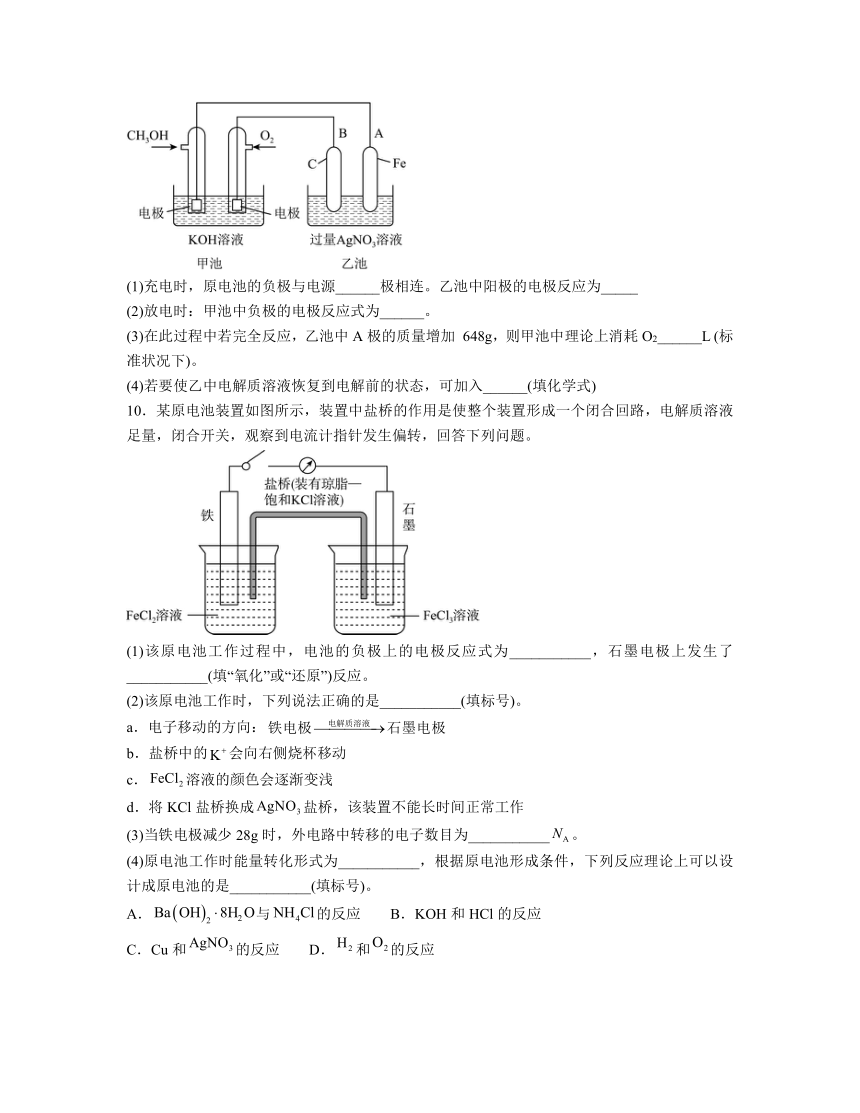
9.某公司开发了一种以甲醇为原料,以 KOH 为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。其中 B 电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:
(1)充电时,原电池的负极与电源______极相连。乙池中阳极的电极反应为_____
(2)放电时:甲池中负极的电极反应式为______。
(3)在此过程中若完全反应,乙池中A极的质量增加 648g,则甲池中理论上消耗O2______L (标准状况下)。
(4)若要使乙中电解质溶液恢复到电解前的状态,可加入______(填化学式)
10.某原电池装置如图所示,装置中盐桥的作用是使整个装置形成一个闭合回路,电解质溶液足量,闭合开关,观察到电流计指针发生偏转,回答下列问题。
(1)该原电池工作过程中,电池的负极上的电极反应式为___________,石墨电极上发生了___________(填“氧化”或“还原”)反应。
(2)该原电池工作时,下列说法正确的是___________(填标号)。
a.电子移动的方向:
b.盐桥中的会向右侧烧杯移动
c.溶液的颜色会逐渐变浅
d.将KCl盐桥换成盐桥,该装置不能长时间正常工作
(3)当铁电极减少28g时,外电路中转移的电子数目为___________。
(4)原电池工作时能量转化形式为___________,根据原电池形成条件,下列反应理论上可以设计成原电池的是___________(填标号)。
A.与的反应 B.KOH和HCl的反应
C.Cu和的反应 D.和的反应
【参考答案】
一、选择题
1.A
【分析】镀层有破损的镀锌铁片被腐蚀,则将其放入到酸化的3%NaCl溶液中,会构成原电池,由于锌比铁活泼,作原电池的负极,而铁片作正极,溶液中破损的位置会变大,铁也会继续和酸化的氯化钠溶液反应产生氢气,溶液中会有亚铁离子生成;
解析:A.若铁片没有被腐蚀,则溶液中不会生成亚铁离子,加入酸性KMnO4溶液紫红色不褪去,说明没有生成亚铁离子,故A符合题意;
B.淀粉碘化钾溶液可检测氧化性物质,但不论铁片是否被腐蚀,均无氧化性物质与碘化钾发生反应,故B不符合题意;
C.KSCN溶液可检测铁离子的存在,上述现象中不会出现铁离子,所以无论铁片是否被腐蚀,加入KSCN溶液后,均无红色出现,故C不符合题意;
D.氯化钠溶液中始终存在氯离子,所以加入硝酸银溶液后,不管铁片是否被腐蚀,均会出现白色沉淀,故D不符合题意。
故选A。
2.C
【分析】由已知电池的总反应可知,Zn化合价升高发生氧化反应,锌筒作为电池的负极,而MnO2化合价降低发生还原反应,石墨电极作为电池的正极,电子有负极流向正极,阳离子移向正极,阴离子移向负极。
解析:A.电池工作时阴离子移向负极,由分析可知,锌筒作为负极,所以移向锌筒,A项错误;
B.电子由负极流向正极,应该为由锌筒流向石墨电极,B错误;
C.,0.1molZn的质量为6.5g,所以C正确;
D.负极应该失电子发生氧化反应,所以电极反应式错误, 为电池正极的电极反应式,D错误;
故答案选C。
3.D
解析:A.AgI见光易分解,能吸收大量的热,且分解产物可提供雨水形成的凝结核,常用作人工增雨剂,描述正确,不符题意;
B.利用烟花爆炸时产生的高温,使加在其中的各种金属盐的阳离子产生相应的焰色反应,形成五颜六色的烟花,描述正确,不符题意;
C.镁活泼性强,与热水器金属内胆接触,再与自来水形成原电池结构,镁做负极消耗,使内胆免于锈蚀,描述正确,不符题意;
D.光导纤维导光,需透明材料,故使用高纯度SiO2做原材料,单晶硅是半导体材料,描述错误,符合题意;
综上,本题选D。
4.A
解析:A.生铁为合金,更易发生电化学腐蚀,比纯铁更容易生锈,A错误;
B.煤的干馏过程中生成焦炭、煤焦油、粗苯等新物质生成,为化学变化,B正确;
C.臭氧具有强氧化性,可以消毒杀菌,且无毒,可用于自来水消毒,C正确;
D.硅是良好的半导体,高纯硅可用于制芯片,D正确;
综上所述答案为A。
5.B
解析:A.该反应气体系数之和增大,ΔS>0,室温下不能自发进行,说明ΔH TΔS>0,所以该反应的ΔH>0,故A错误;
B.一个化学反应的ΔH与实际参加化学反应的物质的多少无关,而ΔH的大小与热化学方程式的计量系数成正比,即ΔH与热化学方程式的计量系数有关,故B正确;
C.将碱溶液分多次缓慢加入酸溶液中,导致热量散失较多,测定的中和热的值偏小,所以应该一次加入,故C错误;
D.Zn、Fe和电解质溶液接触能形成原电池,Zn失电子作负极,被腐蚀,Fe作正极被保护,属于牺牲阳极的阴极保护法,属于原电池原理,故D错误;
答案为B。
6.C
解析:A.a极为苯酚变为,碳原子的化合价由价变为价,化合价降低,得到电子,a极为正极,电极反应式为:,电极附近增大,A错误;
B.自由移动的离子为,阳离子向正极移动,则离子交换膜为阳离子交换膜,从右向左移动,B错误;
C.b电极为负极,失电子发生氧化反应,电极反应式为:,C正确;
D.若有电子通过导线,就1mol H+有从B迁移到A,A区溶液质量增加,B区溶液的质量不变,A、B两区域中液体质量改变量的和为,D项错误;
故选C。
7.C
【分析】金属腐蚀快慢顺序为电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极;
解析:A中铁发生化学腐蚀;B中镁活动性强为负极,铁作正极被镁保护;C中铁作负极加速被腐蚀;D中铁与电源负极相连,作为电解池的阴极被保护;所以铁片最易被腐蚀的是C;
答案为C。
8.C
解析:A.合金的硬度比成分金属的大,即青铜比纯铜硬度大,A错误;
B.晶体是指具有规则几何外形的固体,常温下的金汞齐是液态物质,不是金属晶体,B错误;
C.铜制鎏金兽面纹鼎可能会发生电化学腐蚀,将鎏金兽面纹鼎保存在干燥的环境中,有利于减缓腐蚀,C正确;
D.铜绿为碱式碳酸铜,其化学组成一般可表示为Cu2(OH)2CO3,D错误;
故答案为:C。
二、非选择题
9. 负 4OH--4e-=2H2O+O2↑ 33.6 Ag2O
【分析】甲池为甲醇燃料电池,乙池为电解池,甲醇燃料电池放电时,甲醇失电子发生氧化反应作负极,则A极为阴极,B极为阳极;充电时,燃料电池的正极作阳极,所以正极应该与电源正极相连,原电池负极与电源负极相连。
解析:(1) 充电时,原电池负极与电源负极相连;乙池为电解池,根据放电顺序,阳极上氢氧根离子失电子发生氧化反应,电极反应式为4OH--4e-=2H2O+O2↑;
(2)放电时:甲池中负极甲醇失电子和氢氧根离子反应生成碳酸根离子和水,所以甲池中负极的电极反应式为;
(3) 乙池中A极为阴极,银离子得电子发生还原反应生成银单质,当乙池中A极的质量增加648g,根据电子守恒,每生成1个Ag得1个电子,每消耗一个氧气得到4个电子,则甲池中理论上消耗O2体积=××22.4L/mol=33.6L;
(4)乙中总反应为4AgNO3+2H2O4Ag+O2+4HNO3,可加入Ag2O与硝酸反应恢复到电解前的状态。
10.(1) 还原
(2)bd
(3)1
(4) 化学能转化为电能 CD
【分析】由装置图可知,该电池总反应为Fe+2Fe3+=3Fe2+,Fe是负极,电极反应式为;石墨是正极,石墨电极上Fe3+得电子生成Fe2+,发生了还原反应。
解析:(1)铁发生氧化反应生成Fe2+,Fe是负极,电池的负极反应式为;石墨是正极,石墨电极上Fe3+得电子生成Fe2+,发生了还原反应,故答案为:;还原。
(2)a.铁是负极、石墨是正极,电子移动的方向:铁电极石墨电极,电子不能进入溶液,故a错误;
b.铁是负极、石墨是正极,阳离子向正极移动,盐桥中的会向右侧烧杯移动,故b正确;
c.负极发生反应,溶液的浓度增大,颜色会逐渐加深,故c错误;
d.将盐桥换成盐桥,Ag+能和两个电解质溶液中Cl-发生反应生成AgCl沉淀堵塞盐桥,导致装置不能长时间正常工作,故d正确;
选bd。
(3)负极发生反应,当铁电极减少28g时,外电路中转移的电子数目为,故答案为:1。
(4)原电池工作时化学能转化为电能,原电池中发生的是自发的氧化还原反应;
A.与的反应,不是氧化还原反应,没有电子转移,不能设计成原电池,故不选A;
B.和的反应,不是氧化还原反应,没有电子转移,不能设计成原电池,故不选B;
C.和的反应生成硝酸铜和银,属于氧化还原反应,有电子转移,能设计成原电池,故选C;
D.和的反应生成水,属于氧化还原反应,有电子转移,能设计成原电池,故选D;
选CD。
故答案为:化学能转化为电能;CD
一、选择题
1.为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入硫酸酸化的3%NaCl溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是
A.加入酸性KMnO4溶液紫红色不褪去 B.加入淀粉碘化钾溶液无蓝色出现
C.加入KSCN溶液无红色出现 D.加入AgNO3溶液产生沉淀
2.普通锌锰干电池的简图如图所示,该电池工作时的总反应为。下列关于锌锰干电池的说法中正确的是
A.电池工作时,移向石墨电极
B.电池工作时电子从石墨电极流向锌筒
C.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
D.电池负极反应式为
3.化学与生活密切相关,下列叙述错误的是
A.用飞机播撒AgI是实现人工增雨的方法之一
B.节日燃放的烟花能够呈现各种艳丽的色彩,与焰色试验有关
C.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极法
D.高纯硅可用于制作光导纤维
4.下列说法错误的是
A.纯铁比生铁易生锈 B.煤的干馏是化学变化
C.臭氧可用于自来水消毒 D.高纯硅可用于制芯片
5.下列有关说法正确的是
A.室温下不能自发进行,说明该反应的ΔH<0
B.一个化学反应的ΔH与实际参加化学反应的物质的多少无关,而与热化学方程式的计量系数有关
C.中和热测定实验中,将碱溶液分多次缓慢加入酸溶液中可减小实验误差
D.在海轮外壳连接锌块保护外壳不受腐蚀采用的是牺牲阳极的阴极保护法,属于电解原理
6.如图是处理废水中苯酚的装置,回收利用苯后再排放。下列有关说法正确的是
A.a为正极,电极附近减少
B.该离子交换膜为阴离子交换膜
C.b电极反应式为
D.若有电子通过导线,A、B两区域中液体质量改变量的和为
7.在如图烧杯中均盛有0.1mol/LNaCl溶液,其中铁片最易被腐蚀的是
A. B.
C. D.
8.鎏金兽面纹鼎是湖南省博物馆收藏的珍贵文物。该文物为青铜器,其形制和纹饰与商代铜鼎相同。鎏金又称火法镀金,其工艺是将黄金溶于汞中形成的金汞齐均匀地涂到干净的金属器物表面,加热使汞挥发,黄金与金属表面固结,形成光亮的金黄色镀层。下列说法正确的是
A.青铜比纯铜硬度小
B.常温下的金汞齐是金属晶体
C.鎏金兽面纹鼎应保存在干燥的环境中
D.铜腐蚀后生成的铜绿为CuO
二、非选择题
9.某公司开发了一种以甲醇为原料,以 KOH 为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。其中 B 电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:
(1)充电时,原电池的负极与电源______极相连。乙池中阳极的电极反应为_____
(2)放电时:甲池中负极的电极反应式为______。
(3)在此过程中若完全反应,乙池中A极的质量增加 648g,则甲池中理论上消耗O2______L (标准状况下)。
(4)若要使乙中电解质溶液恢复到电解前的状态,可加入______(填化学式)
10.某原电池装置如图所示,装置中盐桥的作用是使整个装置形成一个闭合回路,电解质溶液足量,闭合开关,观察到电流计指针发生偏转,回答下列问题。
(1)该原电池工作过程中,电池的负极上的电极反应式为___________,石墨电极上发生了___________(填“氧化”或“还原”)反应。
(2)该原电池工作时,下列说法正确的是___________(填标号)。
a.电子移动的方向:
b.盐桥中的会向右侧烧杯移动
c.溶液的颜色会逐渐变浅
d.将KCl盐桥换成盐桥,该装置不能长时间正常工作
(3)当铁电极减少28g时,外电路中转移的电子数目为___________。
(4)原电池工作时能量转化形式为___________,根据原电池形成条件,下列反应理论上可以设计成原电池的是___________(填标号)。
A.与的反应 B.KOH和HCl的反应
C.Cu和的反应 D.和的反应
【参考答案】
一、选择题
1.A
【分析】镀层有破损的镀锌铁片被腐蚀,则将其放入到酸化的3%NaCl溶液中,会构成原电池,由于锌比铁活泼,作原电池的负极,而铁片作正极,溶液中破损的位置会变大,铁也会继续和酸化的氯化钠溶液反应产生氢气,溶液中会有亚铁离子生成;
解析:A.若铁片没有被腐蚀,则溶液中不会生成亚铁离子,加入酸性KMnO4溶液紫红色不褪去,说明没有生成亚铁离子,故A符合题意;
B.淀粉碘化钾溶液可检测氧化性物质,但不论铁片是否被腐蚀,均无氧化性物质与碘化钾发生反应,故B不符合题意;
C.KSCN溶液可检测铁离子的存在,上述现象中不会出现铁离子,所以无论铁片是否被腐蚀,加入KSCN溶液后,均无红色出现,故C不符合题意;
D.氯化钠溶液中始终存在氯离子,所以加入硝酸银溶液后,不管铁片是否被腐蚀,均会出现白色沉淀,故D不符合题意。
故选A。
2.C
【分析】由已知电池的总反应可知,Zn化合价升高发生氧化反应,锌筒作为电池的负极,而MnO2化合价降低发生还原反应,石墨电极作为电池的正极,电子有负极流向正极,阳离子移向正极,阴离子移向负极。
解析:A.电池工作时阴离子移向负极,由分析可知,锌筒作为负极,所以移向锌筒,A项错误;
B.电子由负极流向正极,应该为由锌筒流向石墨电极,B错误;
C.,0.1molZn的质量为6.5g,所以C正确;
D.负极应该失电子发生氧化反应,所以电极反应式错误, 为电池正极的电极反应式,D错误;
故答案选C。
3.D
解析:A.AgI见光易分解,能吸收大量的热,且分解产物可提供雨水形成的凝结核,常用作人工增雨剂,描述正确,不符题意;
B.利用烟花爆炸时产生的高温,使加在其中的各种金属盐的阳离子产生相应的焰色反应,形成五颜六色的烟花,描述正确,不符题意;
C.镁活泼性强,与热水器金属内胆接触,再与自来水形成原电池结构,镁做负极消耗,使内胆免于锈蚀,描述正确,不符题意;
D.光导纤维导光,需透明材料,故使用高纯度SiO2做原材料,单晶硅是半导体材料,描述错误,符合题意;
综上,本题选D。
4.A
解析:A.生铁为合金,更易发生电化学腐蚀,比纯铁更容易生锈,A错误;
B.煤的干馏过程中生成焦炭、煤焦油、粗苯等新物质生成,为化学变化,B正确;
C.臭氧具有强氧化性,可以消毒杀菌,且无毒,可用于自来水消毒,C正确;
D.硅是良好的半导体,高纯硅可用于制芯片,D正确;
综上所述答案为A。
5.B
解析:A.该反应气体系数之和增大,ΔS>0,室温下不能自发进行,说明ΔH TΔS>0,所以该反应的ΔH>0,故A错误;
B.一个化学反应的ΔH与实际参加化学反应的物质的多少无关,而ΔH的大小与热化学方程式的计量系数成正比,即ΔH与热化学方程式的计量系数有关,故B正确;
C.将碱溶液分多次缓慢加入酸溶液中,导致热量散失较多,测定的中和热的值偏小,所以应该一次加入,故C错误;
D.Zn、Fe和电解质溶液接触能形成原电池,Zn失电子作负极,被腐蚀,Fe作正极被保护,属于牺牲阳极的阴极保护法,属于原电池原理,故D错误;
答案为B。
6.C
解析:A.a极为苯酚变为,碳原子的化合价由价变为价,化合价降低,得到电子,a极为正极,电极反应式为:,电极附近增大,A错误;
B.自由移动的离子为,阳离子向正极移动,则离子交换膜为阳离子交换膜,从右向左移动,B错误;
C.b电极为负极,失电子发生氧化反应,电极反应式为:,C正确;
D.若有电子通过导线,就1mol H+有从B迁移到A,A区溶液质量增加,B区溶液的质量不变,A、B两区域中液体质量改变量的和为,D项错误;
故选C。
7.C
【分析】金属腐蚀快慢顺序为电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极;
解析:A中铁发生化学腐蚀;B中镁活动性强为负极,铁作正极被镁保护;C中铁作负极加速被腐蚀;D中铁与电源负极相连,作为电解池的阴极被保护;所以铁片最易被腐蚀的是C;
答案为C。
8.C
解析:A.合金的硬度比成分金属的大,即青铜比纯铜硬度大,A错误;
B.晶体是指具有规则几何外形的固体,常温下的金汞齐是液态物质,不是金属晶体,B错误;
C.铜制鎏金兽面纹鼎可能会发生电化学腐蚀,将鎏金兽面纹鼎保存在干燥的环境中,有利于减缓腐蚀,C正确;
D.铜绿为碱式碳酸铜,其化学组成一般可表示为Cu2(OH)2CO3,D错误;
故答案为:C。
二、非选择题
9. 负 4OH--4e-=2H2O+O2↑ 33.6 Ag2O
【分析】甲池为甲醇燃料电池,乙池为电解池,甲醇燃料电池放电时,甲醇失电子发生氧化反应作负极,则A极为阴极,B极为阳极;充电时,燃料电池的正极作阳极,所以正极应该与电源正极相连,原电池负极与电源负极相连。
解析:(1) 充电时,原电池负极与电源负极相连;乙池为电解池,根据放电顺序,阳极上氢氧根离子失电子发生氧化反应,电极反应式为4OH--4e-=2H2O+O2↑;
(2)放电时:甲池中负极甲醇失电子和氢氧根离子反应生成碳酸根离子和水,所以甲池中负极的电极反应式为;
(3) 乙池中A极为阴极,银离子得电子发生还原反应生成银单质,当乙池中A极的质量增加648g,根据电子守恒,每生成1个Ag得1个电子,每消耗一个氧气得到4个电子,则甲池中理论上消耗O2体积=××22.4L/mol=33.6L;
(4)乙中总反应为4AgNO3+2H2O4Ag+O2+4HNO3,可加入Ag2O与硝酸反应恢复到电解前的状态。
10.(1) 还原
(2)bd
(3)1
(4) 化学能转化为电能 CD
【分析】由装置图可知,该电池总反应为Fe+2Fe3+=3Fe2+,Fe是负极,电极反应式为;石墨是正极,石墨电极上Fe3+得电子生成Fe2+,发生了还原反应。
解析:(1)铁发生氧化反应生成Fe2+,Fe是负极,电池的负极反应式为;石墨是正极,石墨电极上Fe3+得电子生成Fe2+,发生了还原反应,故答案为:;还原。
(2)a.铁是负极、石墨是正极,电子移动的方向:铁电极石墨电极,电子不能进入溶液,故a错误;
b.铁是负极、石墨是正极,阳离子向正极移动,盐桥中的会向右侧烧杯移动,故b正确;
c.负极发生反应,溶液的浓度增大,颜色会逐渐加深,故c错误;
d.将盐桥换成盐桥,Ag+能和两个电解质溶液中Cl-发生反应生成AgCl沉淀堵塞盐桥,导致装置不能长时间正常工作,故d正确;
选bd。
(3)负极发生反应,当铁电极减少28g时,外电路中转移的电子数目为,故答案为:1。
(4)原电池工作时化学能转化为电能,原电池中发生的是自发的氧化还原反应;
A.与的反应,不是氧化还原反应,没有电子转移,不能设计成原电池,故不选A;
B.和的反应,不是氧化还原反应,没有电子转移,不能设计成原电池,故不选B;
C.和的反应生成硝酸铜和银,属于氧化还原反应,有电子转移,能设计成原电池,故选C;
D.和的反应生成水,属于氧化还原反应,有电子转移,能设计成原电池,故选D;
选CD。
故答案为:化学能转化为电能;CD
