化学人教版(2019)选择性必修1 2.4化学反应的调控 课件(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.4化学反应的调控 课件(共26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-24 21:15:23 | ||
图片预览






文档简介
(共26张PPT)
第二章 化学反应速率与化学平衡
第四节 化学反应的调控
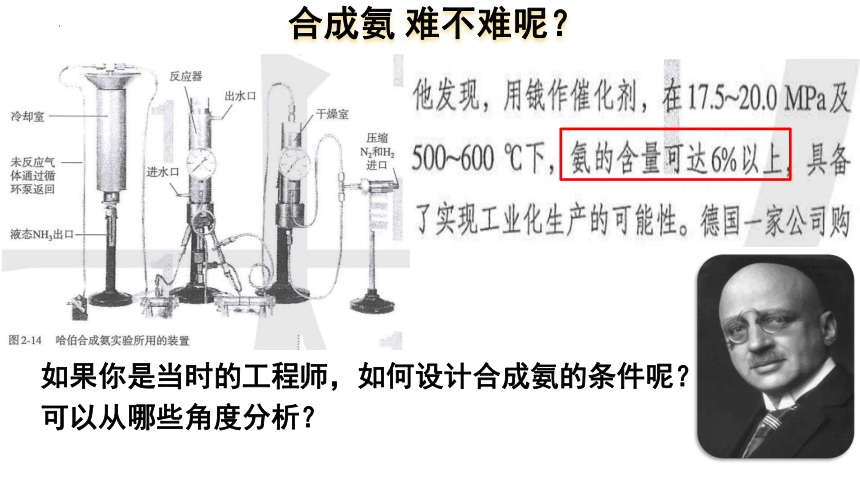
合成氨 难不难呢?
如果你是当时的工程师,如何设计合成氨的条件呢?
可以从哪些角度分析?
一、合成氨反应条件与原理分析
1、反应原理和特点
N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1
可逆反应
正反应是气体体积减小的反应
ΔH<0、ΔS<0
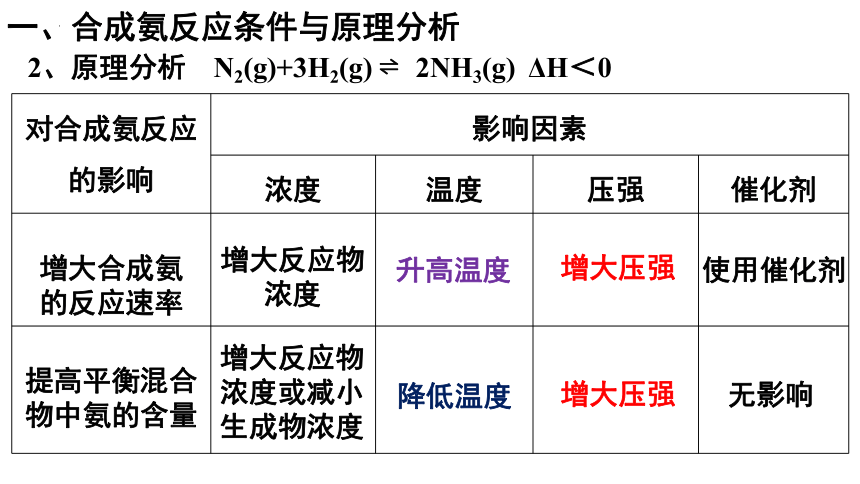
2、原理分析
对合成氨反应的影响 影响因素 浓度 温度 压强 催化剂
增大合成氨 的反应速率
提高平衡混合物中氨的含量
增大反应物浓度
增大反应物浓度或减小生成物浓度
升高温度
降低温度
增大压强
增大压强
使用催化剂
无影响
一、合成氨反应条件与原理分析
N2(g)+3H2(g) 2NH3(g) ΔH<0
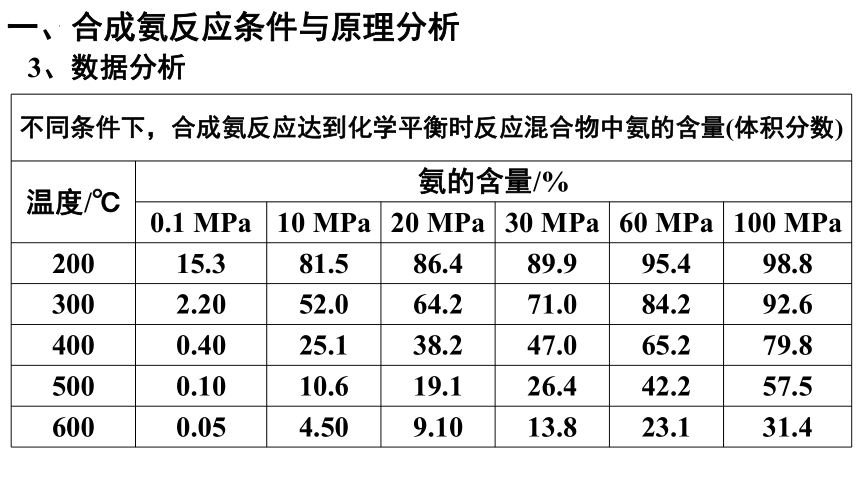
不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数) 温度/℃ 氨的含量/% 0.1 MPa 10 MPa 20 MPa 30 MPa 60 MPa 100 MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
一、合成氨反应条件与原理分析
3、数据分析
升高温度、增大压强、增大反应物浓度及使用催化剂等
可以使合成氨的反应速率增大
降低温度、增大压强、增大反应物浓度等有利于提高平衡混合物中氨的含量
一、合成氨反应条件与原理分析
3、实验数据分析
N2(g)+3H2(g) 2NH3(g) ΔH<0
(1)工业合成氨的反应是ΔH<0、ΔS<0的反应,在任何温度下都可自发进行
(2)在合成氨的实际生产中,温度越低,压强越大越好
(3)在合成氨中,加入催化剂能提高原料的转化率
(4)催化剂在合成氨中质量没有改变,因此催化剂没有参与反应
(5)增大反应物的浓度,减少生成物的浓度,可以提高氨的产率
(6)合成氨中在提高速率和原料的转化率上对温度的要求是一致的
正误判断
×
×
×
×
√
×
应用体验
1.下列有关合成氨工业的说法正确的是
A.N2的量越多,H2的转化率越大,因此,充入的N2越多越有利于NH3的合成
B.恒容条件下充入稀有气体有利于NH3的合成
C.工业合成氨的反应是熵增加的放热反应,在任何温度下都可自发进行
D.工业合成氨的反应是熵减小的放热反应,在常温时可自发进行
D
应用体验
2.在合成氨反应中使用催化剂和施加高压,下列叙述正确的是
A.都能提高反应速率,都对化学平衡无影响
B.都对化学平衡有影响,但都不影响达到平衡状态所用的时间
C.都能缩短达到平衡状态所用的时间,只有施加高压对化学平衡有影响
D.使用催化剂能缩短反应达到平衡状态所用的时间,而施加高压无此效果
C
合成氨反应条件的选择原则
从反应速率和反应限度两个角度
尽量增大反应物的转化率,充分利用原料;
(1)
选择较快的化学反应速率,
提高单位时间内的产量;
(2)
考虑设备的要求和技术条件。
(3)
二、工业合成氨的适宜条件
【原理分析】
压强越大越好
【实际选用】
目前,我国合成氨厂一般采用的压强为 MPa。
10~30
【理由】
压强越大,对设备要求越高,
增加成本,降低综合经济效益。
二、工业合成氨的适宜条件
1.压强
【原理分析】
温度越低转化率越高
但反应速率越慢
【实际选用】
二、工业合成氨的适宜条件
2.温度
目前,实际生产一般采用的温度为 ℃
400~500
【原理分析】
加催化剂可改变反应历程,加快反应速率
【实际选用】
目前,普遍使用以铁为主体成分的催化剂,即 。
铁触媒
500℃时活性最大
二、工业合成氨的适宜条件
3.催化剂
【原理分析】
【实际选用】
及时移走产物
原料气循环利用
及时移走产物氨
增大反应物浓度
n(N2) : n (H2) ≈ 1: 2.8
二、工业合成氨的适宜条件
4.浓度
三、合成氨的生产流程
N2+H2
干燥
净化
防止催化剂中毒
N2+H2
压缩机加压
10MPa~30MPa
N2+H2
热交换
N2+H2
铁触媒
400~500℃
N2+H2+NH3
冷却
液态NH3
N2+H2+NH3
N2+H2
充分利用能源
增大压强
促使化学平衡向生成氨气的方向移动
原料气循环利用,
提高原料利用率
(1)使气态氨变成液氨后及时从平衡混合物中分离出去,可提高原料的利用率
(2)在工业生产条件优化时,只考虑经济性就行,不用考虑环保
(3)合成氨反应选择在400~500 ℃进行的重要原因是催化剂在500 ℃左右时的活性最大
正误判断
×
√
√
可行性
分析
分析
调控方法
实验摸索
设备要求、
安全操作
经济成本
确定最佳条件
选取恰当的反应
考虑参加反应的
物质 、 和
等本身因素
原理分析:
化学平衡
反应速率
尽量增大
______,
充分利用
原料
选择较快的________
四、化工生产中调控反应的一般思路
组成
结构
性质
转化率
反应速率
选择化工生产适宜条件的分析角度
分析角度 原则要求
从化学反应速率分析 既不能过快,又不能太慢
从化学平衡移动分析 既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性
从原料的利用率分析 增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本
从实际生产能力分析 如设备承受高温、高压的能力等
从催化剂的使用活性分析 注意催化剂的活性对温度的限制
在硫酸工业中,通过下列反应使SO2氧化成SO3:
2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1。(已知:催化剂是V2O5,在400~500 ℃时催化剂效果最好)下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
深度思考
温度/℃ 平衡时SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是________________。
深度思考
温度/℃ 平衡时SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
450 ℃、10 MPa
(2)在实际生产中,选定的温度为400~500 ℃,原因是_____________
_________________________________________________________________________________________________。
深度思考
温度/℃ 平衡时SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
在此温度下,
催化剂活性最高。温度较低,会使反应速率减小,达到平衡所需时间变长;温度较高,SO2的转化率会降低
(3)在实际生产中,采用的压强为常压,原因是____________________
_____________________________________________________________________________________________________________。
深度思考
温度/℃ 平衡时SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
在常压下SO2的转化率
就已经很高了(97.5%),若采用高压,平衡向右移动,但效果并不明显,且采用高压时会增大对设备的要求而增大生产成本
(4)在实际生产中,通入过量的空气,原因是______________________
______________________。
深度思考
温度/℃ 平衡时SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
增大反应物O2的浓度,
有利于提高SO2的转化率
(5)尾气中SO2必须回收,原因是_________________________________
______________________。
深度思考
温度/℃ 平衡时SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
料的利用率(合理即可)
防止污染环境;循环利用,提高原
应用体验
1.下列有关合成氨工业的叙述,可用勒夏特列原理来解释的是
A.使用铁触媒,使N2和H2混合气体有利于合成氨
B.高压比常压条件更有利于合成氨的反应
C.700 K左右比室温更有利于合成氨的反应
D.合成氨时采用循环操作,可提高原料的利用率
B
应用体验
2.有平衡体系:CO(g)+2H2(g) CH3OH(g) ΔH<0。工业上为了增加甲醇(CH3OH)的产量,应采取的正确措施是
A.高温,高压
B.适宜温度,高压,催化剂
C.低温,低压
D.高温,高压,催化剂
B
第二章 化学反应速率与化学平衡
第四节 化学反应的调控
合成氨 难不难呢?
如果你是当时的工程师,如何设计合成氨的条件呢?
可以从哪些角度分析?
一、合成氨反应条件与原理分析
1、反应原理和特点
N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1
可逆反应
正反应是气体体积减小的反应
ΔH<0、ΔS<0
2、原理分析
对合成氨反应的影响 影响因素 浓度 温度 压强 催化剂
增大合成氨 的反应速率
提高平衡混合物中氨的含量
增大反应物浓度
增大反应物浓度或减小生成物浓度
升高温度
降低温度
增大压强
增大压强
使用催化剂
无影响
一、合成氨反应条件与原理分析
N2(g)+3H2(g) 2NH3(g) ΔH<0
不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数) 温度/℃ 氨的含量/% 0.1 MPa 10 MPa 20 MPa 30 MPa 60 MPa 100 MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
一、合成氨反应条件与原理分析
3、数据分析
升高温度、增大压强、增大反应物浓度及使用催化剂等
可以使合成氨的反应速率增大
降低温度、增大压强、增大反应物浓度等有利于提高平衡混合物中氨的含量
一、合成氨反应条件与原理分析
3、实验数据分析
N2(g)+3H2(g) 2NH3(g) ΔH<0
(1)工业合成氨的反应是ΔH<0、ΔS<0的反应,在任何温度下都可自发进行
(2)在合成氨的实际生产中,温度越低,压强越大越好
(3)在合成氨中,加入催化剂能提高原料的转化率
(4)催化剂在合成氨中质量没有改变,因此催化剂没有参与反应
(5)增大反应物的浓度,减少生成物的浓度,可以提高氨的产率
(6)合成氨中在提高速率和原料的转化率上对温度的要求是一致的
正误判断
×
×
×
×
√
×
应用体验
1.下列有关合成氨工业的说法正确的是
A.N2的量越多,H2的转化率越大,因此,充入的N2越多越有利于NH3的合成
B.恒容条件下充入稀有气体有利于NH3的合成
C.工业合成氨的反应是熵增加的放热反应,在任何温度下都可自发进行
D.工业合成氨的反应是熵减小的放热反应,在常温时可自发进行
D
应用体验
2.在合成氨反应中使用催化剂和施加高压,下列叙述正确的是
A.都能提高反应速率,都对化学平衡无影响
B.都对化学平衡有影响,但都不影响达到平衡状态所用的时间
C.都能缩短达到平衡状态所用的时间,只有施加高压对化学平衡有影响
D.使用催化剂能缩短反应达到平衡状态所用的时间,而施加高压无此效果
C
合成氨反应条件的选择原则
从反应速率和反应限度两个角度
尽量增大反应物的转化率,充分利用原料;
(1)
选择较快的化学反应速率,
提高单位时间内的产量;
(2)
考虑设备的要求和技术条件。
(3)
二、工业合成氨的适宜条件
【原理分析】
压强越大越好
【实际选用】
目前,我国合成氨厂一般采用的压强为 MPa。
10~30
【理由】
压强越大,对设备要求越高,
增加成本,降低综合经济效益。
二、工业合成氨的适宜条件
1.压强
【原理分析】
温度越低转化率越高
但反应速率越慢
【实际选用】
二、工业合成氨的适宜条件
2.温度
目前,实际生产一般采用的温度为 ℃
400~500
【原理分析】
加催化剂可改变反应历程,加快反应速率
【实际选用】
目前,普遍使用以铁为主体成分的催化剂,即 。
铁触媒
500℃时活性最大
二、工业合成氨的适宜条件
3.催化剂
【原理分析】
【实际选用】
及时移走产物
原料气循环利用
及时移走产物氨
增大反应物浓度
n(N2) : n (H2) ≈ 1: 2.8
二、工业合成氨的适宜条件
4.浓度
三、合成氨的生产流程
N2+H2
干燥
净化
防止催化剂中毒
N2+H2
压缩机加压
10MPa~30MPa
N2+H2
热交换
N2+H2
铁触媒
400~500℃
N2+H2+NH3
冷却
液态NH3
N2+H2+NH3
N2+H2
充分利用能源
增大压强
促使化学平衡向生成氨气的方向移动
原料气循环利用,
提高原料利用率
(1)使气态氨变成液氨后及时从平衡混合物中分离出去,可提高原料的利用率
(2)在工业生产条件优化时,只考虑经济性就行,不用考虑环保
(3)合成氨反应选择在400~500 ℃进行的重要原因是催化剂在500 ℃左右时的活性最大
正误判断
×
√
√
可行性
分析
分析
调控方法
实验摸索
设备要求、
安全操作
经济成本
确定最佳条件
选取恰当的反应
考虑参加反应的
物质 、 和
等本身因素
原理分析:
化学平衡
反应速率
尽量增大
______,
充分利用
原料
选择较快的________
四、化工生产中调控反应的一般思路
组成
结构
性质
转化率
反应速率
选择化工生产适宜条件的分析角度
分析角度 原则要求
从化学反应速率分析 既不能过快,又不能太慢
从化学平衡移动分析 既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性
从原料的利用率分析 增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本
从实际生产能力分析 如设备承受高温、高压的能力等
从催化剂的使用活性分析 注意催化剂的活性对温度的限制
在硫酸工业中,通过下列反应使SO2氧化成SO3:
2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1。(已知:催化剂是V2O5,在400~500 ℃时催化剂效果最好)下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
深度思考
温度/℃ 平衡时SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
(1)从理论上分析,为了使二氧化硫尽可能多地转化为三氧化硫,应选择的条件是________________。
深度思考
温度/℃ 平衡时SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
450 ℃、10 MPa
(2)在实际生产中,选定的温度为400~500 ℃,原因是_____________
_________________________________________________________________________________________________。
深度思考
温度/℃ 平衡时SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
在此温度下,
催化剂活性最高。温度较低,会使反应速率减小,达到平衡所需时间变长;温度较高,SO2的转化率会降低
(3)在实际生产中,采用的压强为常压,原因是____________________
_____________________________________________________________________________________________________________。
深度思考
温度/℃ 平衡时SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
在常压下SO2的转化率
就已经很高了(97.5%),若采用高压,平衡向右移动,但效果并不明显,且采用高压时会增大对设备的要求而增大生产成本
(4)在实际生产中,通入过量的空气,原因是______________________
______________________。
深度思考
温度/℃ 平衡时SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
增大反应物O2的浓度,
有利于提高SO2的转化率
(5)尾气中SO2必须回收,原因是_________________________________
______________________。
深度思考
温度/℃ 平衡时SO2的转化率/% 0.1 MPa 0.5 MPa 1 MPa 5 MPa 10 MPa
450 97.5 98.9 99.2 99.6 99.7
550 85.6 92.9 94.9 97.7 98.3
料的利用率(合理即可)
防止污染环境;循环利用,提高原
应用体验
1.下列有关合成氨工业的叙述,可用勒夏特列原理来解释的是
A.使用铁触媒,使N2和H2混合气体有利于合成氨
B.高压比常压条件更有利于合成氨的反应
C.700 K左右比室温更有利于合成氨的反应
D.合成氨时采用循环操作,可提高原料的利用率
B
应用体验
2.有平衡体系:CO(g)+2H2(g) CH3OH(g) ΔH<0。工业上为了增加甲醇(CH3OH)的产量,应采取的正确措施是
A.高温,高压
B.适宜温度,高压,催化剂
C.低温,低压
D.高温,高压,催化剂
B
