化学人教版(2019)第一册2.1.2钠的几种化合物 课件(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)第一册2.1.2钠的几种化合物 课件(共24张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 46.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-24 21:16:42 | ||
图片预览







文档简介
(共24张PPT)
第二章 海水中的重要元素──钠和氯
第一节 钠及其化合物
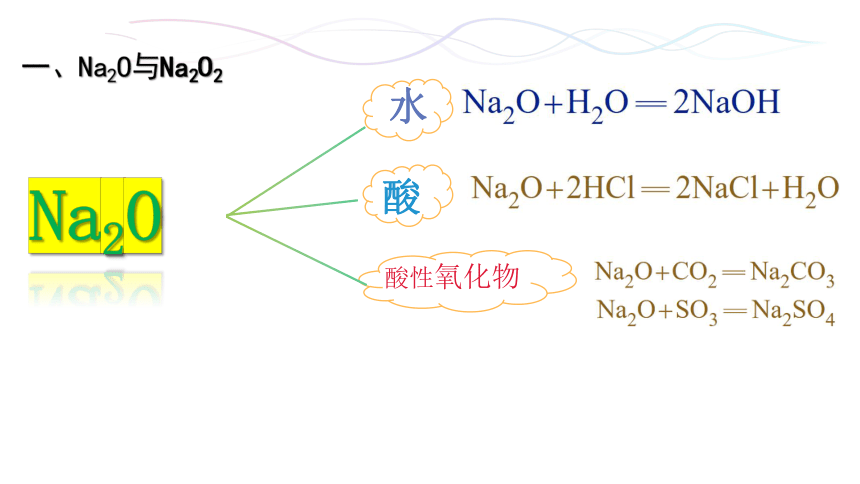
Na2O
水
酸
酸性氧化物
一、Na2O与Na2O2
实验现象
试管外壁_____,带火星的木条______;用pH试纸检验反应所得溶液呈____性
发烫
复燃
碱
一、Na2O与Na2O2
2Na2O2+2H2O===4NaOH+O2↑
吹气生火
2Na2O2+2CO2===2Na2CO3+O2
化学方程式:
一、Na2O与Na2O2
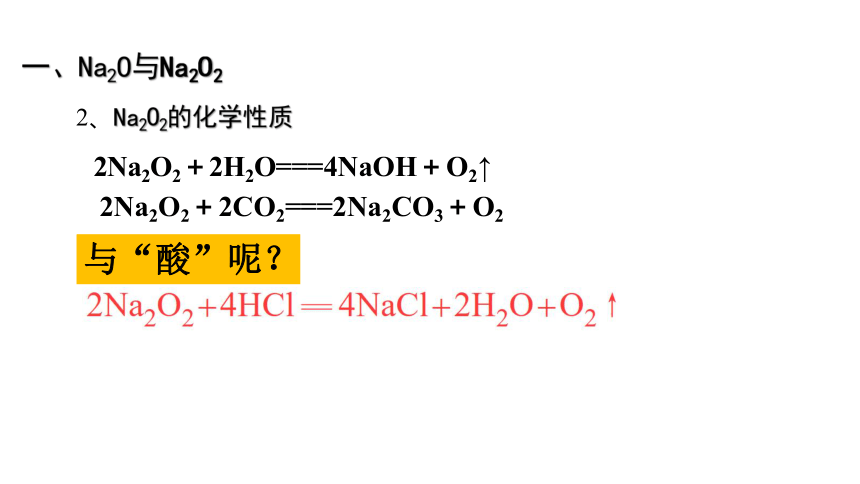
2Na2O2+2H2O===4NaOH+O2↑
2Na2O2+2CO2===2Na2CO3+O2
一、Na2O与Na2O2
2、Na2O2的化学性质
与“酸”呢?
思考应用:
1、过氧化钠如何保存?
2、假设你是消防员,钠或过氧化钠导致着火后如何灭火?
Na2O2用途
氧化钠和过氧化钠性质的对比
名称 氧化钠 过氧化钠
化学式和化合价 Na2O(氧-2价) Na2O2(氧-1价)
构成微粒 Na+,O2- Na+,O22-
颜色状态 白色无定型片状或粉末 淡黄色固体
水 H2O+Na2O=2NaOH 2H2O+2Na2O2=4NaOH+O2
CO2 CO2+Na2O=Na2CO3 2CO2+2Na2O2=2Na2CO3+O2
HCl 2HCl+Na2O=2NaCl+H2O 4HCl+2Na2O2=4NaCl+2H2O+O2
特性 强氧化性
类别 碱性氧化物 非碱性氧化物,过氧化物
用途 漂白剂,供氧剂,氧化剂
转化 2Na2O+O2=2Na2O2
一、Na2O与Na2O2
二、碳酸钠和碳酸氢钠
碳酸钠和碳酸氢钠
实验操作 Na2CO3 NaHCO3
①观察Na2CO3和NaHCO3的外观并进行描述
②向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
③继续向②的试管中分别加入 5 mL 水,用力振荡,有何现象
④分别向③所得的溶液中滴入1~2滴酚酞溶液,有何现象
初步结论: 遇水生成含结晶水的晶体(Na2CO3·xH2O),溶液碱性比NaHCO3强,加水部分溶解,溶液碱性比Na2CO3弱
白色粉末
细小的白色晶体
粉末结块变成晶体;放热,温度计的示数明显升高
晶体部分溶解;吸热,温度计的示数降低
完全溶解
部分溶解
溶液变红色
溶液变微红色
[实验2-4]
Na2CO3+xH2O = Na2CO3·xH2O(密封保存)
物理性质对比
1.酸碱性
Na2CO3水溶液和NaHCO3水溶液都呈碱性,都能使酚酞溶液变红,紫色石蕊变蓝,变色程度不一样。
碱性:Na2CO3水溶液>NaHCO3水溶液
[疑问]它们都属于盐,但其水溶液都呈碱性,说明什么?
(三)化学性质对比
碳酸钠和碳酸氢钠
活动二、探究碳酸钠和碳酸氢钠的稳定性
[加热NaHCO3]澄清石灰水变浑浊
[加热Na2CO3]无现象
热稳定性:Na2CO3 >NaHCO3
[疑问]小苏打发酵后的糕点松软,为什么?
2NaHCO3=Na2CO3+H2O+CO2 ↑
碳酸钠、碳酸氢钠热稳定性的比较
(1)如图所示实验为“套管实验”,小试管内塞有沾有白色无水硫酸铜粉末的棉花球。
点燃酒精灯加热,能观察到的实验现象是_____________________________________
。
(2)实验结论:Na2CO3受热不分解;NaHCO3受热易分解,生成物中含有 。由此可知,Na2CO3的热稳定性比NaHCO3 。
小试管中棉花球变蓝色,B烧杯中澄清石
灰水变浑浊,A烧杯中有少量气泡冒出
CO2和H2O
强
二、碳酸钠和碳酸氢钠
Na2CO3 NaHCO3
盐酸
NaOH溶液
CaCl2溶液
Ca(OH)2
加热
Na2CO3与NaHCO3 的化学性质比较
[课堂小结]
①Na2CO3和NaHCO3的鉴别
[课堂小结]
Na2CO3
NaHCO3
①CO2 + H2O
②NaOH
②HCl(少量)
①△
②Na2CO3和NaHCO3相互转化
③Na2CO3和NaHCO3的除杂
碳酸钠和碳酸氢钠
名称 碳酸钠 碳酸氢钠
化学式
俗名
颜色、状态
水溶性
用途 去除油污、制肥皂、造纸、制玻璃、食用碱的主要成分 制药(治疗胃酸过多)、配制糕点
Na2CO3 NaHCO3
纯碱或苏打 小苏打
白色粉末 细小白色晶体
易溶于水 水中易溶,但比Na2CO3的溶解度小
1.概念
许多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色
焰色试验是表现元素的性质 ,是物理变化。
三、焰色试验
Li Na K Ca Sr Ba Cu
紫红色 黄色 紫色 砖红色 洋红色 黄绿色 绿色
1940年中国科学家侯德榜发明了“侯氏制碱法”,成为世界上生产纯碱的重要方法。其主要化学原理是:
1. CO2 +H2O + NH3 + NaCl (饱和) NH4Cl + NaHCO3↓
2. 2NaHCO3 Na2CO3 + H2O + CO2
上述原理中应用了NaHCO3的哪些性质?
侯德榜
NaHCO3的溶解性
△
和热不稳定性
如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3,然后a通入CO2,c中放碱石灰
C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
C
课堂小结
一、氧化钠和过氧化钠
二、碳酸钠和碳酸氢钠
2、受热分解:2NaHCO3 Na2CO3+H2O+CO2 ↑
加热
1、与酸反应:Na2CO3+2HCl 2NaCl+H2O+CO2 ↑
NaHCO3+HCl NaCl+H2O+CO2 ↑
三、焰色试验
1、与水反应: 2Na2O2+2H2O 4NaOH+O2 ↑
2、与CO2反应:2Na2O2+2CO2 2Na2CO3+O2
1、与酸反应:Na2CO3+2HCl 2NaCl+H2O+CO2 ↑
NaHCO3+HCl NaCl+H2O+CO2 ↑
第二章 海水中的重要元素──钠和氯
第一节 钠及其化合物
Na2O
水
酸
酸性氧化物
一、Na2O与Na2O2
实验现象
试管外壁_____,带火星的木条______;用pH试纸检验反应所得溶液呈____性
发烫
复燃
碱
一、Na2O与Na2O2
2Na2O2+2H2O===4NaOH+O2↑
吹气生火
2Na2O2+2CO2===2Na2CO3+O2
化学方程式:
一、Na2O与Na2O2
2Na2O2+2H2O===4NaOH+O2↑
2Na2O2+2CO2===2Na2CO3+O2
一、Na2O与Na2O2
2、Na2O2的化学性质
与“酸”呢?
思考应用:
1、过氧化钠如何保存?
2、假设你是消防员,钠或过氧化钠导致着火后如何灭火?
Na2O2用途
氧化钠和过氧化钠性质的对比
名称 氧化钠 过氧化钠
化学式和化合价 Na2O(氧-2价) Na2O2(氧-1价)
构成微粒 Na+,O2- Na+,O22-
颜色状态 白色无定型片状或粉末 淡黄色固体
水 H2O+Na2O=2NaOH 2H2O+2Na2O2=4NaOH+O2
CO2 CO2+Na2O=Na2CO3 2CO2+2Na2O2=2Na2CO3+O2
HCl 2HCl+Na2O=2NaCl+H2O 4HCl+2Na2O2=4NaCl+2H2O+O2
特性 强氧化性
类别 碱性氧化物 非碱性氧化物,过氧化物
用途 漂白剂,供氧剂,氧化剂
转化 2Na2O+O2=2Na2O2
一、Na2O与Na2O2
二、碳酸钠和碳酸氢钠
碳酸钠和碳酸氢钠
实验操作 Na2CO3 NaHCO3
①观察Na2CO3和NaHCO3的外观并进行描述
②向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
③继续向②的试管中分别加入 5 mL 水,用力振荡,有何现象
④分别向③所得的溶液中滴入1~2滴酚酞溶液,有何现象
初步结论: 遇水生成含结晶水的晶体(Na2CO3·xH2O),溶液碱性比NaHCO3强,加水部分溶解,溶液碱性比Na2CO3弱
白色粉末
细小的白色晶体
粉末结块变成晶体;放热,温度计的示数明显升高
晶体部分溶解;吸热,温度计的示数降低
完全溶解
部分溶解
溶液变红色
溶液变微红色
[实验2-4]
Na2CO3+xH2O = Na2CO3·xH2O(密封保存)
物理性质对比
1.酸碱性
Na2CO3水溶液和NaHCO3水溶液都呈碱性,都能使酚酞溶液变红,紫色石蕊变蓝,变色程度不一样。
碱性:Na2CO3水溶液>NaHCO3水溶液
[疑问]它们都属于盐,但其水溶液都呈碱性,说明什么?
(三)化学性质对比
碳酸钠和碳酸氢钠
活动二、探究碳酸钠和碳酸氢钠的稳定性
[加热NaHCO3]澄清石灰水变浑浊
[加热Na2CO3]无现象
热稳定性:Na2CO3 >NaHCO3
[疑问]小苏打发酵后的糕点松软,为什么?
2NaHCO3=Na2CO3+H2O+CO2 ↑
碳酸钠、碳酸氢钠热稳定性的比较
(1)如图所示实验为“套管实验”,小试管内塞有沾有白色无水硫酸铜粉末的棉花球。
点燃酒精灯加热,能观察到的实验现象是_____________________________________
。
(2)实验结论:Na2CO3受热不分解;NaHCO3受热易分解,生成物中含有 。由此可知,Na2CO3的热稳定性比NaHCO3 。
小试管中棉花球变蓝色,B烧杯中澄清石
灰水变浑浊,A烧杯中有少量气泡冒出
CO2和H2O
强
二、碳酸钠和碳酸氢钠
Na2CO3 NaHCO3
盐酸
NaOH溶液
CaCl2溶液
Ca(OH)2
加热
Na2CO3与NaHCO3 的化学性质比较
[课堂小结]
①Na2CO3和NaHCO3的鉴别
[课堂小结]
Na2CO3
NaHCO3
①CO2 + H2O
②NaOH
②HCl(少量)
①△
②Na2CO3和NaHCO3相互转化
③Na2CO3和NaHCO3的除杂
碳酸钠和碳酸氢钠
名称 碳酸钠 碳酸氢钠
化学式
俗名
颜色、状态
水溶性
用途 去除油污、制肥皂、造纸、制玻璃、食用碱的主要成分 制药(治疗胃酸过多)、配制糕点
Na2CO3 NaHCO3
纯碱或苏打 小苏打
白色粉末 细小白色晶体
易溶于水 水中易溶,但比Na2CO3的溶解度小
1.概念
许多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色
焰色试验是表现元素的性质 ,是物理变化。
三、焰色试验
Li Na K Ca Sr Ba Cu
紫红色 黄色 紫色 砖红色 洋红色 黄绿色 绿色
1940年中国科学家侯德榜发明了“侯氏制碱法”,成为世界上生产纯碱的重要方法。其主要化学原理是:
1. CO2 +H2O + NH3 + NaCl (饱和) NH4Cl + NaHCO3↓
2. 2NaHCO3 Na2CO3 + H2O + CO2
上述原理中应用了NaHCO3的哪些性质?
侯德榜
NaHCO3的溶解性
△
和热不稳定性
如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3,然后a通入CO2,c中放碱石灰
C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
C
课堂小结
一、氧化钠和过氧化钠
二、碳酸钠和碳酸氢钠
2、受热分解:2NaHCO3 Na2CO3+H2O+CO2 ↑
加热
1、与酸反应:Na2CO3+2HCl 2NaCl+H2O+CO2 ↑
NaHCO3+HCl NaCl+H2O+CO2 ↑
三、焰色试验
1、与水反应: 2Na2O2+2H2O 4NaOH+O2 ↑
2、与CO2反应:2Na2O2+2CO2 2Na2CO3+O2
1、与酸反应:Na2CO3+2HCl 2NaCl+H2O+CO2 ↑
NaHCO3+HCl NaCl+H2O+CO2 ↑
