第四章 物质结构元素周期律(含解析) 单元测试题 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第四章 物质结构元素周期律(含解析) 单元测试题 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 400.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-24 21:18:12 | ||
图片预览




文档简介
第四章 物质结构 元素周期律 单元测试题
一、单选题
1.正高碘酸(结构如图所示)具有强氧化性和弱酸性,脱水可得偏高碘酸(),下列说法正确的是
A.正高碘酸为五元酸
B.的酸性强于
C.正高碘酸与反应后溶液呈紫红色,反应如下:
D.正高碘酸隔绝空气加热分解仅生成、
2.某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表一种元素,其中O点代表氢元素。下列说法不正确的是
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.B、C最高价氧化物对应的水化物可相互反应
D.最简单氢化物的热稳定性:A>D
3.“天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和液态肼(N2H4)等。下列有关说法正确的是
A.肼在燃烧过程中作氧化剂
B.H2燃烧过程中热能转化为化学能
C.火星中的20Ne质量数为20
D.月壤中的3He与地球上的3H互为同位素
4.短周期主族元素X、Y、Z、W的原子序数依次增大,X是目前形成化合物种类最多的元素,Y的单质是空气的成分之一,且其非金属性比空气中形成另一种单质的元素强,Z的最高价氧化物对应的水化物能分别与强酸、强碱反应,W与Y的最外层电子数相等。下列说法正确的是
A.Y、W同主族,且最高化合价相等
B.非金属性:XC.简单离子半径:W>Z>Y
D.由Y、Z、W三种元素组成的化合物中可能含离子键和极性键
5.四种短周期元素W、X、Y、Z原子序数依次增大,其中W的最外层电子数为内层电子总数的3倍,X的焰色反应呈黄色,Y的最高价氧化物对应水化物为中强碱,Z的单质为黄绿色气体。下列说法正确的是
A.Y在元素周期表中位于第三周期第ⅢA族
B.W、X、Y、Z四种元素按原子半径由大到小的顺序排列为X>Y>Z>W
C.元素X、W形成离子化合物中,一定只含离子键
D.Z元素形成的最高价氧化物对应水化物的化学式HZO
6.Na、Mg、Ca、Al是常用作冶炼金属的还原剂,如:工业冶炼金属钾的反应原理是
①,工业冶炼金属铷的反应原理是
②,下列说法不正确的是
A.铝作还原剂冶炼金属的反应称之为铝热反应
B.该冶炼方法属于热还原法
C.①反应无法说明钠元素的金属性强于钾元素
D.①反应中可以选KCl水溶液
7.2022年诺贝尔化学奖颁给了在“点击化学”领域做出贡献的科学家。我国科研人员发现了一种安全、高效的点击化学试剂FSO2N3。下列关于元素F、S、O、N的说法正确的是
A.简单气态氢化物中最稳定的是HF B.元素非金属性最强的是S
C.F原子半径比N原子半径大 D.O元素在周期表中的位置是第二周期Ⅵ族
8.X、Y、Z、W是原子序数依次增大的不同主族的短周期元素,X、Y的简单离子的核外电子数相同,Y的原子半径是短周期主族元素原子中最大的,Z原子最外层电子数是K层的3倍。下列说法正确的是
A.简单离子半径:Y>Z
B.W的单质具有漂白性
C.气态氢化物的热稳定性:WD.Y与Z、W都能形成离子化合物
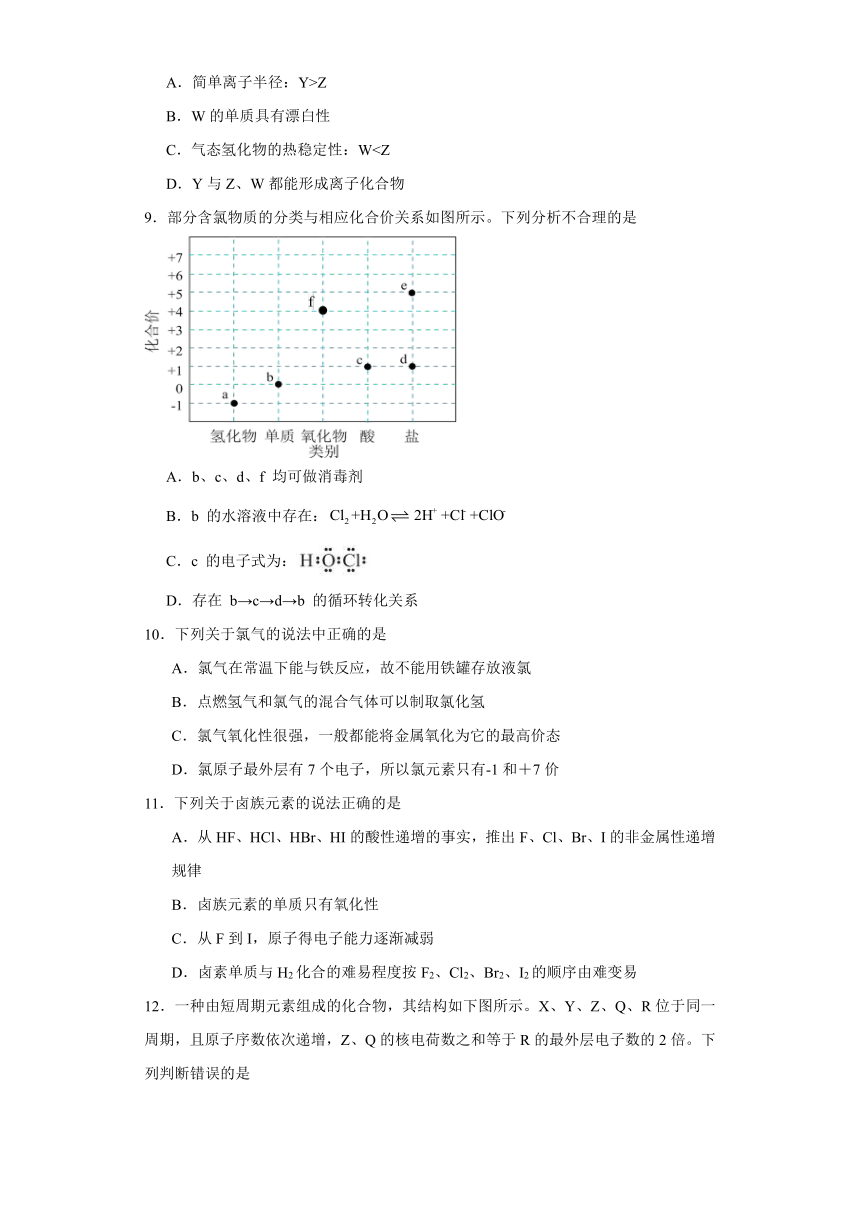
9.部分含氯物质的分类与相应化合价关系如图所示。下列分析不合理的是
A.b、c、d、f 均可做消毒剂
B.b 的水溶液中存在:
C.c 的电子式为:
D.存在 b→c→d→b 的循环转化关系
10.下列关于氯气的说法中正确的是
A.氯气在常温下能与铁反应,故不能用铁罐存放液氯
B.点燃氢气和氯气的混合气体可以制取氯化氢
C.氯气氧化性很强,一般都能将金属氧化为它的最高价态
D.氯原子最外层有7个电子,所以氯元素只有-1和+7价
11.下列关于卤族元素的说法正确的是
A.从HF、HCl、HBr、HI的酸性递增的事实,推出F、Cl、Br、I的非金属性递增规律
B.卤族元素的单质只有氧化性
C.从F到I,原子得电子能力逐渐减弱
D.卤素单质与H2化合的难易程度按F2、Cl2、Br2、I2的顺序由难变易
12.一种由短周期元素组成的化合物,其结构如下图所示。X、Y、Z、Q、R位于同一周期,且原子序数依次递增,Z、Q的核电荷数之和等于R的最外层电子数的2倍。下列判断错误的是
A.离子半径:XB.化合物YR3中各原子最外层均满足8电子稳定结构
C.元素的非金属性:ZD.使用ZQ2跨临界可直接制冰,利用了ZQ2晶体易升华的性质
13.四种短周期元素X、Y、Z和W在周期表中的位置如图所示,它们的原子序数之和为43。下列说法不正确的是
X Y
Z W
Q
A.原子半径(r):
B.Y、Z、W元素在自然界中均存在游离态
C.Q的原子序数为32,Q元素的单质可作半导体材料
D.X的最简气态氢化物比Y的最简气态氢化物沸点低,热稳定性差
二、多选题
14.已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是
A.原子序数:D>C>B>A B.原子半径:B>A>C>D
C.离子半径:C3->D->A2+>B+ D.氧化性:A2+>B+,还原性:C3->D-
三、非选择题
15.端午节是中华民族的传统节日,这一天小美妈妈准备了丰盛的晚餐。
(1)小美一进家门,就闻到粽子的香味,从微观的角度解释闻到香味的原因是 ,包粽子的原料之一是糯米,糯米中富含的营养素是 ;
(2)妈妈煮菜时用了加碘食盐。人体缺碘可引起 疾病;
(3)到家后小美先用酒精消毒液洗手。酒精能杀菌消毒的原因是 ;
(4)饭后,小美看到一篇报道“2021年9月,中国科学家在《科学》杂志撰文宣告首次实现了由到淀粉[]的人工全合成”,其合成淀粉的总反应化学方程式为:。该技术除有望缓解粮食危机外,还可缓解环境问题中的 效应。
16.我国空间站“天和”核心舱太阳翼电池采用自主研发的砷化镓器件,能量转化效率大大提高。已知:砷()与镓()同位于第四周期;与同主族,与P同主族。
(1)P在元素周期表中的位置是 ,镓的原子结构示意图为 。
(2)非金属性强弱S P(填“大于”或“小于”),下列表述中能证明这一事实的是 (填字母)。
a.S的简单氢化物的水溶液比P的简单氢化物的水溶液酸性强
b.S最高价氧化物对应的水化物的酸性强于P最高价氧化物对应的水化物的酸性
c.在反应中,P原子得电子数比S原子得电子数多
d.S的简单阴离子的还原性比P的简单阴离子的还原性弱
(3)下列关于的推断正确的是 (填序号)。
①的最高正价为+5;②原子半径:;③元素的金属性:
(4),的酸性由强到弱的关系是 。
(5)与在一定条件下化合为,用电子式表示的形成过程: 。
17.2022年6月5日10时44分,神舟十四号载人飞船在酒泉卫星发射中心点火发射。飞船返回地球时,为了减弱返回舱着陆的速度,反推发动机的燃料是高氯酸铵和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:
(1)二氧化氯和过氧化氢均能有效灭杀新冠病毒。
①中氯元素的化合价是 ,的结构式是 。
②在酸性条件下,由和双氧水反应制备,其反应的离子方程式为 ;该反应中还原剂与氧化剂的物质的量之比为 。
(2)高氯酸铵中铵根离子的电子式为 ;高氯酸铵和铝粉中的元素所形成的简单离子中,核外电子数相同、半径由小到大的顺序是 (用离子符号表示)。
(3)氮元素的非金属性较强,可分子的性质比较稳定,其原因是 。
(4)高氯酸铵和铝粉反应除了生成和外,还有另外两种不含氮元素的物质生成,请写出其化学方程式 。
18.如图是元素周期表的一部分。回答下列问题:
16 S 硫 32.06 17 Cl 氯 35.45
34 Se 硒 78.96 35 Br 溴 79.90
53 I 碘 126.9
(1)世界上绝大部分卤素都存在于海洋中,海洋是卤素的资源宝库。
①的离子结构示意图 。
②表中几种元素的最高价氧化物对应水化物酸性最强的是 (填化学式)。
③用电子式表示短周期元素中,原子半径最大的元素与氯形成的简单化合物的形成过程: 。
④氰[(CN)2]是一种无色、可燃气体,剧毒、有苦杏仁味,与卤素单质的性质相似,试写出氰与NaOH溶液在常温下反应的离子方程式: 。
(2)硒是人体必需的微量元素,起到抗氧化的作用。
①写出Se在周期表中的位置: 。
②溶于水生成,向所得溶液中通入气体发生反应,生成Se和。写出与反应的化学方程式: 。
(3)下列说法正确的是 (填字母)。
a.原子半径:
b.存在的化学键为极性共价键
c.非金属性:
试卷第1页,共3页
参考答案:
1.A
【详解】A. 正高碘酸分子中含有5个羟基,所以为五元酸,故A正确;
B. 元素非金属性越强,最高价含氧酸的酸性越强,非金属性Br>I,所以的酸性弱于,故B错误;
C. 正高碘酸与反应后溶液呈紫红色,说明Mn2+被氧化为,氧化性大于I-,所以还原产物不是I-,故B错误;
D. 根据氧化还原反应规律,正高碘酸隔绝空气加热分解生成、、O2,故D错误;
选A。
2.A
【详解】A.离O点越远的元素原子序数越大,原子序数越大不一定原子半径越大,同一周期从左往右,原子半径递减,故A错误;
B.虚线相连的元素处于同一族,B正确;
C.B的最高价氧化物对应的水化物为氢氧化钠, C的最高价氧化物对应的水化物为氢氧化铝,反应生成偏铝酸钠和水,故C正确;
D.A、D处于同一主族,同主族元素从上往下,非金属性逐渐减小,最简单氢化物的热稳定性逐渐减小,故最简单氢化物的热稳定性:A>D,故D正确。
答案为:A。
3.C
【详解】A.肼与氧气燃烧过程中氧气作氧化剂,肼作还原剂,故A错误;
B.H2燃烧过程是化学能转化为热能,故B错误;
C.原子符号左上角诶质量数,左下角为质子数;火星陨石中的20Ne质量数为20,故C正确;
D.质子数相同中子数不同的同种元素的不同原子互为同位素,月壤中的3He与地球上的3H是不同元素的不同原子,不能互为同位素,故D错误;
故选:C。
4.D
【分析】由题干信息可知,短周期主族元素X、Y、Z、W的原子序数依次增大,X是目前形成化合物种类最多的元素,则X为C,Y的单质是空气的成分之一即N2或者O2,已知O的非金属性强于N,且其非金属性比空气中形成另一种单质的元素强,则Y为O,Z的最高价氧化物对应的水化物能分别与强酸、强碱反应则Z为Al,W与Y的最外层电子数相等,即最外层上有6个电子,且原子序数比Al大,故W为S,据此分析解题。
【详解】A.由分析可知,Y为O、W为S,故Y、W同主族,但O无最高正价,即二者最高化合价不相等,A错误;
B.由分析可知,X为C、Y为O、W为S,根据同一周期从左往右元素非金属性依次增强,同一主族从上往下元素非金属性依次减弱,且CS2中C显正价,S显负价,故非金属性:O>S>C 即X< W < Y ,B错误;
C.由分析可知, Y为O、Z为Al、W为S,根据电子层数越多微粒半径一般越大,电子层数相同核电荷数越多,半径越小可知,简单离子半径S2->O2->Al3+即W> Y > Z ,C错误;
D.由分析可知,Y为O、Z为Al、W为S,由Y、Z、W三种元素组成的化合物如Al2(SO4)3中含有离子键和极性键,D正确;
故答案为:D。
5.B
【分析】由题干信息可知,四种短周期元素W、X、Y、Z原子序数依次增大,其中W的最外层电子数为内层电子总数的3倍,故W为O,X的焰色反应呈黄色,故X为Na,Y的最高价氧化物对应水化物为中强碱,则Y为Mg,Z的单质为黄绿色气体,则Z为Cl,据此分析解题。
【详解】A.由分析可知,Y为Mg,则Y在元素周期表中位于第三周期第ⅡA族,A错误;
B.由分析可知,W、X、Y、Z分别为O、Na、Mg、Cl,故W、X、Y、Z四种元素按原子半径由大到小的顺序排列为Na>Mg>Cl>O即X>Y>Z>W,B正确;
C.由分析可知,X为Na,W为O,元素X、W形成离子化合物中Na2O只含离子键,但Na2O2中既有离子键又有共价键,C错误;
D.由分析可知,Z为Cl,故Z元素形成的最高价氧化物对应水化物的化学式HClO4即HZO4,D错误;
故答案为:B。
6.D
【详解】A.铝热反应的原理是利用铝作还原剂,置换出相对不活泼的金属,故A正确;
B.该反应为氧化还原反应,该冶炼方法属于热还原法,故B正确;
C.该反应中生成钾气体逸出,导致反应能够进行,不能说明钠的金属性强于钾,故C正确;
D.钠与水反应,所以该反应中不能选KCl水溶液,故D错误;
故选:D。
7.A
【详解】A.F的非金属性最强,因此简单气态氢化物中最稳定的是HF,故A正确;
B.在整个元素周期表中F元素的非金属性最强,故B错误;
C.根据同电子层结构核多径小,则F原子半径比N原子半径小,故C错误;
D.O元素是8号元素,O原子核外电子排布为2、6,则O元素在周期表中的位置是第2周期第VIA族,故D错误;
故选:A。
8.D
【分析】Y的原子半径是短周期主族元素原子中最大的,故Y是Na,Z原子最外层电子数是K层的3倍,故Z为S,X、Y、Z、W是原子序数依次增大,故W为Cl。X、Y的简单离子的核外电子数相同且属不同主族的短周期元素,故X为N。
【详解】A.离子半径:Na+B.氯气无漂白性,次氯酸具有漂白性,B错误;
C.气态氢化物的热稳定性:H2SD.Na是活泼金属,与S、Cl都能形成离子化合物,D正确;
故选D。
9.B
【分析】由元素的化合价及物质类别可知,a为HCl,b为Cl2,c为HClO,f为ClO2,d为次氯酸盐,e为氯酸盐。
【详解】A.b为Cl2,c为HClO,f为ClO2,d为次氯酸盐,均有强氧化性,可做消毒剂,故A正确;
B.b为Cl2,与水反应的离子方程式为:,故B错误;
C.c为HClO,电子式为,故C正确;
D.b为Cl2,c为HClO,d为次氯酸盐,Cl2与水反应生成HClO,HClO可以与碱反应生成次氯酸盐,次氯酸盐具有强氧化性可与盐酸发生归中反应生成氯气,可存在b→c→d→b的循环转化关系,故D正确。
答案选B。
10.C
【详解】A.常温或低温条件下,干燥氯气与铁不能反应,故常温下能用铁罐存放液氯,A错误;
B.如果点燃的是氢气和氯气的混合气体,则可能会发生爆炸,B错误;
C.氯气具有强的氧化性,一般都能将变价金属氧化为它的高价态,C正确;
D.氯原子最外层有7个电子,因此最高化合价为+7价,最低为-1价,此外还有0价(Cl2)、+1价(HClO)、+3价(HClO2)、+4价(ClO2)、+5价(HClO3)等多种价态,D错误;
故合理选项是C。
11.C
【详解】A.F、Cl、Br、I的非金属性逐渐减弱,但HF、HCl、HBr、HI的酸性逐渐增强,A错误;
B.氯气、溴、碘既有氧化性又有还原性,B错误;
C.从F到I,原子核对最外层电子的吸引力逐渐减弱,原子得电子的能力逐渐减弱,C正确;
D.元素的非金属性越强,其单质与氢气越容易化合,非金属性F>Cl>Br>I,所以卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由易变难,D错误;
答案选C。
12.B
【分析】由图及题意可得,X为Li,Y为B,Z为C,Q为O,R为F;
【详解】A.电子层数越多简单离子半径越大,电子层数相同的离子,核电荷数越大,离子半径越小,故离子半径:X(Li+)B.Y与R形成的化合物为BF3,B的最外层电子数为3+3=6,不满足8电子稳定结构,B错误;
C.主族元素同周期从左往右非金属性逐渐增强,则元素非金属性:Z(C)D.ZQ2为CO2,固态二氧化碳是干冰,利用二氧化碳晶体升华的物理性质,使用二氧化碳跨临界可以直接制冰,D正确;
故选B。
13.B
【分析】由四种短周期元素X、Y、Z和W在周期表中的位置可知,它们的原子序数之和为43,设Y的原子序数为a,X、Z、W的原子序数分别为a-1、a-1+8、a+1+8,则a+a-1+a-1+8+a+1+8=43,解得:a=7,则X为C元素,Y为N,Z为Si,W为S元素;Q与X、Z都位于第IVA族,为锗元素,据此解答。
【详解】A.同一周期从左向右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,则原子半径:,A正确;
B.Si在自然界中都是以化合物的形式存在,自然界中没有游离态的Si存在,B错误;
C.Q元素位于第四周期 IVA族,原子序数为32,Ge位于金属与非金属的分界线附近,可以推断Q元素的单质可作半导体材料,C正确;
D.X的最简气态氢化物为CH4,Y的最简气态氢化物为NH3,由于NH3分子之间存在氢键,沸点比高CH4,非金属性越强,氢化物越稳定,则稳定性CH4< NH3,故D正确;
答案选B。
14.BD
【分析】由于四种离子具有相同的电子层结构,离子所对应的元素应位于相邻两个周期,根据阴、阳离子所带的电荷数,得出元素在周期表中的位置关系: 。
【详解】A.根据上述分析,原子序数大小应为A>B>D>C,故A错误;
B.电子层越多,半径越大,电子层数相同,随着原子序数的递增,半径逐渐减小,因此有原子半径:B>A>C>D,故B正确;
C.电子层数相同,随着原子序数的递增,半径逐渐减小,它们核外电子排布相同,因此离子半径应为C3->D->B+>A2+,故C错误;
D.金属性:B>A,推出氧化性:A2+>B+,非金属性:D>C,推出还原性:C3->D-,故D正确;
答案为BD。
15.(1) 微粒在不断运动 糖类
(2)甲状腺肿大
(3)酒精能使蛋白质变性
(4)温室
【详解】(1)从微观的角度解释闻到香味的原因是:微粒在不断运动,引起香味的分子四处扩散;糯米中富含的营养素是糖类;
(2)人体缺碘可引起甲状腺肿大;
(3)酒精能杀菌消毒的原因是酒精能使蛋白质变性,能使细菌、病毒失去活性;
(4)该技术可增加二氧化碳的消耗,缓解温室效应。
16.(1) 第三周期第VA族
(2) 大于 bd
(3)②
(4)
(5)
【详解】(1)P原子序数为15,在元素周期表中的位置是第三周期VA族;Ga是31号元素,所以原子结构示意图为 ;
(2)P的非金属性弱于S的,用原子结构解释原因:P和S在同一周期, 原子核外电子层数相同,核电荷数P小于S,原子半径P大于S,因此P对最外层电子的吸引能力比S弱,得电子能力P弱于S,所以P的非金属性弱于S;a.气态氢化物的稳定性才能说明非金属性强弱,水溶液的酸性强弱不能,a错误;b.S最高价氧化物对应的水化物的酸性强于P最高价氧化物对应的水化物的酸性,可以说明S的非金属性强于P,b正确;c.得电子数目不能比较非金属性强弱,得电子能力才可以,c错误;d. S的简单阴离子的还原性比P的简单阴离子的还原性弱,说明单质的氧化性S强于P,可以说明非金属性S强于P,d正确;故选bd;
(3)①Ga与Al同族,位于第ⅢA族,原子的最外层电子数为3,最高正价为+3价,错误;
② As与Ga均位于第4周期,As位于VA,Ga位于第ⅢA, 故原子半径:Ga>As,正确;
③K与Ga均位于第4周期,该周期中K金属性最强,错误;
故选②;
(4)N、 P、As三种非金属元素位于同主族,最外层电子数相同,随着原子序数逐渐增大,原子半径也逐渐增大,非金属性逐渐减弱,最高价氧化物对应水化物酸性减弱,所以HNO3、H3PO4、H3AsO4的酸性由强到弱的关系是:HNO3>H3PO4>H3AsO4;
(5)As最外层有5个电子,所以的形成过程为 。
17.(1) +4
(2)
(3)分子中氮氮叁键键能大,很难断开,所以比较稳定
(4)
【详解】(1)①二氧化氯中氧为-2价,依据化合物中各元素化合价代数和为0可知,氯元素化合价为+4价;过氧化氢存在2个H-O、1个O-O键,结构式为:H-O-O-H,故答案为:+4;H-O-O-H;
②酸性条件下,做氧化剂,还原产物为,做还原剂,氧化产物是,结合溶液酸碱性与化合价变化可以配平离子方程式为,故该反应中还原剂与氧化剂的物质的量之比为;
(2)铵根离子氮原子与4个氢原子分别共用1对电子,带一个单位正电荷,电子式为: ,高氯酸铵和铅粉含有H、N、O、Al、Cl五种元素,其中形成的简单离子中核外电子数相同的为、、,核外电子数相同,质子数越多,对核外电子的半径吸引力越大,半径就越小,所以离子半径由小到大顺序为。
(3)氮元素的非金属性较强,可N2分子的性质比较稳定,是因为氮气分子中存在氮氮三键,很难断开,故答案为:氮气分子中存在氮氮三键,很难断开;
(4)高氯酸铵和铝粉反应除了生成AlCl3和N2外,还生成氧化铝、水,化学方程式为:。
18.(1) HClO4
(2) 第四周期第ⅥA族
(3)b
【详解】(1)由图知,I为53号元素,所以的离子结构示意图;同主族元素,从上往下非金属性逐渐减弱,非金属性越强,最高价氧化物对应的水化物酸性越强,故最高价氧化物对应的水化物酸性最强的是HClO4;短周期元素中,原子半径最大的是钠元素,钠元素容易失去一个电子,氯容易得到一个电子,故钠与氯形成的简单化合物的电子式为:;由于氰[(CN)2]与卤素单质的性质相似,则它在常温下与氢氧化钠的反应的离子方程式与氯气相似,则为:;
(2)由图知,Se在周期表中的位置为第四周期第ⅥA族;H2SeO3与SO2发生氧化还原反应生成Se和H2SO4,由电子守恒和原子守恒得化学反应方程式为:;
(3)a.由于I位于第五周期,它的半径应该最大,Se和Br是同周期元素,从左往右,半径逐渐减小,故,a错误;b.是由不同种原子构成的共价键,为极性共价键,b正确;c..由元素周期律可知,同周期元素,从左往右非金属性逐渐增强,同主族元素,从上往下,金属性逐渐增强,则非金属性:,c错误
一、单选题
1.正高碘酸(结构如图所示)具有强氧化性和弱酸性,脱水可得偏高碘酸(),下列说法正确的是
A.正高碘酸为五元酸
B.的酸性强于
C.正高碘酸与反应后溶液呈紫红色,反应如下:
D.正高碘酸隔绝空气加热分解仅生成、
2.某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表一种元素,其中O点代表氢元素。下列说法不正确的是
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.B、C最高价氧化物对应的水化物可相互反应
D.最简单氢化物的热稳定性:A>D
3.“天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和液态肼(N2H4)等。下列有关说法正确的是
A.肼在燃烧过程中作氧化剂
B.H2燃烧过程中热能转化为化学能
C.火星中的20Ne质量数为20
D.月壤中的3He与地球上的3H互为同位素
4.短周期主族元素X、Y、Z、W的原子序数依次增大,X是目前形成化合物种类最多的元素,Y的单质是空气的成分之一,且其非金属性比空气中形成另一种单质的元素强,Z的最高价氧化物对应的水化物能分别与强酸、强碱反应,W与Y的最外层电子数相等。下列说法正确的是
A.Y、W同主族,且最高化合价相等
B.非金属性:X
D.由Y、Z、W三种元素组成的化合物中可能含离子键和极性键
5.四种短周期元素W、X、Y、Z原子序数依次增大,其中W的最外层电子数为内层电子总数的3倍,X的焰色反应呈黄色,Y的最高价氧化物对应水化物为中强碱,Z的单质为黄绿色气体。下列说法正确的是
A.Y在元素周期表中位于第三周期第ⅢA族
B.W、X、Y、Z四种元素按原子半径由大到小的顺序排列为X>Y>Z>W
C.元素X、W形成离子化合物中,一定只含离子键
D.Z元素形成的最高价氧化物对应水化物的化学式HZO
6.Na、Mg、Ca、Al是常用作冶炼金属的还原剂,如:工业冶炼金属钾的反应原理是
①,工业冶炼金属铷的反应原理是
②,下列说法不正确的是
A.铝作还原剂冶炼金属的反应称之为铝热反应
B.该冶炼方法属于热还原法
C.①反应无法说明钠元素的金属性强于钾元素
D.①反应中可以选KCl水溶液
7.2022年诺贝尔化学奖颁给了在“点击化学”领域做出贡献的科学家。我国科研人员发现了一种安全、高效的点击化学试剂FSO2N3。下列关于元素F、S、O、N的说法正确的是
A.简单气态氢化物中最稳定的是HF B.元素非金属性最强的是S
C.F原子半径比N原子半径大 D.O元素在周期表中的位置是第二周期Ⅵ族
8.X、Y、Z、W是原子序数依次增大的不同主族的短周期元素,X、Y的简单离子的核外电子数相同,Y的原子半径是短周期主族元素原子中最大的,Z原子最外层电子数是K层的3倍。下列说法正确的是
A.简单离子半径:Y>Z
B.W的单质具有漂白性
C.气态氢化物的热稳定性:W
9.部分含氯物质的分类与相应化合价关系如图所示。下列分析不合理的是
A.b、c、d、f 均可做消毒剂
B.b 的水溶液中存在:
C.c 的电子式为:
D.存在 b→c→d→b 的循环转化关系
10.下列关于氯气的说法中正确的是
A.氯气在常温下能与铁反应,故不能用铁罐存放液氯
B.点燃氢气和氯气的混合气体可以制取氯化氢
C.氯气氧化性很强,一般都能将金属氧化为它的最高价态
D.氯原子最外层有7个电子,所以氯元素只有-1和+7价
11.下列关于卤族元素的说法正确的是
A.从HF、HCl、HBr、HI的酸性递增的事实,推出F、Cl、Br、I的非金属性递增规律
B.卤族元素的单质只有氧化性
C.从F到I,原子得电子能力逐渐减弱
D.卤素单质与H2化合的难易程度按F2、Cl2、Br2、I2的顺序由难变易
12.一种由短周期元素组成的化合物,其结构如下图所示。X、Y、Z、Q、R位于同一周期,且原子序数依次递增,Z、Q的核电荷数之和等于R的最外层电子数的2倍。下列判断错误的是
A.离子半径:X
C.元素的非金属性:Z
13.四种短周期元素X、Y、Z和W在周期表中的位置如图所示,它们的原子序数之和为43。下列说法不正确的是
X Y
Z W
Q
A.原子半径(r):
B.Y、Z、W元素在自然界中均存在游离态
C.Q的原子序数为32,Q元素的单质可作半导体材料
D.X的最简气态氢化物比Y的最简气态氢化物沸点低,热稳定性差
二、多选题
14.已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是
A.原子序数:D>C>B>A B.原子半径:B>A>C>D
C.离子半径:C3->D->A2+>B+ D.氧化性:A2+>B+,还原性:C3->D-
三、非选择题
15.端午节是中华民族的传统节日,这一天小美妈妈准备了丰盛的晚餐。
(1)小美一进家门,就闻到粽子的香味,从微观的角度解释闻到香味的原因是 ,包粽子的原料之一是糯米,糯米中富含的营养素是 ;
(2)妈妈煮菜时用了加碘食盐。人体缺碘可引起 疾病;
(3)到家后小美先用酒精消毒液洗手。酒精能杀菌消毒的原因是 ;
(4)饭后,小美看到一篇报道“2021年9月,中国科学家在《科学》杂志撰文宣告首次实现了由到淀粉[]的人工全合成”,其合成淀粉的总反应化学方程式为:。该技术除有望缓解粮食危机外,还可缓解环境问题中的 效应。
16.我国空间站“天和”核心舱太阳翼电池采用自主研发的砷化镓器件,能量转化效率大大提高。已知:砷()与镓()同位于第四周期;与同主族,与P同主族。
(1)P在元素周期表中的位置是 ,镓的原子结构示意图为 。
(2)非金属性强弱S P(填“大于”或“小于”),下列表述中能证明这一事实的是 (填字母)。
a.S的简单氢化物的水溶液比P的简单氢化物的水溶液酸性强
b.S最高价氧化物对应的水化物的酸性强于P最高价氧化物对应的水化物的酸性
c.在反应中,P原子得电子数比S原子得电子数多
d.S的简单阴离子的还原性比P的简单阴离子的还原性弱
(3)下列关于的推断正确的是 (填序号)。
①的最高正价为+5;②原子半径:;③元素的金属性:
(4),的酸性由强到弱的关系是 。
(5)与在一定条件下化合为,用电子式表示的形成过程: 。
17.2022年6月5日10时44分,神舟十四号载人飞船在酒泉卫星发射中心点火发射。飞船返回地球时,为了减弱返回舱着陆的速度,反推发动机的燃料是高氯酸铵和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:
(1)二氧化氯和过氧化氢均能有效灭杀新冠病毒。
①中氯元素的化合价是 ,的结构式是 。
②在酸性条件下,由和双氧水反应制备,其反应的离子方程式为 ;该反应中还原剂与氧化剂的物质的量之比为 。
(2)高氯酸铵中铵根离子的电子式为 ;高氯酸铵和铝粉中的元素所形成的简单离子中,核外电子数相同、半径由小到大的顺序是 (用离子符号表示)。
(3)氮元素的非金属性较强,可分子的性质比较稳定,其原因是 。
(4)高氯酸铵和铝粉反应除了生成和外,还有另外两种不含氮元素的物质生成,请写出其化学方程式 。
18.如图是元素周期表的一部分。回答下列问题:
16 S 硫 32.06 17 Cl 氯 35.45
34 Se 硒 78.96 35 Br 溴 79.90
53 I 碘 126.9
(1)世界上绝大部分卤素都存在于海洋中,海洋是卤素的资源宝库。
①的离子结构示意图 。
②表中几种元素的最高价氧化物对应水化物酸性最强的是 (填化学式)。
③用电子式表示短周期元素中,原子半径最大的元素与氯形成的简单化合物的形成过程: 。
④氰[(CN)2]是一种无色、可燃气体,剧毒、有苦杏仁味,与卤素单质的性质相似,试写出氰与NaOH溶液在常温下反应的离子方程式: 。
(2)硒是人体必需的微量元素,起到抗氧化的作用。
①写出Se在周期表中的位置: 。
②溶于水生成,向所得溶液中通入气体发生反应,生成Se和。写出与反应的化学方程式: 。
(3)下列说法正确的是 (填字母)。
a.原子半径:
b.存在的化学键为极性共价键
c.非金属性:
试卷第1页,共3页
参考答案:
1.A
【详解】A. 正高碘酸分子中含有5个羟基,所以为五元酸,故A正确;
B. 元素非金属性越强,最高价含氧酸的酸性越强,非金属性Br>I,所以的酸性弱于,故B错误;
C. 正高碘酸与反应后溶液呈紫红色,说明Mn2+被氧化为,氧化性大于I-,所以还原产物不是I-,故B错误;
D. 根据氧化还原反应规律,正高碘酸隔绝空气加热分解生成、、O2,故D错误;
选A。
2.A
【详解】A.离O点越远的元素原子序数越大,原子序数越大不一定原子半径越大,同一周期从左往右,原子半径递减,故A错误;
B.虚线相连的元素处于同一族,B正确;
C.B的最高价氧化物对应的水化物为氢氧化钠, C的最高价氧化物对应的水化物为氢氧化铝,反应生成偏铝酸钠和水,故C正确;
D.A、D处于同一主族,同主族元素从上往下,非金属性逐渐减小,最简单氢化物的热稳定性逐渐减小,故最简单氢化物的热稳定性:A>D,故D正确。
答案为:A。
3.C
【详解】A.肼与氧气燃烧过程中氧气作氧化剂,肼作还原剂,故A错误;
B.H2燃烧过程是化学能转化为热能,故B错误;
C.原子符号左上角诶质量数,左下角为质子数;火星陨石中的20Ne质量数为20,故C正确;
D.质子数相同中子数不同的同种元素的不同原子互为同位素,月壤中的3He与地球上的3H是不同元素的不同原子,不能互为同位素,故D错误;
故选:C。
4.D
【分析】由题干信息可知,短周期主族元素X、Y、Z、W的原子序数依次增大,X是目前形成化合物种类最多的元素,则X为C,Y的单质是空气的成分之一即N2或者O2,已知O的非金属性强于N,且其非金属性比空气中形成另一种单质的元素强,则Y为O,Z的最高价氧化物对应的水化物能分别与强酸、强碱反应则Z为Al,W与Y的最外层电子数相等,即最外层上有6个电子,且原子序数比Al大,故W为S,据此分析解题。
【详解】A.由分析可知,Y为O、W为S,故Y、W同主族,但O无最高正价,即二者最高化合价不相等,A错误;
B.由分析可知,X为C、Y为O、W为S,根据同一周期从左往右元素非金属性依次增强,同一主族从上往下元素非金属性依次减弱,且CS2中C显正价,S显负价,故非金属性:O>S>C 即X< W < Y ,B错误;
C.由分析可知, Y为O、Z为Al、W为S,根据电子层数越多微粒半径一般越大,电子层数相同核电荷数越多,半径越小可知,简单离子半径S2->O2->Al3+即W> Y > Z ,C错误;
D.由分析可知,Y为O、Z为Al、W为S,由Y、Z、W三种元素组成的化合物如Al2(SO4)3中含有离子键和极性键,D正确;
故答案为:D。
5.B
【分析】由题干信息可知,四种短周期元素W、X、Y、Z原子序数依次增大,其中W的最外层电子数为内层电子总数的3倍,故W为O,X的焰色反应呈黄色,故X为Na,Y的最高价氧化物对应水化物为中强碱,则Y为Mg,Z的单质为黄绿色气体,则Z为Cl,据此分析解题。
【详解】A.由分析可知,Y为Mg,则Y在元素周期表中位于第三周期第ⅡA族,A错误;
B.由分析可知,W、X、Y、Z分别为O、Na、Mg、Cl,故W、X、Y、Z四种元素按原子半径由大到小的顺序排列为Na>Mg>Cl>O即X>Y>Z>W,B正确;
C.由分析可知,X为Na,W为O,元素X、W形成离子化合物中Na2O只含离子键,但Na2O2中既有离子键又有共价键,C错误;
D.由分析可知,Z为Cl,故Z元素形成的最高价氧化物对应水化物的化学式HClO4即HZO4,D错误;
故答案为:B。
6.D
【详解】A.铝热反应的原理是利用铝作还原剂,置换出相对不活泼的金属,故A正确;
B.该反应为氧化还原反应,该冶炼方法属于热还原法,故B正确;
C.该反应中生成钾气体逸出,导致反应能够进行,不能说明钠的金属性强于钾,故C正确;
D.钠与水反应,所以该反应中不能选KCl水溶液,故D错误;
故选:D。
7.A
【详解】A.F的非金属性最强,因此简单气态氢化物中最稳定的是HF,故A正确;
B.在整个元素周期表中F元素的非金属性最强,故B错误;
C.根据同电子层结构核多径小,则F原子半径比N原子半径小,故C错误;
D.O元素是8号元素,O原子核外电子排布为2、6,则O元素在周期表中的位置是第2周期第VIA族,故D错误;
故选:A。
8.D
【分析】Y的原子半径是短周期主族元素原子中最大的,故Y是Na,Z原子最外层电子数是K层的3倍,故Z为S,X、Y、Z、W是原子序数依次增大,故W为Cl。X、Y的简单离子的核外电子数相同且属不同主族的短周期元素,故X为N。
【详解】A.离子半径:Na+
C.气态氢化物的热稳定性:H2S
故选D。
9.B
【分析】由元素的化合价及物质类别可知,a为HCl,b为Cl2,c为HClO,f为ClO2,d为次氯酸盐,e为氯酸盐。
【详解】A.b为Cl2,c为HClO,f为ClO2,d为次氯酸盐,均有强氧化性,可做消毒剂,故A正确;
B.b为Cl2,与水反应的离子方程式为:,故B错误;
C.c为HClO,电子式为,故C正确;
D.b为Cl2,c为HClO,d为次氯酸盐,Cl2与水反应生成HClO,HClO可以与碱反应生成次氯酸盐,次氯酸盐具有强氧化性可与盐酸发生归中反应生成氯气,可存在b→c→d→b的循环转化关系,故D正确。
答案选B。
10.C
【详解】A.常温或低温条件下,干燥氯气与铁不能反应,故常温下能用铁罐存放液氯,A错误;
B.如果点燃的是氢气和氯气的混合气体,则可能会发生爆炸,B错误;
C.氯气具有强的氧化性,一般都能将变价金属氧化为它的高价态,C正确;
D.氯原子最外层有7个电子,因此最高化合价为+7价,最低为-1价,此外还有0价(Cl2)、+1价(HClO)、+3价(HClO2)、+4价(ClO2)、+5价(HClO3)等多种价态,D错误;
故合理选项是C。
11.C
【详解】A.F、Cl、Br、I的非金属性逐渐减弱,但HF、HCl、HBr、HI的酸性逐渐增强,A错误;
B.氯气、溴、碘既有氧化性又有还原性,B错误;
C.从F到I,原子核对最外层电子的吸引力逐渐减弱,原子得电子的能力逐渐减弱,C正确;
D.元素的非金属性越强,其单质与氢气越容易化合,非金属性F>Cl>Br>I,所以卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由易变难,D错误;
答案选C。
12.B
【分析】由图及题意可得,X为Li,Y为B,Z为C,Q为O,R为F;
【详解】A.电子层数越多简单离子半径越大,电子层数相同的离子,核电荷数越大,离子半径越小,故离子半径:X(Li+)
C.主族元素同周期从左往右非金属性逐渐增强,则元素非金属性:Z(C)
故选B。
13.B
【分析】由四种短周期元素X、Y、Z和W在周期表中的位置可知,它们的原子序数之和为43,设Y的原子序数为a,X、Z、W的原子序数分别为a-1、a-1+8、a+1+8,则a+a-1+a-1+8+a+1+8=43,解得:a=7,则X为C元素,Y为N,Z为Si,W为S元素;Q与X、Z都位于第IVA族,为锗元素,据此解答。
【详解】A.同一周期从左向右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,则原子半径:,A正确;
B.Si在自然界中都是以化合物的形式存在,自然界中没有游离态的Si存在,B错误;
C.Q元素位于第四周期 IVA族,原子序数为32,Ge位于金属与非金属的分界线附近,可以推断Q元素的单质可作半导体材料,C正确;
D.X的最简气态氢化物为CH4,Y的最简气态氢化物为NH3,由于NH3分子之间存在氢键,沸点比高CH4,非金属性越强,氢化物越稳定,则稳定性CH4< NH3,故D正确;
答案选B。
14.BD
【分析】由于四种离子具有相同的电子层结构,离子所对应的元素应位于相邻两个周期,根据阴、阳离子所带的电荷数,得出元素在周期表中的位置关系: 。
【详解】A.根据上述分析,原子序数大小应为A>B>D>C,故A错误;
B.电子层越多,半径越大,电子层数相同,随着原子序数的递增,半径逐渐减小,因此有原子半径:B>A>C>D,故B正确;
C.电子层数相同,随着原子序数的递增,半径逐渐减小,它们核外电子排布相同,因此离子半径应为C3->D->B+>A2+,故C错误;
D.金属性:B>A,推出氧化性:A2+>B+,非金属性:D>C,推出还原性:C3->D-,故D正确;
答案为BD。
15.(1) 微粒在不断运动 糖类
(2)甲状腺肿大
(3)酒精能使蛋白质变性
(4)温室
【详解】(1)从微观的角度解释闻到香味的原因是:微粒在不断运动,引起香味的分子四处扩散;糯米中富含的营养素是糖类;
(2)人体缺碘可引起甲状腺肿大;
(3)酒精能杀菌消毒的原因是酒精能使蛋白质变性,能使细菌、病毒失去活性;
(4)该技术可增加二氧化碳的消耗,缓解温室效应。
16.(1) 第三周期第VA族
(2) 大于 bd
(3)②
(4)
(5)
【详解】(1)P原子序数为15,在元素周期表中的位置是第三周期VA族;Ga是31号元素,所以原子结构示意图为 ;
(2)P的非金属性弱于S的,用原子结构解释原因:P和S在同一周期, 原子核外电子层数相同,核电荷数P小于S,原子半径P大于S,因此P对最外层电子的吸引能力比S弱,得电子能力P弱于S,所以P的非金属性弱于S;a.气态氢化物的稳定性才能说明非金属性强弱,水溶液的酸性强弱不能,a错误;b.S最高价氧化物对应的水化物的酸性强于P最高价氧化物对应的水化物的酸性,可以说明S的非金属性强于P,b正确;c.得电子数目不能比较非金属性强弱,得电子能力才可以,c错误;d. S的简单阴离子的还原性比P的简单阴离子的还原性弱,说明单质的氧化性S强于P,可以说明非金属性S强于P,d正确;故选bd;
(3)①Ga与Al同族,位于第ⅢA族,原子的最外层电子数为3,最高正价为+3价,错误;
② As与Ga均位于第4周期,As位于VA,Ga位于第ⅢA, 故原子半径:Ga>As,正确;
③K与Ga均位于第4周期,该周期中K金属性最强,错误;
故选②;
(4)N、 P、As三种非金属元素位于同主族,最外层电子数相同,随着原子序数逐渐增大,原子半径也逐渐增大,非金属性逐渐减弱,最高价氧化物对应水化物酸性减弱,所以HNO3、H3PO4、H3AsO4的酸性由强到弱的关系是:HNO3>H3PO4>H3AsO4;
(5)As最外层有5个电子,所以的形成过程为 。
17.(1) +4
(2)
(3)分子中氮氮叁键键能大,很难断开,所以比较稳定
(4)
【详解】(1)①二氧化氯中氧为-2价,依据化合物中各元素化合价代数和为0可知,氯元素化合价为+4价;过氧化氢存在2个H-O、1个O-O键,结构式为:H-O-O-H,故答案为:+4;H-O-O-H;
②酸性条件下,做氧化剂,还原产物为,做还原剂,氧化产物是,结合溶液酸碱性与化合价变化可以配平离子方程式为,故该反应中还原剂与氧化剂的物质的量之比为;
(2)铵根离子氮原子与4个氢原子分别共用1对电子,带一个单位正电荷,电子式为: ,高氯酸铵和铅粉含有H、N、O、Al、Cl五种元素,其中形成的简单离子中核外电子数相同的为、、,核外电子数相同,质子数越多,对核外电子的半径吸引力越大,半径就越小,所以离子半径由小到大顺序为。
(3)氮元素的非金属性较强,可N2分子的性质比较稳定,是因为氮气分子中存在氮氮三键,很难断开,故答案为:氮气分子中存在氮氮三键,很难断开;
(4)高氯酸铵和铝粉反应除了生成AlCl3和N2外,还生成氧化铝、水,化学方程式为:。
18.(1) HClO4
(2) 第四周期第ⅥA族
(3)b
【详解】(1)由图知,I为53号元素,所以的离子结构示意图;同主族元素,从上往下非金属性逐渐减弱,非金属性越强,最高价氧化物对应的水化物酸性越强,故最高价氧化物对应的水化物酸性最强的是HClO4;短周期元素中,原子半径最大的是钠元素,钠元素容易失去一个电子,氯容易得到一个电子,故钠与氯形成的简单化合物的电子式为:;由于氰[(CN)2]与卤素单质的性质相似,则它在常温下与氢氧化钠的反应的离子方程式与氯气相似,则为:;
(2)由图知,Se在周期表中的位置为第四周期第ⅥA族;H2SeO3与SO2发生氧化还原反应生成Se和H2SO4,由电子守恒和原子守恒得化学反应方程式为:;
(3)a.由于I位于第五周期,它的半径应该最大,Se和Br是同周期元素,从左往右,半径逐渐减小,故,a错误;b.是由不同种原子构成的共价键,为极性共价键,b正确;c..由元素周期律可知,同周期元素,从左往右非金属性逐渐增强,同主族元素,从上往下,金属性逐渐增强,则非金属性:,c错误
