2.2 氯及其化合物 第一课时 课件(共22张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2 氯及其化合物 第一课时 课件(共22张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 31.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-24 22:13:23 | ||
图片预览







文档简介
(共22张PPT)
第二章 海水中的重要元素──钠和氯
第二节 氯及其化合物
第1课时
3
2
本节重点
氯气的物理性质
氯气与金属、非金属单质的反应
氯气与水的反应
4
本节重点、难点
氯元素的存在
1
目前,很多自来水厂用液氯杀菌、消毒,氯气是一种有毒气体,为什么要用Cl2对自来水进行杀菌、消毒呢?
化学与生活
存在
氯是一种重要的“____元素”,自然界中除了以NaCl、MgCl2、CaCl2等形式大量
存在于海水中,还存在于陆地的盐湖和盐矿中。
一、氯元素的存在
氯元素的存在
成盐
阅读教材P44第二段
启示:1.科学研究需要有可靠的理论作指导,否则只能浪费时 间和精力。
2.科学研究需要以大量事实为依据。
3.科学研究需要有对科学的热爱和奉献科学的精神。
思考与讨论2:
从氯气的发现到氯被确认为一种新的元素,时间长达三十多年,其间经历了数位科学家的不懈探索。你从这一史实中得到什么启示?
从材料中体现了氯气哪些物理性质?
·2021年4月28日上午7时许,江苏省常州市横山桥发生氯气泄漏事故。大量氯气外泄。据目击者描述 : “一股黄绿色的气体 ‘唰’地射向空中,并有刺鼻的味道,眼睛也熏得睁不开 。”
·事发后消防队员不断地用水枪喷射,但还是造成多人中毒进医院救治, 附近居民采取应急措施,疏散到高坡上。
二、氯气的物理性质
颜色
气味
密度
水溶性
熔沸点
黄绿色
有刺激性气味
密度比空气大
闻气体及未知气体的方法:
用手在瓶口轻轻扇动,仅使极少量气体进入鼻孔。
能溶于水(1体积水可溶解2体积氯气)
易液化——加压液化,贮存在钢瓶中
氯气有毒,对眼睛黏膜和皮肤有高度刺激性;不仅如此,吸入氯气还会刺激呼吸道,使人咳嗽不止。特别说明:有毒不是物理性质。
Cl
+17
8
7
2
-1
0
Cl2
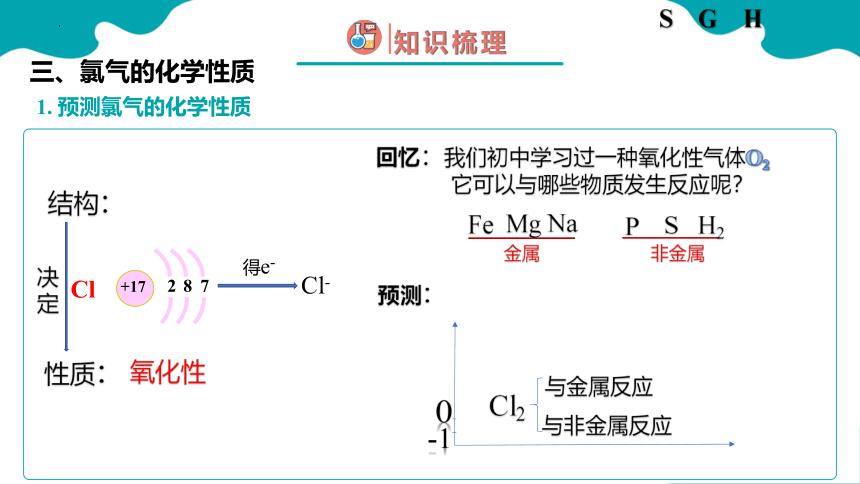
氧化性
性质:
与非金属反应
与金属反应
回忆:我们初中学习过一种氧化性气体O2
它可以与哪些物质发生反应呢?
Na
非金属
金属
预测:
P
S
Mg
Fe
H2
1. 预测氯气的化学性质
三、氯气的化学性质
结构:
决定
得e-
Cl-
与金属单质的反应
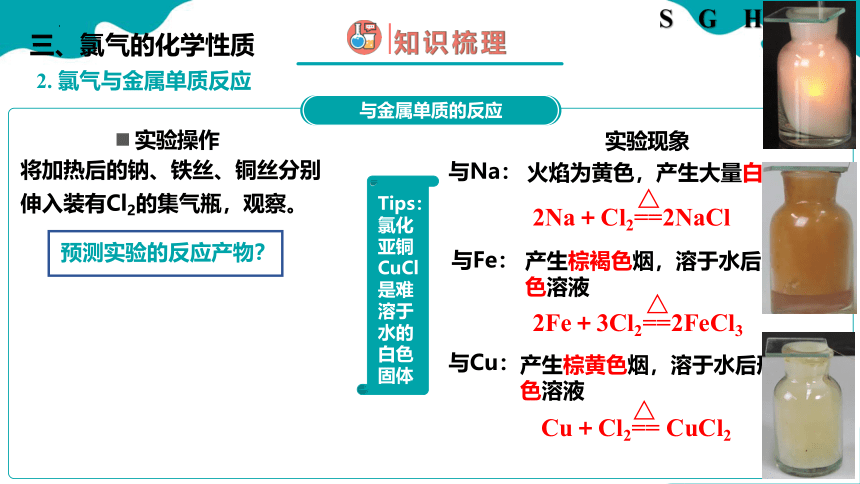
2. 氯气与金属单质反应
三、氯气的化学性质
实验操作
将加热后的钠、铁丝、铜丝分别伸入装有Cl2的集气瓶,观察。
预测实验的反应产物?
实验现象
与Na:
火焰为黄色,产生大量白烟
2Na+Cl2==2NaCl
与Fe:
产生棕褐色烟,溶于水后形成棕黄色溶液
2Fe+3Cl2==2FeCl3
与Cu:
产生棕黄色烟,溶于水后形成蓝绿色溶液
Cu+Cl2== CuCl2
Tips:氯化亚铜CuCl是难溶于水的白色固体
与金属单质的反应
与钠反应
化学方程式:
2Na+Cl2=====2NaCl
与铁反应
化学方程式:
2Fe+3Cl2=====2FeCl3
与铜反应
化学方程式:
Cu+Cl2=====CuCl2
小 结
反应规律:氯气和变价金属反应时生成高价金属氯化物
体现了氯气
的强氧化性
氧化剂
氧化剂
氧化剂
+1
+3
+2
实验探究
探究:在空气中点燃氢气,然后把导管缓慢伸入盛满氯气的集气瓶中,观察现象。
H2在Cl2中点燃
3. 氯气与非金属单质反应
三、氯气的化学性质
与非金属单质的反应
氢气在氯气中安静地______,发出_______火焰,集气瓶口上方出现_________。
实验现象
燃烧
苍白色
白雾
点燃
H2+Cl2======2HCl
注意:
燃烧的本质是氧化还原反应,所有发光发热的剧烈的化学反应都称为燃烧。
化学方程式:
3. 氯气与非金属单质反应
思考与讨论:燃烧是否一定需要氧气参加,燃烧的本质是什么?
氯气与水的反应
常温下,1体积水可溶解约2体积的氯气,氯气的水溶液称为氯水。
储存液氯的钢瓶
4. 氯气与水反应
三、氯气的化学性质
新制氯水
液氯是将氯气加压降温制得的,那么,它和氯水成分一样吗?
思考:
氯气溶于水是简单的溶解还是发生了化学反应?溶液呈现黄绿色说明存在Cl2分子。如果反应,可能会生成什么产物呢?
实验探究
4. 氯气与水反应
实验一:在洁净的试管中加入2mL新制氯水,再向试管中加入3滴AgNO3溶液,观察实验,记录实验现象。
实验二:在表面皿上放两张pH试纸,分别滴两滴稀硝酸、氯水滴在pH试纸上,观察实验现象,做好实验记录。
实验预测:
硝酸酸化的AgNO3溶液
实验一
实验二
目的 预测现象 实验现象
检验Cl-
检验H+
溶液中存在H+
溶液中存在Cl-
硝酸酸化的硝酸银产生白色沉淀
试纸变红色,之后又褪色
与预测现象一致
紫色的石蕊溶液变红色
实验现象分析:
4. 氯气与水反应
思考:
试纸变红色,之后又褪色的原因是什么?
结论:氯气溶于水发生了化学反应,生成了HCl
实验探究
探究一:取干燥的和湿润的有色纸条(或布条)各一条。分别放入两个盛有干燥氯气的集气瓶中,盖上玻璃片,观察现象。
探究二:将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片,观察现象。
5. 次氯酸的性质
三、氯气的化学性质
干燥的Cl2
___________
在有H2O存在的条件下,Cl2__________
在有H2O存在的条件下,Cl2__________
有色纸条_______
有色纸条_______
有色鲜花_____
不褪色
无漂白作用
实验现象
褪色
有漂白作用
次氯酸的漂白性
褪色
有漂白作用
实验结论
5. 次氯酸的性质
Cl2不具有漂白性,氯气与水反应的产物具有漂白性。
-1
0
+1
+5
+3
+7
+4
单质
氧化物
酸
盐
HClO (次氯酸)
HCl
HClO2(亚氯酸)
HClO3(氯酸)
HClO4(高氯酸)
Cl2
与H2O反应
查阅资料:这几种物质中只有次氯酸具有漂白性
Cl2+H2O=HCl+HClO
氯气与水反应:
5. 次氯酸的性质
根据实验结果推测反应产物
主要成分HCl
主要成分NaClO
思考:为什么禁止将洁厕灵和84消毒液混合使用?
1.下列说法中正确的是( )
A.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味
B.用向下排空气法可以收集到纯净的氯气
C.贮氯罐意外泄漏,应沿逆风方向疏散群众
D.氯气车间液氯泄漏时,应弯腰逃离氯气泄漏区域
C
2.下列实验现象的描述正确的是( )
A.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方形成白色烟雾
B.铁丝在氯气中燃烧,产生棕褐色的烟,产物溶于水,溶液呈浅绿色
C.铜丝在氯气中燃烧,产生棕黄色的烟,产物溶于水,溶液呈蓝绿色
D.钠在空气中燃烧,发出黄色火焰,生成白色固体
C
3.下列关于氯水的叙述中正确的是( )
A.新制氯水中的微粒只含Cl2和H2O
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照新制氯水有气泡逸出,该气体是Cl2
D.新制氯水在密闭无色玻璃瓶中放置数天后酸性将减弱
B
4.下列关于液氯和氯水的叙述中正确的是( )
A.液氯是纯净物,而氯水是混合物
B.液氯与氯水均有酸性
C.液氯较氯水的漂白作用更强
D.液氯无色,氯水呈黄绿色
A
第二节
氯及其化合物
第1课时
氯气的物理性质
氯元素的存在
+水反应
+氢气反应
+金属反应
(强氧化性)
氯气的化学性质
第二章 海水中的重要元素──钠和氯
第二节 氯及其化合物
第1课时
3
2
本节重点
氯气的物理性质
氯气与金属、非金属单质的反应
氯气与水的反应
4
本节重点、难点
氯元素的存在
1
目前,很多自来水厂用液氯杀菌、消毒,氯气是一种有毒气体,为什么要用Cl2对自来水进行杀菌、消毒呢?
化学与生活
存在
氯是一种重要的“____元素”,自然界中除了以NaCl、MgCl2、CaCl2等形式大量
存在于海水中,还存在于陆地的盐湖和盐矿中。
一、氯元素的存在
氯元素的存在
成盐
阅读教材P44第二段
启示:1.科学研究需要有可靠的理论作指导,否则只能浪费时 间和精力。
2.科学研究需要以大量事实为依据。
3.科学研究需要有对科学的热爱和奉献科学的精神。
思考与讨论2:
从氯气的发现到氯被确认为一种新的元素,时间长达三十多年,其间经历了数位科学家的不懈探索。你从这一史实中得到什么启示?
从材料中体现了氯气哪些物理性质?
·2021年4月28日上午7时许,江苏省常州市横山桥发生氯气泄漏事故。大量氯气外泄。据目击者描述 : “一股黄绿色的气体 ‘唰’地射向空中,并有刺鼻的味道,眼睛也熏得睁不开 。”
·事发后消防队员不断地用水枪喷射,但还是造成多人中毒进医院救治, 附近居民采取应急措施,疏散到高坡上。
二、氯气的物理性质
颜色
气味
密度
水溶性
熔沸点
黄绿色
有刺激性气味
密度比空气大
闻气体及未知气体的方法:
用手在瓶口轻轻扇动,仅使极少量气体进入鼻孔。
能溶于水(1体积水可溶解2体积氯气)
易液化——加压液化,贮存在钢瓶中
氯气有毒,对眼睛黏膜和皮肤有高度刺激性;不仅如此,吸入氯气还会刺激呼吸道,使人咳嗽不止。特别说明:有毒不是物理性质。
Cl
+17
8
7
2
-1
0
Cl2
氧化性
性质:
与非金属反应
与金属反应
回忆:我们初中学习过一种氧化性气体O2
它可以与哪些物质发生反应呢?
Na
非金属
金属
预测:
P
S
Mg
Fe
H2
1. 预测氯气的化学性质
三、氯气的化学性质
结构:
决定
得e-
Cl-
与金属单质的反应
2. 氯气与金属单质反应
三、氯气的化学性质
实验操作
将加热后的钠、铁丝、铜丝分别伸入装有Cl2的集气瓶,观察。
预测实验的反应产物?
实验现象
与Na:
火焰为黄色,产生大量白烟
2Na+Cl2==2NaCl
与Fe:
产生棕褐色烟,溶于水后形成棕黄色溶液
2Fe+3Cl2==2FeCl3
与Cu:
产生棕黄色烟,溶于水后形成蓝绿色溶液
Cu+Cl2== CuCl2
Tips:氯化亚铜CuCl是难溶于水的白色固体
与金属单质的反应
与钠反应
化学方程式:
2Na+Cl2=====2NaCl
与铁反应
化学方程式:
2Fe+3Cl2=====2FeCl3
与铜反应
化学方程式:
Cu+Cl2=====CuCl2
小 结
反应规律:氯气和变价金属反应时生成高价金属氯化物
体现了氯气
的强氧化性
氧化剂
氧化剂
氧化剂
+1
+3
+2
实验探究
探究:在空气中点燃氢气,然后把导管缓慢伸入盛满氯气的集气瓶中,观察现象。
H2在Cl2中点燃
3. 氯气与非金属单质反应
三、氯气的化学性质
与非金属单质的反应
氢气在氯气中安静地______,发出_______火焰,集气瓶口上方出现_________。
实验现象
燃烧
苍白色
白雾
点燃
H2+Cl2======2HCl
注意:
燃烧的本质是氧化还原反应,所有发光发热的剧烈的化学反应都称为燃烧。
化学方程式:
3. 氯气与非金属单质反应
思考与讨论:燃烧是否一定需要氧气参加,燃烧的本质是什么?
氯气与水的反应
常温下,1体积水可溶解约2体积的氯气,氯气的水溶液称为氯水。
储存液氯的钢瓶
4. 氯气与水反应
三、氯气的化学性质
新制氯水
液氯是将氯气加压降温制得的,那么,它和氯水成分一样吗?
思考:
氯气溶于水是简单的溶解还是发生了化学反应?溶液呈现黄绿色说明存在Cl2分子。如果反应,可能会生成什么产物呢?
实验探究
4. 氯气与水反应
实验一:在洁净的试管中加入2mL新制氯水,再向试管中加入3滴AgNO3溶液,观察实验,记录实验现象。
实验二:在表面皿上放两张pH试纸,分别滴两滴稀硝酸、氯水滴在pH试纸上,观察实验现象,做好实验记录。
实验预测:
硝酸酸化的AgNO3溶液
实验一
实验二
目的 预测现象 实验现象
检验Cl-
检验H+
溶液中存在H+
溶液中存在Cl-
硝酸酸化的硝酸银产生白色沉淀
试纸变红色,之后又褪色
与预测现象一致
紫色的石蕊溶液变红色
实验现象分析:
4. 氯气与水反应
思考:
试纸变红色,之后又褪色的原因是什么?
结论:氯气溶于水发生了化学反应,生成了HCl
实验探究
探究一:取干燥的和湿润的有色纸条(或布条)各一条。分别放入两个盛有干燥氯气的集气瓶中,盖上玻璃片,观察现象。
探究二:将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片,观察现象。
5. 次氯酸的性质
三、氯气的化学性质
干燥的Cl2
___________
在有H2O存在的条件下,Cl2__________
在有H2O存在的条件下,Cl2__________
有色纸条_______
有色纸条_______
有色鲜花_____
不褪色
无漂白作用
实验现象
褪色
有漂白作用
次氯酸的漂白性
褪色
有漂白作用
实验结论
5. 次氯酸的性质
Cl2不具有漂白性,氯气与水反应的产物具有漂白性。
-1
0
+1
+5
+3
+7
+4
单质
氧化物
酸
盐
HClO (次氯酸)
HCl
HClO2(亚氯酸)
HClO3(氯酸)
HClO4(高氯酸)
Cl2
与H2O反应
查阅资料:这几种物质中只有次氯酸具有漂白性
Cl2+H2O=HCl+HClO
氯气与水反应:
5. 次氯酸的性质
根据实验结果推测反应产物
主要成分HCl
主要成分NaClO
思考:为什么禁止将洁厕灵和84消毒液混合使用?
1.下列说法中正确的是( )
A.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味
B.用向下排空气法可以收集到纯净的氯气
C.贮氯罐意外泄漏,应沿逆风方向疏散群众
D.氯气车间液氯泄漏时,应弯腰逃离氯气泄漏区域
C
2.下列实验现象的描述正确的是( )
A.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方形成白色烟雾
B.铁丝在氯气中燃烧,产生棕褐色的烟,产物溶于水,溶液呈浅绿色
C.铜丝在氯气中燃烧,产生棕黄色的烟,产物溶于水,溶液呈蓝绿色
D.钠在空气中燃烧,发出黄色火焰,生成白色固体
C
3.下列关于氯水的叙述中正确的是( )
A.新制氯水中的微粒只含Cl2和H2O
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照新制氯水有气泡逸出,该气体是Cl2
D.新制氯水在密闭无色玻璃瓶中放置数天后酸性将减弱
B
4.下列关于液氯和氯水的叙述中正确的是( )
A.液氯是纯净物,而氯水是混合物
B.液氯与氯水均有酸性
C.液氯较氯水的漂白作用更强
D.液氯无色,氯水呈黄绿色
A
第二节
氯及其化合物
第1课时
氯气的物理性质
氯元素的存在
+水反应
+氢气反应
+金属反应
(强氧化性)
氯气的化学性质
