化学人教版(2019)必修第一册4.1.1原子结构(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.1.1原子结构(共19张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-25 11:17:17 | ||
图片预览


文档简介
(共19张PPT)
原子结构与元素周期表
第一课时
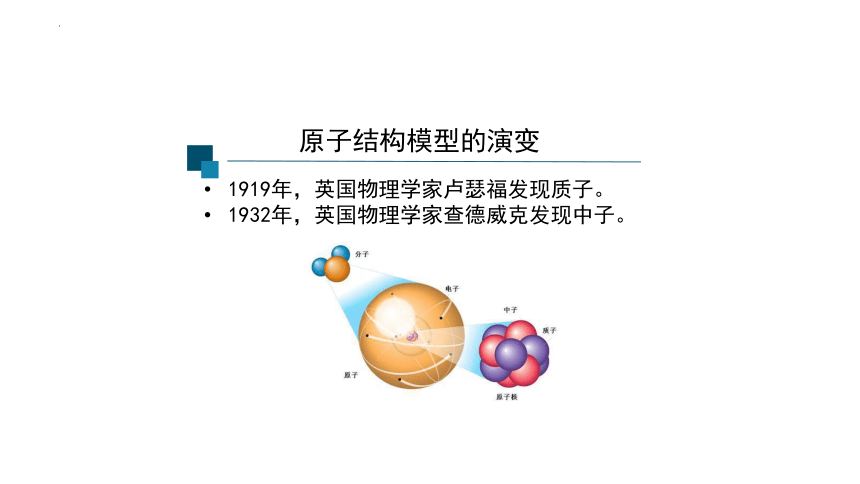
1919年,英国物理学家卢瑟福发现质子。
1932年,英国物理学家查德威克发现中子。
原子结构模型的演变
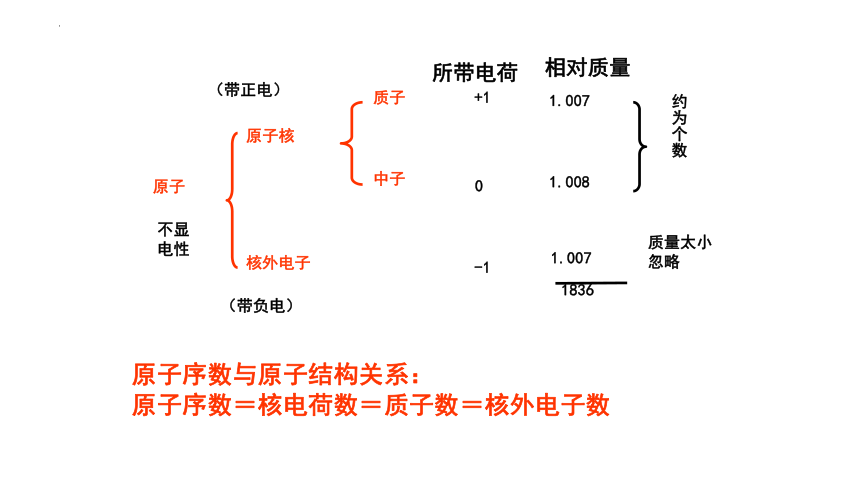
一、原子的结构
原子
原子核
核外电子:
中子:
质子:
原子序数=核电荷数=质子数=核外电子数
带1个单位正电荷
不带电
带1个单位负电荷
原子结构/ ATOM STRUCTURE
原子
原子核
核外电子
质子
中子
所带电荷
+1
0
-1
相对质量
1.007
1.008
1836
1.007
(带正电)
(带负电)
不显
电性
约为个数
质量太小忽略
原子序数与原子结构关系:
原子序数=核电荷数=质子数=核外电子数
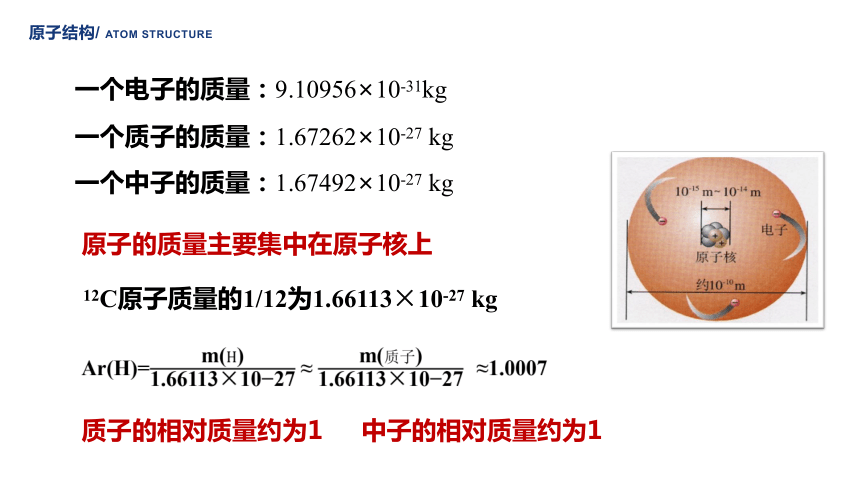
一个电子的质量:9.10956×10-31kg
一个质子的质量:1.67262×10-27 kg
一个中子的质量:1.67492×10-27 kg
原子结构/ ATOM STRUCTURE
原子的质量主要集中在原子核上
Ar(H)= ≈ ≈1.0007
12C原子质量的1/12为1.66113×10-27 kg
质子的相对质量约为1
中子的相对质量约为1
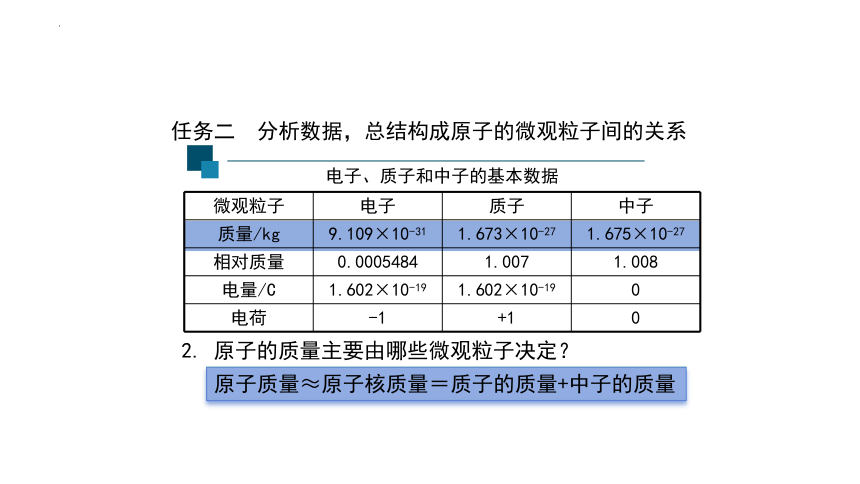
微观粒子 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
电子、质子和中子的基本数据
原子的质量主要由哪些微观粒子决定?
原子质量≈原子核质量=质子的质量+中子的质量
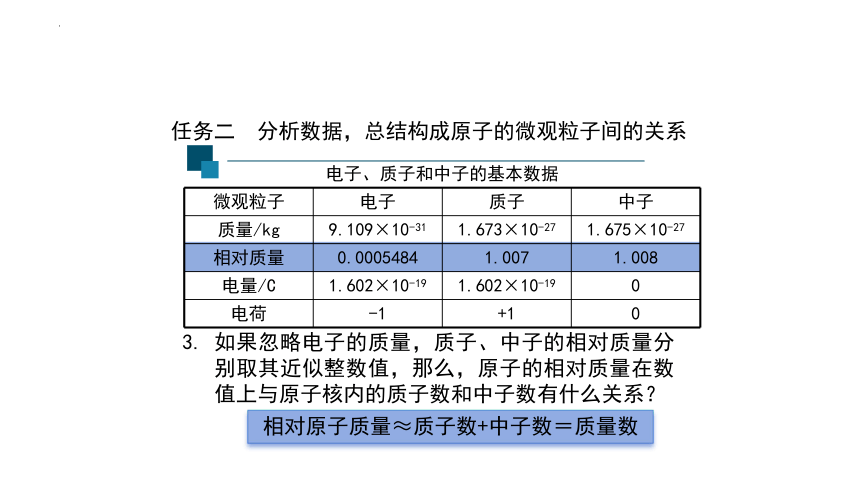
任务二 分析数据,总结构成原子的微观粒子间的关系
微观粒子 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
电子、质子和中子的基本数据
如果忽略电子的质量,质子、中子的相对质量分别取其近似整数值,那么,原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?
相对原子质量≈质子数+中子数=质量数
任务二 分析数据,总结构成原子的微观粒子间的关系
一、原子的结构
(2)质量关系:质量数(A)=质子数(Z)+中子数(N)。
1.质量数
(1)概念:将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数,常用A表示。
原子结构/ ATOM STRUCTURE
Z 个
N =(A-Z)个
Z 个
质量数:将原子核内所有的质子和中子的相对质量取近似整数值相加,所得的数值叫质量数
原子核
核外电子
质子
中子
原子
质量数A= 质子数Z+ 中子数N
2、质量数
e—
N≥0
质量数可以认为是质子与中子的数量和
不同于相对原子质量!
原子 质子数(Z) 中子数(N) 质量数(A)
C 6 6
O 8 8
Na 11 12
12
16
23
练习一:将几种原子的质子数和中子数之和(质量数)填入下表,
原子结构/ ATOM STRUCTURE
A
Z X
2、原子结构的表示方法
(1)原子结构示意图
(2)原子组成表示式
原子( )中,质子有__个,中子有__个,核外电子有___个。
Z
A-Z
Z
质子数+中子数
核电荷数=核外电子数
A
Z X
3、相互关系
(1) 质量数=
(2) 原子中:质子数=
=原子序数
3. 原子的表示方法
一、原子的构成
X
Z
A
质子数
质量数
元素符号
粒子符号 质子数(Z) 质量数(A) 中子数(N) 核外电子数
Na
11
23
Cl
17
37
23 12 11
17 37 20 17
如果是离子,各微观粒子数如何变化?
粒子 符号 质子数 (Z) 质量数 (A) 中子数 (N) 电荷数 核外
电子数
Na+
11
23
Cl-
17
37
23 12
17 37 20
1 10
1 18
阳离子:核外电子数=质子数-电荷数
阴离子:核外电子数=质子数+电荷数
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N)
1 0 氕(piē)
1 1 氘(dāo)
1 2 氚(chuān)
X
Z
A
任务三
在表格中填写三种氢原子的原子符号。
氕、氘、氚的原子结构有何异同?
它们是同一种元素吗?为什么?
H
1
1
H或D
1
2
H或T
1
3
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N)
1 0 氕(piē)
1 1 氘(dāo)
1 2 氚(chuān)
X
Z
A
元素
3. 它们是同一种元素吗?为什么?
H
1
1
H或D
1
2
H或T
1
3
元素是具有相同质子数(核电荷数)的一类原子的总称。
某元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N)
1 0 氕(piē)
1 1 氘(dāo) 或D
1 2 氚(chuān) 或T
X
Z
A
H
1
1
H
1
2
H
1
3
同位素
质子数相同而中子数不同的同一元素的不同原子互称为同位素(即同一元素的不同核素互称为同位素)。
氧元素有和三种核素;
碳元素有 、和等核素;
铀元素有、 和等核素。
用途:在能源、农业、医疗、考古等方面都有重要应用。
同位素
质量数(A )
质子数(Z )
±a
化合价
x±
电荷数
b
原子数
+1
+
2
1
原子结构/ ATOM STRUCTURE
谢谢聆听!
再见
原子结构与元素周期表
第一课时
1919年,英国物理学家卢瑟福发现质子。
1932年,英国物理学家查德威克发现中子。
原子结构模型的演变
一、原子的结构
原子
原子核
核外电子:
中子:
质子:
原子序数=核电荷数=质子数=核外电子数
带1个单位正电荷
不带电
带1个单位负电荷
原子结构/ ATOM STRUCTURE
原子
原子核
核外电子
质子
中子
所带电荷
+1
0
-1
相对质量
1.007
1.008
1836
1.007
(带正电)
(带负电)
不显
电性
约为个数
质量太小忽略
原子序数与原子结构关系:
原子序数=核电荷数=质子数=核外电子数
一个电子的质量:9.10956×10-31kg
一个质子的质量:1.67262×10-27 kg
一个中子的质量:1.67492×10-27 kg
原子结构/ ATOM STRUCTURE
原子的质量主要集中在原子核上
Ar(H)= ≈ ≈1.0007
12C原子质量的1/12为1.66113×10-27 kg
质子的相对质量约为1
中子的相对质量约为1
微观粒子 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
电子、质子和中子的基本数据
原子的质量主要由哪些微观粒子决定?
原子质量≈原子核质量=质子的质量+中子的质量
任务二 分析数据,总结构成原子的微观粒子间的关系
微观粒子 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
电子、质子和中子的基本数据
如果忽略电子的质量,质子、中子的相对质量分别取其近似整数值,那么,原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?
相对原子质量≈质子数+中子数=质量数
任务二 分析数据,总结构成原子的微观粒子间的关系
一、原子的结构
(2)质量关系:质量数(A)=质子数(Z)+中子数(N)。
1.质量数
(1)概念:将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数,常用A表示。
原子结构/ ATOM STRUCTURE
Z 个
N =(A-Z)个
Z 个
质量数:将原子核内所有的质子和中子的相对质量取近似整数值相加,所得的数值叫质量数
原子核
核外电子
质子
中子
原子
质量数A= 质子数Z+ 中子数N
2、质量数
e—
N≥0
质量数可以认为是质子与中子的数量和
不同于相对原子质量!
原子 质子数(Z) 中子数(N) 质量数(A)
C 6 6
O 8 8
Na 11 12
12
16
23
练习一:将几种原子的质子数和中子数之和(质量数)填入下表,
原子结构/ ATOM STRUCTURE
A
Z X
2、原子结构的表示方法
(1)原子结构示意图
(2)原子组成表示式
原子( )中,质子有__个,中子有__个,核外电子有___个。
Z
A-Z
Z
质子数+中子数
核电荷数=核外电子数
A
Z X
3、相互关系
(1) 质量数=
(2) 原子中:质子数=
=原子序数
3. 原子的表示方法
一、原子的构成
X
Z
A
质子数
质量数
元素符号
粒子符号 质子数(Z) 质量数(A) 中子数(N) 核外电子数
Na
11
23
Cl
17
37
23 12 11
17 37 20 17
如果是离子,各微观粒子数如何变化?
粒子 符号 质子数 (Z) 质量数 (A) 中子数 (N) 电荷数 核外
电子数
Na+
11
23
Cl-
17
37
23 12
17 37 20
1 10
1 18
阳离子:核外电子数=质子数-电荷数
阴离子:核外电子数=质子数+电荷数
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N)
1 0 氕(piē)
1 1 氘(dāo)
1 2 氚(chuān)
X
Z
A
任务三
在表格中填写三种氢原子的原子符号。
氕、氘、氚的原子结构有何异同?
它们是同一种元素吗?为什么?
H
1
1
H或D
1
2
H或T
1
3
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N)
1 0 氕(piē)
1 1 氘(dāo)
1 2 氚(chuān)
X
Z
A
元素
3. 它们是同一种元素吗?为什么?
H
1
1
H或D
1
2
H或T
1
3
元素是具有相同质子数(核电荷数)的一类原子的总称。
某元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N)
1 0 氕(piē)
1 1 氘(dāo) 或D
1 2 氚(chuān) 或T
X
Z
A
H
1
1
H
1
2
H
1
3
同位素
质子数相同而中子数不同的同一元素的不同原子互称为同位素(即同一元素的不同核素互称为同位素)。
氧元素有和三种核素;
碳元素有 、和等核素;
铀元素有、 和等核素。
用途:在能源、农业、医疗、考古等方面都有重要应用。
同位素
质量数(A )
质子数(Z )
±a
化合价
x±
电荷数
b
原子数
+1
+
2
1
原子结构/ ATOM STRUCTURE
谢谢聆听!
再见
