2023-2024学年化学九年级上(人教版)第三单元 物质构成的奥秘 课件(共38张PPT)
文档属性
| 名称 | 2023-2024学年化学九年级上(人教版)第三单元 物质构成的奥秘 课件(共38张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-25 14:28:20 | ||
图片预览










文档简介
(共38张PPT)
第三单元 物质构成的奥秘
【单元复习】
-02
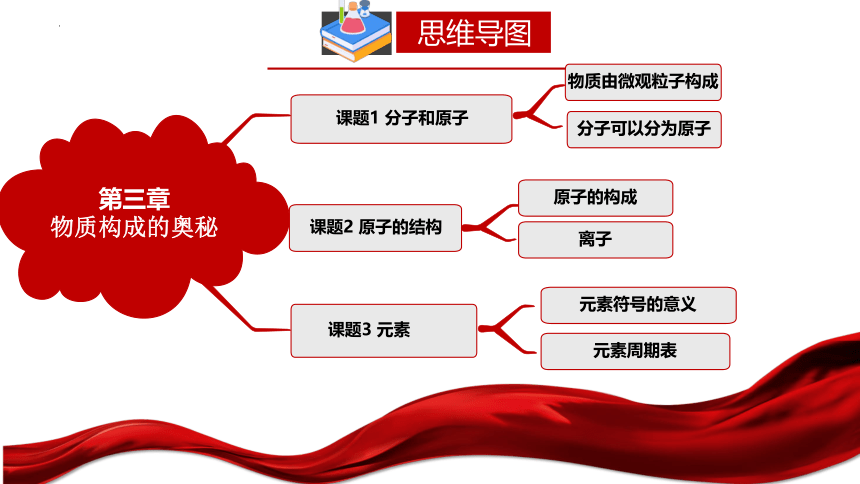
思维导图
第三章
物质构成的奥秘
课题1 分子和原子
课题3 元素
物质由微观粒子构成
元素符号的意义
元素周期表
课题2 原子的结构
原子的构成
分子可以分为原子
离子
物质由微观粒子构成
01
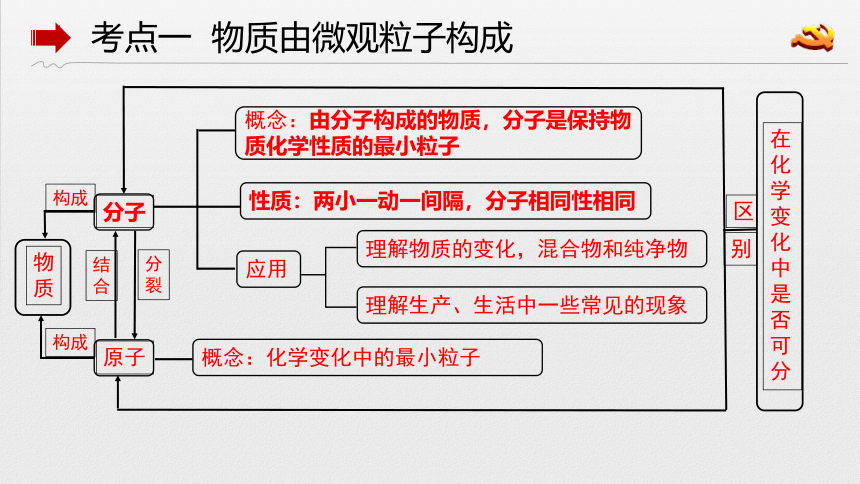
考点一 物质由微观粒子构成
概念:由分子构成的物质,分子是保持物质化学性质的最小粒子
物
质
分子
原子
结
合
分
裂
性质:两小一动一间隔,分子相同性相同
应用
理解物质的变化,混合物和纯净物
理解生产、生活中一些常见的现象
概念:化学变化中的最小粒子
在化学变化中是否可分
区
别
构成
构成
考点一 物质由微观粒子构成
易错警示
1、物理变化:由分子构成的物质,发生物理变化时,物质的分子本身没有发生改变,只是分子间的间隔及排列方式发生改变。
2、化学变化:由分子构成的物质,发生化学变化时,物质的分子发生了改变,变成了其他物质的分子。
典例引领
A
【典例】 从分子的角度分析,下列解释错误的是( )
A.吹胀气球——气体分子间的间隔变大
B.缉毒犬能根据气味发现毒品——分子在不断地运动
C.液氧和氧气都能助燃——同种分子化学性质相同
D.水电解生成氢气和氧气——水分子变成了新的分子
巩固练习
D
【演练1】下列现象从分子的角度加以解释,其中错误的是( )
A.墙内开花墙外可闻到香味是因为分子在不断运动
B.固体难压缩是因为分子间的间隔很小
C.气体受热膨胀是因为分子间的间隔增大
D.二氧化碳能溶解在水中是因为分子很小
巩固练习
A
【演练2】“佩香囊,迎端午”,人们能闻到香囊发出的香味,主
要是因为( )
A.分子是不断运动的 B.分子之间有间隔
C.分子是很小的 D.分子是由原子构成的
分子可以分为原子
02
考点二 分子可以分为原子
类别 分子 原子
定义 保持物质化学性质的最小粒子 化学变化中的最小粒子
相同点 ①都是构成物质的基本粒子;②都很小,但都有一定的体积和质量;③都在不停地运动;④粒子之间都有间隔;⑤都能保持物质的化学性质 区别 在化学变化中可以再分,同种分子化学性质相同 在化学变化中,不能再分
联系 原子
物质
构成
分子
构成
构成
易错警示
考点二 分子可以分为原子
1.有的物质由分子构成,如:氧气、氮气、水、二氧化碳等;
2.有的物质由原子构成,如:金属、稀有气体、固态非金属等;
3.化学反应的微观实质:分子分成原子,原子重新结合成新的分子。
典例引领
【典例】宏观、微观之间存在必然的联系,建立正确的微粒观有助于化学的学习,请用微粒的知识回答下列问题。
(1)分子和原子的本质区别是______________________________________
_________。
(2)“醋酸糖甜”是因为_______________。
(3)空气和氧气的主要区别是_____________________________________
_________。
在化学变化中,分子可以再分而原子不可
以再分
分子构成不同
空气中含有多种分子,氧气中只含有一种
分子
巩固练习
D
【演练1】下列描述正确的是( )
A. 固态物质的分子之间无间隔
B. 液态物质的分子不运动 C. 化学变化中分子和原子都发生了变化
D. 物理变化中分子和原子都不发生变化
【演练2】下列物质中,直接由原子构成的是( ) A.水 B.水银 C.二氧化碳 D.氧气
B
原子的构成
03
考点三 原子的构成
原子
离子
相对原子质量
核外电子
原子核
原子结构示意图
引出
得失电子
集中在
考点三 原子的构成
1.原子是由居于原子中心带正电的_________和核外带负电的 _______构成的;原子核又是由带正电的_______和不带电的________构成的;有的原子不一定有中子,质子数也不一定等于中子数。
2.相对原子质量:以一种碳原子质量的1/12作为标准,其他原子的质量与它相比较所得到的比,就是这种原子的相对原子质量。
3. 电子的质量很小,所以原子的质量主要集中在原子核上
原子核
电子
质子
中子
考点三 原子的构成
3.核外电子是分层排布的。
4.原子结构示意图:氯原子的原子结构示意图如下
电子层
电子数目
原子核
核内质子数
易错警示
考点三 分子可以分为原子
1. 在原子里,质子数=_______数=核电荷数(原子不显电性)。
2. 相对原子质量≈ ___________________。
3. 质子数与中子数不一定相等。
4. 区分原子种类的依据是原子核内质子数。
电子
质子数+中子数
典例引领
【典例】同一原子中下列说法正确的是( )
A.中子数与电子数相同
B.原子核和原子都是电中性的
C.原子是化学变化中的最小粒子
D.原子的大部分体积被原子核占据
C
巩固练习
B
【演练1】锂电池可用作心脏起搏器的电源。已知一种锂原子核内有3个质子和4个中子,则该锂原子的核外电子数为( )
A.1 B.3 C.4 D.7
【演练2】制造“北斗三号”卫星使用了钛合金材料,钛原子的核外电子数为22,则钛原子的核电荷数为 ( )
A.22 B.48 C.70 D.26
A
离子
04
1. 带电的原子或原子团叫做离子。
2. 离子用离子符号表示:在原子团或元素符号的右上角标出离子所带电荷的多少及电荷的正负(数字在前,符号在后,”1”省略)。
常见的离子符号:钠离子 _________,镁离子_________,
氯离子_________, 氢氧根离子_________,硫酸根离子 _________。
Na+
Mg2+
Cl-
OH-
考点四 离子
不同点 原子 离子 结构 质子数=电子数 阳离子 阴离子
电性 不带电 带正电 带负电
联系 质子数=电子数 质子数〉电子数 质子数〈电子数
离子和原子、分子一样是构成物质的基本粒子
考点四 离子
易错警示
典例引领
【典例】从微观视角认识物质是学习化学的重要思维方法。如图是四种粒子的结构示意图
(1)A粒子在化学反应
中容易___________
(填“得到”或“失
去”)电子。
(2)写出B粒子的符号___________
(3)D原子的结构示意图中x的数值为___________。
失去
Mg2+
6
巩固练习
D
【演练】如图为某元素的阴离子的结构示意图。下列有关叙述正确的是( )
A.该阴离子的结构示意图中x=7
B.该元素为硫,是一种非金属元素
C.该元素的原子在化学反应中容易失去电子
D.该阴离子中,核电荷数小于核外电子数
元素符号
05
考点五 元素符号
定义
分布
金属元素
非金属元素
稀有气体元素
符号书写
元素
N、O(按体积分数计算,空气中前两位)
O、C、H、N(按质量分数计算,生物细胞中前四位)
O、Si、Al、Fe(按质量分数计算,地壳中前四位)
O、H、Cl、Na(按质量分数计算,海水中前四位)
分类
元素符号意义
考点五 元素符号
元素 原子
区别 元素是一类原子的总称(质子数相同);只表示种类,不论个数,是宏观概念 原子是微观概念,既表示种类,又有数量含义
化学变化中元素种类不变,但存在形式可能变化 化学变化中,原子种类和数量不变,但最外层电子数可能变化
联系 元素是一类原子的总称,原子是构成元素的基本单元,在物质发生化学变化时,原子的种类不变,元素的种类也不会改变 元素和原子的区别和联系
考点五 元素符号
易错警示
1. 元素符号的含义
(1)表示一种元素,表示这种元素的一个原子。例如O:________、 ____________。
(2)如果物质是由原子构成,则元素符号还可以表示该单质。例如 Fe:_________、 ____________、_________。
氧元素
一个氧原子
铁元素
一个铁原子
铁单质
2.描述物质宏观组成和微观构成
(1)宏观组成(描述物质的组成时用______叙述)。如:铁由________组成;二氧化碳由_________和_________组成。
(2)微观构成(描述物质的构成时用________、________、_________叙述)。如:铁由_________构成。二氧化碳由_______________构成。
(3)描述分子的构成时用_________叙述。如:1个二氧化碳分子由1个_________和2个_________构成。
元素
铁元素
碳元素
氧元素
分子
原子
离子
铁原子
二氧化碳分子
原子
氧原子
碳原子
易错警示
考点五 元素符号
典例引领
【典例】人体每日需要摄入适量的钙,这里的“钙”指的是( )
A.元素 B.单质
C.分子 D.原子
A
巩固练习
C
【演练1】下列化学用语中,既能表示一种元素,又能表示一个原子,还能表示一种物质的是( )
A.N B.O C.Cu D.O2
【演练2】地壳中含量最多的元素是( )
A.Al B.Fe
C.O D.Si
C
元素周期表
06
1.元素周期表:将所有元素按照原子序数(即核电荷数)有序排列而成的表。元素周期表有7个横行、18个纵列,共7个周期、16个族。
考点六 元素周期表
2. 元素周期表中一格的理解(以氧元素为例)
氧
8
O
16.00
相对原子质量
元素符号
元素名称
原子序数
判断元素名称、原子序数、元素符号、相对原子质量。
易错警示
考点六 元素周期表
1. 原子中,原子序数=质子数=核电荷数=核外电子数,
如铜的质子数、核电荷数、原子序数、核外电子数均为29。
2. 中子数≈相对原子质量-质子数
如铜的中子数=63.55 -29 ≈35
3. 相对原子质量单位为1,不能说铜的相对原子质量为63.55g
铜
29
Cu
63.55
典例引领
【典例】根据图示分析,下列说法正确的是 ( )
A.镁属于非金属元素
B.镁原子核外有3个电子层
C.镁的相对原子质量为24.31g
D.镁原子易得到电子变为 Mg2+
B
巩固练习
【演练】神舟十三号载人飞船使用的是目前世界上最先进的砷化镓太阳能电池。砷(As)、镓的原子结构示意图和镓元素在元素周期表中的信息如图所示,下列说法不正确的是( )
A.砷和镓元素位于同一周期
B.镓是非金属元素
C.镓的相对原子质量为69.72
D.砷容易失去电子
B
谢谢欣赏
Thanks For Watching
第三单元 物质构成的奥秘
【单元复习】
-02
思维导图
第三章
物质构成的奥秘
课题1 分子和原子
课题3 元素
物质由微观粒子构成
元素符号的意义
元素周期表
课题2 原子的结构
原子的构成
分子可以分为原子
离子
物质由微观粒子构成
01
考点一 物质由微观粒子构成
概念:由分子构成的物质,分子是保持物质化学性质的最小粒子
物
质
分子
原子
结
合
分
裂
性质:两小一动一间隔,分子相同性相同
应用
理解物质的变化,混合物和纯净物
理解生产、生活中一些常见的现象
概念:化学变化中的最小粒子
在化学变化中是否可分
区
别
构成
构成
考点一 物质由微观粒子构成
易错警示
1、物理变化:由分子构成的物质,发生物理变化时,物质的分子本身没有发生改变,只是分子间的间隔及排列方式发生改变。
2、化学变化:由分子构成的物质,发生化学变化时,物质的分子发生了改变,变成了其他物质的分子。
典例引领
A
【典例】 从分子的角度分析,下列解释错误的是( )
A.吹胀气球——气体分子间的间隔变大
B.缉毒犬能根据气味发现毒品——分子在不断地运动
C.液氧和氧气都能助燃——同种分子化学性质相同
D.水电解生成氢气和氧气——水分子变成了新的分子
巩固练习
D
【演练1】下列现象从分子的角度加以解释,其中错误的是( )
A.墙内开花墙外可闻到香味是因为分子在不断运动
B.固体难压缩是因为分子间的间隔很小
C.气体受热膨胀是因为分子间的间隔增大
D.二氧化碳能溶解在水中是因为分子很小
巩固练习
A
【演练2】“佩香囊,迎端午”,人们能闻到香囊发出的香味,主
要是因为( )
A.分子是不断运动的 B.分子之间有间隔
C.分子是很小的 D.分子是由原子构成的
分子可以分为原子
02
考点二 分子可以分为原子
类别 分子 原子
定义 保持物质化学性质的最小粒子 化学变化中的最小粒子
相同点 ①都是构成物质的基本粒子;②都很小,但都有一定的体积和质量;③都在不停地运动;④粒子之间都有间隔;⑤都能保持物质的化学性质 区别 在化学变化中可以再分,同种分子化学性质相同 在化学变化中,不能再分
联系 原子
物质
构成
分子
构成
构成
易错警示
考点二 分子可以分为原子
1.有的物质由分子构成,如:氧气、氮气、水、二氧化碳等;
2.有的物质由原子构成,如:金属、稀有气体、固态非金属等;
3.化学反应的微观实质:分子分成原子,原子重新结合成新的分子。
典例引领
【典例】宏观、微观之间存在必然的联系,建立正确的微粒观有助于化学的学习,请用微粒的知识回答下列问题。
(1)分子和原子的本质区别是______________________________________
_________。
(2)“醋酸糖甜”是因为_______________。
(3)空气和氧气的主要区别是_____________________________________
_________。
在化学变化中,分子可以再分而原子不可
以再分
分子构成不同
空气中含有多种分子,氧气中只含有一种
分子
巩固练习
D
【演练1】下列描述正确的是( )
A. 固态物质的分子之间无间隔
B. 液态物质的分子不运动 C. 化学变化中分子和原子都发生了变化
D. 物理变化中分子和原子都不发生变化
【演练2】下列物质中,直接由原子构成的是( ) A.水 B.水银 C.二氧化碳 D.氧气
B
原子的构成
03
考点三 原子的构成
原子
离子
相对原子质量
核外电子
原子核
原子结构示意图
引出
得失电子
集中在
考点三 原子的构成
1.原子是由居于原子中心带正电的_________和核外带负电的 _______构成的;原子核又是由带正电的_______和不带电的________构成的;有的原子不一定有中子,质子数也不一定等于中子数。
2.相对原子质量:以一种碳原子质量的1/12作为标准,其他原子的质量与它相比较所得到的比,就是这种原子的相对原子质量。
3. 电子的质量很小,所以原子的质量主要集中在原子核上
原子核
电子
质子
中子
考点三 原子的构成
3.核外电子是分层排布的。
4.原子结构示意图:氯原子的原子结构示意图如下
电子层
电子数目
原子核
核内质子数
易错警示
考点三 分子可以分为原子
1. 在原子里,质子数=_______数=核电荷数(原子不显电性)。
2. 相对原子质量≈ ___________________。
3. 质子数与中子数不一定相等。
4. 区分原子种类的依据是原子核内质子数。
电子
质子数+中子数
典例引领
【典例】同一原子中下列说法正确的是( )
A.中子数与电子数相同
B.原子核和原子都是电中性的
C.原子是化学变化中的最小粒子
D.原子的大部分体积被原子核占据
C
巩固练习
B
【演练1】锂电池可用作心脏起搏器的电源。已知一种锂原子核内有3个质子和4个中子,则该锂原子的核外电子数为( )
A.1 B.3 C.4 D.7
【演练2】制造“北斗三号”卫星使用了钛合金材料,钛原子的核外电子数为22,则钛原子的核电荷数为 ( )
A.22 B.48 C.70 D.26
A
离子
04
1. 带电的原子或原子团叫做离子。
2. 离子用离子符号表示:在原子团或元素符号的右上角标出离子所带电荷的多少及电荷的正负(数字在前,符号在后,”1”省略)。
常见的离子符号:钠离子 _________,镁离子_________,
氯离子_________, 氢氧根离子_________,硫酸根离子 _________。
Na+
Mg2+
Cl-
OH-
考点四 离子
不同点 原子 离子 结构 质子数=电子数 阳离子 阴离子
电性 不带电 带正电 带负电
联系 质子数=电子数 质子数〉电子数 质子数〈电子数
离子和原子、分子一样是构成物质的基本粒子
考点四 离子
易错警示
典例引领
【典例】从微观视角认识物质是学习化学的重要思维方法。如图是四种粒子的结构示意图
(1)A粒子在化学反应
中容易___________
(填“得到”或“失
去”)电子。
(2)写出B粒子的符号___________
(3)D原子的结构示意图中x的数值为___________。
失去
Mg2+
6
巩固练习
D
【演练】如图为某元素的阴离子的结构示意图。下列有关叙述正确的是( )
A.该阴离子的结构示意图中x=7
B.该元素为硫,是一种非金属元素
C.该元素的原子在化学反应中容易失去电子
D.该阴离子中,核电荷数小于核外电子数
元素符号
05
考点五 元素符号
定义
分布
金属元素
非金属元素
稀有气体元素
符号书写
元素
N、O(按体积分数计算,空气中前两位)
O、C、H、N(按质量分数计算,生物细胞中前四位)
O、Si、Al、Fe(按质量分数计算,地壳中前四位)
O、H、Cl、Na(按质量分数计算,海水中前四位)
分类
元素符号意义
考点五 元素符号
元素 原子
区别 元素是一类原子的总称(质子数相同);只表示种类,不论个数,是宏观概念 原子是微观概念,既表示种类,又有数量含义
化学变化中元素种类不变,但存在形式可能变化 化学变化中,原子种类和数量不变,但最外层电子数可能变化
联系 元素是一类原子的总称,原子是构成元素的基本单元,在物质发生化学变化时,原子的种类不变,元素的种类也不会改变 元素和原子的区别和联系
考点五 元素符号
易错警示
1. 元素符号的含义
(1)表示一种元素,表示这种元素的一个原子。例如O:________、 ____________。
(2)如果物质是由原子构成,则元素符号还可以表示该单质。例如 Fe:_________、 ____________、_________。
氧元素
一个氧原子
铁元素
一个铁原子
铁单质
2.描述物质宏观组成和微观构成
(1)宏观组成(描述物质的组成时用______叙述)。如:铁由________组成;二氧化碳由_________和_________组成。
(2)微观构成(描述物质的构成时用________、________、_________叙述)。如:铁由_________构成。二氧化碳由_______________构成。
(3)描述分子的构成时用_________叙述。如:1个二氧化碳分子由1个_________和2个_________构成。
元素
铁元素
碳元素
氧元素
分子
原子
离子
铁原子
二氧化碳分子
原子
氧原子
碳原子
易错警示
考点五 元素符号
典例引领
【典例】人体每日需要摄入适量的钙,这里的“钙”指的是( )
A.元素 B.单质
C.分子 D.原子
A
巩固练习
C
【演练1】下列化学用语中,既能表示一种元素,又能表示一个原子,还能表示一种物质的是( )
A.N B.O C.Cu D.O2
【演练2】地壳中含量最多的元素是( )
A.Al B.Fe
C.O D.Si
C
元素周期表
06
1.元素周期表:将所有元素按照原子序数(即核电荷数)有序排列而成的表。元素周期表有7个横行、18个纵列,共7个周期、16个族。
考点六 元素周期表
2. 元素周期表中一格的理解(以氧元素为例)
氧
8
O
16.00
相对原子质量
元素符号
元素名称
原子序数
判断元素名称、原子序数、元素符号、相对原子质量。
易错警示
考点六 元素周期表
1. 原子中,原子序数=质子数=核电荷数=核外电子数,
如铜的质子数、核电荷数、原子序数、核外电子数均为29。
2. 中子数≈相对原子质量-质子数
如铜的中子数=63.55 -29 ≈35
3. 相对原子质量单位为1,不能说铜的相对原子质量为63.55g
铜
29
Cu
63.55
典例引领
【典例】根据图示分析,下列说法正确的是 ( )
A.镁属于非金属元素
B.镁原子核外有3个电子层
C.镁的相对原子质量为24.31g
D.镁原子易得到电子变为 Mg2+
B
巩固练习
【演练】神舟十三号载人飞船使用的是目前世界上最先进的砷化镓太阳能电池。砷(As)、镓的原子结构示意图和镓元素在元素周期表中的信息如图所示,下列说法不正确的是( )
A.砷和镓元素位于同一周期
B.镓是非金属元素
C.镓的相对原子质量为69.72
D.砷容易失去电子
B
谢谢欣赏
Thanks For Watching
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
