河南省郑州市第四十七高级中学2023-2024学年高二上学期10月月考化学试题(含答案)
文档属性
| 名称 | 河南省郑州市第四十七高级中学2023-2024学年高二上学期10月月考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 483.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-25 14:52:59 | ||
图片预览



文档简介
郑州市第四十七高级中学2023-2024学年高二上学期10月月考
化学学科
可能用到的相对原子质量:H-1 C-12 Br-80
一、选择题:本题共14小题,每题3分,共42分。
1.《厉害了,我的国》展示了我国科技发展的巨大成就,中国近五年来在探索太空、开发深海、开发新材料、开发5G技术等取得了举世瞩目的成就。下列说法不正确的是
A.华为5G手机搭载智能7nm制程SOC“麒麟980”芯片,芯片的主要成分是单质硅
B.“天宫课堂”实验中,乙酸钠过饱和溶液结晶形成温热“冰球”,该过程发生吸热反应
C.火星车的热控材料纳米气凝胶能产生丁达尔效应
D.“华龙一号”核电项目中核反应堆所用铀棒中含有的与互为同位素
2.中国诗词中包含了丰富的化学知识,下列说法错误的是
A.“嫘祖栽桑蚕吐丝,抽丝织作绣神奇”中的“丝”不耐酸碱
B.“纷纷灿烂如星陨,赫赫喧豗似火攻”中烟花是某些金属的焰色反应,属于化学变化
C.“墨滴无声入水惊,如烟袅袅幻形生”中的“墨滴”具有胶体的性质
D.“煮豆燃豆荚,豆在釜中泣”中的能量变化主要是化学能转化为热能
3.海带灰富含以I-形式存在的碘元素。在实验室中,从海带灰浸取液中提取碘单质的流程如图:
下列说法正确的是
A.为提高①中反应的速率,可增大硫酸浓度或在高温条件下进行
B.操作②中CCl4,可用酒精、苯等代替
C.操作③使用的是反萃取法,得到的上层溶液为紫红色
D.操作Z所需的玻璃仪器有烧杯、玻璃棒、漏斗
4.下列说法中正确的是
A.某酸性溶液中:Cl-、CH3COO-、Mg2+、能大量共存
B.含有大量的溶液中:、K+、、OH-能大量共存
C.某透明溶液中:Fe3+、、Na+、Cl-可能大量共存
D.取少量某溶液,向其中加入盐酸酸化的BaCl2溶液,观察到有白色沉淀生成,证明该溶液中含有
5.把下列四种X溶液分别加入四个盛有10mL2mol/L盐酸的烧杯中,均匀加水稀释到50mL。此时X和盐酸进行反应,其中反应速率最大的是
A.40mL1.5mol/L的X溶液 B.20mL2mol/L的X溶液
C.10mL4mol/L的X溶液 D.10mL2mol/L的X溶液
6.已知A、B、C、D为原子序数依次增大的短周期主族元素,A与D同主族,B与C同周期,且C与D的原子序数之和为20。E为地壳中含量最高的过渡元素。甲、乙分别为元素E、A的单质,丙、丁为A、E分别与B形成的二元化合物,它们之间的转化关系如图(反应条件已略去)。下列说法错误的是
A.A、B形成的一种化合物具有漂白性
B.D的离子半径小于C的离子半径
C.C的单质能与丙反应置换出B的单质
D.将反应后的固体混合物溶于稀盐酸中,再滴加KSCN溶液,溶液一定呈红色
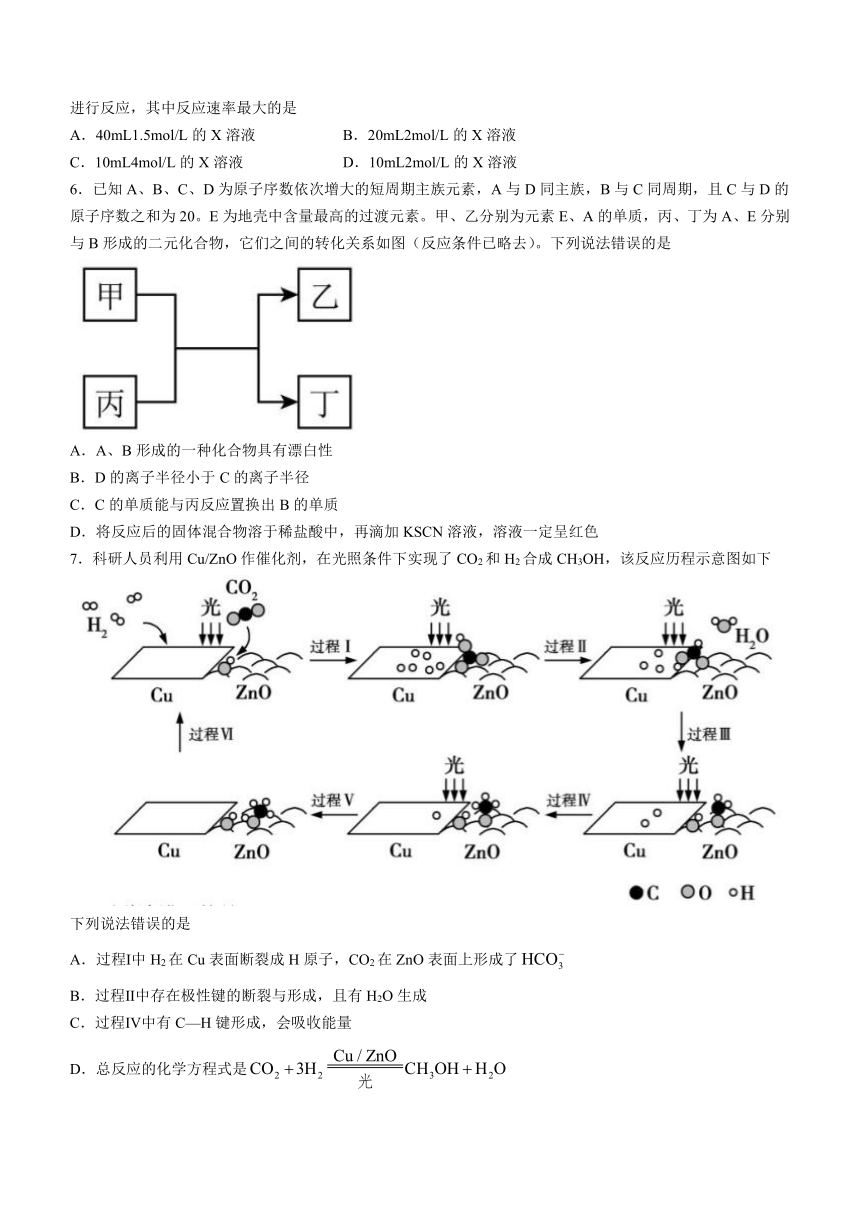
7.科研人员利用Cu/ZnO作催化剂,在光照条件下实现了CO2和H2合成CH3OH,该反应历程示意图如下
下列说法错误的是
A.过程Ⅰ中H2在Cu表面断裂成H原子,CO2在ZnO表面上形成了
B.过程Ⅱ中存在极性键的断裂与形成,且有H2O生成
C.过程Ⅳ中有C—H键形成,会吸收能量
D.总反应的化学方程式是
8.室温下,下列实验探究方案能达到目的的是
选项 探究方案 探究目的
A 向5mL0.1mol-1·LFeCl3溶液中滴加1mL0.1mol·L-1KI溶液,再滴加几滴KSCN溶液。观察溶液颜色变化 FeCl3和KI的反应为可逆反应
B 向NaBr溶液中滴加过量的氯水,再加入淀粉KI溶液,观察溶液颜色变化 氧化性:
C 用0.55mol·L-1NaOH溶液分别与等体积等浓度CH3COOH溶液、盐酸反应,测得反应热依次为、,
D 在淀粉溶液中加入稀硫酸,水浴加热一段时间,冷却后再加入新制浊液并煮沸,没有生成砖红色沉淀 淀粉没有水解
A.A B.B C.C D.D
9.能正确表示下列反应的离子方程式为
A.硫化钠溶液和硝酸混合:
B.明矾溶液与过量氨水混合:
C.硅酸钠溶液中通入二氧化碳:
D.将等物质的量浓度的和溶液以体积比1:2混合:
10.利用生物燃料电池原理研究室温下氨的合成,电池工作时在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.负极区,电极反应式为
C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D.电池工作时质子通过交换膜由负极区向正极区移动
11.下列说法正确的有
①石油裂化的主要目的是制得更多的乙烯等工业原料
②石油的分馏和煤的干馏、气化及液化都是化学变化
③利用与HCl反应制得,是理想的原子经济性反应
④丙烯中最多有7个原子处于同一平面
⑤CH2Cl2只有一种结构,说明CH4是正四面体结构
⑥常温下浓硝酸可以用铝罐储存,说明铝与浓硝酸不反应
A.2个 B.3个 C.4个 D.5个
12.有机物的结构共有(不考虑立体异构)
A.6种 B.7种 C.8种 D.9种
13.下面有机物具有玫瑰香气,其结构简式如下:
下列关于该有机物的叙述中错误的是
A.该有机物的分子式为C15H26O
B.既能发生取代反应,也能发生加成反应
C.1mol该有机物在氧气中充分燃烧需消耗481.6L(标准状况下)氧气
D.1mol该有机物在室温下与溴的四氯化碳溶液反应,最多消耗480gBr2
14.向绝热恒容密闭容器中通入SO2和NO2,在一定条件下发生反应,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
①反应在c点到达平衡
②SO2浓度:a点小于c点
③反应物的总能量高于生成物的总能量
④,ab段NO2的消耗量小于bc段NO2的消耗量
⑤混合物颜色不再变化,说明反应达到平衡
A.3个 B.4个 C.5个 D.6个
二、非选择题,共58分。
15.(12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)Z原子的结构示意图为___________,X与Y形成的含有18e-的化合物是___________
(2)用电子式表示X与W组成的化合物的形成过程___________
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为___________。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式___________。
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式___________。
16.(16分)A是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平,F是链状化合物、一种油状液体,转化关系如下图所示(部分反应条件、产物省略)。
已知:。
回答下列问题:
(1)A的结构简式为___________;D分子中最多有___________个原子共平面;E中官能团的名称为___________。
(2)已知烃X中碳、氢元素的质量比为5:1,它的名称是___________,它的同分异构体共有___________种,其中一氯代物有4种的是___________(写结构简式)。
(3)CEF 的化学方程式为___________。
(4)E可用于制取聚丙烯酸树脂漆,聚丙烯酸的结构简式为___________。
17.(14分)I.完成下列问题。
(1)在298K、100kPa时,已知:C(s,石墨)的摩尔燃烧焓为-393.5kJ·mol-1;
H2(g)的摩尔燃烧焓为-285.8kJ·mol-1;C2H2(g)的摩尔燃烧焓为-1299.5kJ·mol-1。
则2C(s,石墨)+H2(g) C2H2(g) △H=___________kJ·mol-1。
(2)在2L的恒温容器中加入240g石墨和足量氢气发生反应:2C(s,石墨)+H2(g) C2H2(g)。
①能判断该反应达到化学平衡状态的依据是。
A. B.容器中的气体压强不再改变
C.容器中的气体密度不再改变 D.石墨的质量不再改变
E.断开1molH-H键时,同时生成2molC-H键
②若5min达到平衡时石墨的质量为90g,则___________。
II.在密闭容器中加入1molX和3molY发生反应: ,回答下列问题:
(3)若该反应在恒温恒容条件下进行:
①初始时充入惰性气体,化学反应速率会___________(填“增大”“减小”或“不变”)。
②平衡时产生1.2mol物质Z,则X的转化率___________。
[已知:转化率]
(4)若该反应在绝热恒容条件下进行:
①相同时间内生成Z的量比恒温恒容时多,原因是___________。
②当气体压强不再变化时,该反应___________(填“是”或“否”)达到平衡状态。
18.(16分)磺酰氯可用于制造锂电池正极活性物质。实验室可利用SO2和Cl2在活性炭催化下反应制取少量,制备过程中应用的装置如图(部分夹持装置已省略)
已知:①
②熔点为-54.1℃,沸点69.1℃,常温较稳定,100℃以上易分解,遇水剧烈反应。
(1)仪器b中盛放的试剂为___________,其作用是___________。
(2)甲装置用于制备SO2,则下列试剂组合中合适的是___________。
A.18.4mol·L-1的硫酸和Cu
B.10mol·L-1的硝酸和Na2SO3固体
C.70%的硫酸和Na2SO3固体
庚装置用于制备Cl2,写出该装置中反应的离子方程式:___________。
(3)装置乙和丁中可使用同一种试剂,该试剂为___________。
(4)实验过程中需将装置丙置于冷水浴中,其原因是___________;向中加入足量NaOH溶液,振荡、静置得到无色混合盐溶液。写出该过程的离子方程式:___________。
(5)某公司开发的Li-SO2Cl2电池,其示意图如下。
已知电池反应为:。则电池工作时,正极的电极反应式为___________。
郑州市第四十七高级中学2023-2024学年高二上学期10月月考
参考答案
1-5BBDCA 6-10DCCDB 11-14BDCA
15.(1)
(2)
(3)
(4)①②
16.(1) 7 碳碳双键、羧基
(2)戊烷 3
(3)
(4)
17.(1)226.7
(2)CD 0.625
(3)不变 30%
(4)反应放热使体系温度升高,化学反应速率增大 是
18.(1)碱石灰 除去多余和Cl2,避免污染空气;避免空气中的水蒸气进入装置丙,影响产物纯度
(2)C
(3)浓硫酸
(4) 防止温度过高SO2Cl2汽化和分解
化学学科
可能用到的相对原子质量:H-1 C-12 Br-80
一、选择题:本题共14小题,每题3分,共42分。
1.《厉害了,我的国》展示了我国科技发展的巨大成就,中国近五年来在探索太空、开发深海、开发新材料、开发5G技术等取得了举世瞩目的成就。下列说法不正确的是
A.华为5G手机搭载智能7nm制程SOC“麒麟980”芯片,芯片的主要成分是单质硅
B.“天宫课堂”实验中,乙酸钠过饱和溶液结晶形成温热“冰球”,该过程发生吸热反应
C.火星车的热控材料纳米气凝胶能产生丁达尔效应
D.“华龙一号”核电项目中核反应堆所用铀棒中含有的与互为同位素
2.中国诗词中包含了丰富的化学知识,下列说法错误的是
A.“嫘祖栽桑蚕吐丝,抽丝织作绣神奇”中的“丝”不耐酸碱
B.“纷纷灿烂如星陨,赫赫喧豗似火攻”中烟花是某些金属的焰色反应,属于化学变化
C.“墨滴无声入水惊,如烟袅袅幻形生”中的“墨滴”具有胶体的性质
D.“煮豆燃豆荚,豆在釜中泣”中的能量变化主要是化学能转化为热能
3.海带灰富含以I-形式存在的碘元素。在实验室中,从海带灰浸取液中提取碘单质的流程如图:
下列说法正确的是
A.为提高①中反应的速率,可增大硫酸浓度或在高温条件下进行
B.操作②中CCl4,可用酒精、苯等代替
C.操作③使用的是反萃取法,得到的上层溶液为紫红色
D.操作Z所需的玻璃仪器有烧杯、玻璃棒、漏斗
4.下列说法中正确的是
A.某酸性溶液中:Cl-、CH3COO-、Mg2+、能大量共存
B.含有大量的溶液中:、K+、、OH-能大量共存
C.某透明溶液中:Fe3+、、Na+、Cl-可能大量共存
D.取少量某溶液,向其中加入盐酸酸化的BaCl2溶液,观察到有白色沉淀生成,证明该溶液中含有
5.把下列四种X溶液分别加入四个盛有10mL2mol/L盐酸的烧杯中,均匀加水稀释到50mL。此时X和盐酸进行反应,其中反应速率最大的是
A.40mL1.5mol/L的X溶液 B.20mL2mol/L的X溶液
C.10mL4mol/L的X溶液 D.10mL2mol/L的X溶液
6.已知A、B、C、D为原子序数依次增大的短周期主族元素,A与D同主族,B与C同周期,且C与D的原子序数之和为20。E为地壳中含量最高的过渡元素。甲、乙分别为元素E、A的单质,丙、丁为A、E分别与B形成的二元化合物,它们之间的转化关系如图(反应条件已略去)。下列说法错误的是
A.A、B形成的一种化合物具有漂白性
B.D的离子半径小于C的离子半径
C.C的单质能与丙反应置换出B的单质
D.将反应后的固体混合物溶于稀盐酸中,再滴加KSCN溶液,溶液一定呈红色
7.科研人员利用Cu/ZnO作催化剂,在光照条件下实现了CO2和H2合成CH3OH,该反应历程示意图如下
下列说法错误的是
A.过程Ⅰ中H2在Cu表面断裂成H原子,CO2在ZnO表面上形成了
B.过程Ⅱ中存在极性键的断裂与形成,且有H2O生成
C.过程Ⅳ中有C—H键形成,会吸收能量
D.总反应的化学方程式是
8.室温下,下列实验探究方案能达到目的的是
选项 探究方案 探究目的
A 向5mL0.1mol-1·LFeCl3溶液中滴加1mL0.1mol·L-1KI溶液,再滴加几滴KSCN溶液。观察溶液颜色变化 FeCl3和KI的反应为可逆反应
B 向NaBr溶液中滴加过量的氯水,再加入淀粉KI溶液,观察溶液颜色变化 氧化性:
C 用0.55mol·L-1NaOH溶液分别与等体积等浓度CH3COOH溶液、盐酸反应,测得反应热依次为、,
D 在淀粉溶液中加入稀硫酸,水浴加热一段时间,冷却后再加入新制浊液并煮沸,没有生成砖红色沉淀 淀粉没有水解
A.A B.B C.C D.D
9.能正确表示下列反应的离子方程式为
A.硫化钠溶液和硝酸混合:
B.明矾溶液与过量氨水混合:
C.硅酸钠溶液中通入二氧化碳:
D.将等物质的量浓度的和溶液以体积比1:2混合:
10.利用生物燃料电池原理研究室温下氨的合成,电池工作时在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.负极区,电极反应式为
C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D.电池工作时质子通过交换膜由负极区向正极区移动
11.下列说法正确的有
①石油裂化的主要目的是制得更多的乙烯等工业原料
②石油的分馏和煤的干馏、气化及液化都是化学变化
③利用与HCl反应制得,是理想的原子经济性反应
④丙烯中最多有7个原子处于同一平面
⑤CH2Cl2只有一种结构,说明CH4是正四面体结构
⑥常温下浓硝酸可以用铝罐储存,说明铝与浓硝酸不反应
A.2个 B.3个 C.4个 D.5个
12.有机物的结构共有(不考虑立体异构)
A.6种 B.7种 C.8种 D.9种
13.下面有机物具有玫瑰香气,其结构简式如下:
下列关于该有机物的叙述中错误的是
A.该有机物的分子式为C15H26O
B.既能发生取代反应,也能发生加成反应
C.1mol该有机物在氧气中充分燃烧需消耗481.6L(标准状况下)氧气
D.1mol该有机物在室温下与溴的四氯化碳溶液反应,最多消耗480gBr2
14.向绝热恒容密闭容器中通入SO2和NO2,在一定条件下发生反应,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
①反应在c点到达平衡
②SO2浓度:a点小于c点
③反应物的总能量高于生成物的总能量
④,ab段NO2的消耗量小于bc段NO2的消耗量
⑤混合物颜色不再变化,说明反应达到平衡
A.3个 B.4个 C.5个 D.6个
二、非选择题,共58分。
15.(12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)Z原子的结构示意图为___________,X与Y形成的含有18e-的化合物是___________
(2)用电子式表示X与W组成的化合物的形成过程___________
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为___________。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式___________。
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式___________。
16.(16分)A是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平,F是链状化合物、一种油状液体,转化关系如下图所示(部分反应条件、产物省略)。
已知:。
回答下列问题:
(1)A的结构简式为___________;D分子中最多有___________个原子共平面;E中官能团的名称为___________。
(2)已知烃X中碳、氢元素的质量比为5:1,它的名称是___________,它的同分异构体共有___________种,其中一氯代物有4种的是___________(写结构简式)。
(3)CEF 的化学方程式为___________。
(4)E可用于制取聚丙烯酸树脂漆,聚丙烯酸的结构简式为___________。
17.(14分)I.完成下列问题。
(1)在298K、100kPa时,已知:C(s,石墨)的摩尔燃烧焓为-393.5kJ·mol-1;
H2(g)的摩尔燃烧焓为-285.8kJ·mol-1;C2H2(g)的摩尔燃烧焓为-1299.5kJ·mol-1。
则2C(s,石墨)+H2(g) C2H2(g) △H=___________kJ·mol-1。
(2)在2L的恒温容器中加入240g石墨和足量氢气发生反应:2C(s,石墨)+H2(g) C2H2(g)。
①能判断该反应达到化学平衡状态的依据是。
A. B.容器中的气体压强不再改变
C.容器中的气体密度不再改变 D.石墨的质量不再改变
E.断开1molH-H键时,同时生成2molC-H键
②若5min达到平衡时石墨的质量为90g,则___________。
II.在密闭容器中加入1molX和3molY发生反应: ,回答下列问题:
(3)若该反应在恒温恒容条件下进行:
①初始时充入惰性气体,化学反应速率会___________(填“增大”“减小”或“不变”)。
②平衡时产生1.2mol物质Z,则X的转化率___________。
[已知:转化率]
(4)若该反应在绝热恒容条件下进行:
①相同时间内生成Z的量比恒温恒容时多,原因是___________。
②当气体压强不再变化时,该反应___________(填“是”或“否”)达到平衡状态。
18.(16分)磺酰氯可用于制造锂电池正极活性物质。实验室可利用SO2和Cl2在活性炭催化下反应制取少量,制备过程中应用的装置如图(部分夹持装置已省略)
已知:①
②熔点为-54.1℃,沸点69.1℃,常温较稳定,100℃以上易分解,遇水剧烈反应。
(1)仪器b中盛放的试剂为___________,其作用是___________。
(2)甲装置用于制备SO2,则下列试剂组合中合适的是___________。
A.18.4mol·L-1的硫酸和Cu
B.10mol·L-1的硝酸和Na2SO3固体
C.70%的硫酸和Na2SO3固体
庚装置用于制备Cl2,写出该装置中反应的离子方程式:___________。
(3)装置乙和丁中可使用同一种试剂,该试剂为___________。
(4)实验过程中需将装置丙置于冷水浴中,其原因是___________;向中加入足量NaOH溶液,振荡、静置得到无色混合盐溶液。写出该过程的离子方程式:___________。
(5)某公司开发的Li-SO2Cl2电池,其示意图如下。
已知电池反应为:。则电池工作时,正极的电极反应式为___________。
郑州市第四十七高级中学2023-2024学年高二上学期10月月考
参考答案
1-5BBDCA 6-10DCCDB 11-14BDCA
15.(1)
(2)
(3)
(4)①②
16.(1) 7 碳碳双键、羧基
(2)戊烷 3
(3)
(4)
17.(1)226.7
(2)CD 0.625
(3)不变 30%
(4)反应放热使体系温度升高,化学反应速率增大 是
18.(1)碱石灰 除去多余和Cl2,避免污染空气;避免空气中的水蒸气进入装置丙,影响产物纯度
(2)C
(3)浓硫酸
(4) 防止温度过高SO2Cl2汽化和分解
同课章节目录
