2.3 物质的量 (含解析)同步练习题 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.3 物质的量 (含解析)同步练习题 2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 215.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-25 00:00:00 | ||
图片预览

文档简介
2.3 物质的量 同步练习题
一、选择题
1.中国药学家屠呦呦因发现青蒿素开创了治疗疟疾的新方法,荣获了诺贝尔奖。第十三届全国人民代表大会常务委员会第十三次会议决定授予屠呦呦“共和国勋章”,表彰她及其团队为新中国建设和发展作出的杰出贡献。已知青蒿素的分子式为C15H22O5,下列有关说法正确的是
A.青蒿素的摩尔质量为282g B.青蒿素中碳元素质量分数最高
C.标准状况下,1mol青蒿素的体积约为22.4L D.1mol青蒿素中含11molH2
2.同温同压下,相同体积的气体 NO2 和NO 具有相同的
A.质量 B.原子数 C.氮原子数 D.密度
3.设为阿伏加德罗常数的值,下列叙述中正确的是
A.1mol/L溶液中的数目为
B.71g氯气发生氧化还原反应,转移电子数一定为
C.室温下,14g和CO的混合气体中含有的原子数目为
D.标准状况下,22.4L中所含原子数为
4.下列说法不正确的是
A.一氧化碳的摩尔质量与6.02×1023个氮气分子的质量(以g为单位)在数值上相等
B.6.02×1023个H2和6.02×1023个O2的质量比为1∶16
C.3.2gO2所含的原子数目约为0.2×6.02×1023
D.常温常压下,0.5×6.02×1023个二氧化碳分子的质量是44g
5.有一份气体样品的质量是3.2g,标准状况下的体积为1.12L,该气体的摩尔质量是
A.32g B.32g·mol-1 C.64g D.64g·mol-1
6.若中含有x个原子,则阿伏加德罗常数是
A.7x B.14 x C. x /14 D. x /7
7.用NA表示阿伏加德罗常数的值。下列判断不正确的是
A.1molO3含有的原子数目为3NA
B.24gMg变为Mg2+时失去的电子数目为2NA
C.常温常压下,11.2LSO2中含有的原子数目为1.5NA
D.1L1mol L-1MgCl2溶液中含有的Cl-数目为2NA
8.设NA代表阿伏加德罗常数的值,下列说法正确的是
A.46gNO2和N2O4混合气体中含有原子数为3NA
B.1molCl2与足量NaOH溶液完全反应转移电子数为2NA
C.标准状况下,2.24LH2O中含有原子数为0.3NA
D.1mol L-1Mg(NO3)2溶液中含有NO的数目为2NA
二、非选择题
9.根据所学知识填空:
(1)2molH2O含有___个H2O;
(2)6.02×1023个CO2中,有___molO;
(3)1.5molNH3的质量为___,有___个NH3分子;
(4)49gH2SO4约含有___个H,O原子的物质的量为___。
10.小明去超市购买A4纸和订书钉,发现A4纸外包装上注明1包500张,订书钉外包装标明一盒500枚。在日常生活和工作中我们经常用到这样一些小物品,不是按单个出售的,而是按一定数量整体出售,而构成物质的原子、分子和离子非常微小,用宏观物质的方式表示微观粒子极其困难,也没有意义。因此科学家引入了“物质的量”这一基本物理量,来描述微观粒子集合体数目的多少。
问题:材料中提到的一包、一盒和物质的量描述的对象有何不同_________? “1 mol A4纸”“1 mol订书钉”的说法正确吗?_________
11.在400 mL2 mol·L-1H2SO4溶液中,溶质的质量是___________,此溶液中H+的物质的量浓度为___________,SO的物质的量浓度为___________。
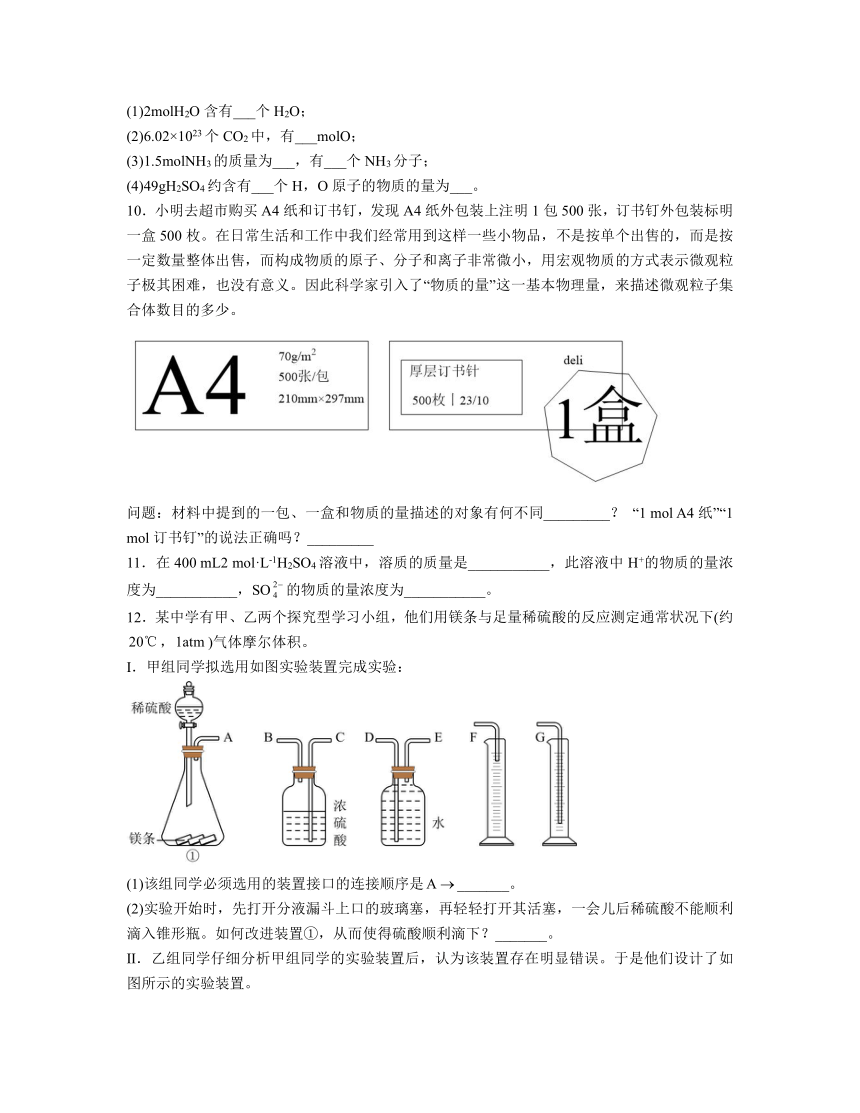
12.某中学有甲、乙两个探究型学习小组,他们用镁条与足量稀硫酸的反应测定通常状况下(约,)气体摩尔体积。
Ⅰ.甲组同学拟选用如图实验装置完成实验:
(1)该组同学必须选用的装置接口的连接顺序是_______。
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸不能顺利滴入锥形瓶。如何改进装置①,从而使得硫酸顺利滴下?_______。
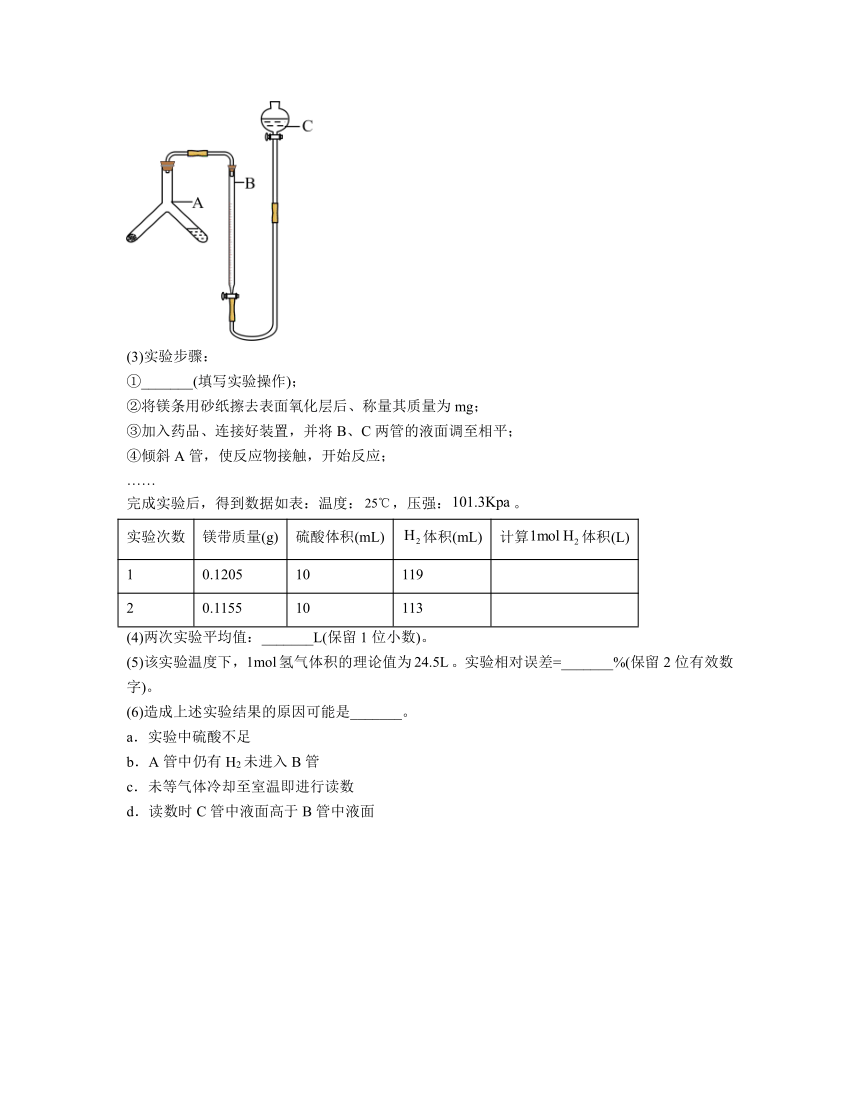
Ⅱ.乙组同学仔细分析甲组同学的实验装置后,认为该装置存在明显错误。于是他们设计了如图所示的实验装置。
(3)实验步骤:
①_______(填写实验操作);
②将镁条用砂纸擦去表面氧化层后、称量其质量为mg;
③加入药品、连接好装置,并将B、C两管的液面调至相平;
④倾斜A管,使反应物接触,开始反应;
……
完成实验后,得到数据如表:温度:,压强:。
实验次数 镁带质量(g) 硫酸体积(mL) 体积(mL) 计算体积(L)
1 0.1205 10 119
2 0.1155 10 113
(4)两次实验平均值:_______L(保留1位小数)。
(5)该实验温度下,氢气体积的理论值为。实验相对误差=_______%(保留2位有效数字)。
(6)造成上述实验结果的原因可能是_______。
a.实验中硫酸不足
b.A管中仍有H2未进入B管
c.未等气体冷却至室温即进行读数
d.读数时C管中液面高于B管中液面
【参考答案】
一、选择题
1.B
解析:A.摩尔质量的单位为g/mol,所以青蒿素的摩尔质量为282g/mol,A错误;
B.青蒿素中C元素的质量分数为,H元素的质量分数为,O元素的质量分数为,所以碳元素质量分数最高,B正确;
C.标况下青蒿素不是气体,所以1mol青蒿素的体积不是22.4L,C错误;
D.青蒿素中不含氢气分子,D错误;
综上所述答案为B。
2.C
【分析】由阿伏加德罗定律可知,同温同压下,相同体积的二氧化氮和一氧化氮具有相同的物质的量;
解析:A.一氧化氮和二氧化氮的摩尔质量不相等,则等物质的量的二氧化氮和一氧化氮的质量不相同,故A错误;
B.一氧化氮和二氧化氮的原子个数不相等,则等物质的量的二氧化氮和一氧化氮的原子个数不相同,故B错误;
C.一氧化氮和二氧化氮的氮原子个数相等,则等物质的量的二氧化氮和一氧化氮的氮原子个数相同,故C正确;
D.一氧化氮和二氧化氮的摩尔质量不相等,则等体积、等物质的量的二氧化氮和一氧化氮的质量不相同,密度不相同,故D错误;
故选C。
3.C
解析:A.没有给溶液体积,不能计算出的数目,A错误;
B.71g氯气为1mol,中1mol氯气转移的电子数为,B错误;
C.和CO的摩尔质量均为28g/mol,14g和CO的混合气体为0.5mol,含原子数为,C正确;
D.标准状况下,Br2不是气体,不能用体积进行计算,D错误;
故选C。
4.D
解析:A.一氧化碳的摩尔质量是28g·mol-1,6.02×1023个氮气分子的物质的量是1mol,质量是28 g,所以在数值上相等,故A正确;
B.6.02×1023个H2和6.02×1023个O2的物质的量均为1mol,根据m=nM可知,它们的质量之比为1mol×2g/mol:32g/mol×1mol=1:16,故B正确;
C.3.2g O2所含的原子数目约为,故C正确;
D.0.5×6.02×1023个二氧化碳分子的物质的量是0.5mol,质量是0.5mol×44 g·mol-1=22 g,故D错误;
故答案选D。
5.D
解析:标准状况下,该气体的物质的量为 ,,答案选D。
6.A
解析:,则,含有个原子,则;
故选A。
7.C
解析:A.1mol含有的原子的数目为3,A项正确;
B.24gMg的物质的量mol,变为时失去的电子数目为2,B项正确;
C.常温常压下气体摩尔体积大于22.4L,11.2L中物质的量小于0.5mol,含有的原子数目小于1.5,C项错误;
D.1L1溶液中含有数目为2,D项正确;
答案选C。
8.A
解析:A.NO2和N2O4的最简式均为NO2,46gNO2和N2O4混合气体可看做1molNO2,则含有原子数为3NA,A正确;
B.氯气和氢氧化钠反应生成氯化钠和次氯酸钠,,则1molCl2与足量NaOH溶液完全反应转移电子数为NA,B错误;
C.标况下水不是气体,不能计算其物质的量,C错误;
D.没有溶液体积不能计算其物质的量,D错误;
故选A。
二、非选择题
9. 2NA 2mol 25.5g 1.5NA NA 2mol
解析:(1)2molH2O含有2NA个H2O;
(2)6.02×1023个CO2的物质的量为1mol,含有2molO;
(3)1.5molNH3的质量为1.5mol17g/mol=25.5g;有1.5 NA个NH3分子;
(4)49gH2SO4的物质的量为=0.5mol,含有0.5mol2=1molH,即NA个;O原子的物质的量为0.5mol4=2mol。
10. 材料中提到的包、盒等都是针对宏观物质;而物质的量是用来描述微观粒子集合体数目的多少,只能针对具体的微观粒子,如原子、分子、离子等 不正确
解析:物质的量表示含有一定数目粒子的集合体,这里的粒子指的是微观粒子,即材料中提到的包、盒等都是针对宏观物质,而物质的量是用来描述微观粒子集合体数目的多少,只能针对具体的微观粒子,如原子、分子、离子等,故“1 mol A4纸”“1 mol订书钉”的说法不正确。
11.4g 4 mol·L-1 2 mol·L-1
解析:在400 mL2 mol·L-1H2SO4溶液中, ,溶质的质量是,此溶液中H+的物质的量浓度为,SO的物质的量浓度为。
12.(1)EDG
(2)需用一根导管连接锥形瓶和分液漏斗的上口玻璃塞处
(3)检查装置气密性
(4)23.59
(5)3.7
(6)ad
解析:本题是利用金属镁与稀硫酸反应产生H2,反应方程式为:H2SO4+Mg=MgSO4+H2↑,并利用排水法来测量生成H2的体积,从而计算1molH2在常温常压下的体积,据此分析解题。
(1)装置的组装顺序:金属与酸反应生成盐和H2,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:(A)接(E)(D)接(G);
故答案为:EDG;
(2)镁与稀硫酸反应放热且产生的氢气使锥形瓶内气压增大,锥形瓶内的压强大于大气压,所以稀硫酸不能顺利滴入锥形瓶中,需用一根导管连接锥形瓶和分液漏斗的上口玻璃塞处,如图所示:使内外压强始终保持相等,故答案为:需用一根导管连接锥形瓶和分液漏斗的上口玻璃塞处;
(3)装置是利用测定反应生成氢气体积计算气体摩尔体积,开始需要检查装置气密性,故答案为:检查装置气密性;
(4)将镁条用砂纸仔细擦去表面氧化层后、称量其质量为mg,Mg的物质的量==mol,镁和稀硫酸反应化学方程式:,Mg+H2SO4=MgSO4+H2↑,生成气体物质的量mol,反应结束后量气管中气体体积为VmL,1molH2的体积V===L=L,带入数据得到第一次实验结果为:V1===23.70L,第二次实验结果为:V2===23.48L,二者的数据的平均值为:=23.59 L,故答案为:23.59;
(5)由(4)项计算可知,该实验温度下,氢气体积的理论值为。实验相对误差==3.7%,故答案为:3.7;
(6)a.实验中硫酸不足,测定氢气体积会减小,结果偏低,a符合题意;
b.A管中仍有H2未进入B管,A管中的原来的空气进入了B管中,故测定结果无影响, b不合题意;
c.未等气体冷却至室温即进行读数,读取气体体积增大,测定结果偏高, c不合题意;
d.读数时C管中液面高于B管中液面,由于气体的压强大于外界大气压,故读取气体体积减小,测定结果偏小, d符合题意;
故答案为:ad
一、选择题
1.中国药学家屠呦呦因发现青蒿素开创了治疗疟疾的新方法,荣获了诺贝尔奖。第十三届全国人民代表大会常务委员会第十三次会议决定授予屠呦呦“共和国勋章”,表彰她及其团队为新中国建设和发展作出的杰出贡献。已知青蒿素的分子式为C15H22O5,下列有关说法正确的是
A.青蒿素的摩尔质量为282g B.青蒿素中碳元素质量分数最高
C.标准状况下,1mol青蒿素的体积约为22.4L D.1mol青蒿素中含11molH2
2.同温同压下,相同体积的气体 NO2 和NO 具有相同的
A.质量 B.原子数 C.氮原子数 D.密度
3.设为阿伏加德罗常数的值,下列叙述中正确的是
A.1mol/L溶液中的数目为
B.71g氯气发生氧化还原反应,转移电子数一定为
C.室温下,14g和CO的混合气体中含有的原子数目为
D.标准状况下,22.4L中所含原子数为
4.下列说法不正确的是
A.一氧化碳的摩尔质量与6.02×1023个氮气分子的质量(以g为单位)在数值上相等
B.6.02×1023个H2和6.02×1023个O2的质量比为1∶16
C.3.2gO2所含的原子数目约为0.2×6.02×1023
D.常温常压下,0.5×6.02×1023个二氧化碳分子的质量是44g
5.有一份气体样品的质量是3.2g,标准状况下的体积为1.12L,该气体的摩尔质量是
A.32g B.32g·mol-1 C.64g D.64g·mol-1
6.若中含有x个原子,则阿伏加德罗常数是
A.7x B.14 x C. x /14 D. x /7
7.用NA表示阿伏加德罗常数的值。下列判断不正确的是
A.1molO3含有的原子数目为3NA
B.24gMg变为Mg2+时失去的电子数目为2NA
C.常温常压下,11.2LSO2中含有的原子数目为1.5NA
D.1L1mol L-1MgCl2溶液中含有的Cl-数目为2NA
8.设NA代表阿伏加德罗常数的值,下列说法正确的是
A.46gNO2和N2O4混合气体中含有原子数为3NA
B.1molCl2与足量NaOH溶液完全反应转移电子数为2NA
C.标准状况下,2.24LH2O中含有原子数为0.3NA
D.1mol L-1Mg(NO3)2溶液中含有NO的数目为2NA
二、非选择题
9.根据所学知识填空:
(1)2molH2O含有___个H2O;
(2)6.02×1023个CO2中,有___molO;
(3)1.5molNH3的质量为___,有___个NH3分子;
(4)49gH2SO4约含有___个H,O原子的物质的量为___。
10.小明去超市购买A4纸和订书钉,发现A4纸外包装上注明1包500张,订书钉外包装标明一盒500枚。在日常生活和工作中我们经常用到这样一些小物品,不是按单个出售的,而是按一定数量整体出售,而构成物质的原子、分子和离子非常微小,用宏观物质的方式表示微观粒子极其困难,也没有意义。因此科学家引入了“物质的量”这一基本物理量,来描述微观粒子集合体数目的多少。
问题:材料中提到的一包、一盒和物质的量描述的对象有何不同_________? “1 mol A4纸”“1 mol订书钉”的说法正确吗?_________
11.在400 mL2 mol·L-1H2SO4溶液中,溶质的质量是___________,此溶液中H+的物质的量浓度为___________,SO的物质的量浓度为___________。
12.某中学有甲、乙两个探究型学习小组,他们用镁条与足量稀硫酸的反应测定通常状况下(约,)气体摩尔体积。
Ⅰ.甲组同学拟选用如图实验装置完成实验:
(1)该组同学必须选用的装置接口的连接顺序是_______。
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸不能顺利滴入锥形瓶。如何改进装置①,从而使得硫酸顺利滴下?_______。
Ⅱ.乙组同学仔细分析甲组同学的实验装置后,认为该装置存在明显错误。于是他们设计了如图所示的实验装置。
(3)实验步骤:
①_______(填写实验操作);
②将镁条用砂纸擦去表面氧化层后、称量其质量为mg;
③加入药品、连接好装置,并将B、C两管的液面调至相平;
④倾斜A管,使反应物接触,开始反应;
……
完成实验后,得到数据如表:温度:,压强:。
实验次数 镁带质量(g) 硫酸体积(mL) 体积(mL) 计算体积(L)
1 0.1205 10 119
2 0.1155 10 113
(4)两次实验平均值:_______L(保留1位小数)。
(5)该实验温度下,氢气体积的理论值为。实验相对误差=_______%(保留2位有效数字)。
(6)造成上述实验结果的原因可能是_______。
a.实验中硫酸不足
b.A管中仍有H2未进入B管
c.未等气体冷却至室温即进行读数
d.读数时C管中液面高于B管中液面
【参考答案】
一、选择题
1.B
解析:A.摩尔质量的单位为g/mol,所以青蒿素的摩尔质量为282g/mol,A错误;
B.青蒿素中C元素的质量分数为,H元素的质量分数为,O元素的质量分数为,所以碳元素质量分数最高,B正确;
C.标况下青蒿素不是气体,所以1mol青蒿素的体积不是22.4L,C错误;
D.青蒿素中不含氢气分子,D错误;
综上所述答案为B。
2.C
【分析】由阿伏加德罗定律可知,同温同压下,相同体积的二氧化氮和一氧化氮具有相同的物质的量;
解析:A.一氧化氮和二氧化氮的摩尔质量不相等,则等物质的量的二氧化氮和一氧化氮的质量不相同,故A错误;
B.一氧化氮和二氧化氮的原子个数不相等,则等物质的量的二氧化氮和一氧化氮的原子个数不相同,故B错误;
C.一氧化氮和二氧化氮的氮原子个数相等,则等物质的量的二氧化氮和一氧化氮的氮原子个数相同,故C正确;
D.一氧化氮和二氧化氮的摩尔质量不相等,则等体积、等物质的量的二氧化氮和一氧化氮的质量不相同,密度不相同,故D错误;
故选C。
3.C
解析:A.没有给溶液体积,不能计算出的数目,A错误;
B.71g氯气为1mol,中1mol氯气转移的电子数为,B错误;
C.和CO的摩尔质量均为28g/mol,14g和CO的混合气体为0.5mol,含原子数为,C正确;
D.标准状况下,Br2不是气体,不能用体积进行计算,D错误;
故选C。
4.D
解析:A.一氧化碳的摩尔质量是28g·mol-1,6.02×1023个氮气分子的物质的量是1mol,质量是28 g,所以在数值上相等,故A正确;
B.6.02×1023个H2和6.02×1023个O2的物质的量均为1mol,根据m=nM可知,它们的质量之比为1mol×2g/mol:32g/mol×1mol=1:16,故B正确;
C.3.2g O2所含的原子数目约为,故C正确;
D.0.5×6.02×1023个二氧化碳分子的物质的量是0.5mol,质量是0.5mol×44 g·mol-1=22 g,故D错误;
故答案选D。
5.D
解析:标准状况下,该气体的物质的量为 ,,答案选D。
6.A
解析:,则,含有个原子,则;
故选A。
7.C
解析:A.1mol含有的原子的数目为3,A项正确;
B.24gMg的物质的量mol,变为时失去的电子数目为2,B项正确;
C.常温常压下气体摩尔体积大于22.4L,11.2L中物质的量小于0.5mol,含有的原子数目小于1.5,C项错误;
D.1L1溶液中含有数目为2,D项正确;
答案选C。
8.A
解析:A.NO2和N2O4的最简式均为NO2,46gNO2和N2O4混合气体可看做1molNO2,则含有原子数为3NA,A正确;
B.氯气和氢氧化钠反应生成氯化钠和次氯酸钠,,则1molCl2与足量NaOH溶液完全反应转移电子数为NA,B错误;
C.标况下水不是气体,不能计算其物质的量,C错误;
D.没有溶液体积不能计算其物质的量,D错误;
故选A。
二、非选择题
9. 2NA 2mol 25.5g 1.5NA NA 2mol
解析:(1)2molH2O含有2NA个H2O;
(2)6.02×1023个CO2的物质的量为1mol,含有2molO;
(3)1.5molNH3的质量为1.5mol17g/mol=25.5g;有1.5 NA个NH3分子;
(4)49gH2SO4的物质的量为=0.5mol,含有0.5mol2=1molH,即NA个;O原子的物质的量为0.5mol4=2mol。
10. 材料中提到的包、盒等都是针对宏观物质;而物质的量是用来描述微观粒子集合体数目的多少,只能针对具体的微观粒子,如原子、分子、离子等 不正确
解析:物质的量表示含有一定数目粒子的集合体,这里的粒子指的是微观粒子,即材料中提到的包、盒等都是针对宏观物质,而物质的量是用来描述微观粒子集合体数目的多少,只能针对具体的微观粒子,如原子、分子、离子等,故“1 mol A4纸”“1 mol订书钉”的说法不正确。
11.4g 4 mol·L-1 2 mol·L-1
解析:在400 mL2 mol·L-1H2SO4溶液中, ,溶质的质量是,此溶液中H+的物质的量浓度为,SO的物质的量浓度为。
12.(1)EDG
(2)需用一根导管连接锥形瓶和分液漏斗的上口玻璃塞处
(3)检查装置气密性
(4)23.59
(5)3.7
(6)ad
解析:本题是利用金属镁与稀硫酸反应产生H2,反应方程式为:H2SO4+Mg=MgSO4+H2↑,并利用排水法来测量生成H2的体积,从而计算1molH2在常温常压下的体积,据此分析解题。
(1)装置的组装顺序:金属与酸反应生成盐和H2,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:(A)接(E)(D)接(G);
故答案为:EDG;
(2)镁与稀硫酸反应放热且产生的氢气使锥形瓶内气压增大,锥形瓶内的压强大于大气压,所以稀硫酸不能顺利滴入锥形瓶中,需用一根导管连接锥形瓶和分液漏斗的上口玻璃塞处,如图所示:使内外压强始终保持相等,故答案为:需用一根导管连接锥形瓶和分液漏斗的上口玻璃塞处;
(3)装置是利用测定反应生成氢气体积计算气体摩尔体积,开始需要检查装置气密性,故答案为:检查装置气密性;
(4)将镁条用砂纸仔细擦去表面氧化层后、称量其质量为mg,Mg的物质的量==mol,镁和稀硫酸反应化学方程式:,Mg+H2SO4=MgSO4+H2↑,生成气体物质的量mol,反应结束后量气管中气体体积为VmL,1molH2的体积V===L=L,带入数据得到第一次实验结果为:V1===23.70L,第二次实验结果为:V2===23.48L,二者的数据的平均值为:=23.59 L,故答案为:23.59;
(5)由(4)项计算可知,该实验温度下,氢气体积的理论值为。实验相对误差==3.7%,故答案为:3.7;
(6)a.实验中硫酸不足,测定氢气体积会减小,结果偏低,a符合题意;
b.A管中仍有H2未进入B管,A管中的原来的空气进入了B管中,故测定结果无影响, b不合题意;
c.未等气体冷却至室温即进行读数,读取气体体积增大,测定结果偏高, c不合题意;
d.读数时C管中液面高于B管中液面,由于气体的压强大于外界大气压,故读取气体体积减小,测定结果偏小, d符合题意;
故答案为:ad
