3.2水的电离和溶液的PH(含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2水的电离和溶液的PH(含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |
|
|
| 格式 | docx | ||
| 文件大小 | 322.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-25 15:07:27 | ||
图片预览


文档简介
3.2水的电离和溶液的PH同步练习题
一、选择题
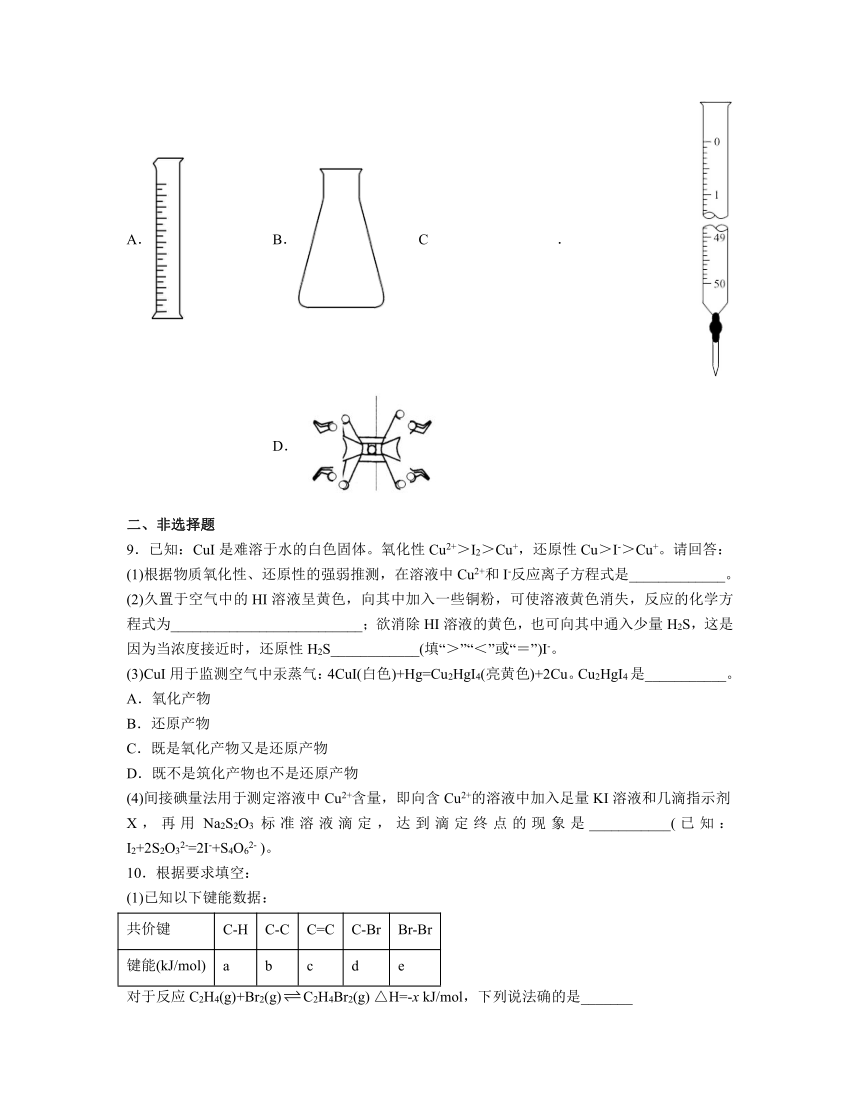
1.下列装置能达到相应实验目的的是
A.装置Ⅰ可用于除去苯中的溴 B.装置Ⅱ可用于配制的稀硫酸
C.装置Ⅲ可用于实验室制备少量氧气 D.装置Ⅳ可用于滴定盐酸
2.下列有关实验操作的说法不正确的是
A.测定中和反应反应热时,将NaOH溶液一次迅速倒入量热计的内筒
B.用碱式滴定管量取NaOH溶液23.25mL
C.用润湿的pH试纸测NaOH溶液的pH
D.用10mL的量筒量取8.2mLNaOH溶液
3.实验基本操作是学习化学的灵魂。下列图示的“错误操作”,与相对应选项的“可能产生后果”不一致的是
A.图甲标签受损 B.图乙读数偏小
C.图丙污染待测液 D.图丁液体飞溅
4.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作正确的是( )
A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
B.锥形瓶用蒸馏水洗净后,润洗后加入一定体积的未知浓度的NaOH溶液
C.滴定时,没有逐出滴定管下口的气泡
D.滴定时,眼睛注视锥形瓶内溶液颜色的变化
5.如图,图Ⅰ表示10mL量筒中液面位置,A与B,B与C之间刻度相差1mL,图Ⅱ表示50ml滴定管中液面位置,D与E之间相差1mL,若A、D刻度均为6,则两容器液面读数分别为( )
A.图Ⅰ5.20mL 图Ⅱ6.6mL B.图Ⅰ5.20mL 图Ⅱ5.4mL
C.图Ⅰ5.2mL 图Ⅱ5.40mL D.图Ⅰ5.2mL 图Ⅱ6.60mL
6.准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol L-1NaOH溶液滴定,下列说法不正确的是
A.滴定前用蒸馏水冲洗锥形瓶对测定结果无影响
B.滴定操作时,眼睛要一直关注锥形瓶中的颜色变化
C.用酚酞作指示剂,当锥形瓶中溶液由粉红色变无色时停止滴定
D.酸式滴定管可以盛放盐酸,但不能盛放Na2CO3溶液
7.根据实验目的,下列实验设计、现象及结论都正确的是
选项 实验目的 实验设计及现象 结论
A 探究维生素C的还原性 向盛有溶液的试管中滴加过量维生素C溶液,原溶液由黄色变为浅绿色 维生素C具有还原性
B 判断淀粉是否水解 向淀粉溶液中加入少量稀硫酸,加热,再加入银氨溶液,加热后未出现银镜 淀粉未水解
C 比较B和C的非金属性强弱 用计测定溶液的,溶液的更小 非金属性:
D 比较的氧化性 向含有等量混合溶液中依次加入少量新制氯水和,振荡、静置,溶液分层,下层呈紫红色 氧化性:
A.A B.B C.C D.D
8.下列玻璃仪器在酸碱中和滴定实验中不需要用到的是
A. B. C. D.
二、非选择题
9.已知:CuI是难溶于水的白色固体。氧化性Cu2+>I2>Cu+,还原性Cu>I->Cu+。请回答:
(1)根据物质氧化性、还原性的强弱推测,在溶液中Cu2+和I-反应离子方程式是_____________。
(2)久置于空气中的HI溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,反应的化学方程式为__________________________;欲消除HI溶液的黄色,也可向其中通入少量H2S,这是因为当浓度接近时,还原性H2S____________(填“>”“<”或“=”)I-。
(3)CuI用于监测空气中汞蒸气:4CuI(白色)+Hg=Cu2HgI4(亮黄色)+2Cu。Cu2HgI4是___________。
A.氧化产物
B.还原产物
C.既是氧化产物又是还原产物
D.既不是筑化产物也不是还原产物
(4)间接碘量法用于测定溶液中Cu2+含量,即向含Cu2+的溶液中加入足量KI溶液和几滴指示剂X,再用Na2S2O3标准溶液滴定,达到滴定终点的现象是___________(已知:I2+2S2O32-=2I-+S4O62- )。
10.根据要求填空:
(1)已知以下键能数据:
共价键 C-H C-C C=C C-Br Br-Br
键能(kJ/mol) a b c d e
对于反应C2H4(g)+Br2(g)C2H4Br2(g) △H=-x kJ/mol,下列说法确的是_______
A.c<2b
B.x=c+e-b-2d
C.对于该反应来说,当C2H4(g)与Br2(g)反应时,每断裂1 molπ键放出xkJ热量
(2)已知电离常数:Ka(HCN)=5×10-10,H2CO3:Ka1=4.3×107,Ka2=5.6×10-11。若向KCN溶液中通入少量CO2气体发生反应的离子方程式为______________。
(3)某温度下,纯水的pH=6。将pH=11的NaOH溶液与pH=1的H2SO4溶液等体积混合,所得溶液的pH=___ (忽略体积变化,已知lg2=0.3,lg5=0.7)。
【参考答案】
一、选择题
1.A
解析:A.易与溶液反应而苯与氢氧化钠不互溶,所以该装置可除去溴得到苯,A正确;
B.容量瓶不能用于溶解固体或稀释浓溶液,溶解固体或稀释浓溶液时应在烧杯中进行,B错误;
C.启普发生器适用于固液不加热制气体的反应且反应物为块状或颗粒状固体,反应物固体呈粉末状或反应剧烈时均不可用此装置;过氧化钠是粉末,故不能用此装置,C错误;
D.溶液应用碱式滴定管盛装,而图中是酸式滴定管,D错误;
故选A。
2.C
解析:A.测定中和反应的反应热时,为了防止热量散失,将NaOH溶液一次迅速倒入量热计的内筒,A正确;
B. 碱式滴定管能精确到0.01mL,氢氧化钠是碱,可用碱式滴定管量取NaOH溶液23.25mL,B正确;
C.用润湿的pH试纸测NaOH溶液的pH,会将溶液稀释,所测pH偏小,C错误;
D.量筒可精确到0.1mL,可用10mL的量筒量取8.2mLNaOH溶液,D正确;
故答案选C。
3.B
解析:A.试剂瓶的标签应朝向手心,图甲中标签易被倾倒试剂结束后瓶口残留的流下的试剂腐蚀而受损,图示的“错误操作”,与相对应选项的“可能产生后果”一致,故A不符合;
B.图乙中俯视读数偏大,图示的“错误操作”,与相对应选项的“可能产生后果”不一致,故B符合;
C.检测溶液的pH时应用玻璃棒蘸少许,再滴在pH试剂上,图丙直接将pH试纸放进待测液中,易污染待测液,图示的“错误操作”,与相对应选项的“可能产生后果”一致,故C不符合;
D.水的密度比浓硫酸的密度小,且浓硫酸溶于水放出大量热,水倒入浓硫酸中,易造成液体飞溅,图示的“错误操作”,与相对应选项的“可能产生后果”一致,故D不符合;
故选B。
4.D
解析:A. 酸式滴定管用蒸馏水洗净后,没有标准溶液润洗,直接加入已知浓度的盐酸会导致V(标准)偏大,根据c(待测)=分析可知c(待测)偏大,故A错误;
B. 锥形瓶不需要润洗,可直接加入溶液,润洗会导致c(待测)偏大,故B错误;
C. 滴定前,没有逐出酸式滴定管尖嘴处的气泡,滴定终点时气泡消失,造成V(标准)偏大,根据c(待测)=分析可知c(待测)偏大,故C错误;
D. 滴定时,眼睛注视锥形瓶内溶液颜色的变化,故D正确;
故选D。
5.D
解析:量筒小刻度在下,A与B与C刻度间相差1mL,刻度A为6,则刻度B为5,AB间每一小格为0.2mL,则量筒中液体的体积为5.2mL;滴定管大刻度在下方,D与E之间的刻度差为1mL,如果刻度D为6,则E刻度为7,DE间每一小格为0.10mL,则该酸式滴定管中液体体积的读数为6.60mL,故选D。
6.C
解析:A.滴定前用蒸馏水冲洗锥形瓶对测定结果无影响,不影响标准液的用量,不影响测定结果,A正确;
B.滴定操作时,眼睛要一直关注锥形瓶中的颜色变化,便于观察滴定终点,B正确;
C.用酚酞作指示剂,当锥形瓶中溶液由无色变粉红色时停止滴定,C错误;
D.碳酸钠溶液显碱性,酸式滴定管可以盛放盐酸,但不能盛放Na2CO3溶液,D正确;
故选C。
7.A
解析:A.维生素C可还原氯化铁,溶液由黄色变为浅绿色,可探究维生素C的还原性,故A正确;
B.银镜反应必须在碱性条件下才能进行,加入银氨溶液之前要先加入过量NaOH溶液,故B错误;
C.用计测定等浓度的溶液的,才可以判断B和C的非金属性强弱,故C错误;
D.向KBr、KI混合溶液中依次加入少量氯水和CCl4,振荡,静置,溶液分层,下层呈紫红色,说明反应产生I2,发生反应:2KI+Cl2=2KCl+I2,证明氧化性:Cl2>I2、Br2>I2,但不能比较Br2与Cl2的氧化性强弱,故D错误;
故选A。
8.A
解析:酸碱中和滴定实验中用到的仪器有带有滴定管夹的铁架台、滴定管、锥形瓶,不需要用到量筒,故选A。
二、非选择题
9.(1)2Cu2++4I-=2CuI↓+I2
(2) 2Cu+I2=2CuI >
(3)A
(4)当滴入最后一滴Na2S2O3标准溶液时,溶液恰好从蓝色变为无色,且半分钟内不改变
解析:(1)根据题意:还原性Cu>I->Cu+,碘离子对应的氧化产物是单质碘,铜离子做氧化剂时被还原为低价的亚铜离子,2Cu2++4I-=2CuI↓+I2。
(2)久置于空气中的HI溶液呈黄色,是因为其中的碘离子被氧化为碘单质的缘故,加入金属铜,金属铜可以和碘单质反应,即2Cu+I2=2CuI;碘离子的还原性比硫离子的还原性弱,所以碘单质可以和硫化氢反应生成单质硫和碘化氢。
(3)化合价升高的汞元素所在产物Cu2HgI4是氧化产物,故选A。
(4)利用淀粉作指示剂,反应结束时,碘消耗完,蓝色消失。达到滴定终点的现象是:当滴入最后一滴Na2S2O3标准溶液时,溶液恰好从蓝色变为无色,且半分钟内不改变。
10.(1)AC
(2)
(3)6
解析:(1)A.碳碳双键的键能小于碳碳单键键能的2倍,故c<2b,A正确;
B.反应的焓变等于反应物键能和减去生成物的键能和,故焓变为△H =(4a+c+e-4a-b-2d ) kJ/mol =(c+e-b-2d) kJ/mol,故x=-(c+e-b-2d),B错误;
C.单键均为σ键,双键中含有1个σ键1个π键,对于该反应来说,当C2H4(g)与Br2(g)反应时,每断裂1 molπ键,则有1mol C2H4(g)参与反应,结合B分析可知,放出xkJ热量,C正确;
故选AC;
(2)已知电离常数:Ka(HCN)=5×10-10,H2CO3:Ka1=4.3×107,Ka2=5.6×10-11;则向KCN溶液中通入少量CO2气体发生反应生成HCN和HCO,反应为;
(3)某温度下,纯水的pH=6,则Kw=10-12;pH=11的NaOH溶液中氢氧根离子浓度为0.1mol/L,pH=1的H2SO4溶液中氢离子浓度为0.1mol/L,两者等体积混合,所得溶液为中性,pH=6
一、选择题
1.下列装置能达到相应实验目的的是
A.装置Ⅰ可用于除去苯中的溴 B.装置Ⅱ可用于配制的稀硫酸
C.装置Ⅲ可用于实验室制备少量氧气 D.装置Ⅳ可用于滴定盐酸
2.下列有关实验操作的说法不正确的是
A.测定中和反应反应热时,将NaOH溶液一次迅速倒入量热计的内筒
B.用碱式滴定管量取NaOH溶液23.25mL
C.用润湿的pH试纸测NaOH溶液的pH
D.用10mL的量筒量取8.2mLNaOH溶液
3.实验基本操作是学习化学的灵魂。下列图示的“错误操作”,与相对应选项的“可能产生后果”不一致的是
A.图甲标签受损 B.图乙读数偏小
C.图丙污染待测液 D.图丁液体飞溅
4.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作正确的是( )
A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
B.锥形瓶用蒸馏水洗净后,润洗后加入一定体积的未知浓度的NaOH溶液
C.滴定时,没有逐出滴定管下口的气泡
D.滴定时,眼睛注视锥形瓶内溶液颜色的变化
5.如图,图Ⅰ表示10mL量筒中液面位置,A与B,B与C之间刻度相差1mL,图Ⅱ表示50ml滴定管中液面位置,D与E之间相差1mL,若A、D刻度均为6,则两容器液面读数分别为( )
A.图Ⅰ5.20mL 图Ⅱ6.6mL B.图Ⅰ5.20mL 图Ⅱ5.4mL
C.图Ⅰ5.2mL 图Ⅱ5.40mL D.图Ⅰ5.2mL 图Ⅱ6.60mL
6.准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol L-1NaOH溶液滴定,下列说法不正确的是
A.滴定前用蒸馏水冲洗锥形瓶对测定结果无影响
B.滴定操作时,眼睛要一直关注锥形瓶中的颜色变化
C.用酚酞作指示剂,当锥形瓶中溶液由粉红色变无色时停止滴定
D.酸式滴定管可以盛放盐酸,但不能盛放Na2CO3溶液
7.根据实验目的,下列实验设计、现象及结论都正确的是
选项 实验目的 实验设计及现象 结论
A 探究维生素C的还原性 向盛有溶液的试管中滴加过量维生素C溶液,原溶液由黄色变为浅绿色 维生素C具有还原性
B 判断淀粉是否水解 向淀粉溶液中加入少量稀硫酸,加热,再加入银氨溶液,加热后未出现银镜 淀粉未水解
C 比较B和C的非金属性强弱 用计测定溶液的,溶液的更小 非金属性:
D 比较的氧化性 向含有等量混合溶液中依次加入少量新制氯水和,振荡、静置,溶液分层,下层呈紫红色 氧化性:
A.A B.B C.C D.D
8.下列玻璃仪器在酸碱中和滴定实验中不需要用到的是
A. B. C. D.
二、非选择题
9.已知:CuI是难溶于水的白色固体。氧化性Cu2+>I2>Cu+,还原性Cu>I->Cu+。请回答:
(1)根据物质氧化性、还原性的强弱推测,在溶液中Cu2+和I-反应离子方程式是_____________。
(2)久置于空气中的HI溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,反应的化学方程式为__________________________;欲消除HI溶液的黄色,也可向其中通入少量H2S,这是因为当浓度接近时,还原性H2S____________(填“>”“<”或“=”)I-。
(3)CuI用于监测空气中汞蒸气:4CuI(白色)+Hg=Cu2HgI4(亮黄色)+2Cu。Cu2HgI4是___________。
A.氧化产物
B.还原产物
C.既是氧化产物又是还原产物
D.既不是筑化产物也不是还原产物
(4)间接碘量法用于测定溶液中Cu2+含量,即向含Cu2+的溶液中加入足量KI溶液和几滴指示剂X,再用Na2S2O3标准溶液滴定,达到滴定终点的现象是___________(已知:I2+2S2O32-=2I-+S4O62- )。
10.根据要求填空:
(1)已知以下键能数据:
共价键 C-H C-C C=C C-Br Br-Br
键能(kJ/mol) a b c d e
对于反应C2H4(g)+Br2(g)C2H4Br2(g) △H=-x kJ/mol,下列说法确的是_______
A.c<2b
B.x=c+e-b-2d
C.对于该反应来说,当C2H4(g)与Br2(g)反应时,每断裂1 molπ键放出xkJ热量
(2)已知电离常数:Ka(HCN)=5×10-10,H2CO3:Ka1=4.3×107,Ka2=5.6×10-11。若向KCN溶液中通入少量CO2气体发生反应的离子方程式为______________。
(3)某温度下,纯水的pH=6。将pH=11的NaOH溶液与pH=1的H2SO4溶液等体积混合,所得溶液的pH=___ (忽略体积变化,已知lg2=0.3,lg5=0.7)。
【参考答案】
一、选择题
1.A
解析:A.易与溶液反应而苯与氢氧化钠不互溶,所以该装置可除去溴得到苯,A正确;
B.容量瓶不能用于溶解固体或稀释浓溶液,溶解固体或稀释浓溶液时应在烧杯中进行,B错误;
C.启普发生器适用于固液不加热制气体的反应且反应物为块状或颗粒状固体,反应物固体呈粉末状或反应剧烈时均不可用此装置;过氧化钠是粉末,故不能用此装置,C错误;
D.溶液应用碱式滴定管盛装,而图中是酸式滴定管,D错误;
故选A。
2.C
解析:A.测定中和反应的反应热时,为了防止热量散失,将NaOH溶液一次迅速倒入量热计的内筒,A正确;
B. 碱式滴定管能精确到0.01mL,氢氧化钠是碱,可用碱式滴定管量取NaOH溶液23.25mL,B正确;
C.用润湿的pH试纸测NaOH溶液的pH,会将溶液稀释,所测pH偏小,C错误;
D.量筒可精确到0.1mL,可用10mL的量筒量取8.2mLNaOH溶液,D正确;
故答案选C。
3.B
解析:A.试剂瓶的标签应朝向手心,图甲中标签易被倾倒试剂结束后瓶口残留的流下的试剂腐蚀而受损,图示的“错误操作”,与相对应选项的“可能产生后果”一致,故A不符合;
B.图乙中俯视读数偏大,图示的“错误操作”,与相对应选项的“可能产生后果”不一致,故B符合;
C.检测溶液的pH时应用玻璃棒蘸少许,再滴在pH试剂上,图丙直接将pH试纸放进待测液中,易污染待测液,图示的“错误操作”,与相对应选项的“可能产生后果”一致,故C不符合;
D.水的密度比浓硫酸的密度小,且浓硫酸溶于水放出大量热,水倒入浓硫酸中,易造成液体飞溅,图示的“错误操作”,与相对应选项的“可能产生后果”一致,故D不符合;
故选B。
4.D
解析:A. 酸式滴定管用蒸馏水洗净后,没有标准溶液润洗,直接加入已知浓度的盐酸会导致V(标准)偏大,根据c(待测)=分析可知c(待测)偏大,故A错误;
B. 锥形瓶不需要润洗,可直接加入溶液,润洗会导致c(待测)偏大,故B错误;
C. 滴定前,没有逐出酸式滴定管尖嘴处的气泡,滴定终点时气泡消失,造成V(标准)偏大,根据c(待测)=分析可知c(待测)偏大,故C错误;
D. 滴定时,眼睛注视锥形瓶内溶液颜色的变化,故D正确;
故选D。
5.D
解析:量筒小刻度在下,A与B与C刻度间相差1mL,刻度A为6,则刻度B为5,AB间每一小格为0.2mL,则量筒中液体的体积为5.2mL;滴定管大刻度在下方,D与E之间的刻度差为1mL,如果刻度D为6,则E刻度为7,DE间每一小格为0.10mL,则该酸式滴定管中液体体积的读数为6.60mL,故选D。
6.C
解析:A.滴定前用蒸馏水冲洗锥形瓶对测定结果无影响,不影响标准液的用量,不影响测定结果,A正确;
B.滴定操作时,眼睛要一直关注锥形瓶中的颜色变化,便于观察滴定终点,B正确;
C.用酚酞作指示剂,当锥形瓶中溶液由无色变粉红色时停止滴定,C错误;
D.碳酸钠溶液显碱性,酸式滴定管可以盛放盐酸,但不能盛放Na2CO3溶液,D正确;
故选C。
7.A
解析:A.维生素C可还原氯化铁,溶液由黄色变为浅绿色,可探究维生素C的还原性,故A正确;
B.银镜反应必须在碱性条件下才能进行,加入银氨溶液之前要先加入过量NaOH溶液,故B错误;
C.用计测定等浓度的溶液的,才可以判断B和C的非金属性强弱,故C错误;
D.向KBr、KI混合溶液中依次加入少量氯水和CCl4,振荡,静置,溶液分层,下层呈紫红色,说明反应产生I2,发生反应:2KI+Cl2=2KCl+I2,证明氧化性:Cl2>I2、Br2>I2,但不能比较Br2与Cl2的氧化性强弱,故D错误;
故选A。
8.A
解析:酸碱中和滴定实验中用到的仪器有带有滴定管夹的铁架台、滴定管、锥形瓶,不需要用到量筒,故选A。
二、非选择题
9.(1)2Cu2++4I-=2CuI↓+I2
(2) 2Cu+I2=2CuI >
(3)A
(4)当滴入最后一滴Na2S2O3标准溶液时,溶液恰好从蓝色变为无色,且半分钟内不改变
解析:(1)根据题意:还原性Cu>I->Cu+,碘离子对应的氧化产物是单质碘,铜离子做氧化剂时被还原为低价的亚铜离子,2Cu2++4I-=2CuI↓+I2。
(2)久置于空气中的HI溶液呈黄色,是因为其中的碘离子被氧化为碘单质的缘故,加入金属铜,金属铜可以和碘单质反应,即2Cu+I2=2CuI;碘离子的还原性比硫离子的还原性弱,所以碘单质可以和硫化氢反应生成单质硫和碘化氢。
(3)化合价升高的汞元素所在产物Cu2HgI4是氧化产物,故选A。
(4)利用淀粉作指示剂,反应结束时,碘消耗完,蓝色消失。达到滴定终点的现象是:当滴入最后一滴Na2S2O3标准溶液时,溶液恰好从蓝色变为无色,且半分钟内不改变。
10.(1)AC
(2)
(3)6
解析:(1)A.碳碳双键的键能小于碳碳单键键能的2倍,故c<2b,A正确;
B.反应的焓变等于反应物键能和减去生成物的键能和,故焓变为△H =(4a+c+e-4a-b-2d ) kJ/mol =(c+e-b-2d) kJ/mol,故x=-(c+e-b-2d),B错误;
C.单键均为σ键,双键中含有1个σ键1个π键,对于该反应来说,当C2H4(g)与Br2(g)反应时,每断裂1 molπ键,则有1mol C2H4(g)参与反应,结合B分析可知,放出xkJ热量,C正确;
故选AC;
(2)已知电离常数:Ka(HCN)=5×10-10,H2CO3:Ka1=4.3×107,Ka2=5.6×10-11;则向KCN溶液中通入少量CO2气体发生反应生成HCN和HCO,反应为;
(3)某温度下,纯水的pH=6,则Kw=10-12;pH=11的NaOH溶液中氢氧根离子浓度为0.1mol/L,pH=1的H2SO4溶液中氢离子浓度为0.1mol/L,两者等体积混合,所得溶液为中性,pH=6
