4.2 元素周期律 (含解析)同步练习题 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.2 元素周期律 (含解析)同步练习题 2023-2024学年高一上学期化学人教版(2019)必修第一册 | 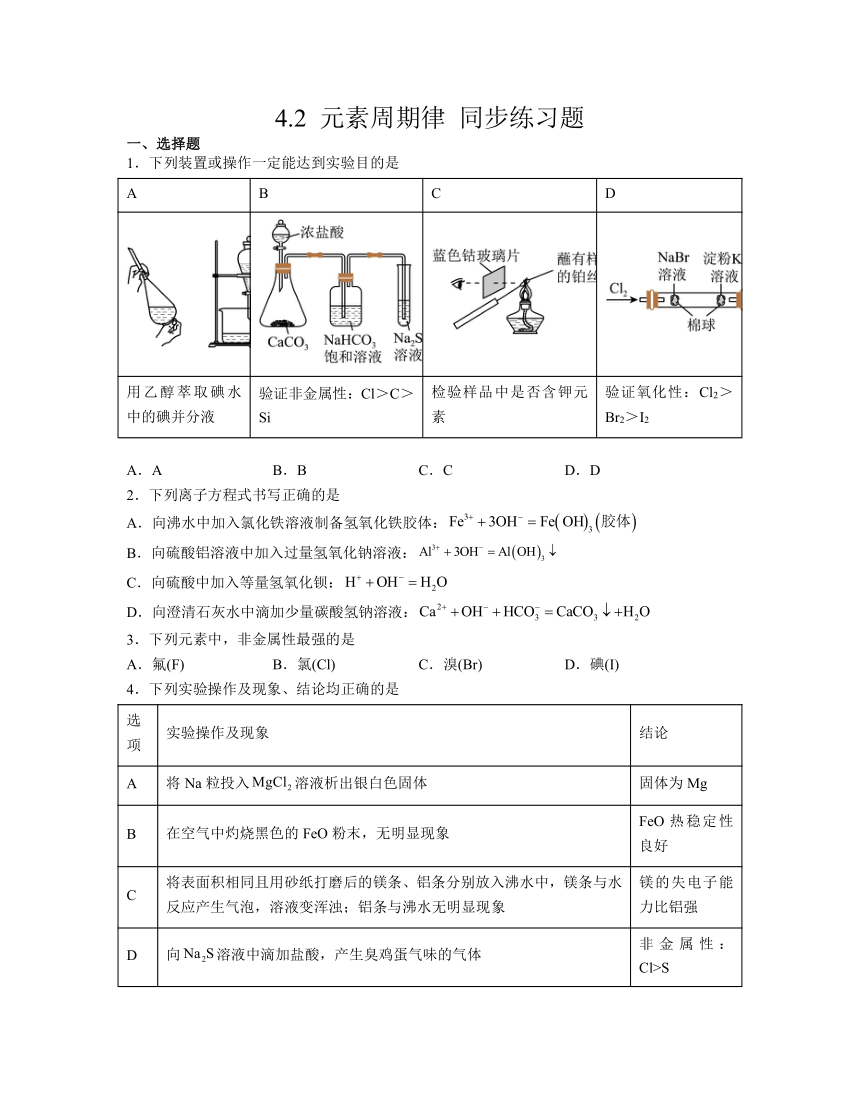 | |
| 格式 | docx | ||
| 文件大小 | 247.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-25 15:08:44 | ||
图片预览




文档简介
4.2 元素周期律 同步练习题
一、选择题
1.下列装置或操作一定能达到实验目的是
A B C D
用乙醇萃取碘水中的碘并分液 验证非金属性:Cl>C>Si 检验样品中是否含钾元素 验证氧化性:Cl2>Br2>I2
A.A B.B C.C D.D
2.下列离子方程式书写正确的是
A.向沸水中加入氯化铁溶液制备氢氧化铁胶体:
B.向硫酸铝溶液中加入过量氢氧化钠溶液:
C.向硫酸中加入等量氢氧化钡:
D.向澄清石灰水中滴加少量碳酸氢钠溶液:
3.下列元素中,非金属性最强的是
A.氟(F) B.氯(Cl) C.溴(Br) D.碘(I)
4.下列实验操作及现象、结论均正确的是
选项 实验操作及现象 结论
A 将Na粒投入溶液析出银白色固体 固体为Mg
B 在空气中灼烧黑色的FeO粉末,无明显现象 FeO热稳定性良好
C 将表面积相同且用砂纸打磨后的镁条、铝条分别放入沸水中,镁条与水反应产生气泡,溶液变浑浊;铝条与沸水无明显现象 镁的失电子能力比铝强
D 向溶液中滴加盐酸,产生臭鸡蛋气味的气体 非金属性:Cl>S
A.A B.B C.C D.D
5.纳米酶在医学、食品、环境等领域有广泛应用。地壳中含量第二的金属元素R可与短周期主族元素X、Y、Z组成纳米酶。其中X、Y、Z原子序数依次增大且相邻,原子核外电子数之和为31,X与Y同周期。下列判断正确的是
A.原子半径: X>Y> Z
B.简单氢化物的沸点: XC.R元素的氧化物都为黑色
D.Y、Z与R可形成既含离子键又含共价键的化合物
6.下列事实不能用元素周期律知识解释的是
A.原子半径:Li>F B.溶解度:Na2CO3>NaHCO3
C.还原性:H2S>HCl D.碱性:NaOH>Mg(OH)2
7.元素的性质呈现周期性变化的根本原因是
A.元素的相对原子质量的递增 B.元素的原子半径呈现周期性变化
C.元素原子的核外电子排布呈现周期性变化 D.元素的金属性和非金属性呈现周期性变化
8.W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍,Y是地壳中含量最多的金属元素。W和X的单质常温下均为气体。下列叙述正确的是
A.原子半径: B.非金属性:
C.W、X形成的化合物只含有极性共价键 D.Y的氧化物属于碱性氧化物
二、非选择题
9.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下: _____NaIO3+__NaHSO3→3NaHSO4+___Na2SO4+____I2+______H2O(未配平),完成下列填空:
(1)该反应实质是两步反应:①IO+3HSO→3SO+I-+3H+,则第二步反应的离子方程式为② ;若要使碘酸钠的利用率最高,碘酸钠在第一步和第二步反应中的用量之比是 。
(2)过滤反应析出的碘沉淀得到粗碘,再用升华法即可得到99%左右的碘产品,碘升华克服的微粒间作用力为 。
(3)能说明氯、碘两种元素非金属性相对强弱的依据是___________。(选填编号)
A.原子的最外层都有7个电子
B.ICl中碘元素为+1价
C.酸性:HClO3>HIO3
D.氯化钠、碘化钠与浓硫酸共热,分别生成氯化氢、单质碘
(4)检验亚硫酸钠固体是否氧化变质的方法是 。
10.某研究性学习小组设计了一组实验,验证元素周期律。
甲同学在a、b、c、d四只烧杯里分别加入50mL冷水,再分别滴加几滴酚酞溶液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)甲同学设计实验的目的是验证:同一主族,从上到下元素的元素金属性逐渐增强;同一周期,从左到右,元素金属性 ;
(2)反应最剧烈的烧杯里金属是_____ (填字母)
A.钠 B.镁 C.铝 D.钾;
(3)写出a烧杯里发生反应的离子方程式 。
(4)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验的目的,请你帮助选择下列合适的方法 。
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液
(5)写出铝和盐酸反应的化学方程式 。
11.A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20,其中A为非金属元素,C是金属元素;A、C元素原子的最外层都只有一个电子;B和D元素原子的最外层电子数相同,且B元素原子L层电子数是K层电子数的3倍,E元素原子最外层电子数比次外层电子数少1。
回答下列问题:
(1)写出五种元素的元素符号:
A ,B ,C ,D ,E 。
(2)画出B、C的原子结构示意图:B ,C 。画出D的简单离子结构示意图: 。
(3)从原子核外电子排布的角度分析C元素的化合价为什么为+1价? 。
12.某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学用以下实验探究Mg、Al的金属性强弱。
(1)请填写完整实验操作和实验结论:
实验目的 比较Mg、Al金属性强弱
实验试剂 热水、酚酞
实验操作 将打磨好的镁片和铝片
实验现象 Mg片表面逐渐产生气泡,溶液变为浅红色,铝片的表面和溶液无明显变化
实验结论 金属性:
Ⅱ.乙同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图的装置来一次性完成元素Cl、C、Si非金属性强弱比较的实验研究。
可选用的实验药品有:1.0 HCl、1.0 (挥发性强酸)、碳酸钙(固体)、1.0 溶液。
打开A处的活塞后,可看到有大量气泡产生,烧杯中可观察到有白色沉淀生成。
(2)图中B的仪器名称为 ,A中所装的试剂为 (只填化学式)。
(3)B中发生反应的离子方程式为 。
(4)乙同学认为甲同学设计的实验不够严谨,应在B和C之间增加一个装置,该装置中所盛试剂为 溶液。
【参考答案】
一、选择题
1.C
解析:A.乙醇与水混溶,不能作萃取剂,A错误;
B.浓盐酸具有挥发性,挥发的HCl溶于Na2SiO3溶液,会发生反应:2HCl+Na2SiO3=2NaCl+H2SiO3↓,因此不能证明元素的非金属性:Cl>C>Si,B错误;
C.若样品中含钾元素,当用酒精灯火焰灼烧,并透过蓝色钴玻璃观察时,会看到火焰显紫色,否则不显紫色,因此可用透过焰色试验检验样品中是否含钾元素,C正确;
D.Cl2与NaBr发生反应:Cl2+2NaBr=2NaCl+Br2;未反应的Cl2也会与KI发生反应:Cl2+2KI=2KCl+I2,I2遇淀粉溶液变为蓝色,因此不能证明氧化性:Cl2>Br2>I2,D错误;
故合理选项是C。
2.D
解析:A.水是弱电解质,不能拆写成离子,正确的是Fe3++3H2O=Fe(OH)3(胶体)+3H+,故A错误;
B.氢氧化铝为两性氢氧化物,能与过量的氢氧化钠反应生成偏铝酸钠,正确的离子方程式为Al3++4OH-=AlO+2H2O,故B错误;
C.缺少Ba2+与SO反应,正确的是Ba2++2OH-+2H++SO=BaSO4↓+2H2O,故C错误;
D.滴加少量碳酸氢钠,1个HCO只能与1个OH-反应,因此离子方程式为Ca2++OH-+ HCO=CaCO3↓+H2O,故D正确;
答案为D。
3.A
解析:氟氯溴碘四种元素在元素周期表中属于同主族,最外层电子数相同,原子电子层数不同,随着电子层数的增加,原子核对最外层电子的吸引力逐渐减弱,得电子能力逐渐减弱,非金属性逐渐减弱,所以氟氯溴碘中非金属性最强的是氟,故答案为:A
4.C
解析:A.钠和水反应生成氢氧化钠,氢氧化钠和氯化镁生成氢氧化镁白色沉淀,A错误;
B.在空气中灼烧黑色的FeO粉末,黑色氧化亚铁被空气中氧气氧化为四氧化三铁,B错误;
C.镁条与水反应产生气泡,溶液变浑浊;铝条与沸水无明显现象,说明镁失去电子形成镁离子、而铝不反应,则镁的失电子能力比铝强,C正确;
D.向溶液中滴加盐酸,产生臭鸡蛋气味的气体为硫化氢气体,但是HCl、H2S均不是最高价氧化物的水合物,不能体现其非金属性强弱,D错误;
故选C。
5.D
【分析】地壳中元素含量排名为O、Si、Al、Fe、Ca,含量第二的金属元素为Fe,所以R为Fe元素;X、Y、Z原子序数依次增大且相邻,X与Y同周期,所以X、Y为第二周期元素,Z为第三周期元素,设X的原子序数为a,则Y的原子序数为a+1,Z的原子序数为a+8或a+9,因为三种元素核外电子数之和为31,则有a+a+1+a+8=31或a+a+1+a+9=31,解得a=(舍)或a=7,所以X为N元素、Y为O元素、Z为S元素;
解析:A.X、Y、Z原子序数依次增大且相邻,X与Y同周期,所以X、Y为第二周期元素,Z为第三周期元素,同周期原子半径从左到右依次递减,第三周期元素原子半径大于第二周期,所以原子半径:Z>X>Y,故A错误;
B.X为N元素、Y为O元素、Z为S元素;因为N、O形成的氢化物能形成氢键,S不能,所以简单氢化物的沸点: Z< XC.R为Fe元素,其氧化物中除了为红色外,其余均为黑色,故C错误;
D.Y为O元素、Z为S元素、R为Fe元素,能形成等,中既含离子键,也含共价键,故D正确;
故选D。
6.B
解析:A.同周期从左向右原子半径逐渐减小,则原子半径:Li>F,可用元素周期律知识解释,故A不选;
B.碳酸钠和碳酸氢钠的溶解度不能用元素周期律解释,故B选;
C.同周期自左向右非金属性逐渐增强,非金属性越强,简单氢化物的还原性越弱,则还原性:H2S>HCl,能用元素周期律知识解释,故C不选;
D.同周期从左向右金属性减弱,金属性越强,对应碱的碱性越强,则碱性:NaOH>Mg(OH)2,可用元素周期律知识解释,故D不选;
故选:B。
7.C
解析:元素的性质呈周期性变化是元素原子的最外层电子排布呈周期性变化的必然结果;
答案选C。
8.B
【分析】Y为地壳中含量最多的金属元素,则Y为Al。Z的最外层电子数为Y的最外层的2倍,则Z的最外层电子数为6,Z为S。Z的最外层电子数为W和X的最外层电子数之和,同时W和X的单质常温下为气体,则W为H而X为N。由此推出W、X、Y、Z分别为H、N、Al、S。
解析:A.原子半径大小判断:电子层多半径大;若电子层相同,则核电荷数大半径小,原子半径:Al > S >N,A错误;
B.对于主族元素同周期自左向右依次增强,同周期自下而上依次增强,所以非金属性为N>H>Al,B正确;
C.W与X形成的化合物有NH3和N2H4,N2H4中存在N-N非极性键和N-H的极性键,C错误;
D.Y的氧化物为Al2O3为两性氧化物,D错误;
故选B。
二、非选择题
9.(1) IO+5I-+6H+→3I2+3H2O 5:1
(2)分子间作用力(范德华力)
(3)BD
(4)取样溶于水,加入过量盐酸后,再加氯化钡,产生白色沉淀则已变质,若无白色沉淀生成,则未变质
解析:(1)第二步反应有碘单质生成,第(1)问总反应的离子方程式为:②2+5→3H++5+I2+H2O,则根据第一步反应①+3→3+I-+3H+可看出已经被氧化为,第二步不需要,则②3-①5消去得到第二步离子方程式为:+5I-+6H+→3I2+3H2O;从第二步可看出,最终要得到3mol I2,其中第一步提供5mol 转化为第二步所需的I-,因此若要使碘酸钠的利用率最高,完全反应完,即碘酸钠在第一步和第二步反应中的用量之比是5:1,故答案为:+5I-+6H+→3I2+3H2O;5:1;
(2)碘升华为物理变化,没有化学键的断裂,因此克服的微粒间作用力为分子间作用力,故答案为:分子间作用力(范德华力);
(3)a.原子的最外层电子数目不能决定元素的非金属性强弱,故a错误;
b.ICl中碘元素为+1价,说明Cl更易容易得到电子,非金属性更强,故b正确;
c.酸性:HClO3>HIO3,不是最高价氧化物对应水化物的酸性,所以无法判断非金属性,故c错误;
d.氯化钠与浓硫酸共热制备氯化氢,利用的是高沸点酸制备低沸点酸的原理,氯化碘与浓硫酸共热可制备碘单质,这说明碘离子更易被氧化,其还原性比氯离子的更强,所以氯气的氧化性强于碘单质的氧化性,即可说明氯、碘两种元素非金属性得相对强弱,故d正确;故答案为:bd;
(4)亚硫酸钠固体容易被空气氧化为硫酸钠,若检验是否变质,主要检验溶于水后是否存在硫酸根离子,其方法如下:取样溶于水,加入过量盐酸后,再加氯化钡,产生白色沉淀则已变质,若无白色沉淀生成,则未变质。
10.(1)逐渐减弱
(2)D
(3)2Na+2H2O=2Na++2OH-+H2↑
(4)BC
(5)2Al+6H+=2Al3++3H2↑
解析:(1)同一周期,从左到右,原子失电子能力减弱,则元素金属性逐渐减弱;故答案为:逐渐减弱;
(2)金属性K>Na>Mg>Al,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是D,故答案为:D;
(3)钠与水反应生成氢氧化钠和氢气,则钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(4)反应现象不明显,说明反应速率小,升高温度可以加快速率,所以把冷水换为热水,把水换为盐酸增大了溶液中氢离子的浓度,可以加快速率;故答案为:BC;
(5)铝与盐酸反应生成氯化铝和氢气,其反应的离子方程式为:2Al+6H+=2Al3++3H2↑;故答案为:2Al+6H+=2Al3++3H2↑。
11.(1) H O Na S Cl
(2)
(3)钠元素原子的最外层只有1个电子,易失去而形成最外层为8个电子的稳定结构,故Na表现为+1价
【分析】A为非金属元素,C是金属元素;A、C元素原子的最外层都只有一个电子,可知A、C处于同一主族,A为氢元素;B元素原子L层电子数是K层电子数的3倍,可知B是氧元素,得到D硫元素,则C是钠元素;E元素原子最外层电子数比次外层电子数少1,为氯元素,所以A、B、C、D、E分别为:H、O、Na、S、Cl。
解析:(1)由分析知分别为: H、O、Na、S、Cl,故为: H、O、Na、S、Cl;
(2)B的原子结构示意图; C的原子结构示意图;D的简单离子结构示意图:,故为: ;;;
(3)钠元素原子的最外层只有1个电子,易失去而形成最外层为8个电子的稳定结构,故Na表现为+1价。
12.(1)放入热水中 镁大于铝
(2)圆底烧瓶
(3)
(4)饱和碳酸氢钠
【分析】非金属性越强,最高价氧化物对应水化物的酸性越强;高氯酸和碳酸钙反应生成二氧化碳,二氧化碳和硅酸钠生成硅酸沉淀,可以说明酸性高氯酸大于碳酸大于硅酸;
解析:(1)越活泼的金属越容易置换出水中的氢;根据题意可知,将打磨好的镁片和铝片放入热水中,观察到Mg片表面逐渐产生气泡,溶液变为浅红色,铝片的表面和溶液无明显变化,说明镁和热水反应生成氢气和氢氧化镁,而铝不反应,则金属性镁大于铝;
(2)图中B的仪器名称为圆底烧瓶,A中所装的试剂为高氯酸;
(3)B中发生反应高氯酸和碳酸钙反应生成二氧化碳,离子方程式为;
(4)为挥发性强酸,挥发出的高氯酸会和硅酸钠反应生成硅酸沉淀,故应在B和C之间增加一个盛有饱和碳酸氢钠溶液的装置,除去挥发的高氯酸
一、选择题
1.下列装置或操作一定能达到实验目的是
A B C D
用乙醇萃取碘水中的碘并分液 验证非金属性:Cl>C>Si 检验样品中是否含钾元素 验证氧化性:Cl2>Br2>I2
A.A B.B C.C D.D
2.下列离子方程式书写正确的是
A.向沸水中加入氯化铁溶液制备氢氧化铁胶体:
B.向硫酸铝溶液中加入过量氢氧化钠溶液:
C.向硫酸中加入等量氢氧化钡:
D.向澄清石灰水中滴加少量碳酸氢钠溶液:
3.下列元素中,非金属性最强的是
A.氟(F) B.氯(Cl) C.溴(Br) D.碘(I)
4.下列实验操作及现象、结论均正确的是
选项 实验操作及现象 结论
A 将Na粒投入溶液析出银白色固体 固体为Mg
B 在空气中灼烧黑色的FeO粉末,无明显现象 FeO热稳定性良好
C 将表面积相同且用砂纸打磨后的镁条、铝条分别放入沸水中,镁条与水反应产生气泡,溶液变浑浊;铝条与沸水无明显现象 镁的失电子能力比铝强
D 向溶液中滴加盐酸,产生臭鸡蛋气味的气体 非金属性:Cl>S
A.A B.B C.C D.D
5.纳米酶在医学、食品、环境等领域有广泛应用。地壳中含量第二的金属元素R可与短周期主族元素X、Y、Z组成纳米酶。其中X、Y、Z原子序数依次增大且相邻,原子核外电子数之和为31,X与Y同周期。下列判断正确的是
A.原子半径: X>Y> Z
B.简单氢化物的沸点: X
D.Y、Z与R可形成既含离子键又含共价键的化合物
6.下列事实不能用元素周期律知识解释的是
A.原子半径:Li>F B.溶解度:Na2CO3>NaHCO3
C.还原性:H2S>HCl D.碱性:NaOH>Mg(OH)2
7.元素的性质呈现周期性变化的根本原因是
A.元素的相对原子质量的递增 B.元素的原子半径呈现周期性变化
C.元素原子的核外电子排布呈现周期性变化 D.元素的金属性和非金属性呈现周期性变化
8.W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍,Y是地壳中含量最多的金属元素。W和X的单质常温下均为气体。下列叙述正确的是
A.原子半径: B.非金属性:
C.W、X形成的化合物只含有极性共价键 D.Y的氧化物属于碱性氧化物
二、非选择题
9.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下: _____NaIO3+__NaHSO3→3NaHSO4+___Na2SO4+____I2+______H2O(未配平),完成下列填空:
(1)该反应实质是两步反应:①IO+3HSO→3SO+I-+3H+,则第二步反应的离子方程式为② ;若要使碘酸钠的利用率最高,碘酸钠在第一步和第二步反应中的用量之比是 。
(2)过滤反应析出的碘沉淀得到粗碘,再用升华法即可得到99%左右的碘产品,碘升华克服的微粒间作用力为 。
(3)能说明氯、碘两种元素非金属性相对强弱的依据是___________。(选填编号)
A.原子的最外层都有7个电子
B.ICl中碘元素为+1价
C.酸性:HClO3>HIO3
D.氯化钠、碘化钠与浓硫酸共热,分别生成氯化氢、单质碘
(4)检验亚硫酸钠固体是否氧化变质的方法是 。
10.某研究性学习小组设计了一组实验,验证元素周期律。
甲同学在a、b、c、d四只烧杯里分别加入50mL冷水,再分别滴加几滴酚酞溶液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)甲同学设计实验的目的是验证:同一主族,从上到下元素的元素金属性逐渐增强;同一周期,从左到右,元素金属性 ;
(2)反应最剧烈的烧杯里金属是_____ (填字母)
A.钠 B.镁 C.铝 D.钾;
(3)写出a烧杯里发生反应的离子方程式 。
(4)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验的目的,请你帮助选择下列合适的方法 。
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液
(5)写出铝和盐酸反应的化学方程式 。
11.A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20,其中A为非金属元素,C是金属元素;A、C元素原子的最外层都只有一个电子;B和D元素原子的最外层电子数相同,且B元素原子L层电子数是K层电子数的3倍,E元素原子最外层电子数比次外层电子数少1。
回答下列问题:
(1)写出五种元素的元素符号:
A ,B ,C ,D ,E 。
(2)画出B、C的原子结构示意图:B ,C 。画出D的简单离子结构示意图: 。
(3)从原子核外电子排布的角度分析C元素的化合价为什么为+1价? 。
12.某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学用以下实验探究Mg、Al的金属性强弱。
(1)请填写完整实验操作和实验结论:
实验目的 比较Mg、Al金属性强弱
实验试剂 热水、酚酞
实验操作 将打磨好的镁片和铝片
实验现象 Mg片表面逐渐产生气泡,溶液变为浅红色,铝片的表面和溶液无明显变化
实验结论 金属性:
Ⅱ.乙同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图的装置来一次性完成元素Cl、C、Si非金属性强弱比较的实验研究。
可选用的实验药品有:1.0 HCl、1.0 (挥发性强酸)、碳酸钙(固体)、1.0 溶液。
打开A处的活塞后,可看到有大量气泡产生,烧杯中可观察到有白色沉淀生成。
(2)图中B的仪器名称为 ,A中所装的试剂为 (只填化学式)。
(3)B中发生反应的离子方程式为 。
(4)乙同学认为甲同学设计的实验不够严谨,应在B和C之间增加一个装置,该装置中所盛试剂为 溶液。
【参考答案】
一、选择题
1.C
解析:A.乙醇与水混溶,不能作萃取剂,A错误;
B.浓盐酸具有挥发性,挥发的HCl溶于Na2SiO3溶液,会发生反应:2HCl+Na2SiO3=2NaCl+H2SiO3↓,因此不能证明元素的非金属性:Cl>C>Si,B错误;
C.若样品中含钾元素,当用酒精灯火焰灼烧,并透过蓝色钴玻璃观察时,会看到火焰显紫色,否则不显紫色,因此可用透过焰色试验检验样品中是否含钾元素,C正确;
D.Cl2与NaBr发生反应:Cl2+2NaBr=2NaCl+Br2;未反应的Cl2也会与KI发生反应:Cl2+2KI=2KCl+I2,I2遇淀粉溶液变为蓝色,因此不能证明氧化性:Cl2>Br2>I2,D错误;
故合理选项是C。
2.D
解析:A.水是弱电解质,不能拆写成离子,正确的是Fe3++3H2O=Fe(OH)3(胶体)+3H+,故A错误;
B.氢氧化铝为两性氢氧化物,能与过量的氢氧化钠反应生成偏铝酸钠,正确的离子方程式为Al3++4OH-=AlO+2H2O,故B错误;
C.缺少Ba2+与SO反应,正确的是Ba2++2OH-+2H++SO=BaSO4↓+2H2O,故C错误;
D.滴加少量碳酸氢钠,1个HCO只能与1个OH-反应,因此离子方程式为Ca2++OH-+ HCO=CaCO3↓+H2O,故D正确;
答案为D。
3.A
解析:氟氯溴碘四种元素在元素周期表中属于同主族,最外层电子数相同,原子电子层数不同,随着电子层数的增加,原子核对最外层电子的吸引力逐渐减弱,得电子能力逐渐减弱,非金属性逐渐减弱,所以氟氯溴碘中非金属性最强的是氟,故答案为:A
4.C
解析:A.钠和水反应生成氢氧化钠,氢氧化钠和氯化镁生成氢氧化镁白色沉淀,A错误;
B.在空气中灼烧黑色的FeO粉末,黑色氧化亚铁被空气中氧气氧化为四氧化三铁,B错误;
C.镁条与水反应产生气泡,溶液变浑浊;铝条与沸水无明显现象,说明镁失去电子形成镁离子、而铝不反应,则镁的失电子能力比铝强,C正确;
D.向溶液中滴加盐酸,产生臭鸡蛋气味的气体为硫化氢气体,但是HCl、H2S均不是最高价氧化物的水合物,不能体现其非金属性强弱,D错误;
故选C。
5.D
【分析】地壳中元素含量排名为O、Si、Al、Fe、Ca,含量第二的金属元素为Fe,所以R为Fe元素;X、Y、Z原子序数依次增大且相邻,X与Y同周期,所以X、Y为第二周期元素,Z为第三周期元素,设X的原子序数为a,则Y的原子序数为a+1,Z的原子序数为a+8或a+9,因为三种元素核外电子数之和为31,则有a+a+1+a+8=31或a+a+1+a+9=31,解得a=(舍)或a=7,所以X为N元素、Y为O元素、Z为S元素;
解析:A.X、Y、Z原子序数依次增大且相邻,X与Y同周期,所以X、Y为第二周期元素,Z为第三周期元素,同周期原子半径从左到右依次递减,第三周期元素原子半径大于第二周期,所以原子半径:Z>X>Y,故A错误;
B.X为N元素、Y为O元素、Z为S元素;因为N、O形成的氢化物能形成氢键,S不能,所以简单氢化物的沸点: Z< X
D.Y为O元素、Z为S元素、R为Fe元素,能形成等,中既含离子键,也含共价键,故D正确;
故选D。
6.B
解析:A.同周期从左向右原子半径逐渐减小,则原子半径:Li>F,可用元素周期律知识解释,故A不选;
B.碳酸钠和碳酸氢钠的溶解度不能用元素周期律解释,故B选;
C.同周期自左向右非金属性逐渐增强,非金属性越强,简单氢化物的还原性越弱,则还原性:H2S>HCl,能用元素周期律知识解释,故C不选;
D.同周期从左向右金属性减弱,金属性越强,对应碱的碱性越强,则碱性:NaOH>Mg(OH)2,可用元素周期律知识解释,故D不选;
故选:B。
7.C
解析:元素的性质呈周期性变化是元素原子的最外层电子排布呈周期性变化的必然结果;
答案选C。
8.B
【分析】Y为地壳中含量最多的金属元素,则Y为Al。Z的最外层电子数为Y的最外层的2倍,则Z的最外层电子数为6,Z为S。Z的最外层电子数为W和X的最外层电子数之和,同时W和X的单质常温下为气体,则W为H而X为N。由此推出W、X、Y、Z分别为H、N、Al、S。
解析:A.原子半径大小判断:电子层多半径大;若电子层相同,则核电荷数大半径小,原子半径:Al > S >N,A错误;
B.对于主族元素同周期自左向右依次增强,同周期自下而上依次增强,所以非金属性为N>H>Al,B正确;
C.W与X形成的化合物有NH3和N2H4,N2H4中存在N-N非极性键和N-H的极性键,C错误;
D.Y的氧化物为Al2O3为两性氧化物,D错误;
故选B。
二、非选择题
9.(1) IO+5I-+6H+→3I2+3H2O 5:1
(2)分子间作用力(范德华力)
(3)BD
(4)取样溶于水,加入过量盐酸后,再加氯化钡,产生白色沉淀则已变质,若无白色沉淀生成,则未变质
解析:(1)第二步反应有碘单质生成,第(1)问总反应的离子方程式为:②2+5→3H++5+I2+H2O,则根据第一步反应①+3→3+I-+3H+可看出已经被氧化为,第二步不需要,则②3-①5消去得到第二步离子方程式为:+5I-+6H+→3I2+3H2O;从第二步可看出,最终要得到3mol I2,其中第一步提供5mol 转化为第二步所需的I-,因此若要使碘酸钠的利用率最高,完全反应完,即碘酸钠在第一步和第二步反应中的用量之比是5:1,故答案为:+5I-+6H+→3I2+3H2O;5:1;
(2)碘升华为物理变化,没有化学键的断裂,因此克服的微粒间作用力为分子间作用力,故答案为:分子间作用力(范德华力);
(3)a.原子的最外层电子数目不能决定元素的非金属性强弱,故a错误;
b.ICl中碘元素为+1价,说明Cl更易容易得到电子,非金属性更强,故b正确;
c.酸性:HClO3>HIO3,不是最高价氧化物对应水化物的酸性,所以无法判断非金属性,故c错误;
d.氯化钠与浓硫酸共热制备氯化氢,利用的是高沸点酸制备低沸点酸的原理,氯化碘与浓硫酸共热可制备碘单质,这说明碘离子更易被氧化,其还原性比氯离子的更强,所以氯气的氧化性强于碘单质的氧化性,即可说明氯、碘两种元素非金属性得相对强弱,故d正确;故答案为:bd;
(4)亚硫酸钠固体容易被空气氧化为硫酸钠,若检验是否变质,主要检验溶于水后是否存在硫酸根离子,其方法如下:取样溶于水,加入过量盐酸后,再加氯化钡,产生白色沉淀则已变质,若无白色沉淀生成,则未变质。
10.(1)逐渐减弱
(2)D
(3)2Na+2H2O=2Na++2OH-+H2↑
(4)BC
(5)2Al+6H+=2Al3++3H2↑
解析:(1)同一周期,从左到右,原子失电子能力减弱,则元素金属性逐渐减弱;故答案为:逐渐减弱;
(2)金属性K>Na>Mg>Al,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是D,故答案为:D;
(3)钠与水反应生成氢氧化钠和氢气,则钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(4)反应现象不明显,说明反应速率小,升高温度可以加快速率,所以把冷水换为热水,把水换为盐酸增大了溶液中氢离子的浓度,可以加快速率;故答案为:BC;
(5)铝与盐酸反应生成氯化铝和氢气,其反应的离子方程式为:2Al+6H+=2Al3++3H2↑;故答案为:2Al+6H+=2Al3++3H2↑。
11.(1) H O Na S Cl
(2)
(3)钠元素原子的最外层只有1个电子,易失去而形成最外层为8个电子的稳定结构,故Na表现为+1价
【分析】A为非金属元素,C是金属元素;A、C元素原子的最外层都只有一个电子,可知A、C处于同一主族,A为氢元素;B元素原子L层电子数是K层电子数的3倍,可知B是氧元素,得到D硫元素,则C是钠元素;E元素原子最外层电子数比次外层电子数少1,为氯元素,所以A、B、C、D、E分别为:H、O、Na、S、Cl。
解析:(1)由分析知分别为: H、O、Na、S、Cl,故为: H、O、Na、S、Cl;
(2)B的原子结构示意图; C的原子结构示意图;D的简单离子结构示意图:,故为: ;;;
(3)钠元素原子的最外层只有1个电子,易失去而形成最外层为8个电子的稳定结构,故Na表现为+1价。
12.(1)放入热水中 镁大于铝
(2)圆底烧瓶
(3)
(4)饱和碳酸氢钠
【分析】非金属性越强,最高价氧化物对应水化物的酸性越强;高氯酸和碳酸钙反应生成二氧化碳,二氧化碳和硅酸钠生成硅酸沉淀,可以说明酸性高氯酸大于碳酸大于硅酸;
解析:(1)越活泼的金属越容易置换出水中的氢;根据题意可知,将打磨好的镁片和铝片放入热水中,观察到Mg片表面逐渐产生气泡,溶液变为浅红色,铝片的表面和溶液无明显变化,说明镁和热水反应生成氢气和氢氧化镁,而铝不反应,则金属性镁大于铝;
(2)图中B的仪器名称为圆底烧瓶,A中所装的试剂为高氯酸;
(3)B中发生反应高氯酸和碳酸钙反应生成二氧化碳,离子方程式为;
(4)为挥发性强酸,挥发出的高氯酸会和硅酸钠反应生成硅酸沉淀,故应在B和C之间增加一个盛有饱和碳酸氢钠溶液的装置,除去挥发的高氯酸
