2.1化学反应速率课堂同步练-人教版高中化学选择性必修1((含解析))
文档属性
| 名称 | 2.1化学反应速率课堂同步练-人教版高中化学选择性必修1((含解析)) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-25 15:30:43 | ||
图片预览




文档简介
2.1化学反应速率课堂同步练-人教版高中化学选择性必修1
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.升高温度能加快化学反应速率的主要原因是
A.增加反应物中活化分子的百分数 B.降低活化分子的能量
C.增加分子碰撞机会 D.增加分子数
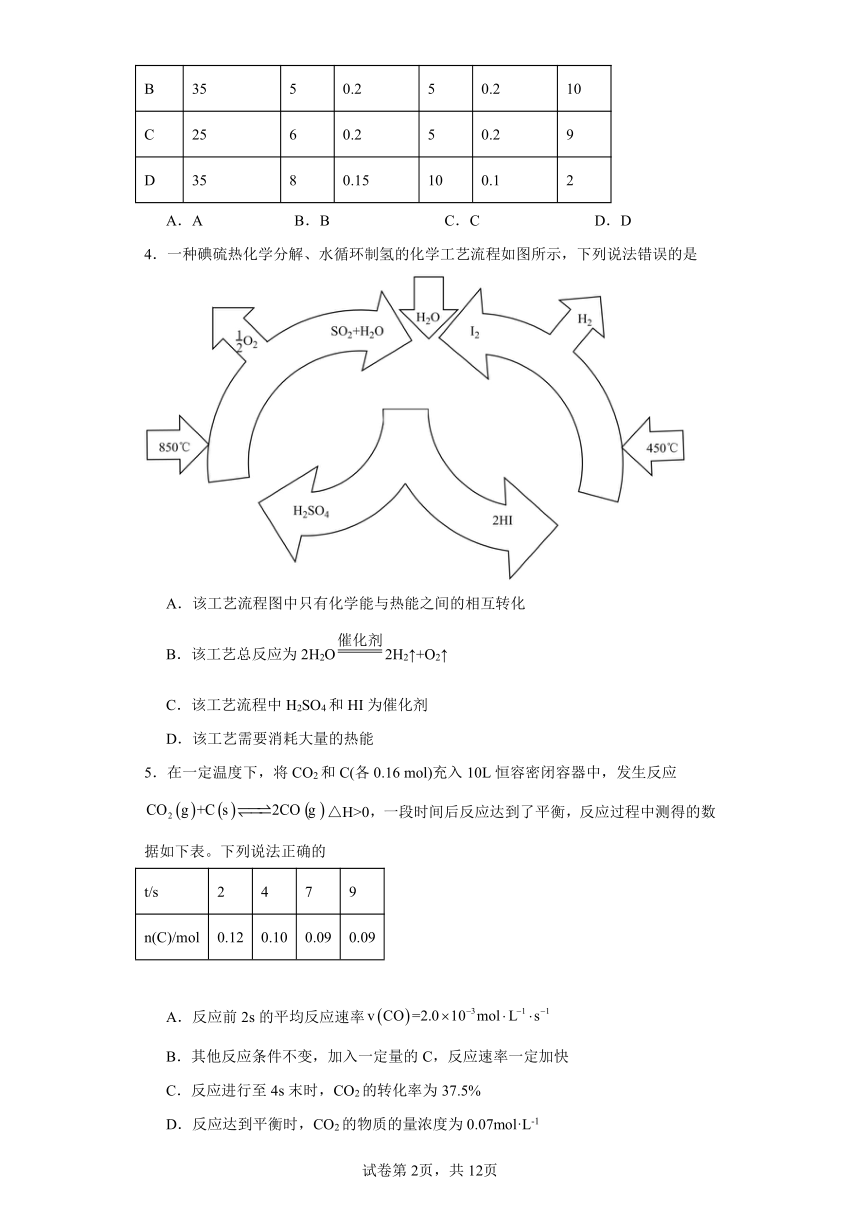
2.Pb- Mg/SiO2催化剂从环境保护和能源角度实现了CO2到甲烷的转变,其催化机理如图,由机理可知下列反应不能实现的是
A.MgO+CO2=MgCO3
B.Mg(HCO3)2+16H=MgO+2CH4+5H2O
C.MgCO3+8H=CH4+2H2O+MgO
D.CO2+4H2=CH4+2H2O
3.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,可以通过出现浑浊的快慢来判断反应的快慢程度,下列各组实验中最先出现浑浊的是
实验 反应温度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol L-1) V/mL c/(mol L-1) V/mL
A 25 5 0.1 10 0.1 5
B 35 5 0.2 5 0.2 10
C 25 6 0.2 5 0.2 9
D 35 8 0.15 10 0.1 2
A.A B.B C.C D.D
4.一种碘硫热化学分解、水循环制氢的化学工艺流程如图所示,下列说法错误的是
A.该工艺流程图中只有化学能与热能之间的相互转化
B.该工艺总反应为2H2O2H2↑+O2↑
C.该工艺流程中H2SO4和HI为催化剂
D.该工艺需要消耗大量的热能
5.在一定温度下,将CO2和C(各0.16 mol)充入10L恒容密闭容器中,发生反应△H>0,一段时间后反应达到了平衡,反应过程中测得的数据如下表。下列说法正确的
t/s 2 4 7 9
n(C)/mol 0.12 0.10 0.09 0.09
A.反应前2s的平均反应速率
B.其他反应条件不变,加入一定量的C,反应速率一定加快
C.反应进行至4s末时,CO2的转化率为37.5%
D.反应达到平衡时,CO2的物质的量浓度为0.07mol·L-1
6.反应2SO2(g)+O2(g) 2SO3(g)经a min后SO3(g)的浓度变化情况如下图所示,在0~a min内用O2表示的平均反应速率为0.04 mol·L-1·min-1,则a等于
A.5 B.2.5 C.0.1 D.10
7.对于可逆反应2SO2+O2 2SO3(正反应为放热反应),决定反应速率的主要因素是
A.温度 B.压强 C.SO2和O2的性质 D.催化剂
8.下列实验方案设计、现象和结论均正确的是
目的 方案设计 现象和结论
A 检验乙醇是否发生消去反应 将乙醇和浓共热产生的气体依次通入足量的溶液、稀酸性溶液 溶液褪色,证明发生了消去反应
B 检验与的还原性强弱 向含的溶液中通入,再滴加淀粉溶液,观察现象 溶液变蓝色,说明还原性
C 鉴别同为白色粉末状晶体的尿素和氯化铵 分别取少量晶体于试管中,加入足量浓溶液加热,在试管口放置湿润的红色石蕊试纸,观察试纸是否变色 若试纸不变蓝色,说明该晶体为尿素,若试纸变蓝色,说明该晶体为氯化铵
D 探究温度对化学反应速率的影响 向两支试管各加入酸性溶液和溶液,将其中一支放入冰水中,一支放入80℃热水中 80℃热水中褪色快,说明温度升高,反应速率加快
A.A B.B C.C D.D
9.一种基于光催化剂MeOx(某金属氧化物)催化氮还原制取氨的反应过程如下图所示(图中h+表示空穴),下列说法错误的是
A.该过程总反应可表示为:N2 +3H2 2NH3
B.导带上发生的反应为:2H2O +4h+= 4H++ O2↑ +4h
C.光能转变为化学能
D.H+是反应的中间体
10.下列有关有效碰撞理论和活化能的认识,正确的是
A.增大压强(对于气体反应),活化分子总数增大,故反应速率增大
B.温度升高,分子动能增加,反应所需活化能减小,故反应速率增大
C.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大
D.H+和 OH-的反应活化能接近于零,反应几乎在瞬间完成
二、填空题
11.反应历程: 。
12.草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO+H2C2O4+H+ —Mn2++CO2↑+H2O(未配平)。用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
组别 10%硫酸体积/mL 温度/℃ 其他物质
I 2 mL 20
II 2 mL 20 10滴饱和MnSO4溶液
III 2 mL 30
IV 1 mL 20 1 mL蒸馏水
(1)该反应中氧化剂和还原剂的物质的量之比为 。
(2)如果研究催化剂对化学反应速率的影响,使用实验 和 (用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(3)对比实验I和IV,可以研究 对化学反应速率的影响。
13.一定条件下,将SO2和O2充入一密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:
回答下列问题:
(1)降低温度,SO2的转化率 ,化学反应速度 。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是 。
(3)反应进行至20 min时,曲线发生变化的原因是 (用文字表达)。10 min到15 min的曲线变化的原因可能是 (填写编号)。
a. 加了催化剂
b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
14.一定条件下,2CO(g)+SO2(g)2CO2(g)+S(l) △H。可实现燃煤烟气中硫的回收:
(1)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图所示。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑价格因素,选择Fe2O3的主要优点是 。
(2)工业上还可用Na2SO3溶液吸收烟气中的SO2:Na2SO3+SO2+H2O=2NaHSO3。某温度下用1.0mol/LNa2SO3溶液吸收纯净的SO2,当溶液中c(SO)降至0.2mol/L时,吸收能力显著下降,应更换吸收剂。此时溶液中c(HSO)约为 mol/L。
15.尿素是目前使用量较大的一种化学氮肥。
I.以、为原料生产尿素的反应历程与能量变化示意图如下:
(1)图中的两步反应属于放热反应的 。(用、、、表示,下同)
(2)根据图像写出以、为原料生产尿素的热化学方程式: 。
(3)根据上述反应历程与能量变化示意图,过程 (填“第一步反应”或“第二步反应”)为决速步。
II.氨基甲酸铵为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进行探究。
已知:①
②
③
(4)请写出分解生成与气体的热化学方程式: 。
16.回答下列问题:
(1)某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式为 。
反应开始至2min,Z的平均反应速率为 。
(2)甲烷作为能源燃烧放出大量的热,已知:
①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol
则表示甲烷燃烧热的热化学方程式 。
17.2SO2(g) +O2(g)2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g)氧化为lmol SO3(g)的△H =-99kJ·mol-1
请回答下列问题:
(1)图中C表示 ,该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ;
(2)图中反应的逆反应活化能为 (请用含有E和△H的式子表示);
(3)如果反应速率v(SO2)为0.06 mol·L-1·min-1,则v(O2)为 mol·L-1·min-1
(4)已知S(s) + O2(g)= SO2(g)△H =-296kJ·mol-1,则由S(s)生成4 mol SO3(g)的△H kJ·mol-1。
18.研究反应速率的影响因素有助于对相关反应原理的理解。
I.某些金属及金属氧化物对H2O2的分解反应具有催化作用。某同学选用Ag、Pt、Cu、TiO2作为催化剂,在25℃时,保持其它实验条件相同,测得生成的O2体积(V)。V与分解时间(t)的关系如图所示(O2的体积已折算成标准状况)。则:
(1)在不同催化剂存在下,H2O2分解反应的活化能大小顺序是 Ea(___________) > Ea(___________)>Ea(___________)>Ea(___________), (括号内填写催化剂的化学式)。
(2)金属Pt 催化下,H2O2分解生成氧气的反应速率v(O2)= mol·s-1。
II.环戊二烯(Y)容易发生聚合生成二聚体,该反应为可逆反应(以2YY2表示该反应)。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示。
(3)温度T1与T2的大小关系为T1 T2。
(4)a点的正反应速率 (选填“大于”、“小于”或“等于”)b点的逆反应速率。
(5)b点时Y2的浓度为 mol·L-1。
19.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号 反应物 催化剂
① 10 mL 2% H2O2溶液 无
② 10 mL 5% H2O2溶液 无
③ 10 mL 5% H2O2溶液 1 mL 0.1 mol·L-1FeCl3溶液
④ 10 mL 5% H2O2溶液+少量HCl溶液 1 mL 0.1 mol·L-1FeCl3溶液
⑤ 10 mL 5% H2O2溶液+少量NaOH溶液 1 mL 0.1 mol·L-1FeCl3溶液
(1)催化剂能加快化学反应速率的原因是 。
(2)实验①和②的目的是 。
实验时由于没有观察到明显现象而无法得出结论,资料显示,通常条件下H2O2较稳定,不易分解,为了达到实验目的,你对原实验方案的改进是 。
(3)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
分析上图能够得出的实验结论是 。
20.已知①N2(g)+3H2(g) 2NH3(g) ΔH<0,反应速率为v1;
②2HI(g) H2(g)+I2(g) ΔH>0,反应速率为v2。
对于上述两个可逆反应,当改变条件时,试判断v1、v2的变化(填“增大”、“减小”或“不变”)
(1)保持体积不变,反应①通入N2,反应②分离出I2(g),v1 ,v2 。
(2)保持压强不变,反应①②通入“He”气,v1 ,v2 。
(3)反应①、反应②均压缩体积,v1 ,v2 。
(4)保持体积不变,反应①②通入“He”气,v1 ,v2 。
(5)其他条件不变,反应①②均升温,v1 ,v2 。
(6)其他条件不变,反应①②均加入正催化剂,v1 ,v2 。
三、实验题
21.I.某研究性学习小组利用溶液和酸性溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 实验温度 有关物质 溶液颜色褪至无色所需时间/s
和酸性溶液 溶液
V/mL c/ V/mL c/ V/mL
A 293 2 0.02 4 0.1 0
B 2 0.02 3 0.1 8
C 313 2 0.02 0.1 1
(1)写出草酸与高锰酸钾反应的离子方程式 。
(2)通过实验A、B,可探究出 (填外部因素)的改变对化学反应速率的影响,其中 、 ;通过实验 (填实验序号)可探究出温度变化对化学反应速率的影响,其中 。
(3)若,则由此实验可以得出的结论是 ;忽略溶液体积的变化,利用实验B中数据计算,0-8s内,用的浓度变化表示的反应速率 。
II.催化剂在生产和科技领域起到重大作用。某化学研究小组的同学分别设计了如图1所示的实验,用控制变量法比较和对分解的催化效果。请回答相关问题;
(4)定性分析:某同学通过观察甲中两支试管产生气泡的快慢,由此得出和对分解的催化效果,该结论 填(“合理”或“不合理”),原因 。
22.草酸与高锰酸钾在酸性条件下能够发生如下反应:+H2C2O4+H+=Mn2++CO2↑+H2O(未配平),用4mL 0.001mol L﹣1KMnO4溶液与2mL 0.01mol L﹣1 H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:回答下列问题:
组别 10%硫酸体积/mL 温度/℃ 其他物质
Ⅰ 2 20
Ⅱ 2 20 5滴饱和MnSO4溶液
Ⅲ 2 30
Ⅳ 1 20 1 mL蒸馏水
(1)该反应中氧化剂和还原剂的物质的量之比为 。
(2)我们可以通过观察 ,来判断反应速率的大小
(3)如果研究催化剂对化学反应速率的影响,使用实验 和 (用Ⅰ~Ⅳ表示,下同),如果研究温度对化学反应速率的影响,使用实验 和 (用Ⅰ~Ⅳ表示,下同)。
(4)实验Ⅰ和Ⅳ研究浓度对反应速率的影响,Ⅳ中加入1mL蒸馏水的目的是 。
(5)反应I、III、IV中都可观察到反应速率先慢后快的现象,引起这种现象的原因是 。
23.回答下列问题:
(1)我校化学社团做了如下探究实验:利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究外界条件改变对化学反应速率的影响。实验数据如表所示:
实验 序号 实验温度/K KMnO4溶液(含硫酸) H2C2O4溶液 H2O 溶液颜色褪至无色时所需时间/s
A 293 2 0.02 5 0.1 3
B 293 2 0.02 3 0.1 8
C 313 2 0.02 0.1 5
①写出该反应的离子方程式: 。
②通过实验A、B可探究 (填外部因素)的改变对反应速率的影响,其中V1= ;通过实验 (填实验序号)可探究温度变化对化学反应速率的影响。
③利用实验B中数据计算,用KMnO4溶液的浓度变化表示的反应速率v(KMnO4)= 。
④实验中发现:反应一段时间后该反应速率会突然加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是 ,相应的粒子最有可能是 。
(2)一种新型催化剂能使NO和CO发生反应:2NO+2CO2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
实验 编号 t/℃ NO初始浓度/mol·L-1 CO初始浓度/mol·L-1 催化剂的比表面积/m2/g
I 280 82
II 280 b 124
Ⅲ 350 a 82
①表中a= ,b= 。
②能验证温度对化学反应速率影响规律的是实验 (填实验编号)。
③实验I和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验II的是曲线 (填“甲”或“乙”)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】升高温度能加快化学反应速率的主要原因是通过升高温度使分子获得更高的能量,活化分子百分数提高;温度升高使得含有较高能量的分子间的碰撞频率随之提高,增加分子碰撞机会,这是次要原因,故A正确;
故选A。
2.B
【详解】A.图分析可知MgO与CO2生成MgCO3,故A正确;
B.转化过程中无Mg(HCO3)2与H反应的信息,故B错误;
C.看图可知1molMgOCO2经过加入4molH2中间生成2molH2O,最后生成1molMgO和1molCH4,故C正确;
D.图中分析可知1molCO2和4molH2在Pd的作用下生成1molCH4和2molH2O,故D正确;
故选:B。
3.D
【分析】温度越高、浓度越大,则反应速率就越快,在实验中就最先出现浑浊。
【详解】因35℃>25℃,则选项B和D中的反应速率大于选项A和C中的反应速率,又B中,混合液中硫代硫酸钠和稀硫酸的浓度均为,D中硫代硫酸钠为、稀硫酸的浓度均为,则D中反应物的浓度大于B中反应物的浓度,则D中反应速率最快,即在实验中就最先出现浑浊;
答案选D。
4.C
【分析】由图可知,碘硫热化学分解、水循环制氢的化学工艺流程涉及的反应为、、,总反应为,反应中I2和SO2是反应的催化剂。
【详解】A.该工艺流程图中只有化学能与热能之间的相互转化,无其他能量变化,A正确;
B.根据上述分析可知:总反应为2H2O2H2↑+O2↑,B正确;
C.该工艺流程制氢是独立的三步反应组成的循环,该工艺流程中H2SO4和HI为中间产物,I2和SO2是反应的催化剂,C错误;
D.该工艺流程图中HI及H2SO4的分解反应,都需要高温在一定温度下进行, 因此需要消耗大量的热能,D正确;
故合理选项是C。
5.C
【详解】A.通过表格数据可知,反应前2s,C减少了0.16-0.12=0.04 mol,根据化学方程式可知,则CO增加了0.08 mol,则V(CO)===4.010-3 mol·L-1·S-1,故A错误;
B.固体和纯液体的浓度是常数,所以改变固体反应物的量不能改变反应速率,故B错误;
C.由表格数据可知,反应进行至4s末时,所以二氧化碳的转化率,故C正确;
D.由表格数据可知反应在第7s时已经建立平衡,通过化学方程式可知,CO2和C在反应中消耗的量是相等的,所以,平衡时剩余,所以,故D错误;
本题答案C。
6.A
【详解】由速率之比等于系数比,v(SO3)=2×0.04 mol·L-1·min-1=0.08 mol·L-1·min-1,a= 0.4mol L-1÷0.08mol L-1 min-1 =5 min,故选A。
7.C
【详解】对于一个化学反应来说,化学反应进行的快慢程度由内因决定,即由参加反应的物质本身的性质决定。对于可逆反应2SO2+O2 2SO3(正反应为放热反应),决定反应速率的主要因素是SO2和O2的性质,故合理选项是C。
8.A
【详解】A.挥发出的乙醇通过KOH溶液溶解了,能使酸性溶液褪色说明生成了乙烯,即发生消去反应,A正确;
B.向含的溶液中通入,再滴加淀粉溶液,溶液变蓝色,说明有单质碘生成,但不能说明亚铁离子是否被氧化,所以不能证明还原性:,B错误;
C.尿素与浓氢氧化钠加热条件下反应生成NH3和碳酸钠,氯化铵与浓氢氧化钠加热条件下反应生成NH3和氯化钠,均使湿润的红色石蕊试纸变蓝,C错误;
D.高锰酸钾过量,两支试管均不会褪色,D错误;
故选A。
9.A
【详解】A.据图可知该反应的反应物为N2和H2O,产物为NH3和O2,总反应为2N2+6H2O 4NH3+O2,A错误;
B.据图可知导带上H2O结合h+反应生成氧气和氢离子,反应为2H2O +4h+= 4H++ O2↑ +4h,B正确;
C.整个过程吸收太阳光的能量发生,将光能转变为化学能,C正确;
D.H2O转变为H+和O2,H+和N2转变为NH3,说明H+是反应的中间体,D正确;
综上所述答案为A。
10.D
【详解】A.反应前后气体体积不变的反应,增大压强,体积减小,活化分子总数不变,但活化分子浓度增大,反应速率增大,故A错误;
B.温度升高,更多分子吸收能量成为活化分子,反应速率增大,活化能不变,故B错误;
C.使用催化剂,降低活化能,使更多分子成为活化分子,反应速率增大,故C错误;
D.酸和碱反应不需要外界做功的条件下就能发生,说明它们已经处于活跃状态,因此活化能非常小,故D正确。
答案选D。
11.基元反应构成的反应序列(又称反应机理)
【解析】略
12.(1)2:5
(2) Ⅰ Ⅱ Ⅰ Ⅲ
(3)浓度
【分析】探究反应物浓度、温度、催化剂对反应速率影响,需在其它条件相同的条件下设置对比实验;对比实验I和IV,根据两个实验中反应物不同量分析实验目的;对比实验中,必须确保溶液总体积相同,以此解题。
【详解】(1)反应MnO4-+H2C2O4+H+ →Mn2++CO2↑+H2O中,Mn元素的化合价由+7价降至+2价,MnO4-为氧化剂,1molMnO4-得到5mol电子,C元素的化合价由+3价升至+4价,H2C2O4为还原剂,1molH2C2O4失去2mol电子,根据得失电子守恒,氧化剂与还原剂物质的量之比为2:5;
(2)研究催化剂对化学反应速率的影响,应保证温度、浓度相同,则选实验Ⅰ和Ⅱ;研究温度对化学反应速率的影响,应保证浓度、不使用催化剂相同,则选实验Ⅰ和Ⅲ;
(3)实验Ⅰ和Ⅳ,硫酸的浓度不同,可研究硫酸溶液浓度对反应速率的影响。
13. 增大 减小 (15—20)min、(25—30)min 增大了O2的浓度 a、b
【详解】(1)正反应是放热反应,所以降低温度,正逆反应速率均是减小的,平衡向正反应方向进行,所以平衡常数增大。
(2)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以根据图象可知,处于平衡状态的是15~20min,25~30min。
(3)反应进行至20 min时,氧气的浓度突然增大,而SO2的浓度逐渐减小,三氧化硫的浓度逐渐增大,所以改变的条件是增大氧气的浓度;根据图象可知,10 min到15 min时,物质的浓度变化量增大,即反应速率加快,所以改变的条件是使用了催化剂或改变了压强,答案选ab。
14.(1)Fe2O3作催化剂时,在相对较低温度下可获得较高的SO2的转化率,从而节约大量能源
(2)1.6
【详解】(1)由题干图象信息可知,Fe2O3作催化剂时,在相对较低温度下可获得较高的SO2的转化率,从而节约大量能源,故答案为:Fe2O3作催化剂时,在相对较低温度下可获得较高的SO2的转化率,从而节约大量能源;
(2)工业上还可用Na2SO3溶液吸收烟气中的SO2:Na2SO3+SO2+H2O=2NaHSO3。某温度下用1.0mol/LNa2SO3溶液吸收纯净的SO2,当溶液中c(SO)降至0.2mol/L时,c(SO)减小了1.0mol/L-0.2mol/L=0.8mol/L,根据反应方程式可知,生成的c(HSO)=1.6mol/L,故此时溶液中c(HSO)约为1.6mol/L,故答案为:1.6。
15.(1)
(2)
(3)第二步反应
(4)
【详解】(1)图中的第一步反应属于放热反应,断键吸收的总能量 形成化学键放出的总能量=();
(2)图中的第一步反应加上第二步反应即可得到以、为原料生产尿素的反应,第二步反应的断键吸收的总能量 形成化学键放出的总能量=( ),则以、为原料生产尿素的热化学方程式: ;
(3)慢反应决定了总反应速率,即活化能大的这一步是决速步,则第二步反应为决速步;
(4)根据盖斯定律,由①+② ③即可得到分解生成与气体的热化学方程式: 。
16.(1) 3X+Y2Z 0.05mol L-1 min-1
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890kJ mol-1
【分析】根据图象中曲线的变化判断反应物和生成物,利用各物质的量的变化判断反应的系数比;根据盖斯定律计算总反应的焓变;
【详解】(1)根据图象中减小的是反应物,增大的是生成物,故反应物是X和Y ,生成物是Z,根据变化量之比等于系数比,且在2min中各物质的量都保持不变,且不为零,故反应为可逆反应,反应方程为:3X+Y2Z;故答案为:3X+Y2Z;根据图象及速率公式 ,故答案为:0.05mol L-1 min-1;
(2)根据盖斯定律,①×+②×得甲烷燃烧热的焓变为-890kJ mol-1,故甲烷燃烧热的化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890kJ mol-1;
【点睛】此题考查焓变的计算及速率计算;根据图象信息进行判断,注意可逆反应的判断。
17. 生成物能量 降低 E-△H 0.03 -1580
【详解】(1)因图中C表示生成物总能量,该反应通常用V2O5作催化剂,催化剂改变了反应的历程使活化能降低,故加V2O5会使图中B点降低;(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变,图中反应的逆反应活化能为:E-△H;(3)根据反应速率之比等于化学计量数之比,如果反应速率 v(SO2)为0.06 mol·L-1·min-1,则 v(O2)= v(SO2)=×0.06mol·L-1·min-1 =0.03 mol·L-1·min-1;(4)已知1mol SO2(g)氧化为 lmol SO3(g)的△H =-99kJ·mol-1 ,则有:①2SO2(g) +O2(g) 2SO3(g) △H1 =-198kJ·mol-1 ,②S(s) + O2(g)= SO2(g) △H2 =-296kJ·mol-1,根据盖斯定律,由②×4+①×2可得:4S(s) + 6O2(g)= 4SO3(g) △H =2△H1 +4△H2= -1580 kJ·mol-1。
18.(1)Ea(TiO2)>Ea(Cu)>Ea(Pt)>Ea(Ag)
(2)8.9×10-7
(3)<
(4)大于
(5)0.45
【解析】(1)
从图示看出:反应速率由快到慢的顺序为:Ag、Pt、Cu、TiO2,活化能越小,反应越容易进行,反应速率越快,故活化能由大到小顺序为:Ea(TiO2)>Ea(Cu)>Ea(Pt)>Ea(Ag);
(2)
从图象可看出:400 s时,Pt催化分解生成O2 8 mL,其物质的量为n(O2)=,则1 s分解产生O2:;
(3)
反应温度越高,化学反应速率越快。根据图示可知,在温度T2 (虚线)的反应速率较大,则T1(4)
a到b的过程为正反应速率逐渐减小,且b点v(正)>v(逆)。则a点的正反应速率大于b点的逆反应速率;
(5)
b点时环戊二烯的浓度变化为△c(Y)=1.5 mol/L-0.6 mol/L=0.9 mol/L,环戊二烯的二聚体的浓度为环戊二烯浓度变化的,则b点时二聚体的浓度c(Y2)=0.9 mol/L×=0.45 mol/L。
19.(1)降低了反应的活化能
(2) 探究浓度对反应速率的影响 向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)
(3)碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
【详解】(1)加入催化剂能使化学反应速率加快,其原因是加入催化剂降低了反应的活化能,使更多的普通分子变为活化分子,增大了活化分子的碰撞几率,使活化分子的有效碰撞增多,从而加快反应速率。
(2)实验①和②的区别是①中H2O2的浓度小,②中H2O2的浓度大,所以实验①和②的目的是探究浓度对反应速率的影响。为了能够通过实验①和②探究浓度对反应速率的影响,对原实验方案进行改进,可向反应物中加入等量同种催化剂或将盛有反应物的试管放入同一热水浴中观察实验现象。
(3)由图象知实验⑤反应速率最快,实验④反应速率最慢,说明碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率。
20.(1) 增大 减小
(2) 减小 减小
(3) 增大 增大
(4) 不变 不变
(5) 增大 增大
(6) 增大 增大
【解析】(1)
体积不变,反应①通入N2,N2浓度增大,v1增大;反应②分离出I2(g),I2(g)浓度降低,v2减小;故答案为:增大;减小;
(2)
保持压强不变,反应①②通入“He”气,则体积增大,反应体系中各组分浓度减小,v1减小,v2减小;故答案为:减小;减小;
(3)
反应①、反应②均压缩体积,反应体系中各组分浓度增大,v1增大,v2增大;故答案为:增大;增大;
(4)
保持体积不变,反应①②通入“He”气,反应体系中各组分浓度不变,v1不变,v2不变;故答案为:不变;不变;
(5)
其他条件不变,反应①②均升温,升温反应速率均变大,v1增大,v2增大;故答案为:增大;增大;
(6)
其他条件不变,反应①②均加入正催化剂,加入正催化剂反应速率均变大,v1增大,v2增大;故答案为:增大;增大。
21.(1)
(2) 浓度 1 293 B、C 3
(3) 浓度越大,反应速率越快
(4) 不合理 阴离子种类不同
【详解】(1)草酸被高锰酸钾氧化为二氧化碳,高锰酸根离子被还原为锰离子,反应的离子方程式为;
(2)实验A、B中草酸的浓度不用,可探究出浓度的改变对化学反应速率的影响,根据“控制变量法”,为使的浓度相同,必须使混合后溶液的总体积相等,所以1,温度相同293K;实验B、C的变量是温度,通过实验B、C可探究出温度变化对化学反应速率的影响;为控制草酸的浓度相同,3。
(3)若,由此实验可以得出的结论是浓度越大,反应速率越快;根据实验B中数据,0-8s内,用的浓度变化表示的反应速率= 。
(4)由于两溶液中加入的阴离子、阳离子都不相同,所以不能得出和对分解的催化效果。
22. 2:5 生成气泡速率 Ⅰ Ⅱ Ⅰ Ⅲ 保证KMnO4溶液与H2C2O4溶液的起始浓度相同或确保溶液总体积不变 生成的Mn2+有催化作用
【分析】利用控制变量法研究不同条件对化学反应速率的影响,Ⅰ为对照实验;Ⅱ与Ⅰ作比较,探究催化剂对化学反应速率的影响;Ⅲ与Ⅰ作比较,探究温度对化学反应速率的影响;IV与Ⅰ作比较,探究酸度对化学反应速率的影响,加入1mL蒸馏水是为了保证KMnO4溶液与H2C2O4溶液的起始浓度相同或确保溶液总体积不变。
【详解】(1)中,Mn元素的化合价降低,C元素的化合价升高,MnO4为氧化剂,H2C2O4为还原剂,氧化剂和还原剂的物质的量之比为2:5;
(2)因为有气体生成,可以通过观察生成气泡速率判断反应速率;
(3)研究催化剂对化学反应速率的影响,应保证温度、浓度相同,则选实验Ⅰ、Ⅱ ;研究温度对化学反应速率的影响,应保证浓度、不使用催化剂相同,则选实验Ⅰ、Ⅲ;
(4)对比实验Ⅰ和IV,IV中只加入1mL 10%硫酸,与Ⅰ中加入的溶液体积不等,就不能保证4mL 0.01mol·L-1 KMnO4溶液与2mL 0.1mol·L-1 H2C2O4溶液中反应物浓度相同,实验IV中加入1mL蒸馏水的目的是保证KMnO4溶液与H2C2O4溶液的起始浓度相同或确保溶液总体积不变;
(5)Ⅰ、Ⅲ、IV中没有加入催化剂,但反应中都生成Mn2+,随着反应进行反应物浓度减小,反应速率应该减慢,但实际上观察到反应速率先慢后快的现象,是生成的Mn2+有催化作用。
23.(1) H2C2O4溶液浓度的改变对反应速率的影响 5 BC 催化作用 Mn2+
(2) I、Ⅲ 乙
【详解】(1)①酸性KMnO4具有强氧化性,和H2C2O4溶液反应生成二氧化碳和锰离子,反应为;
②实验A、B中控制的变量为H2C2O4溶液浓度,可探究H2C2O4溶液浓度的改变对反应速率的影响,实验中溶液总体积要相同,故其中V1=5;
实验BC中控制的变量为H2C2O4溶液浓度,通过实验BC可探究温度变化对化学反应速率的影响。
③实验B中n(KMnO4)=2×10-3L×0.02mol/L=4×10-5mol,n(H2C2O4)=3×10-3L×0.1mol/L=3×10-4mol,反应中H2C2O4过量,KMnO4全部反应;KMnO4起始浓度为,用KMnO4溶液的浓度变化表示的反应速率v(KMnO4)= 。
④反应一段时间后该反应速率会突然加快,造成此种变化的原因是反应体系中的生成的锰离子对KMnO4与H2C2O4之间的反应有催化作用,故填:催化作用,Mn2+;
(2)①验证温度、催化剂的比表面积对化学反应速率的影响规律,设计了三组实验,实验I、II中变量为催化剂的比表面积,则b=;实验I、Ⅲ中变量为温度,则a=;
②实验I、Ⅲ中变量为温度,能验证温度对化学反应速率影响规律的是实验I、Ⅲ;
③已知增大催化剂的比表面积可提高该反应速率,实验Ⅱ中催化剂的比表面积更大,反应速率更快,故表示实验II的是曲线乙。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.升高温度能加快化学反应速率的主要原因是
A.增加反应物中活化分子的百分数 B.降低活化分子的能量
C.增加分子碰撞机会 D.增加分子数
2.Pb- Mg/SiO2催化剂从环境保护和能源角度实现了CO2到甲烷的转变,其催化机理如图,由机理可知下列反应不能实现的是
A.MgO+CO2=MgCO3
B.Mg(HCO3)2+16H=MgO+2CH4+5H2O
C.MgCO3+8H=CH4+2H2O+MgO
D.CO2+4H2=CH4+2H2O
3.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,可以通过出现浑浊的快慢来判断反应的快慢程度,下列各组实验中最先出现浑浊的是
实验 反应温度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol L-1) V/mL c/(mol L-1) V/mL
A 25 5 0.1 10 0.1 5
B 35 5 0.2 5 0.2 10
C 25 6 0.2 5 0.2 9
D 35 8 0.15 10 0.1 2
A.A B.B C.C D.D
4.一种碘硫热化学分解、水循环制氢的化学工艺流程如图所示,下列说法错误的是
A.该工艺流程图中只有化学能与热能之间的相互转化
B.该工艺总反应为2H2O2H2↑+O2↑
C.该工艺流程中H2SO4和HI为催化剂
D.该工艺需要消耗大量的热能
5.在一定温度下,将CO2和C(各0.16 mol)充入10L恒容密闭容器中,发生反应△H>0,一段时间后反应达到了平衡,反应过程中测得的数据如下表。下列说法正确的
t/s 2 4 7 9
n(C)/mol 0.12 0.10 0.09 0.09
A.反应前2s的平均反应速率
B.其他反应条件不变,加入一定量的C,反应速率一定加快
C.反应进行至4s末时,CO2的转化率为37.5%
D.反应达到平衡时,CO2的物质的量浓度为0.07mol·L-1
6.反应2SO2(g)+O2(g) 2SO3(g)经a min后SO3(g)的浓度变化情况如下图所示,在0~a min内用O2表示的平均反应速率为0.04 mol·L-1·min-1,则a等于
A.5 B.2.5 C.0.1 D.10
7.对于可逆反应2SO2+O2 2SO3(正反应为放热反应),决定反应速率的主要因素是
A.温度 B.压强 C.SO2和O2的性质 D.催化剂
8.下列实验方案设计、现象和结论均正确的是
目的 方案设计 现象和结论
A 检验乙醇是否发生消去反应 将乙醇和浓共热产生的气体依次通入足量的溶液、稀酸性溶液 溶液褪色,证明发生了消去反应
B 检验与的还原性强弱 向含的溶液中通入,再滴加淀粉溶液,观察现象 溶液变蓝色,说明还原性
C 鉴别同为白色粉末状晶体的尿素和氯化铵 分别取少量晶体于试管中,加入足量浓溶液加热,在试管口放置湿润的红色石蕊试纸,观察试纸是否变色 若试纸不变蓝色,说明该晶体为尿素,若试纸变蓝色,说明该晶体为氯化铵
D 探究温度对化学反应速率的影响 向两支试管各加入酸性溶液和溶液,将其中一支放入冰水中,一支放入80℃热水中 80℃热水中褪色快,说明温度升高,反应速率加快
A.A B.B C.C D.D
9.一种基于光催化剂MeOx(某金属氧化物)催化氮还原制取氨的反应过程如下图所示(图中h+表示空穴),下列说法错误的是
A.该过程总反应可表示为:N2 +3H2 2NH3
B.导带上发生的反应为:2H2O +4h+= 4H++ O2↑ +4h
C.光能转变为化学能
D.H+是反应的中间体
10.下列有关有效碰撞理论和活化能的认识,正确的是
A.增大压强(对于气体反应),活化分子总数增大,故反应速率增大
B.温度升高,分子动能增加,反应所需活化能减小,故反应速率增大
C.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大
D.H+和 OH-的反应活化能接近于零,反应几乎在瞬间完成
二、填空题
11.反应历程: 。
12.草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO+H2C2O4+H+ —Mn2++CO2↑+H2O(未配平)。用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
组别 10%硫酸体积/mL 温度/℃ 其他物质
I 2 mL 20
II 2 mL 20 10滴饱和MnSO4溶液
III 2 mL 30
IV 1 mL 20 1 mL蒸馏水
(1)该反应中氧化剂和还原剂的物质的量之比为 。
(2)如果研究催化剂对化学反应速率的影响,使用实验 和 (用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(3)对比实验I和IV,可以研究 对化学反应速率的影响。
13.一定条件下,将SO2和O2充入一密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:
回答下列问题:
(1)降低温度,SO2的转化率 ,化学反应速度 。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是 。
(3)反应进行至20 min时,曲线发生变化的原因是 (用文字表达)。10 min到15 min的曲线变化的原因可能是 (填写编号)。
a. 加了催化剂
b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
14.一定条件下,2CO(g)+SO2(g)2CO2(g)+S(l) △H。可实现燃煤烟气中硫的回收:
(1)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图所示。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑价格因素,选择Fe2O3的主要优点是 。
(2)工业上还可用Na2SO3溶液吸收烟气中的SO2:Na2SO3+SO2+H2O=2NaHSO3。某温度下用1.0mol/LNa2SO3溶液吸收纯净的SO2,当溶液中c(SO)降至0.2mol/L时,吸收能力显著下降,应更换吸收剂。此时溶液中c(HSO)约为 mol/L。
15.尿素是目前使用量较大的一种化学氮肥。
I.以、为原料生产尿素的反应历程与能量变化示意图如下:
(1)图中的两步反应属于放热反应的 。(用、、、表示,下同)
(2)根据图像写出以、为原料生产尿素的热化学方程式: 。
(3)根据上述反应历程与能量变化示意图,过程 (填“第一步反应”或“第二步反应”)为决速步。
II.氨基甲酸铵为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进行探究。
已知:①
②
③
(4)请写出分解生成与气体的热化学方程式: 。
16.回答下列问题:
(1)某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式为 。
反应开始至2min,Z的平均反应速率为 。
(2)甲烷作为能源燃烧放出大量的热,已知:
①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol
则表示甲烷燃烧热的热化学方程式 。
17.2SO2(g) +O2(g)2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g)氧化为lmol SO3(g)的△H =-99kJ·mol-1
请回答下列问题:
(1)图中C表示 ,该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ;
(2)图中反应的逆反应活化能为 (请用含有E和△H的式子表示);
(3)如果反应速率v(SO2)为0.06 mol·L-1·min-1,则v(O2)为 mol·L-1·min-1
(4)已知S(s) + O2(g)= SO2(g)△H =-296kJ·mol-1,则由S(s)生成4 mol SO3(g)的△H kJ·mol-1。
18.研究反应速率的影响因素有助于对相关反应原理的理解。
I.某些金属及金属氧化物对H2O2的分解反应具有催化作用。某同学选用Ag、Pt、Cu、TiO2作为催化剂,在25℃时,保持其它实验条件相同,测得生成的O2体积(V)。V与分解时间(t)的关系如图所示(O2的体积已折算成标准状况)。则:
(1)在不同催化剂存在下,H2O2分解反应的活化能大小顺序是 Ea(___________) > Ea(___________)>Ea(___________)>Ea(___________), (括号内填写催化剂的化学式)。
(2)金属Pt 催化下,H2O2分解生成氧气的反应速率v(O2)= mol·s-1。
II.环戊二烯(Y)容易发生聚合生成二聚体,该反应为可逆反应(以2YY2表示该反应)。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示。
(3)温度T1与T2的大小关系为T1 T2。
(4)a点的正反应速率 (选填“大于”、“小于”或“等于”)b点的逆反应速率。
(5)b点时Y2的浓度为 mol·L-1。
19.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号 反应物 催化剂
① 10 mL 2% H2O2溶液 无
② 10 mL 5% H2O2溶液 无
③ 10 mL 5% H2O2溶液 1 mL 0.1 mol·L-1FeCl3溶液
④ 10 mL 5% H2O2溶液+少量HCl溶液 1 mL 0.1 mol·L-1FeCl3溶液
⑤ 10 mL 5% H2O2溶液+少量NaOH溶液 1 mL 0.1 mol·L-1FeCl3溶液
(1)催化剂能加快化学反应速率的原因是 。
(2)实验①和②的目的是 。
实验时由于没有观察到明显现象而无法得出结论,资料显示,通常条件下H2O2较稳定,不易分解,为了达到实验目的,你对原实验方案的改进是 。
(3)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
分析上图能够得出的实验结论是 。
20.已知①N2(g)+3H2(g) 2NH3(g) ΔH<0,反应速率为v1;
②2HI(g) H2(g)+I2(g) ΔH>0,反应速率为v2。
对于上述两个可逆反应,当改变条件时,试判断v1、v2的变化(填“增大”、“减小”或“不变”)
(1)保持体积不变,反应①通入N2,反应②分离出I2(g),v1 ,v2 。
(2)保持压强不变,反应①②通入“He”气,v1 ,v2 。
(3)反应①、反应②均压缩体积,v1 ,v2 。
(4)保持体积不变,反应①②通入“He”气,v1 ,v2 。
(5)其他条件不变,反应①②均升温,v1 ,v2 。
(6)其他条件不变,反应①②均加入正催化剂,v1 ,v2 。
三、实验题
21.I.某研究性学习小组利用溶液和酸性溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 实验温度 有关物质 溶液颜色褪至无色所需时间/s
和酸性溶液 溶液
V/mL c/ V/mL c/ V/mL
A 293 2 0.02 4 0.1 0
B 2 0.02 3 0.1 8
C 313 2 0.02 0.1 1
(1)写出草酸与高锰酸钾反应的离子方程式 。
(2)通过实验A、B,可探究出 (填外部因素)的改变对化学反应速率的影响,其中 、 ;通过实验 (填实验序号)可探究出温度变化对化学反应速率的影响,其中 。
(3)若,则由此实验可以得出的结论是 ;忽略溶液体积的变化,利用实验B中数据计算,0-8s内,用的浓度变化表示的反应速率 。
II.催化剂在生产和科技领域起到重大作用。某化学研究小组的同学分别设计了如图1所示的实验,用控制变量法比较和对分解的催化效果。请回答相关问题;
(4)定性分析:某同学通过观察甲中两支试管产生气泡的快慢,由此得出和对分解的催化效果,该结论 填(“合理”或“不合理”),原因 。
22.草酸与高锰酸钾在酸性条件下能够发生如下反应:+H2C2O4+H+=Mn2++CO2↑+H2O(未配平),用4mL 0.001mol L﹣1KMnO4溶液与2mL 0.01mol L﹣1 H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:回答下列问题:
组别 10%硫酸体积/mL 温度/℃ 其他物质
Ⅰ 2 20
Ⅱ 2 20 5滴饱和MnSO4溶液
Ⅲ 2 30
Ⅳ 1 20 1 mL蒸馏水
(1)该反应中氧化剂和还原剂的物质的量之比为 。
(2)我们可以通过观察 ,来判断反应速率的大小
(3)如果研究催化剂对化学反应速率的影响,使用实验 和 (用Ⅰ~Ⅳ表示,下同),如果研究温度对化学反应速率的影响,使用实验 和 (用Ⅰ~Ⅳ表示,下同)。
(4)实验Ⅰ和Ⅳ研究浓度对反应速率的影响,Ⅳ中加入1mL蒸馏水的目的是 。
(5)反应I、III、IV中都可观察到反应速率先慢后快的现象,引起这种现象的原因是 。
23.回答下列问题:
(1)我校化学社团做了如下探究实验:利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究外界条件改变对化学反应速率的影响。实验数据如表所示:
实验 序号 实验温度/K KMnO4溶液(含硫酸) H2C2O4溶液 H2O 溶液颜色褪至无色时所需时间/s
A 293 2 0.02 5 0.1 3
B 293 2 0.02 3 0.1 8
C 313 2 0.02 0.1 5
①写出该反应的离子方程式: 。
②通过实验A、B可探究 (填外部因素)的改变对反应速率的影响,其中V1= ;通过实验 (填实验序号)可探究温度变化对化学反应速率的影响。
③利用实验B中数据计算,用KMnO4溶液的浓度变化表示的反应速率v(KMnO4)= 。
④实验中发现:反应一段时间后该反应速率会突然加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是 ,相应的粒子最有可能是 。
(2)一种新型催化剂能使NO和CO发生反应:2NO+2CO2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
实验 编号 t/℃ NO初始浓度/mol·L-1 CO初始浓度/mol·L-1 催化剂的比表面积/m2/g
I 280 82
II 280 b 124
Ⅲ 350 a 82
①表中a= ,b= 。
②能验证温度对化学反应速率影响规律的是实验 (填实验编号)。
③实验I和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验II的是曲线 (填“甲”或“乙”)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】升高温度能加快化学反应速率的主要原因是通过升高温度使分子获得更高的能量,活化分子百分数提高;温度升高使得含有较高能量的分子间的碰撞频率随之提高,增加分子碰撞机会,这是次要原因,故A正确;
故选A。
2.B
【详解】A.图分析可知MgO与CO2生成MgCO3,故A正确;
B.转化过程中无Mg(HCO3)2与H反应的信息,故B错误;
C.看图可知1molMgOCO2经过加入4molH2中间生成2molH2O,最后生成1molMgO和1molCH4,故C正确;
D.图中分析可知1molCO2和4molH2在Pd的作用下生成1molCH4和2molH2O,故D正确;
故选:B。
3.D
【分析】温度越高、浓度越大,则反应速率就越快,在实验中就最先出现浑浊。
【详解】因35℃>25℃,则选项B和D中的反应速率大于选项A和C中的反应速率,又B中,混合液中硫代硫酸钠和稀硫酸的浓度均为,D中硫代硫酸钠为、稀硫酸的浓度均为,则D中反应物的浓度大于B中反应物的浓度,则D中反应速率最快,即在实验中就最先出现浑浊;
答案选D。
4.C
【分析】由图可知,碘硫热化学分解、水循环制氢的化学工艺流程涉及的反应为、、,总反应为,反应中I2和SO2是反应的催化剂。
【详解】A.该工艺流程图中只有化学能与热能之间的相互转化,无其他能量变化,A正确;
B.根据上述分析可知:总反应为2H2O2H2↑+O2↑,B正确;
C.该工艺流程制氢是独立的三步反应组成的循环,该工艺流程中H2SO4和HI为中间产物,I2和SO2是反应的催化剂,C错误;
D.该工艺流程图中HI及H2SO4的分解反应,都需要高温在一定温度下进行, 因此需要消耗大量的热能,D正确;
故合理选项是C。
5.C
【详解】A.通过表格数据可知,反应前2s,C减少了0.16-0.12=0.04 mol,根据化学方程式可知,则CO增加了0.08 mol,则V(CO)===4.010-3 mol·L-1·S-1,故A错误;
B.固体和纯液体的浓度是常数,所以改变固体反应物的量不能改变反应速率,故B错误;
C.由表格数据可知,反应进行至4s末时,所以二氧化碳的转化率,故C正确;
D.由表格数据可知反应在第7s时已经建立平衡,通过化学方程式可知,CO2和C在反应中消耗的量是相等的,所以,平衡时剩余,所以,故D错误;
本题答案C。
6.A
【详解】由速率之比等于系数比,v(SO3)=2×0.04 mol·L-1·min-1=0.08 mol·L-1·min-1,a= 0.4mol L-1÷0.08mol L-1 min-1 =5 min,故选A。
7.C
【详解】对于一个化学反应来说,化学反应进行的快慢程度由内因决定,即由参加反应的物质本身的性质决定。对于可逆反应2SO2+O2 2SO3(正反应为放热反应),决定反应速率的主要因素是SO2和O2的性质,故合理选项是C。
8.A
【详解】A.挥发出的乙醇通过KOH溶液溶解了,能使酸性溶液褪色说明生成了乙烯,即发生消去反应,A正确;
B.向含的溶液中通入,再滴加淀粉溶液,溶液变蓝色,说明有单质碘生成,但不能说明亚铁离子是否被氧化,所以不能证明还原性:,B错误;
C.尿素与浓氢氧化钠加热条件下反应生成NH3和碳酸钠,氯化铵与浓氢氧化钠加热条件下反应生成NH3和氯化钠,均使湿润的红色石蕊试纸变蓝,C错误;
D.高锰酸钾过量,两支试管均不会褪色,D错误;
故选A。
9.A
【详解】A.据图可知该反应的反应物为N2和H2O,产物为NH3和O2,总反应为2N2+6H2O 4NH3+O2,A错误;
B.据图可知导带上H2O结合h+反应生成氧气和氢离子,反应为2H2O +4h+= 4H++ O2↑ +4h,B正确;
C.整个过程吸收太阳光的能量发生,将光能转变为化学能,C正确;
D.H2O转变为H+和O2,H+和N2转变为NH3,说明H+是反应的中间体,D正确;
综上所述答案为A。
10.D
【详解】A.反应前后气体体积不变的反应,增大压强,体积减小,活化分子总数不变,但活化分子浓度增大,反应速率增大,故A错误;
B.温度升高,更多分子吸收能量成为活化分子,反应速率增大,活化能不变,故B错误;
C.使用催化剂,降低活化能,使更多分子成为活化分子,反应速率增大,故C错误;
D.酸和碱反应不需要外界做功的条件下就能发生,说明它们已经处于活跃状态,因此活化能非常小,故D正确。
答案选D。
11.基元反应构成的反应序列(又称反应机理)
【解析】略
12.(1)2:5
(2) Ⅰ Ⅱ Ⅰ Ⅲ
(3)浓度
【分析】探究反应物浓度、温度、催化剂对反应速率影响,需在其它条件相同的条件下设置对比实验;对比实验I和IV,根据两个实验中反应物不同量分析实验目的;对比实验中,必须确保溶液总体积相同,以此解题。
【详解】(1)反应MnO4-+H2C2O4+H+ →Mn2++CO2↑+H2O中,Mn元素的化合价由+7价降至+2价,MnO4-为氧化剂,1molMnO4-得到5mol电子,C元素的化合价由+3价升至+4价,H2C2O4为还原剂,1molH2C2O4失去2mol电子,根据得失电子守恒,氧化剂与还原剂物质的量之比为2:5;
(2)研究催化剂对化学反应速率的影响,应保证温度、浓度相同,则选实验Ⅰ和Ⅱ;研究温度对化学反应速率的影响,应保证浓度、不使用催化剂相同,则选实验Ⅰ和Ⅲ;
(3)实验Ⅰ和Ⅳ,硫酸的浓度不同,可研究硫酸溶液浓度对反应速率的影响。
13. 增大 减小 (15—20)min、(25—30)min 增大了O2的浓度 a、b
【详解】(1)正反应是放热反应,所以降低温度,正逆反应速率均是减小的,平衡向正反应方向进行,所以平衡常数增大。
(2)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以根据图象可知,处于平衡状态的是15~20min,25~30min。
(3)反应进行至20 min时,氧气的浓度突然增大,而SO2的浓度逐渐减小,三氧化硫的浓度逐渐增大,所以改变的条件是增大氧气的浓度;根据图象可知,10 min到15 min时,物质的浓度变化量增大,即反应速率加快,所以改变的条件是使用了催化剂或改变了压强,答案选ab。
14.(1)Fe2O3作催化剂时,在相对较低温度下可获得较高的SO2的转化率,从而节约大量能源
(2)1.6
【详解】(1)由题干图象信息可知,Fe2O3作催化剂时,在相对较低温度下可获得较高的SO2的转化率,从而节约大量能源,故答案为:Fe2O3作催化剂时,在相对较低温度下可获得较高的SO2的转化率,从而节约大量能源;
(2)工业上还可用Na2SO3溶液吸收烟气中的SO2:Na2SO3+SO2+H2O=2NaHSO3。某温度下用1.0mol/LNa2SO3溶液吸收纯净的SO2,当溶液中c(SO)降至0.2mol/L时,c(SO)减小了1.0mol/L-0.2mol/L=0.8mol/L,根据反应方程式可知,生成的c(HSO)=1.6mol/L,故此时溶液中c(HSO)约为1.6mol/L,故答案为:1.6。
15.(1)
(2)
(3)第二步反应
(4)
【详解】(1)图中的第一步反应属于放热反应,断键吸收的总能量 形成化学键放出的总能量=();
(2)图中的第一步反应加上第二步反应即可得到以、为原料生产尿素的反应,第二步反应的断键吸收的总能量 形成化学键放出的总能量=( ),则以、为原料生产尿素的热化学方程式: ;
(3)慢反应决定了总反应速率,即活化能大的这一步是决速步,则第二步反应为决速步;
(4)根据盖斯定律,由①+② ③即可得到分解生成与气体的热化学方程式: 。
16.(1) 3X+Y2Z 0.05mol L-1 min-1
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890kJ mol-1
【分析】根据图象中曲线的变化判断反应物和生成物,利用各物质的量的变化判断反应的系数比;根据盖斯定律计算总反应的焓变;
【详解】(1)根据图象中减小的是反应物,增大的是生成物,故反应物是X和Y ,生成物是Z,根据变化量之比等于系数比,且在2min中各物质的量都保持不变,且不为零,故反应为可逆反应,反应方程为:3X+Y2Z;故答案为:3X+Y2Z;根据图象及速率公式 ,故答案为:0.05mol L-1 min-1;
(2)根据盖斯定律,①×+②×得甲烷燃烧热的焓变为-890kJ mol-1,故甲烷燃烧热的化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890kJ mol-1;
【点睛】此题考查焓变的计算及速率计算;根据图象信息进行判断,注意可逆反应的判断。
17. 生成物能量 降低 E-△H 0.03 -1580
【详解】(1)因图中C表示生成物总能量,该反应通常用V2O5作催化剂,催化剂改变了反应的历程使活化能降低,故加V2O5会使图中B点降低;(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变,图中反应的逆反应活化能为:E-△H;(3)根据反应速率之比等于化学计量数之比,如果反应速率 v(SO2)为0.06 mol·L-1·min-1,则 v(O2)= v(SO2)=×0.06mol·L-1·min-1 =0.03 mol·L-1·min-1;(4)已知1mol SO2(g)氧化为 lmol SO3(g)的△H =-99kJ·mol-1 ,则有:①2SO2(g) +O2(g) 2SO3(g) △H1 =-198kJ·mol-1 ,②S(s) + O2(g)= SO2(g) △H2 =-296kJ·mol-1,根据盖斯定律,由②×4+①×2可得:4S(s) + 6O2(g)= 4SO3(g) △H =2△H1 +4△H2= -1580 kJ·mol-1。
18.(1)Ea(TiO2)>Ea(Cu)>Ea(Pt)>Ea(Ag)
(2)8.9×10-7
(3)<
(4)大于
(5)0.45
【解析】(1)
从图示看出:反应速率由快到慢的顺序为:Ag、Pt、Cu、TiO2,活化能越小,反应越容易进行,反应速率越快,故活化能由大到小顺序为:Ea(TiO2)>Ea(Cu)>Ea(Pt)>Ea(Ag);
(2)
从图象可看出:400 s时,Pt催化分解生成O2 8 mL,其物质的量为n(O2)=,则1 s分解产生O2:;
(3)
反应温度越高,化学反应速率越快。根据图示可知,在温度T2 (虚线)的反应速率较大,则T1
a到b的过程为正反应速率逐渐减小,且b点v(正)>v(逆)。则a点的正反应速率大于b点的逆反应速率;
(5)
b点时环戊二烯的浓度变化为△c(Y)=1.5 mol/L-0.6 mol/L=0.9 mol/L,环戊二烯的二聚体的浓度为环戊二烯浓度变化的,则b点时二聚体的浓度c(Y2)=0.9 mol/L×=0.45 mol/L。
19.(1)降低了反应的活化能
(2) 探究浓度对反应速率的影响 向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)
(3)碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
【详解】(1)加入催化剂能使化学反应速率加快,其原因是加入催化剂降低了反应的活化能,使更多的普通分子变为活化分子,增大了活化分子的碰撞几率,使活化分子的有效碰撞增多,从而加快反应速率。
(2)实验①和②的区别是①中H2O2的浓度小,②中H2O2的浓度大,所以实验①和②的目的是探究浓度对反应速率的影响。为了能够通过实验①和②探究浓度对反应速率的影响,对原实验方案进行改进,可向反应物中加入等量同种催化剂或将盛有反应物的试管放入同一热水浴中观察实验现象。
(3)由图象知实验⑤反应速率最快,实验④反应速率最慢,说明碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率。
20.(1) 增大 减小
(2) 减小 减小
(3) 增大 增大
(4) 不变 不变
(5) 增大 增大
(6) 增大 增大
【解析】(1)
体积不变,反应①通入N2,N2浓度增大,v1增大;反应②分离出I2(g),I2(g)浓度降低,v2减小;故答案为:增大;减小;
(2)
保持压强不变,反应①②通入“He”气,则体积增大,反应体系中各组分浓度减小,v1减小,v2减小;故答案为:减小;减小;
(3)
反应①、反应②均压缩体积,反应体系中各组分浓度增大,v1增大,v2增大;故答案为:增大;增大;
(4)
保持体积不变,反应①②通入“He”气,反应体系中各组分浓度不变,v1不变,v2不变;故答案为:不变;不变;
(5)
其他条件不变,反应①②均升温,升温反应速率均变大,v1增大,v2增大;故答案为:增大;增大;
(6)
其他条件不变,反应①②均加入正催化剂,加入正催化剂反应速率均变大,v1增大,v2增大;故答案为:增大;增大。
21.(1)
(2) 浓度 1 293 B、C 3
(3) 浓度越大,反应速率越快
(4) 不合理 阴离子种类不同
【详解】(1)草酸被高锰酸钾氧化为二氧化碳,高锰酸根离子被还原为锰离子,反应的离子方程式为;
(2)实验A、B中草酸的浓度不用,可探究出浓度的改变对化学反应速率的影响,根据“控制变量法”,为使的浓度相同,必须使混合后溶液的总体积相等,所以1,温度相同293K;实验B、C的变量是温度,通过实验B、C可探究出温度变化对化学反应速率的影响;为控制草酸的浓度相同,3。
(3)若,由此实验可以得出的结论是浓度越大,反应速率越快;根据实验B中数据,0-8s内,用的浓度变化表示的反应速率= 。
(4)由于两溶液中加入的阴离子、阳离子都不相同,所以不能得出和对分解的催化效果。
22. 2:5 生成气泡速率 Ⅰ Ⅱ Ⅰ Ⅲ 保证KMnO4溶液与H2C2O4溶液的起始浓度相同或确保溶液总体积不变 生成的Mn2+有催化作用
【分析】利用控制变量法研究不同条件对化学反应速率的影响,Ⅰ为对照实验;Ⅱ与Ⅰ作比较,探究催化剂对化学反应速率的影响;Ⅲ与Ⅰ作比较,探究温度对化学反应速率的影响;IV与Ⅰ作比较,探究酸度对化学反应速率的影响,加入1mL蒸馏水是为了保证KMnO4溶液与H2C2O4溶液的起始浓度相同或确保溶液总体积不变。
【详解】(1)中,Mn元素的化合价降低,C元素的化合价升高,MnO4为氧化剂,H2C2O4为还原剂,氧化剂和还原剂的物质的量之比为2:5;
(2)因为有气体生成,可以通过观察生成气泡速率判断反应速率;
(3)研究催化剂对化学反应速率的影响,应保证温度、浓度相同,则选实验Ⅰ、Ⅱ ;研究温度对化学反应速率的影响,应保证浓度、不使用催化剂相同,则选实验Ⅰ、Ⅲ;
(4)对比实验Ⅰ和IV,IV中只加入1mL 10%硫酸,与Ⅰ中加入的溶液体积不等,就不能保证4mL 0.01mol·L-1 KMnO4溶液与2mL 0.1mol·L-1 H2C2O4溶液中反应物浓度相同,实验IV中加入1mL蒸馏水的目的是保证KMnO4溶液与H2C2O4溶液的起始浓度相同或确保溶液总体积不变;
(5)Ⅰ、Ⅲ、IV中没有加入催化剂,但反应中都生成Mn2+,随着反应进行反应物浓度减小,反应速率应该减慢,但实际上观察到反应速率先慢后快的现象,是生成的Mn2+有催化作用。
23.(1) H2C2O4溶液浓度的改变对反应速率的影响 5 BC 催化作用 Mn2+
(2) I、Ⅲ 乙
【详解】(1)①酸性KMnO4具有强氧化性,和H2C2O4溶液反应生成二氧化碳和锰离子,反应为;
②实验A、B中控制的变量为H2C2O4溶液浓度,可探究H2C2O4溶液浓度的改变对反应速率的影响,实验中溶液总体积要相同,故其中V1=5;
实验BC中控制的变量为H2C2O4溶液浓度,通过实验BC可探究温度变化对化学反应速率的影响。
③实验B中n(KMnO4)=2×10-3L×0.02mol/L=4×10-5mol,n(H2C2O4)=3×10-3L×0.1mol/L=3×10-4mol,反应中H2C2O4过量,KMnO4全部反应;KMnO4起始浓度为,用KMnO4溶液的浓度变化表示的反应速率v(KMnO4)= 。
④反应一段时间后该反应速率会突然加快,造成此种变化的原因是反应体系中的生成的锰离子对KMnO4与H2C2O4之间的反应有催化作用,故填:催化作用,Mn2+;
(2)①验证温度、催化剂的比表面积对化学反应速率的影响规律,设计了三组实验,实验I、II中变量为催化剂的比表面积,则b=;实验I、Ⅲ中变量为温度,则a=;
②实验I、Ⅲ中变量为温度,能验证温度对化学反应速率影响规律的是实验I、Ⅲ;
③已知增大催化剂的比表面积可提高该反应速率,实验Ⅱ中催化剂的比表面积更大,反应速率更快,故表示实验II的是曲线乙。
答案第1页,共2页
答案第1页,共2页
