广西钦州市浦北县2023-2024学年高二上学期10月月考化学试卷(含解析)
文档属性
| 名称 | 广西钦州市浦北县2023-2024学年高二上学期10月月考化学试卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 246.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-25 17:16:15 | ||
图片预览


文档简介
浦北县2023-2024学年高二上学期10月月考
化学
考试时间:60分钟
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32
一、单选题(每题4分,共14题)
1.下列有关热化学方程式书写及对应表述均正确的是( )。
A.已知2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,则可知C的燃烧热△H=-110.5kJ/mol
B.稀醋酸与0.1mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol
C.已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5kJ/mol
D.密闭容器中,16g硫粉与足量铁粉混合加热生成硫化亚铁时,放出47.8kJ热量。则Fe(s)+S(s)=FeS(s)△H=-95.6kJ/mol
2.已知可逆反应A2(g)+B2(g) 2AB(g)的能量变化如图所示,则下列叙述中不正确的是( )。
A.该反应的活化能为a kJ·mol-1 B.该反应的逆反应的活化能为b kJ·mol-1
C.该反应的ΔH=+(a-b) kJ·mol-1 D.使用催化剂,a的数值减小,ΔH也减小
3.下列有关热化学方程式的叙述正确的是( )。
A.在稀溶液中,H+(aq)+OH-(aq)=H2O(1) H=-57.3kJ/mol,若将1mol NaOH固体的加入1L 1mo/L的稀盐酸溶液中,放出的热量大于57.3kJ
B.已知:2H2(g)+O2(g)=2H2O(g) H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
C.已知:S(g)+O2(g)=SO2(g) H1;S(s)+O2(g)=SO2(g) H2,则 H1> H2
D.已知:N2(g)+3H2(g) 2NH3(g) H=-92kJ/mol,增加氮气和氢气的用量,则 H变大
4.用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H1=+64.3kJ·mol-1
②2H2O2(l)=2H2O(l)+O2(g) △H2= —196.1kJ·mol-1
③H2(g)+O2(g)=H2O(l) △H3= —285.8kJ·mol-1
在H2SO4溶液中,1molCu(s)与H2O2(l)反应生成Cu2+(aq)和H2O(l)的反应热△H等于
+546.7kJ·mol-1 B.—17.9kJ·mol-1
C.—118.5kJ·mol-1 D.—319.55kJ·mol-1
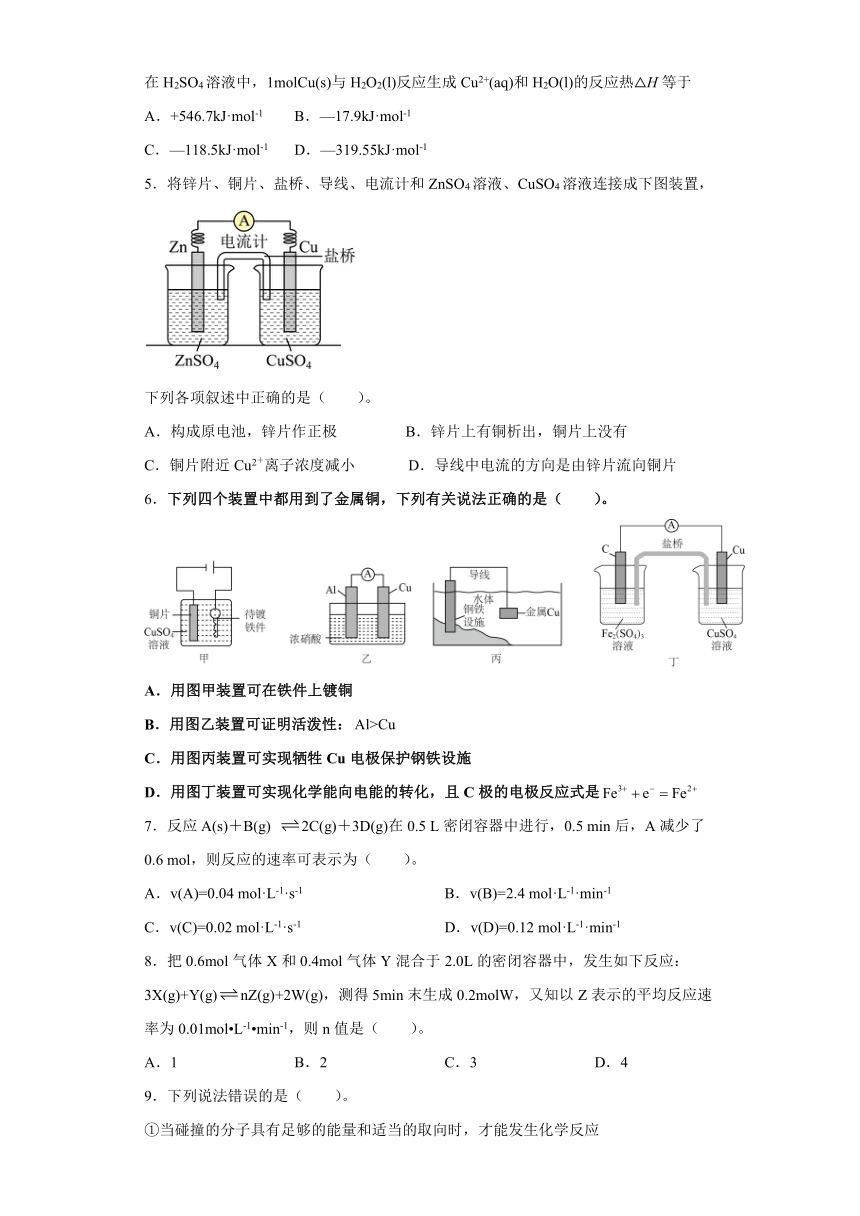
5.将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成下图装置,
下列各项叙述中正确的是( )。
A.构成原电池,锌片作正极 B.锌片上有铜析出,铜片上没有
C.铜片附近Cu2+离子浓度减小 D.导线中电流的方向是由锌片流向铜片
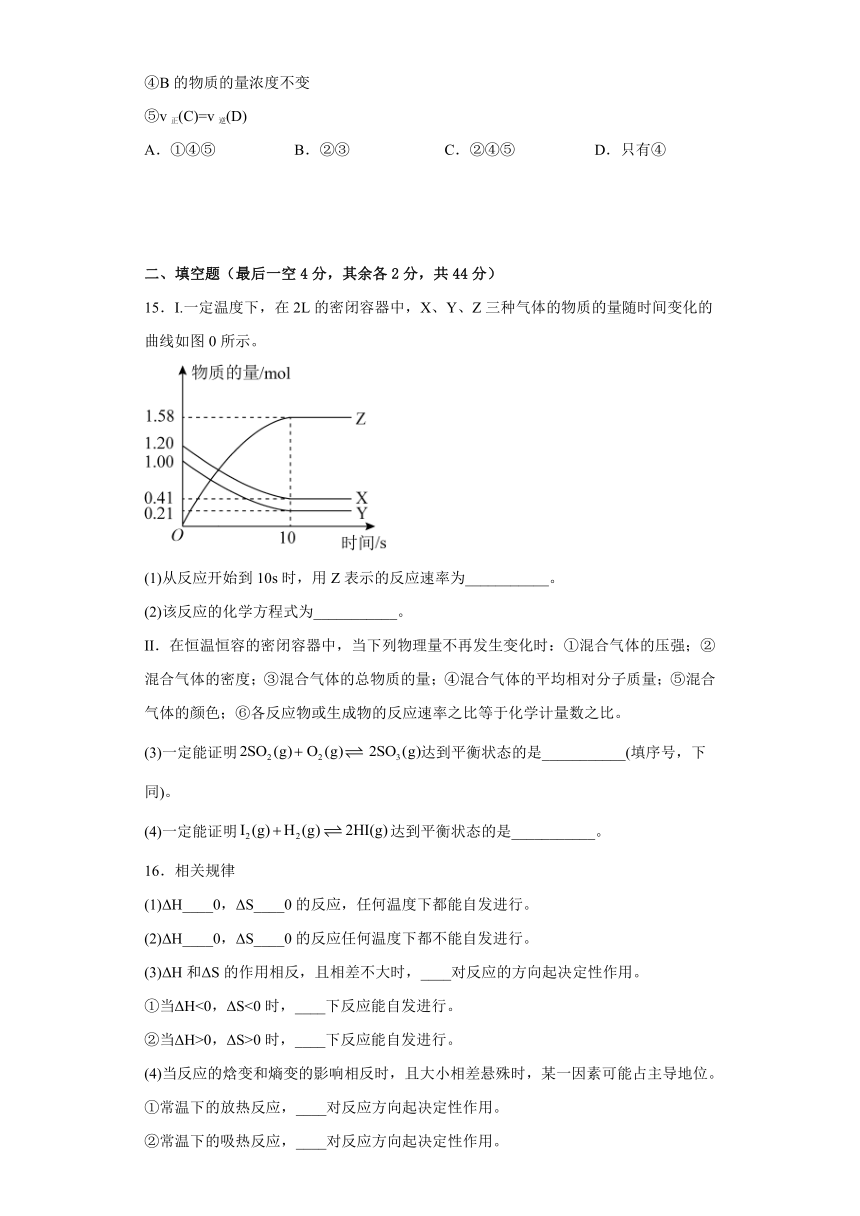
6.下列四个装置中都用到了金属铜,下列有关说法正确的是( )。
A.用图甲装置可在铁件上镀铜
B.用图乙装置可证明活泼性:
C.用图丙装置可实现牺牲Cu电极保护钢铁设施
D.用图丁装置可实现化学能向电能的转化,且C极的电极反应式是
7.反应A(s)+B(g) 2C(g)+3D(g)在0.5 L密闭容器中进行,0.5 min后,A减少了0.6 mol,则反应的速率可表示为( )。
A.v(A)=0.04 mol·L-1·s-1 B.v(B)=2.4 mol·L-1·min-1
C.v(C)=0.02 mol·L-1·s-1 D.v(D)=0.12 mol·L-1·min-1
8.把0.6mol气体X和0.4mol气体Y混合于2.0L的密闭容器中,发生如下反应:3X(g)+Y(g)nZ(g)+2W(g),测得5min末生成0.2molW,又知以Z表示的平均反应速率为0.01mol L-1 min-1,则n值是( )。
A.1 B.2 C.3 D.4
9.下列说法错误的是( )。
①当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
②发生有效碰撞的分子一定是活化分子
③活化分子间的碰撞一定是有效碰撞
④活化分子间每次碰撞都发生化学反应
⑤能发生有效碰撞的分子必须具有相当高的能量
A.①④ B.③④ C.④⑤ D.②⑤
10.关于有效碰撞理论,下列说法不正确的是( )。
A.相同条件下活化分子百分数越多,有效碰撞次数越多,反应速率越快
B.一般情况下,正、逆反应的活化能越小反应速率越快
C.增大压强提高活化分子百分数,反应速率增大
D.催化剂降低反应所需活化能,提高活化分子百分数反应速率增大
11.已知凡气体分子总数增多的反应一定是熵增大的反应。一定条件下,下列反应不能自发进行的是( )。
A.3O2(g)=2O3(g) △H>0 B.2C(s)+O2(g)=2CO(g) △H<0
C.N2(g)+3H2(g)2NH3(g) △H<0 D.CaCO3(s)=CaO(s)+CO2(g) △H>0
12.已知“凡气体分子总数增加的反应都是熵增大的反应”。下列反应在任何温度下都不自发进行的是( )。
A.2O3(g)=3O2(g) △H<0
B.2CO(g)=2C(s)+O2(g) △H>0
C.N2(g)+3H2(g)=2NH3(g ) △H<0
D.CaCO3(s)=CaO(s)+CO2(g) △H>0
13.在一定温度下的密闭容器中,不能说明可逆反应H2(g)+I2(g)=2HI(g)已经达到平衡的标志是( )。
A.HI的生成速率与HI的分解速率相等
B.HI的生成速率与H2的生成速率之比是2∶1
C.单位时间内一个H H键断裂的同时有两个H I键断裂
D.单位时间里断裂2n mol HI的同时生成nmol I2
14.一定温度下,在容积恒定的密闭容器中进行反应A(s)+2B(g) C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是( )。
①混合气体的密度不变
②容器内气体的压强不变
③混合气体的总物质的量不变
④B的物质的量浓度不变
⑤v正(C)=v逆(D)
A.①④⑤ B.②③ C.②④⑤ D.只有④
二、填空题(最后一空4分,其余各2分,共44分)
15.I.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图0所示。
(1)从反应开始到10s时,用Z表示的反应速率为___________。
(2)该反应的化学方程式为___________。
II.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强;②混合气体的密度;③混合气体的总物质的量;④混合气体的平均相对分子质量;⑤混合气体的颜色;⑥各反应物或生成物的反应速率之比等于化学计量数之比。
(3)一定能证明达到平衡状态的是___________(填序号,下同)。
(4)一定能证明达到平衡状态的是___________。
16.相关规律
(1)ΔH____0,ΔS____0的反应,任何温度下都能自发进行。
(2)ΔH____0,ΔS____0的反应任何温度下都不能自发进行。
(3)ΔH和ΔS的作用相反,且相差不大时,____对反应的方向起决定性作用。
①当ΔH<0,ΔS<0时,____下反应能自发进行。
②当ΔH>0,ΔS>0时,____下反应能自发进行。
(4)当反应的焓变和熵变的影响相反时,且大小相差悬殊时,某一因素可能占主导地位。
①常温下的放热反应,____对反应方向起决定性作用。
②常温下的吸热反应,____对反应方向起决定性作用。
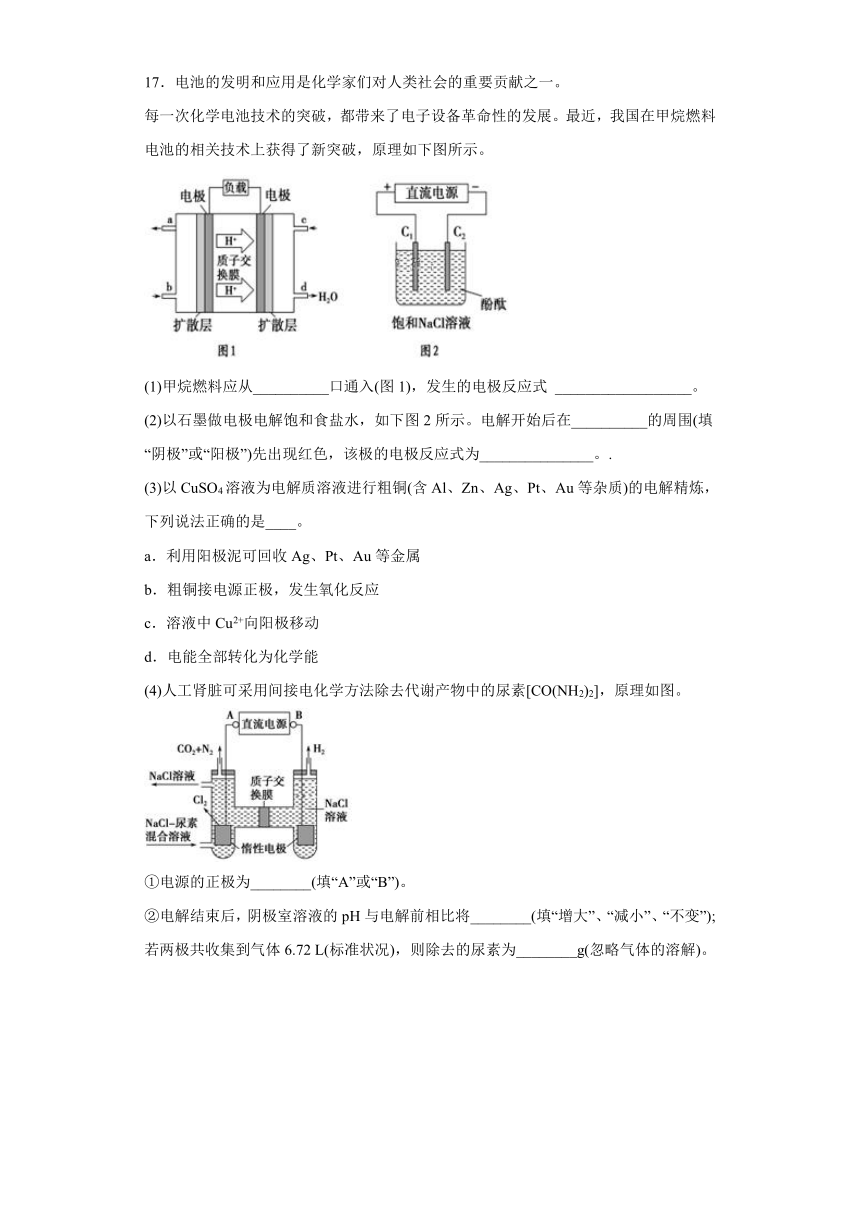
17.电池的发明和应用是化学家们对人类社会的重要贡献之一。
每一次化学电池技术的突破,都带来了电子设备革命性的发展。最近,我国在甲烷燃料电池的相关技术上获得了新突破,原理如下图所示。
(1)甲烷燃料应从__________口通入(图1),发生的电极反应式 __________________。
(2)以石墨做电极电解饱和食盐水,如下图2所示。电解开始后在__________的周围(填“阴极”或“阳极”)先出现红色,该极的电极反应式为_______________。.
(3)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是____。
a.利用阳极泥可回收Ag、Pt、Au等金属
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.电能全部转化为化学能
(4)人工肾脏可采用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图。
①电源的正极为________(填“A”或“B”)。
②电解结束后,阴极室溶液的pH与电解前相比将________(填“增大”、“减小”、“不变”);若两极共收集到气体6.72 L(标准状况),则除去的尿素为________g(忽略气体的溶解)。
参考答案:
1.D【详解】A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物所放出的热量,C燃烧生成的稳定氧化物是CO2(g)而不是CO(g),A项错误;
B.稀溶液中强酸与强碱的中和热为H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ·mol-1,醋酸为弱酸,其电离吸热,其中和热的数值小于57.3kJ·mol-1,B项错误;
C.1mol氢气完全燃烧生成液态水放热285.5kJ,则1mol液态水完全分解吸热285.5kJ,水分解的热化学方程式可写成2H2O(l)=2H2(g)+O2(g) ΔH=+571kJ·mol-1,C项错误;
D.16g硫粉(0.5mol)与足量铁粉混合加热生成硫化亚铁时,放出47.8kJ热量,热化学方程式为Fe(s)+S(s)=FeS(s) ΔH=-95.6kJ·mol-1,D项正确。
2.D【详解】A.活化能为反应物与图像中能量最高点的差值,即a kJ·mol-1,A正确;
B.该反应逆反应的活化能为产物与图像最高点的差值,即b kJ·mol-1,B正确;
C.由图可知,反应物能量低于产物能量,反应为吸热反应,ΔH为产物与反应物能量之差,应为正值,由图可知+(a-b) 为正数,C正确;
D.催化剂可降低反应的活化能,但不能改变反应的焓变,D错误;
3.A【详解】A.在稀溶液中,H+(aq)+OH-(aq)=H2O(1) H=-57.3kJ/mol,固体氢氧化钠溶于水也会放热,则若将1mol NaOH固体加入1L 1mo/L的稀盐酸溶液中,放出的热量大于57.3kJ,A正确;
B.燃烧热是指在101kP时,1mol可燃物完全燃烧生成指定产物时的反应热,常见元素的指定产物:H→H2O(l),根据2H2(g)+O2(g)=2H2O(g) H=-483.6kJ/mol,氢气的燃烧热数值不是此数值,B错误;
C.燃烧是放热反应,焓变小于零,放出热量越多,焓变越小,气态硫能量比等质量的固态硫能量高,因此硫蒸气充分燃烧放出的热量更多。已知:S(g)+O2(g)=SO2(g) H1;S(s)+O2(g)=SO2(g) H2,则 H1< H2,C错误;
D.已知:N2(g)+3H2(g)2NH3(g) H=-92kJ/mol,即消耗1mol氮气和3mol氢气生成2mol氨气时放热92kJ,则焓变与该化学方程式的化学计量数相关,跟实际反应中氮气和氢气的用量无关,即增加氮气和氢气的用量, H不变,D错误;
4.D【详解】由盖斯定律可知,①+②×+③可得反应Cu(s)+H2O2(1)+2H+(aq)=Cu2+(aq)+2H2O(1),则△H=(+64.3kJ/mol)+(—196.1 kJ/mol)×+(—285.8 kJ/mol)=—319.55kJ/mol,故选D。
5.C【详解】A.该装置为原电池装置,锌片失去电子,发生氧化反应,则锌片作负极,A错误;
B.锌片作负极,电极反应为Zn-2e-=Zn2+,铜片作正极,电极反应为Cu2++2e-=Cu,则锌片上没有铜析出,铜片上有铜析出,B错误;
C.铜片作正极,电极反应为Cu2++2e-=Cu,则铜片附近Cu2+离子浓度减小,C正确;
D.锌片作负极,铜片作正极,导线作外电路,则电流的方向为由铜片流向锌片,D错误;
6.D【详解】A.在铁件上镀铜,铁件作阴极、铜棒作阳极,故A错误;
B.铝在浓硝酸中钝化,图乙装置,Cu是负极、Al是正极,不能证明活泼性:,故B错误;
C.铁的活泼型大于铜,铜、铁构成原电池,铁为负极,图丙装置不能牺牲Cu电极保护钢铁,故C错误;
D.铜和Fe3+反应生成Cu2+、Fe2+,图丁装置构成原电池,可实现化学能向电能的转化, Cu是负极、C极是正极,正极的电极反应式是,故D正确;
7.B【详解】反应速率通常用单位时间内浓度的变化量来表示, 0.5 min 即30s内A减少了0.60mol,所以用A单位时间内转化的物质的量与B相同,故表示的反应速率为v(B)==0.04 mol·L-1·s-1=2.4 mol·L-1·min-1,由各物质的化学反应速率之比等于化学计量数之比可知v(C)=2v(B)=0.08mol·L-1·s-1、v(D) =3v(B)=7.2 mol·L-1·min-1;
8.A【详解】5min末生成0.2molW可知,W的5min的平均反应速率v(W)=,由化学反应速率之比等于化学计量数之比可得:,解得n=1,故选A。
9.B【详解】分子具有足够的能量才是活化分子,活化分子之间发生碰撞时必须具有合适的取向才能发生有效碰撞,发生有效碰撞才能发生化学反应,故发生有效碰撞的分子一定是活化分子,故①②正确;但活化分子之间的碰撞不一定是有效碰撞,要有适当的取向才是有效碰撞,故③错误;活化分子间发生有效碰撞才能发生化学反应,无效碰撞不发生化学反应,故④错误;分子具有足够的能量才是活化分子,能发生有效碰撞的分子必须具有相当高的能量,故⑤正确;故答案为B。
10.C【详解】A.相同条件下活化分子百分数越多,有效碰撞次数越多,会使得化学反应速率越快,A正确;
B.过渡态物质的总能量与反应物总能量的差值为活化能,活化能越大反应越慢;一般情况下,正、逆反应的活化能越小反应速率越快,B正确;
C.增大压强时,能增大单位体积内活化分子的个数,但活化分子百分数是不变的,C错误;
D.催化剂降低反应所需活化能,使得活化分子百分数得到提高,促使反应速率增大,D正确;
11.A【详解】利用ΔG=△H-TΔS进行分析,凡ΔG<0的反应,能自发进行。
A.反应3O2(g)=2O3(g), △H>0,ΔS<0,ΔG=△H-TΔS>0,该反应一定不能自发进行,A符合题意;
B.反应2C(s)+O2(g)=2CO(g),ΔH<0,ΔS>0,该反应一定能自发进行,B不合题意;
C.反应N2(g)+3H2(g) 2NH3(g),ΔH<0,ΔS<0,该反应在低温下能自发进行,C不合题意;
D.反应CaCO3(s)=CaO(s)+CO2(g),ΔH>0,ΔS>0,该反应在高温下能自发进行,D不合题意;
12.B【详解】A.该反应ΔH<0,ΔS>0,任何温度下都能自发进行,选项A不符合;
B.该反应ΔH>0,ΔS<0,任何温度都不能自发进行,选项B符合;
C.该反应ΔH<0,ΔS<0,低温条件下能自发进行,选项C不符合;
D.该反应ΔH>0,ΔS>0,高温条件下能自发进行,选项D不符合;
13.D
【详解】A.HI的生成速率与HI的分解速率相等,HI的物质的量浓度不再改变,因此能作为判断平衡标志,故A不符合题意;
B.HI的生成速率,正向反应,H2的生成速率,逆向反应,HI的生成速率与H2的生成速率之比是2∶1,速率之比等于计量系数之比,能作为判断平衡标志,故B不符合题意;
C.单位时间内一个H H键断裂,正向反应,同时有两个H I键断裂,逆向反应,两者比率等于计量系数之比,能作为判断平衡标志,故C不符合题意;
D.单位时间里断裂2n mol HI,逆向反应,同时生成nmol I2,逆向反应,同一个方向,因此不能作为判断平衡标志,故D符合题意。
14.A【详解】①混合气的密度等于混合气的总质量除以容器体积,A是固体,所以混合气的总质量是一个变量,容器体积是定值,所以混合气密度在未平衡前一直在变化,当密度不变时,反应达到平衡状态;②该反应是反应前后气体系数之和相等的反应,在温度和容积一定时,压强和气体的总物质的量成正比,所以容器内气体的压强一直不变,则压强不变不能判断该反应是否平衡;③该反应的混合气的总物质的量一直不变,故不能用总的物质的量不变判断是否平衡;④B的物质的量浓度不再变化说明达到了平衡状态;⑤用C表示的正反应速率等于用D表示的逆反应速率,说明正逆反应速率相等,反应达到了平衡状态;故①④⑤都是平衡状态的标志,故答案为:A。
15.(1)
(2)
(3)①③④
(4)⑤
16.(1) < >
(2) > <
(3) 温度 低温 高温
(4) 焓变 熵变
17. b CH4-8e-+2H2O=CO2+8H+ 阴极 2H++2e-=H2↑或2H2O+2e- = H2↑+ 2OH- ab A 不变 3.6
【详解】
(4)①根据电解池中阴离子在阳极放电和阳离子在阴极放电的规律及图中的电极产物H2和Cl2,可以判断出放出氢气的电极为阴极,与之连接的电极B为电源的负极,A为电源的正极,故答案为:A;
②阴极反应为:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑),阳极反应为:6Cl--6e-=3Cl2↑,阳极附近还发生反应CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl。
根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;由上述反应式可以看出,转移6mole-时,阴极产生3molH2,阳极产生1molN2和1molCO2,故电解收集到的6.72 L气体中,V(N2)=V(CO2)==1.344 L,即n(N2)=n(CO2)==0.06mol,根据方程式CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl可知生成0.06 mol N2所消耗的CO(NH2)2的物质的量也为0.06 mol,其质量为m[CO(NH2)2]=0.06 mol×60 g mol-1=3.6g,故答案为:不变;3.6。
化学
考试时间:60分钟
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32
一、单选题(每题4分,共14题)
1.下列有关热化学方程式书写及对应表述均正确的是( )。
A.已知2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,则可知C的燃烧热△H=-110.5kJ/mol
B.稀醋酸与0.1mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol
C.已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5kJ/mol
D.密闭容器中,16g硫粉与足量铁粉混合加热生成硫化亚铁时,放出47.8kJ热量。则Fe(s)+S(s)=FeS(s)△H=-95.6kJ/mol
2.已知可逆反应A2(g)+B2(g) 2AB(g)的能量变化如图所示,则下列叙述中不正确的是( )。
A.该反应的活化能为a kJ·mol-1 B.该反应的逆反应的活化能为b kJ·mol-1
C.该反应的ΔH=+(a-b) kJ·mol-1 D.使用催化剂,a的数值减小,ΔH也减小
3.下列有关热化学方程式的叙述正确的是( )。
A.在稀溶液中,H+(aq)+OH-(aq)=H2O(1) H=-57.3kJ/mol,若将1mol NaOH固体的加入1L 1mo/L的稀盐酸溶液中,放出的热量大于57.3kJ
B.已知:2H2(g)+O2(g)=2H2O(g) H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
C.已知:S(g)+O2(g)=SO2(g) H1;S(s)+O2(g)=SO2(g) H2,则 H1> H2
D.已知:N2(g)+3H2(g) 2NH3(g) H=-92kJ/mol,增加氮气和氢气的用量,则 H变大
4.用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H1=+64.3kJ·mol-1
②2H2O2(l)=2H2O(l)+O2(g) △H2= —196.1kJ·mol-1
③H2(g)+O2(g)=H2O(l) △H3= —285.8kJ·mol-1
在H2SO4溶液中,1molCu(s)与H2O2(l)反应生成Cu2+(aq)和H2O(l)的反应热△H等于
+546.7kJ·mol-1 B.—17.9kJ·mol-1
C.—118.5kJ·mol-1 D.—319.55kJ·mol-1
5.将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成下图装置,
下列各项叙述中正确的是( )。
A.构成原电池,锌片作正极 B.锌片上有铜析出,铜片上没有
C.铜片附近Cu2+离子浓度减小 D.导线中电流的方向是由锌片流向铜片
6.下列四个装置中都用到了金属铜,下列有关说法正确的是( )。
A.用图甲装置可在铁件上镀铜
B.用图乙装置可证明活泼性:
C.用图丙装置可实现牺牲Cu电极保护钢铁设施
D.用图丁装置可实现化学能向电能的转化,且C极的电极反应式是
7.反应A(s)+B(g) 2C(g)+3D(g)在0.5 L密闭容器中进行,0.5 min后,A减少了0.6 mol,则反应的速率可表示为( )。
A.v(A)=0.04 mol·L-1·s-1 B.v(B)=2.4 mol·L-1·min-1
C.v(C)=0.02 mol·L-1·s-1 D.v(D)=0.12 mol·L-1·min-1
8.把0.6mol气体X和0.4mol气体Y混合于2.0L的密闭容器中,发生如下反应:3X(g)+Y(g)nZ(g)+2W(g),测得5min末生成0.2molW,又知以Z表示的平均反应速率为0.01mol L-1 min-1,则n值是( )。
A.1 B.2 C.3 D.4
9.下列说法错误的是( )。
①当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
②发生有效碰撞的分子一定是活化分子
③活化分子间的碰撞一定是有效碰撞
④活化分子间每次碰撞都发生化学反应
⑤能发生有效碰撞的分子必须具有相当高的能量
A.①④ B.③④ C.④⑤ D.②⑤
10.关于有效碰撞理论,下列说法不正确的是( )。
A.相同条件下活化分子百分数越多,有效碰撞次数越多,反应速率越快
B.一般情况下,正、逆反应的活化能越小反应速率越快
C.增大压强提高活化分子百分数,反应速率增大
D.催化剂降低反应所需活化能,提高活化分子百分数反应速率增大
11.已知凡气体分子总数增多的反应一定是熵增大的反应。一定条件下,下列反应不能自发进行的是( )。
A.3O2(g)=2O3(g) △H>0 B.2C(s)+O2(g)=2CO(g) △H<0
C.N2(g)+3H2(g)2NH3(g) △H<0 D.CaCO3(s)=CaO(s)+CO2(g) △H>0
12.已知“凡气体分子总数增加的反应都是熵增大的反应”。下列反应在任何温度下都不自发进行的是( )。
A.2O3(g)=3O2(g) △H<0
B.2CO(g)=2C(s)+O2(g) △H>0
C.N2(g)+3H2(g)=2NH3(g ) △H<0
D.CaCO3(s)=CaO(s)+CO2(g) △H>0
13.在一定温度下的密闭容器中,不能说明可逆反应H2(g)+I2(g)=2HI(g)已经达到平衡的标志是( )。
A.HI的生成速率与HI的分解速率相等
B.HI的生成速率与H2的生成速率之比是2∶1
C.单位时间内一个H H键断裂的同时有两个H I键断裂
D.单位时间里断裂2n mol HI的同时生成nmol I2
14.一定温度下,在容积恒定的密闭容器中进行反应A(s)+2B(g) C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是( )。
①混合气体的密度不变
②容器内气体的压强不变
③混合气体的总物质的量不变
④B的物质的量浓度不变
⑤v正(C)=v逆(D)
A.①④⑤ B.②③ C.②④⑤ D.只有④
二、填空题(最后一空4分,其余各2分,共44分)
15.I.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图0所示。
(1)从反应开始到10s时,用Z表示的反应速率为___________。
(2)该反应的化学方程式为___________。
II.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强;②混合气体的密度;③混合气体的总物质的量;④混合气体的平均相对分子质量;⑤混合气体的颜色;⑥各反应物或生成物的反应速率之比等于化学计量数之比。
(3)一定能证明达到平衡状态的是___________(填序号,下同)。
(4)一定能证明达到平衡状态的是___________。
16.相关规律
(1)ΔH____0,ΔS____0的反应,任何温度下都能自发进行。
(2)ΔH____0,ΔS____0的反应任何温度下都不能自发进行。
(3)ΔH和ΔS的作用相反,且相差不大时,____对反应的方向起决定性作用。
①当ΔH<0,ΔS<0时,____下反应能自发进行。
②当ΔH>0,ΔS>0时,____下反应能自发进行。
(4)当反应的焓变和熵变的影响相反时,且大小相差悬殊时,某一因素可能占主导地位。
①常温下的放热反应,____对反应方向起决定性作用。
②常温下的吸热反应,____对反应方向起决定性作用。
17.电池的发明和应用是化学家们对人类社会的重要贡献之一。
每一次化学电池技术的突破,都带来了电子设备革命性的发展。最近,我国在甲烷燃料电池的相关技术上获得了新突破,原理如下图所示。
(1)甲烷燃料应从__________口通入(图1),发生的电极反应式 __________________。
(2)以石墨做电极电解饱和食盐水,如下图2所示。电解开始后在__________的周围(填“阴极”或“阳极”)先出现红色,该极的电极反应式为_______________。.
(3)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是____。
a.利用阳极泥可回收Ag、Pt、Au等金属
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.电能全部转化为化学能
(4)人工肾脏可采用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图。
①电源的正极为________(填“A”或“B”)。
②电解结束后,阴极室溶液的pH与电解前相比将________(填“增大”、“减小”、“不变”);若两极共收集到气体6.72 L(标准状况),则除去的尿素为________g(忽略气体的溶解)。
参考答案:
1.D【详解】A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物所放出的热量,C燃烧生成的稳定氧化物是CO2(g)而不是CO(g),A项错误;
B.稀溶液中强酸与强碱的中和热为H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ·mol-1,醋酸为弱酸,其电离吸热,其中和热的数值小于57.3kJ·mol-1,B项错误;
C.1mol氢气完全燃烧生成液态水放热285.5kJ,则1mol液态水完全分解吸热285.5kJ,水分解的热化学方程式可写成2H2O(l)=2H2(g)+O2(g) ΔH=+571kJ·mol-1,C项错误;
D.16g硫粉(0.5mol)与足量铁粉混合加热生成硫化亚铁时,放出47.8kJ热量,热化学方程式为Fe(s)+S(s)=FeS(s) ΔH=-95.6kJ·mol-1,D项正确。
2.D【详解】A.活化能为反应物与图像中能量最高点的差值,即a kJ·mol-1,A正确;
B.该反应逆反应的活化能为产物与图像最高点的差值,即b kJ·mol-1,B正确;
C.由图可知,反应物能量低于产物能量,反应为吸热反应,ΔH为产物与反应物能量之差,应为正值,由图可知+(a-b) 为正数,C正确;
D.催化剂可降低反应的活化能,但不能改变反应的焓变,D错误;
3.A【详解】A.在稀溶液中,H+(aq)+OH-(aq)=H2O(1) H=-57.3kJ/mol,固体氢氧化钠溶于水也会放热,则若将1mol NaOH固体加入1L 1mo/L的稀盐酸溶液中,放出的热量大于57.3kJ,A正确;
B.燃烧热是指在101kP时,1mol可燃物完全燃烧生成指定产物时的反应热,常见元素的指定产物:H→H2O(l),根据2H2(g)+O2(g)=2H2O(g) H=-483.6kJ/mol,氢气的燃烧热数值不是此数值,B错误;
C.燃烧是放热反应,焓变小于零,放出热量越多,焓变越小,气态硫能量比等质量的固态硫能量高,因此硫蒸气充分燃烧放出的热量更多。已知:S(g)+O2(g)=SO2(g) H1;S(s)+O2(g)=SO2(g) H2,则 H1< H2,C错误;
D.已知:N2(g)+3H2(g)2NH3(g) H=-92kJ/mol,即消耗1mol氮气和3mol氢气生成2mol氨气时放热92kJ,则焓变与该化学方程式的化学计量数相关,跟实际反应中氮气和氢气的用量无关,即增加氮气和氢气的用量, H不变,D错误;
4.D【详解】由盖斯定律可知,①+②×+③可得反应Cu(s)+H2O2(1)+2H+(aq)=Cu2+(aq)+2H2O(1),则△H=(+64.3kJ/mol)+(—196.1 kJ/mol)×+(—285.8 kJ/mol)=—319.55kJ/mol,故选D。
5.C【详解】A.该装置为原电池装置,锌片失去电子,发生氧化反应,则锌片作负极,A错误;
B.锌片作负极,电极反应为Zn-2e-=Zn2+,铜片作正极,电极反应为Cu2++2e-=Cu,则锌片上没有铜析出,铜片上有铜析出,B错误;
C.铜片作正极,电极反应为Cu2++2e-=Cu,则铜片附近Cu2+离子浓度减小,C正确;
D.锌片作负极,铜片作正极,导线作外电路,则电流的方向为由铜片流向锌片,D错误;
6.D【详解】A.在铁件上镀铜,铁件作阴极、铜棒作阳极,故A错误;
B.铝在浓硝酸中钝化,图乙装置,Cu是负极、Al是正极,不能证明活泼性:,故B错误;
C.铁的活泼型大于铜,铜、铁构成原电池,铁为负极,图丙装置不能牺牲Cu电极保护钢铁,故C错误;
D.铜和Fe3+反应生成Cu2+、Fe2+,图丁装置构成原电池,可实现化学能向电能的转化, Cu是负极、C极是正极,正极的电极反应式是,故D正确;
7.B【详解】反应速率通常用单位时间内浓度的变化量来表示, 0.5 min 即30s内A减少了0.60mol,所以用A单位时间内转化的物质的量与B相同,故表示的反应速率为v(B)==0.04 mol·L-1·s-1=2.4 mol·L-1·min-1,由各物质的化学反应速率之比等于化学计量数之比可知v(C)=2v(B)=0.08mol·L-1·s-1、v(D) =3v(B)=7.2 mol·L-1·min-1;
8.A【详解】5min末生成0.2molW可知,W的5min的平均反应速率v(W)=,由化学反应速率之比等于化学计量数之比可得:,解得n=1,故选A。
9.B【详解】分子具有足够的能量才是活化分子,活化分子之间发生碰撞时必须具有合适的取向才能发生有效碰撞,发生有效碰撞才能发生化学反应,故发生有效碰撞的分子一定是活化分子,故①②正确;但活化分子之间的碰撞不一定是有效碰撞,要有适当的取向才是有效碰撞,故③错误;活化分子间发生有效碰撞才能发生化学反应,无效碰撞不发生化学反应,故④错误;分子具有足够的能量才是活化分子,能发生有效碰撞的分子必须具有相当高的能量,故⑤正确;故答案为B。
10.C【详解】A.相同条件下活化分子百分数越多,有效碰撞次数越多,会使得化学反应速率越快,A正确;
B.过渡态物质的总能量与反应物总能量的差值为活化能,活化能越大反应越慢;一般情况下,正、逆反应的活化能越小反应速率越快,B正确;
C.增大压强时,能增大单位体积内活化分子的个数,但活化分子百分数是不变的,C错误;
D.催化剂降低反应所需活化能,使得活化分子百分数得到提高,促使反应速率增大,D正确;
11.A【详解】利用ΔG=△H-TΔS进行分析,凡ΔG<0的反应,能自发进行。
A.反应3O2(g)=2O3(g), △H>0,ΔS<0,ΔG=△H-TΔS>0,该反应一定不能自发进行,A符合题意;
B.反应2C(s)+O2(g)=2CO(g),ΔH<0,ΔS>0,该反应一定能自发进行,B不合题意;
C.反应N2(g)+3H2(g) 2NH3(g),ΔH<0,ΔS<0,该反应在低温下能自发进行,C不合题意;
D.反应CaCO3(s)=CaO(s)+CO2(g),ΔH>0,ΔS>0,该反应在高温下能自发进行,D不合题意;
12.B【详解】A.该反应ΔH<0,ΔS>0,任何温度下都能自发进行,选项A不符合;
B.该反应ΔH>0,ΔS<0,任何温度都不能自发进行,选项B符合;
C.该反应ΔH<0,ΔS<0,低温条件下能自发进行,选项C不符合;
D.该反应ΔH>0,ΔS>0,高温条件下能自发进行,选项D不符合;
13.D
【详解】A.HI的生成速率与HI的分解速率相等,HI的物质的量浓度不再改变,因此能作为判断平衡标志,故A不符合题意;
B.HI的生成速率,正向反应,H2的生成速率,逆向反应,HI的生成速率与H2的生成速率之比是2∶1,速率之比等于计量系数之比,能作为判断平衡标志,故B不符合题意;
C.单位时间内一个H H键断裂,正向反应,同时有两个H I键断裂,逆向反应,两者比率等于计量系数之比,能作为判断平衡标志,故C不符合题意;
D.单位时间里断裂2n mol HI,逆向反应,同时生成nmol I2,逆向反应,同一个方向,因此不能作为判断平衡标志,故D符合题意。
14.A【详解】①混合气的密度等于混合气的总质量除以容器体积,A是固体,所以混合气的总质量是一个变量,容器体积是定值,所以混合气密度在未平衡前一直在变化,当密度不变时,反应达到平衡状态;②该反应是反应前后气体系数之和相等的反应,在温度和容积一定时,压强和气体的总物质的量成正比,所以容器内气体的压强一直不变,则压强不变不能判断该反应是否平衡;③该反应的混合气的总物质的量一直不变,故不能用总的物质的量不变判断是否平衡;④B的物质的量浓度不再变化说明达到了平衡状态;⑤用C表示的正反应速率等于用D表示的逆反应速率,说明正逆反应速率相等,反应达到了平衡状态;故①④⑤都是平衡状态的标志,故答案为:A。
15.(1)
(2)
(3)①③④
(4)⑤
16.(1) < >
(2) > <
(3) 温度 低温 高温
(4) 焓变 熵变
17. b CH4-8e-+2H2O=CO2+8H+ 阴极 2H++2e-=H2↑或2H2O+2e- = H2↑+ 2OH- ab A 不变 3.6
【详解】
(4)①根据电解池中阴离子在阳极放电和阳离子在阴极放电的规律及图中的电极产物H2和Cl2,可以判断出放出氢气的电极为阴极,与之连接的电极B为电源的负极,A为电源的正极,故答案为:A;
②阴极反应为:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑),阳极反应为:6Cl--6e-=3Cl2↑,阳极附近还发生反应CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl。
根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;由上述反应式可以看出,转移6mole-时,阴极产生3molH2,阳极产生1molN2和1molCO2,故电解收集到的6.72 L气体中,V(N2)=V(CO2)==1.344 L,即n(N2)=n(CO2)==0.06mol,根据方程式CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl可知生成0.06 mol N2所消耗的CO(NH2)2的物质的量也为0.06 mol,其质量为m[CO(NH2)2]=0.06 mol×60 g mol-1=3.6g,故答案为:不变;3.6。
同课章节目录
