4.3金属的腐蚀与防护(含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.3金属的腐蚀与防护(含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1 | 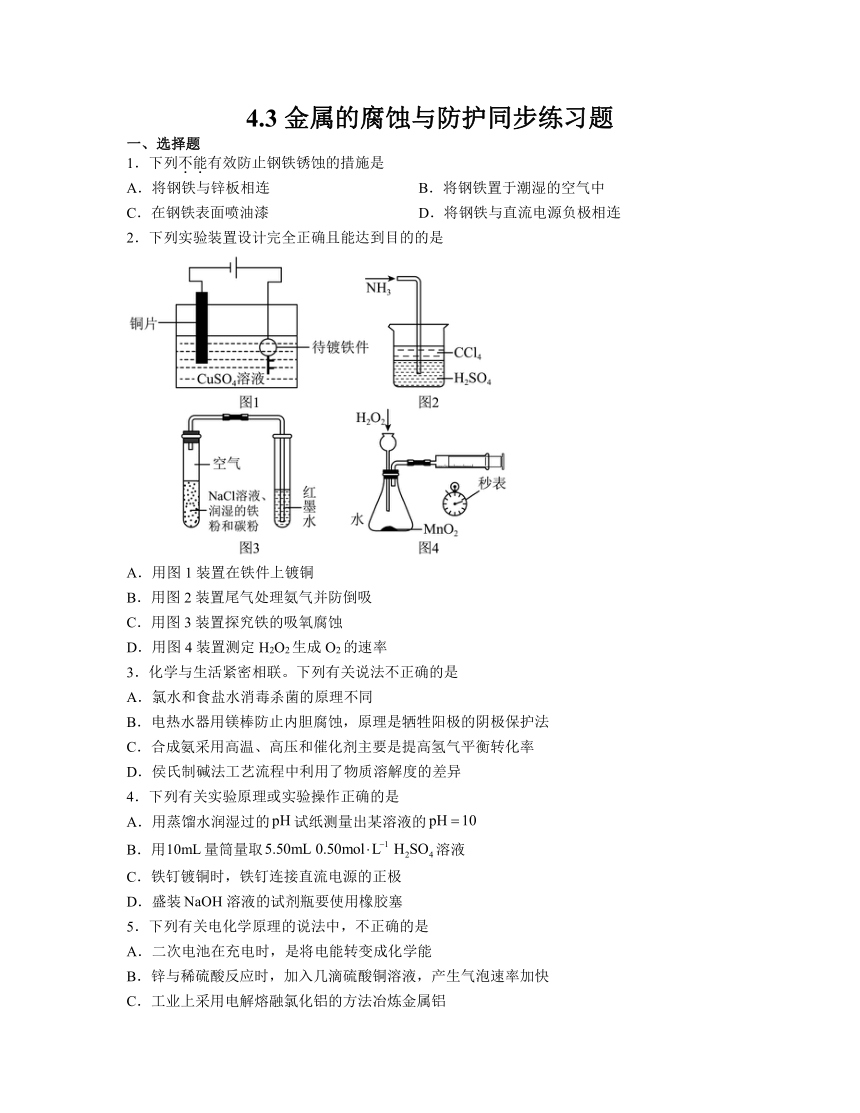 | |
| 格式 | docx | ||
| 文件大小 | 190.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-25 20:37:46 | ||
图片预览



文档简介
4.3金属的腐蚀与防护同步练习题
一、选择题
1.下列不能有效防止钢铁锈蚀的措施是
A.将钢铁与锌板相连 B.将钢铁置于潮湿的空气中
C.在钢铁表面喷油漆 D.将钢铁与直流电源负极相连
2.下列实验装置设计完全正确且能达到目的的是
A.用图1装置在铁件上镀铜
B.用图2装置尾气处理氨气并防倒吸
C.用图3装置探究铁的吸氧腐蚀
D.用图4装置测定H2O2生成O2的速率
3.化学与生活紧密相联。下列有关说法不正确的是
A.氯水和食盐水消毒杀菌的原理不同
B.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
C.合成氨采用高温、高压和催化剂主要是提高氢气平衡转化率
D.侯氏制碱法工艺流程中利用了物质溶解度的差异
4.下列有关实验原理或实验操作正确的是
A.用蒸馏水润湿过的试纸测量出某溶液的
B.用量筒量取溶液
C.铁钉镀铜时,铁钉连接直流电源的正极
D.盛装溶液的试剂瓶要使用橡胶塞
5.下列有关电化学原理的说法中,不正确的是
A.二次电池在充电时,是将电能转变成化学能
B.锌与稀硫酸反应时,加入几滴硫酸铜溶液,产生气泡速率加快
C.工业上采用电解熔融氯化铝的方法冶炼金属铝
D.水库里钢闸门与电源负极相连的方法叫做外加电源的阴极保护法
6.下列各变化中属于原电池反应的是
A.在空气中金属铝表面迅速氧化形成保护层
B.金属钠长期放置在空气中变质
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.锌与稀硫酸反应时,加入少量溶液可使反应加快
7.下列说法不正确的是
A.生铁中含碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.电解精炼铜时,阴极反应式为
D.在铁制品上镀铜时,铁制品连接电源的正极
8.钴(Co)的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是
A.工作时,Ⅰ室和Ⅱ室溶液的pH均增大
B.生成2 mol Co,Ⅰ室溶液质量理论上减少32 g
C.移除两交换膜后,石墨电极上发生的反应不变
D.电解总反应:
二、非选择题
9.下列说法正确的是________。
①用电解法精炼粗铜时,粗铜作阴极
②电解稀硫酸制H2和O2时铜做阳极
③可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
④电解熔融的氧化铝制取金属铝,用铁作阳极
⑤电解是把电能转化成化学能
⑥任何溶液被电解时,必然导致氧化还原反应的发生
⑦在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
⑧与铜质水龙头连接处的钢质水管不易发生腐蚀
⑨钢铁在潮湿的空气中不能发生电化学腐蚀
⑩用如图装置电解精炼铝
可充电电池在充电的时候是电解池
氯碱工业中,烧碱在阳极区生成
10.在原电池中,较活泼的金属发生_______反应,是______极;活动性较差的金属极上发生_______反应,是______极。潮湿空气中钢铁表面容易发生腐蚀,发生腐蚀时,铁是______极,电极反应式为_____;杂质碳是____极,电极反应式为_________。
【参考答案】
一、选择题
1.B
解析:A.由于金属活动性Zn>Fe,首先被腐蚀的是活动性强的Zn,Fe就得到了保护,所以能有效防止钢铁腐蚀,A不符合题意;
B.钢铁只与潮湿空气中,会加速钢铁生锈,不能有效防止钢铁腐蚀,B符合题意;
C.在钢铁表面喷涂油漆,起到隔绝空气和水作用,能有效防止钢铁腐蚀,C不符合题意;
D.钢铁与电源的负极相连,钢铁为阴极,外加电流的阴极保护法,钢铁受到保护,D不符合题意;
故选B。
2.C
解析:A.在铁件上镀铜需将铜作阳极,镀件作阴极,故图1装置阴极和阳极接反了,A错误;
B.NH3极易溶于水和硫酸中,用图2装置可以尾气处理氨气,但不能防倒吸,B错误;
C.可以用图3装置探究铁的吸氧腐蚀,发生的现象为红墨水上升形成倒吸,C正确;
D.由于长颈漏斗下端未形成液封,产生的H2可以从长颈漏斗中逸出,故不能用图4装置测定H2O2生成O2的速率,D错误;
故答案为:C。
3.C
解析:A.氯水中的次氯酸有强氧化性,食盐水能使细菌病毒脱水,它们消毒杀菌的原理不同,故A正确;
B.镁比铁活泼,易形成原电池负极,可防止电热水器内胆腐蚀,这是利用了栖牲阳极的阴极保护法,故B正确;
C.合成氨的反应是放热反应,采用高温并不利于反应正向移动,不能提高氢气平衡转化率,采用高温是为了提高化学反应速率,使用催化剂只能加快反应速率,不能提高氢气平衡转化率,故C不正确;
D.侯氏制碱法是将CO2、NH3通入饱和的氯化钠溶液中,发生以下的反应:NH3 +CO2 +H2O = NH4HCO3,NH4HCO3 + NaCl = NH4Cl + NaHCO3其中NaHCO3溶解度最小,故有NaHCO3的晶体析出,利用了物质溶解度的差异,故D正确;
故选C。
4.D
解析:A.pH试纸测量溶液的pH值时不能事先用蒸馏水润湿,A错误;
B.10 mL量筒量取溶液的体积时只能估读到小数点后一位,B错误;
C.向铁钉上镀铜时,镀件铁钉连接直流电源的负极,镀层金属连接在电源的正极上;C错误;
D.溶液呈碱性,容易与玻璃中的SiO2发生反应产生有粘性的Na2SiO3,若用玻璃塞就会导致玻璃瓶一玻璃塞粘在一起,所以盛装溶液的试剂瓶要使用胶塞,故D正确;
故选D。
5.C
解析:A.由能量转化关系可知,二次电池在充电时,是将电能转变成化学能,A项正确;
B.锌与稀硫酸反应时,加入几滴硫酸铜溶液,可形成锌铜原电池,加快反应速率,产生气泡更快,B项正确;
C.由于氯化铝为共价化合物,工业上通常采用电解熔融氧化铝的方法冶炼金属铝,C项错误;
D.水库里钢闸门与电源负极相连作阴极,被保护,该方法叫做外加电源的阴极保护法,D项正确;
故答案选C。
6.D
解析:A.在空气中金属铝表面迅速氧化形成保护层是发生的化学腐蚀,不是原电池反应,A错误;
B.金属钠长期放置在空气中,和空气中氧气变成 Na2O,进而变成 NaOH 和 Na2CO3,属于化学腐蚀,不属于原电池反应,B错误;
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层是铁与水蒸气反应生成四氧化三铁,不属于原电池反应,C错误;
D.锌和硫酸铜反应置换出铜,锌、铜和稀硫酸符合原电池构成条件,所以能构成原电池,使反应加快,D正确;
故选D。
7.D
解析:A.生铁中含碳,容易形成碳铁原电池,加速铁的锈蚀,故抗腐蚀能力比纯铁弱,A正确;
B.铁比锡活泼,用锡焊接的铁质器件,容易形成锡铁原电池,加速铁的锈蚀,故焊接处易生锈,B正确;
C.电解精炼铜时,阴极铜离子发生还原反应,反应式为,C正确;
D.在铁制品上镀铜时,镀件铁制品做阴极,连接电源的负极,D错误;
故选D。
8.D
解析:A.由分析可知,左边为阳极,放电生成的氢离子通过阳离子交换膜由Ⅰ室向Ⅱ室移动,使Ⅱ室中氢离子浓度增大,溶液pH减小,故A错误;
B.由分析可知,阴极生成2 mol钴,阳极有2 mol水放电生成1mol氧气和4mol氢离子,4mol氢离子穿过阳离子交换膜进入Ⅱ室,则Ⅰ室溶液质量减少36 g,故B错误;
C.若移除离子交换膜,氯离子的放电能力强于水,氯离子会在阳极失去电子发生氧化反应生成氯气,则移除离子交换膜,石墨电极的电极反应会发生变化,故C错误;
D.由分析可知,阳极是是中氢氧根失去电子,阴极是钴离子得到电子,则电解总反应为,故D正确。
综上所述,答案为D。
二、非选择题
9.①⑤⑥
解析:①电解精炼铜时,粗铜中的铜失去电子,做阳极,①错误;
②电解稀硫酸时,铜做阳极,失电子的是铜而不是溶液中的OH-,因而得不到氧气,②错误;
③外加直流电源保护器件时,必须连接电源负极,③错误;
④电解熔融的氧化铝制取金属铝,是用石墨作阳极,④错误;
⑤从能量角度看,电解是把电能转化成化学能的过程,⑤正确;
⑥电解质溶液的导电过程,必然伴随着两个电极上氧化、还原反应的发生,同时生成新的物质,⑥正确;
⑦与Zn块形成原电池,Zn作负极(阳极),从而保护Fe正极(阴极),⑦正确;
⑧铜和钢构成原电池,腐蚀速度加快,⑧错误;
⑨钢铁是铁和碳的混合物,在潮湿的空气的中易发生吸氧腐蚀,属于电化学腐蚀,⑨错误;
⑩电解氯化铝溶液无法制得金属铝,⑩错误;
可充电电池在放电时是原电池,充电的时候是电解池, 正确;
氯碱工业中,阴极区水中H+放电,促使水的电离平衡正向移动,产生OH-,因而NaOH在阴极区产生, 错误;
故正确的是①⑤⑥ 。
10. 氧化 负 还原 正 负 Fe-2e-=Fe2+ 正 O2+2H2O+4e-=4OH-
解析:在原电池中,较活泼的金属发生氧化反应,是负极;活动性较差的金属极上发生还原反应,是正极;钢铁中含有Fe、C,C、Fe和电解质溶液构成原电池,Fe易失电子作负极,电极反应式为Fe-2e-=Fe2+,C为正极,正极上氧气 得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-
一、选择题
1.下列不能有效防止钢铁锈蚀的措施是
A.将钢铁与锌板相连 B.将钢铁置于潮湿的空气中
C.在钢铁表面喷油漆 D.将钢铁与直流电源负极相连
2.下列实验装置设计完全正确且能达到目的的是
A.用图1装置在铁件上镀铜
B.用图2装置尾气处理氨气并防倒吸
C.用图3装置探究铁的吸氧腐蚀
D.用图4装置测定H2O2生成O2的速率
3.化学与生活紧密相联。下列有关说法不正确的是
A.氯水和食盐水消毒杀菌的原理不同
B.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
C.合成氨采用高温、高压和催化剂主要是提高氢气平衡转化率
D.侯氏制碱法工艺流程中利用了物质溶解度的差异
4.下列有关实验原理或实验操作正确的是
A.用蒸馏水润湿过的试纸测量出某溶液的
B.用量筒量取溶液
C.铁钉镀铜时,铁钉连接直流电源的正极
D.盛装溶液的试剂瓶要使用橡胶塞
5.下列有关电化学原理的说法中,不正确的是
A.二次电池在充电时,是将电能转变成化学能
B.锌与稀硫酸反应时,加入几滴硫酸铜溶液,产生气泡速率加快
C.工业上采用电解熔融氯化铝的方法冶炼金属铝
D.水库里钢闸门与电源负极相连的方法叫做外加电源的阴极保护法
6.下列各变化中属于原电池反应的是
A.在空气中金属铝表面迅速氧化形成保护层
B.金属钠长期放置在空气中变质
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.锌与稀硫酸反应时,加入少量溶液可使反应加快
7.下列说法不正确的是
A.生铁中含碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.电解精炼铜时,阴极反应式为
D.在铁制品上镀铜时,铁制品连接电源的正极
8.钴(Co)的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是
A.工作时,Ⅰ室和Ⅱ室溶液的pH均增大
B.生成2 mol Co,Ⅰ室溶液质量理论上减少32 g
C.移除两交换膜后,石墨电极上发生的反应不变
D.电解总反应:
二、非选择题
9.下列说法正确的是________。
①用电解法精炼粗铜时,粗铜作阴极
②电解稀硫酸制H2和O2时铜做阳极
③可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
④电解熔融的氧化铝制取金属铝,用铁作阳极
⑤电解是把电能转化成化学能
⑥任何溶液被电解时,必然导致氧化还原反应的发生
⑦在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
⑧与铜质水龙头连接处的钢质水管不易发生腐蚀
⑨钢铁在潮湿的空气中不能发生电化学腐蚀
⑩用如图装置电解精炼铝
可充电电池在充电的时候是电解池
氯碱工业中,烧碱在阳极区生成
10.在原电池中,较活泼的金属发生_______反应,是______极;活动性较差的金属极上发生_______反应,是______极。潮湿空气中钢铁表面容易发生腐蚀,发生腐蚀时,铁是______极,电极反应式为_____;杂质碳是____极,电极反应式为_________。
【参考答案】
一、选择题
1.B
解析:A.由于金属活动性Zn>Fe,首先被腐蚀的是活动性强的Zn,Fe就得到了保护,所以能有效防止钢铁腐蚀,A不符合题意;
B.钢铁只与潮湿空气中,会加速钢铁生锈,不能有效防止钢铁腐蚀,B符合题意;
C.在钢铁表面喷涂油漆,起到隔绝空气和水作用,能有效防止钢铁腐蚀,C不符合题意;
D.钢铁与电源的负极相连,钢铁为阴极,外加电流的阴极保护法,钢铁受到保护,D不符合题意;
故选B。
2.C
解析:A.在铁件上镀铜需将铜作阳极,镀件作阴极,故图1装置阴极和阳极接反了,A错误;
B.NH3极易溶于水和硫酸中,用图2装置可以尾气处理氨气,但不能防倒吸,B错误;
C.可以用图3装置探究铁的吸氧腐蚀,发生的现象为红墨水上升形成倒吸,C正确;
D.由于长颈漏斗下端未形成液封,产生的H2可以从长颈漏斗中逸出,故不能用图4装置测定H2O2生成O2的速率,D错误;
故答案为:C。
3.C
解析:A.氯水中的次氯酸有强氧化性,食盐水能使细菌病毒脱水,它们消毒杀菌的原理不同,故A正确;
B.镁比铁活泼,易形成原电池负极,可防止电热水器内胆腐蚀,这是利用了栖牲阳极的阴极保护法,故B正确;
C.合成氨的反应是放热反应,采用高温并不利于反应正向移动,不能提高氢气平衡转化率,采用高温是为了提高化学反应速率,使用催化剂只能加快反应速率,不能提高氢气平衡转化率,故C不正确;
D.侯氏制碱法是将CO2、NH3通入饱和的氯化钠溶液中,发生以下的反应:NH3 +CO2 +H2O = NH4HCO3,NH4HCO3 + NaCl = NH4Cl + NaHCO3其中NaHCO3溶解度最小,故有NaHCO3的晶体析出,利用了物质溶解度的差异,故D正确;
故选C。
4.D
解析:A.pH试纸测量溶液的pH值时不能事先用蒸馏水润湿,A错误;
B.10 mL量筒量取溶液的体积时只能估读到小数点后一位,B错误;
C.向铁钉上镀铜时,镀件铁钉连接直流电源的负极,镀层金属连接在电源的正极上;C错误;
D.溶液呈碱性,容易与玻璃中的SiO2发生反应产生有粘性的Na2SiO3,若用玻璃塞就会导致玻璃瓶一玻璃塞粘在一起,所以盛装溶液的试剂瓶要使用胶塞,故D正确;
故选D。
5.C
解析:A.由能量转化关系可知,二次电池在充电时,是将电能转变成化学能,A项正确;
B.锌与稀硫酸反应时,加入几滴硫酸铜溶液,可形成锌铜原电池,加快反应速率,产生气泡更快,B项正确;
C.由于氯化铝为共价化合物,工业上通常采用电解熔融氧化铝的方法冶炼金属铝,C项错误;
D.水库里钢闸门与电源负极相连作阴极,被保护,该方法叫做外加电源的阴极保护法,D项正确;
故答案选C。
6.D
解析:A.在空气中金属铝表面迅速氧化形成保护层是发生的化学腐蚀,不是原电池反应,A错误;
B.金属钠长期放置在空气中,和空气中氧气变成 Na2O,进而变成 NaOH 和 Na2CO3,属于化学腐蚀,不属于原电池反应,B错误;
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层是铁与水蒸气反应生成四氧化三铁,不属于原电池反应,C错误;
D.锌和硫酸铜反应置换出铜,锌、铜和稀硫酸符合原电池构成条件,所以能构成原电池,使反应加快,D正确;
故选D。
7.D
解析:A.生铁中含碳,容易形成碳铁原电池,加速铁的锈蚀,故抗腐蚀能力比纯铁弱,A正确;
B.铁比锡活泼,用锡焊接的铁质器件,容易形成锡铁原电池,加速铁的锈蚀,故焊接处易生锈,B正确;
C.电解精炼铜时,阴极铜离子发生还原反应,反应式为,C正确;
D.在铁制品上镀铜时,镀件铁制品做阴极,连接电源的负极,D错误;
故选D。
8.D
解析:A.由分析可知,左边为阳极,放电生成的氢离子通过阳离子交换膜由Ⅰ室向Ⅱ室移动,使Ⅱ室中氢离子浓度增大,溶液pH减小,故A错误;
B.由分析可知,阴极生成2 mol钴,阳极有2 mol水放电生成1mol氧气和4mol氢离子,4mol氢离子穿过阳离子交换膜进入Ⅱ室,则Ⅰ室溶液质量减少36 g,故B错误;
C.若移除离子交换膜,氯离子的放电能力强于水,氯离子会在阳极失去电子发生氧化反应生成氯气,则移除离子交换膜,石墨电极的电极反应会发生变化,故C错误;
D.由分析可知,阳极是是中氢氧根失去电子,阴极是钴离子得到电子,则电解总反应为,故D正确。
综上所述,答案为D。
二、非选择题
9.①⑤⑥
解析:①电解精炼铜时,粗铜中的铜失去电子,做阳极,①错误;
②电解稀硫酸时,铜做阳极,失电子的是铜而不是溶液中的OH-,因而得不到氧气,②错误;
③外加直流电源保护器件时,必须连接电源负极,③错误;
④电解熔融的氧化铝制取金属铝,是用石墨作阳极,④错误;
⑤从能量角度看,电解是把电能转化成化学能的过程,⑤正确;
⑥电解质溶液的导电过程,必然伴随着两个电极上氧化、还原反应的发生,同时生成新的物质,⑥正确;
⑦与Zn块形成原电池,Zn作负极(阳极),从而保护Fe正极(阴极),⑦正确;
⑧铜和钢构成原电池,腐蚀速度加快,⑧错误;
⑨钢铁是铁和碳的混合物,在潮湿的空气的中易发生吸氧腐蚀,属于电化学腐蚀,⑨错误;
⑩电解氯化铝溶液无法制得金属铝,⑩错误;
可充电电池在放电时是原电池,充电的时候是电解池, 正确;
氯碱工业中,阴极区水中H+放电,促使水的电离平衡正向移动,产生OH-,因而NaOH在阴极区产生, 错误;
故正确的是①⑤⑥ 。
10. 氧化 负 还原 正 负 Fe-2e-=Fe2+ 正 O2+2H2O+4e-=4OH-
解析:在原电池中,较活泼的金属发生氧化反应,是负极;活动性较差的金属极上发生还原反应,是正极;钢铁中含有Fe、C,C、Fe和电解质溶液构成原电池,Fe易失电子作负极,电极反应式为Fe-2e-=Fe2+,C为正极,正极上氧气 得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-
