2.4化学反应的调控(含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.4化学反应的调控(含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 344.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-25 20:41:22 | ||
图片预览



文档简介
2.4化学反应的调控同步练习题
一、选择题
1.我国科研人员研制了Ti H Fe双温区催化剂(Ti H区域和Fe区域的温度差可超过100℃)。利用该催化剂合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是
A.该历程中能量变化最大的是2.46eV,是氮分子中氮氮三键的断裂过程
B.在高温区加快了反应速率,低温区提高了氨的产率
C.③为N原子由Fe区域向Ti H区域的传递过程
D.①③在高温区发生,②④⑤在低温区发生
2.下列各反应达到化学平衡后,增大压强或降低温度,都能使化学平衡向正反应方向移动的是( )
A.C(s) + CO2(g)2CO(g) (正反应为吸热反应)
B.3O2(g)2O3(g)(正反应为吸热反应)
C.CO(g) + NO2(g)CO2(g)+NO(g) (正反应为放热反应)
D.N2 (g) + 3H2(g)2NH3(g) (正反应为放热反应)
3.某温度下,浓度均为的两种气体和在恒容密闭容器中发生反应生成气体Z,经过后,测得各物质的浓度分别为,,,则该反应的化学方程式可表示为( )
A. B.
C. D.
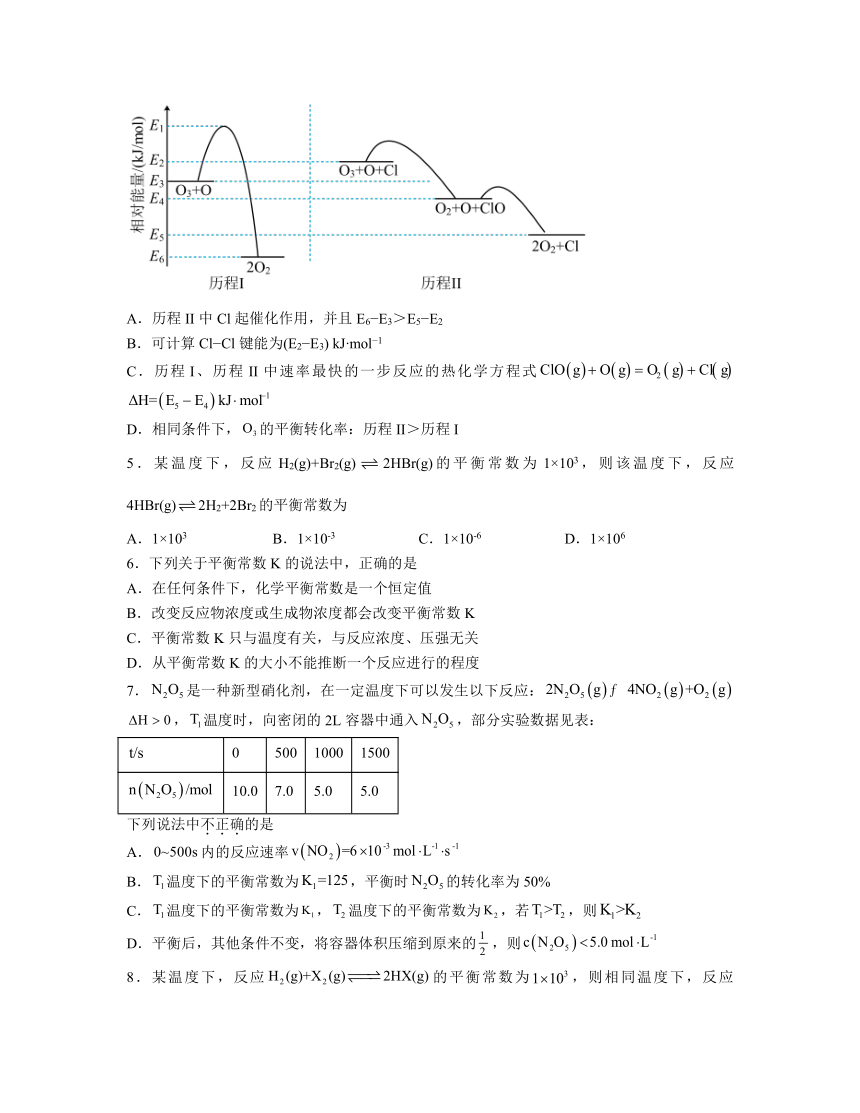
4.标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下(已知O2(g)和Cl2(g)的相对能量为0),下列说法正确的是
A.历程II中Cl起催化作用,并且E6 E3>E5 E2
B.可计算Cl Cl键能为(E2 E3) kJ mol 1
C.历程I、历程II中速率最快的一步反应的热化学方程式
D.相同条件下,的平衡转化率:历程II>历程I
5.某温度下,反应H2(g)+Br2(g)2HBr(g)的平衡常数为1×103,则该温度下,反应4HBr(g)2H2+2Br2的平衡常数为
A.1×103 B.1×10-3 C.1×10-6 D.1×106
6.下列关于平衡常数K的说法中,正确的是
A.在任何条件下,化学平衡常数是一个恒定值
B.改变反应物浓度或生成物浓度都会改变平衡常数K
C.平衡常数K只与温度有关,与反应浓度、压强无关
D.从平衡常数K的大小不能推断一个反应进行的程度
7.是一种新型硝化剂,在一定温度下可以发生以下反应: ,温度时,向密闭的2L容器中通入,部分实验数据见表:
0 500 1000 1500
10.0 7.0 5.0 5.0
下列说法中不正确的是
A.内的反应速率
B.温度下的平衡常数为,平衡时的转化率为50%
C.温度下的平衡常数为,温度下的平衡常数为,若,则
D.平衡后,其他条件不变,将容器体积压缩到原来的,则
8.某温度下,反应的平衡常数为,则相同温度下,反应的平衡常数为
A. B. C. D.
二、非选择题
9.在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g)ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
(1)根据图示,计算从反应开始到平衡时,平均反应速率v(NH3)=__。
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为___。
a.0.20mol·L-1 b.0.12mol·L-1 c.0.10mol·L-1 d.0.08mol·L-1
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡__移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数__(填“增大”、“减小”或“不变”)。
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol·L-1)。请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线___。
10.已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(CH3OH)]2,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
请回答下列问题:
(1)写出上述反应的化学方程式_____________________.
(2)该反应的正反应是_________反应(填“放热”或者“吸热”)
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
①此时系统温度400℃,比较正、逆反应速率的大小:v正____v逆(填“>”、“<”或“=”).
②若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中____点.比较图中B、D两点所对应的正反应速率B___D(填“>”、“<”或“=”).理由是__________________.
(4)一定条件下要提高反应物的转化率,可以采用的措施是________
a.升高温度b.加入催化剂
c.压缩容器的体积d.增加水蒸气的浓度
e.及时分离出产物.
【参考答案】
一、选择题
1.B
解析:A.该历程中能量变化最大的是2.46eV,是氮分子中吸附过程,氮氮三键的断裂过程是历程②,吸热 1.87eV ( 2.46eV)=0.59eV,故A错误;
B.一般而言,升高温度可提高反应速率,则在高温区加快了反应速率,由于合成氨反应是放热反应,因此低温区提高了氨的产率,故B正确;
C.③为Ti H Fe吸附N的历程,④为N原子由Fe区域向Ti H区域的传递过程,故C错误;
D.①是催化剂吸附氮气的历程,②是过渡态的历程,③为氮气解离为氮原子的历程,都为吸热反应,因此在高温区发生,④⑤为了增大平衡产率,需要在低温区进行,故D错误。
综上所述,答案为B。
2.D
解析:A.C(s) + CO2(g)2CO(g) (正反应为吸热反应),增大压强,平衡逆向移动,降低温度,平衡逆向移动,A不符合题意;
B.3O2(g)2O3(g)(正反应为吸热反应),增大压强,平衡正向移动,降低温度,平衡逆向移动,B不符合题意;
C.CO(g) + NO2(g)CO2(g)+NO(g) (正反应为放热反应),增大压强,平衡不移动,降低温度,平衡正向移动,C不符合题意;
D.N2 (g) + 3H2(g)2NH3(g) (正反应为放热反应),增大压强,平衡正向移动,降低温度,平衡正向移动,D符合题意。
答案选D。
3.A
解析:tmin后,△c(X2)=2mol·L-1-0.8 mol·L-1=1.2 mol·L-1,△c(Y2)= 2mol·L-1-1.6mol·L-1=0.4 mol·L-1,△c(Z)=0.8 mol·L-1,则X2、Y2、Z的化学计量数之比=1.2 mol·L-1: 0.4 mol·L-1: 0.8 mol·L-1=3:1:2,故反应为3X2+Y2=2Z,根据原子守恒可知,Z为X3Y,故反应可以表示为:3X2+Y2=2X3Y;故选A。
4.C
解析:A.历程II中Cl起催化作用,催化剂降低反应活化能,但焓变不变即E6 E3=E5 E2,故A错误;
B.Cl2(g)的相对能量为0,由图可知Cl(g)的相对能量为(E2 E3) kJ mol 1,断裂化学键吸收热量,Cl2(g)→2Cl(g)吸收能量为2(E2 E3) kJ mol 1,则Cl Cl键能为2(E2 E3) kJ mol 1,故B错误;
C.历程I、历程II中速率最快的一步是活化能最小的一步即,其反应的热化学方程式 ,故C正确;
D.相同条件下,催化剂不改变平衡移动,因此的平衡转化率:历程II=历程I,故D错误。
综上所述,答案为C。
5.C
解析:反应H2(g)+Br2(g) 2HBr(g)的K=,反应4HBr(g) 2H2(g)+2Br2(g)的K=,两个反应的平衡常数为倒数再平方关系,则平衡常数为=1×10-6,故选:C。
6.C
解析:A.在给定的反应方程式中,化学平衡常数只受温度的影响,故A错误;
B.在给定的反应方程式中,化学平衡常数只受温度的影响,浓度和压强对化学平衡常数无影响,故B错误;
C.在给定的反应方程式中,化学平衡常数只受温度的影响,浓度和压强对化学平衡常数无影响,故C正确;
D.化学平衡常数可以判断一个反应进行程度,平衡常数越大,反应进行程度越大,故D错误;
综上所述答案为C。
7.D
解析:A.500 s内N2O5分解速率为υ(N2O5)=÷500 s =6×10-3mol·L-1·s-1,A正确;
B.T1温度下反应达到平衡时,各种物质的浓度分别是:c(N2O5)= 2.50mol/L,c(NO2)= 5.0mol/L,c(O2)= 1.250mol/L,所以反应的平衡常数为K1===125,平衡时N2O5的转化率为(2.50÷5.00)×100%=50%,B正确;
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,由于该反应的正反应是吸热反应,升高温度,平衡向吸热的正反应方向移动,化学平衡常数增大,所以K1>K2,C错误;
D.达平衡后其他条件不变,将容器的体积压缩到原来的,假如平衡不发生移动,则c(N2O5)=5.00mol·L-1,缩小体积即增大压强,由于该反应的正反应是气体体积增大的反应,增大压强,平衡逆向移动,则再次平衡时c(N2O5)> 5.00 mol·L-1,D正确;
答案选C。
8.C
解析:某温度下,反应的平衡常数为,则相同温度下,反应的平衡常数为,故A符合题意。
综上所述,答案为A。
二、非选择题
9.025mol·L-1·min-1 ac 向正反应方向 不变
解析:(1)根据图象分析平衡时氨气的 c(NH3)=0.1mol/L,时间为4min,则v(NH3)==0.025mol/(L min);
(2)初始投料为0.2mol的N2和0.6mol的H2,容器体积为2L,若反应物完全转化,则氨气的浓度为0.2mol/L,但该反应为可逆反应,反应物不可能完全转化,则NH3的物质的量浓度不可能为0.2mol/L,温度改变平衡一定发生移动,则NH3的物质的量浓度不可能仍为0.1mol/L,故答案为ac;
(3)反应达到平衡后,第5分钟末,保持其它条件不变,体积缩小一半,容器内气体压强增大,平衡正反应方向进行,平衡常数只随温度变化,改变压强、浓度,平衡常数不变;
(4)第5分钟末将容器的体积缩小一半的瞬间氨气的浓度变为0.20mol/L,压强增大平衡向正方向移动,氨气的浓度逐渐增大,到8min时达到平衡,浓度约为0.25mol/L,则第5分钟末到此平衡时NH3浓度的变化曲线为。
10. 2CH3OH=CH3OCH3+H2O 吸热 ①>② A < 温度升高,化学反应速率加快 ae
解析:(1)根据平衡常数的表达式分析,甲醚和水为生成物,甲醇为反应物,且家畜的化学计量数为2,所以方程式为2CH3OH=CH3OCH3+H2O;
(2)根据不同温度下的平衡常数分析,温度越高,平衡常数越大,说明升温平衡正向移动,则正反应为吸热;
(3)①根据物质的浓度计算浓度商为:= 1.57<32,说明反应向正向进行,正反应速率大于逆反应速率;
②反应向正向进行,甲醇的百分含量要逐渐减小,所以为A点;因为横坐标为温度,温度升高,化学反应速率加快,所以B的反应速率小于D点的反应速率;
(4)a、升温,平衡正向移动,可以提高反应物的转化率,正确;
b、加入催化剂,反应速率加快,但平衡不移动,转化率不变,错误;
c、压缩,平衡逆向移动,转化率降低,错误;
d、增加水蒸气的浓度,平衡逆向移动,转化率降低,错误;
e、及时分离出产物,平衡正向移动,转化率提高,正确;
所以选ae
一、选择题
1.我国科研人员研制了Ti H Fe双温区催化剂(Ti H区域和Fe区域的温度差可超过100℃)。利用该催化剂合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是
A.该历程中能量变化最大的是2.46eV,是氮分子中氮氮三键的断裂过程
B.在高温区加快了反应速率,低温区提高了氨的产率
C.③为N原子由Fe区域向Ti H区域的传递过程
D.①③在高温区发生,②④⑤在低温区发生
2.下列各反应达到化学平衡后,增大压强或降低温度,都能使化学平衡向正反应方向移动的是( )
A.C(s) + CO2(g)2CO(g) (正反应为吸热反应)
B.3O2(g)2O3(g)(正反应为吸热反应)
C.CO(g) + NO2(g)CO2(g)+NO(g) (正反应为放热反应)
D.N2 (g) + 3H2(g)2NH3(g) (正反应为放热反应)
3.某温度下,浓度均为的两种气体和在恒容密闭容器中发生反应生成气体Z,经过后,测得各物质的浓度分别为,,,则该反应的化学方程式可表示为( )
A. B.
C. D.
4.标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下(已知O2(g)和Cl2(g)的相对能量为0),下列说法正确的是
A.历程II中Cl起催化作用,并且E6 E3>E5 E2
B.可计算Cl Cl键能为(E2 E3) kJ mol 1
C.历程I、历程II中速率最快的一步反应的热化学方程式
D.相同条件下,的平衡转化率:历程II>历程I
5.某温度下,反应H2(g)+Br2(g)2HBr(g)的平衡常数为1×103,则该温度下,反应4HBr(g)2H2+2Br2的平衡常数为
A.1×103 B.1×10-3 C.1×10-6 D.1×106
6.下列关于平衡常数K的说法中,正确的是
A.在任何条件下,化学平衡常数是一个恒定值
B.改变反应物浓度或生成物浓度都会改变平衡常数K
C.平衡常数K只与温度有关,与反应浓度、压强无关
D.从平衡常数K的大小不能推断一个反应进行的程度
7.是一种新型硝化剂,在一定温度下可以发生以下反应: ,温度时,向密闭的2L容器中通入,部分实验数据见表:
0 500 1000 1500
10.0 7.0 5.0 5.0
下列说法中不正确的是
A.内的反应速率
B.温度下的平衡常数为,平衡时的转化率为50%
C.温度下的平衡常数为,温度下的平衡常数为,若,则
D.平衡后,其他条件不变,将容器体积压缩到原来的,则
8.某温度下,反应的平衡常数为,则相同温度下,反应的平衡常数为
A. B. C. D.
二、非选择题
9.在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g)ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
(1)根据图示,计算从反应开始到平衡时,平均反应速率v(NH3)=__。
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为___。
a.0.20mol·L-1 b.0.12mol·L-1 c.0.10mol·L-1 d.0.08mol·L-1
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡__移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数__(填“增大”、“减小”或“不变”)。
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol·L-1)。请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线___。
10.已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(CH3OH)]2,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
请回答下列问题:
(1)写出上述反应的化学方程式_____________________.
(2)该反应的正反应是_________反应(填“放热”或者“吸热”)
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
①此时系统温度400℃,比较正、逆反应速率的大小:v正____v逆(填“>”、“<”或“=”).
②若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中____点.比较图中B、D两点所对应的正反应速率B___D(填“>”、“<”或“=”).理由是__________________.
(4)一定条件下要提高反应物的转化率,可以采用的措施是________
a.升高温度b.加入催化剂
c.压缩容器的体积d.增加水蒸气的浓度
e.及时分离出产物.
【参考答案】
一、选择题
1.B
解析:A.该历程中能量变化最大的是2.46eV,是氮分子中吸附过程,氮氮三键的断裂过程是历程②,吸热 1.87eV ( 2.46eV)=0.59eV,故A错误;
B.一般而言,升高温度可提高反应速率,则在高温区加快了反应速率,由于合成氨反应是放热反应,因此低温区提高了氨的产率,故B正确;
C.③为Ti H Fe吸附N的历程,④为N原子由Fe区域向Ti H区域的传递过程,故C错误;
D.①是催化剂吸附氮气的历程,②是过渡态的历程,③为氮气解离为氮原子的历程,都为吸热反应,因此在高温区发生,④⑤为了增大平衡产率,需要在低温区进行,故D错误。
综上所述,答案为B。
2.D
解析:A.C(s) + CO2(g)2CO(g) (正反应为吸热反应),增大压强,平衡逆向移动,降低温度,平衡逆向移动,A不符合题意;
B.3O2(g)2O3(g)(正反应为吸热反应),增大压强,平衡正向移动,降低温度,平衡逆向移动,B不符合题意;
C.CO(g) + NO2(g)CO2(g)+NO(g) (正反应为放热反应),增大压强,平衡不移动,降低温度,平衡正向移动,C不符合题意;
D.N2 (g) + 3H2(g)2NH3(g) (正反应为放热反应),增大压强,平衡正向移动,降低温度,平衡正向移动,D符合题意。
答案选D。
3.A
解析:tmin后,△c(X2)=2mol·L-1-0.8 mol·L-1=1.2 mol·L-1,△c(Y2)= 2mol·L-1-1.6mol·L-1=0.4 mol·L-1,△c(Z)=0.8 mol·L-1,则X2、Y2、Z的化学计量数之比=1.2 mol·L-1: 0.4 mol·L-1: 0.8 mol·L-1=3:1:2,故反应为3X2+Y2=2Z,根据原子守恒可知,Z为X3Y,故反应可以表示为:3X2+Y2=2X3Y;故选A。
4.C
解析:A.历程II中Cl起催化作用,催化剂降低反应活化能,但焓变不变即E6 E3=E5 E2,故A错误;
B.Cl2(g)的相对能量为0,由图可知Cl(g)的相对能量为(E2 E3) kJ mol 1,断裂化学键吸收热量,Cl2(g)→2Cl(g)吸收能量为2(E2 E3) kJ mol 1,则Cl Cl键能为2(E2 E3) kJ mol 1,故B错误;
C.历程I、历程II中速率最快的一步是活化能最小的一步即,其反应的热化学方程式 ,故C正确;
D.相同条件下,催化剂不改变平衡移动,因此的平衡转化率:历程II=历程I,故D错误。
综上所述,答案为C。
5.C
解析:反应H2(g)+Br2(g) 2HBr(g)的K=,反应4HBr(g) 2H2(g)+2Br2(g)的K=,两个反应的平衡常数为倒数再平方关系,则平衡常数为=1×10-6,故选:C。
6.C
解析:A.在给定的反应方程式中,化学平衡常数只受温度的影响,故A错误;
B.在给定的反应方程式中,化学平衡常数只受温度的影响,浓度和压强对化学平衡常数无影响,故B错误;
C.在给定的反应方程式中,化学平衡常数只受温度的影响,浓度和压强对化学平衡常数无影响,故C正确;
D.化学平衡常数可以判断一个反应进行程度,平衡常数越大,反应进行程度越大,故D错误;
综上所述答案为C。
7.D
解析:A.500 s内N2O5分解速率为υ(N2O5)=÷500 s =6×10-3mol·L-1·s-1,A正确;
B.T1温度下反应达到平衡时,各种物质的浓度分别是:c(N2O5)= 2.50mol/L,c(NO2)= 5.0mol/L,c(O2)= 1.250mol/L,所以反应的平衡常数为K1===125,平衡时N2O5的转化率为(2.50÷5.00)×100%=50%,B正确;
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,由于该反应的正反应是吸热反应,升高温度,平衡向吸热的正反应方向移动,化学平衡常数增大,所以K1>K2,C错误;
D.达平衡后其他条件不变,将容器的体积压缩到原来的,假如平衡不发生移动,则c(N2O5)=5.00mol·L-1,缩小体积即增大压强,由于该反应的正反应是气体体积增大的反应,增大压强,平衡逆向移动,则再次平衡时c(N2O5)> 5.00 mol·L-1,D正确;
答案选C。
8.C
解析:某温度下,反应的平衡常数为,则相同温度下,反应的平衡常数为,故A符合题意。
综上所述,答案为A。
二、非选择题
9.025mol·L-1·min-1 ac 向正反应方向 不变
解析:(1)根据图象分析平衡时氨气的 c(NH3)=0.1mol/L,时间为4min,则v(NH3)==0.025mol/(L min);
(2)初始投料为0.2mol的N2和0.6mol的H2,容器体积为2L,若反应物完全转化,则氨气的浓度为0.2mol/L,但该反应为可逆反应,反应物不可能完全转化,则NH3的物质的量浓度不可能为0.2mol/L,温度改变平衡一定发生移动,则NH3的物质的量浓度不可能仍为0.1mol/L,故答案为ac;
(3)反应达到平衡后,第5分钟末,保持其它条件不变,体积缩小一半,容器内气体压强增大,平衡正反应方向进行,平衡常数只随温度变化,改变压强、浓度,平衡常数不变;
(4)第5分钟末将容器的体积缩小一半的瞬间氨气的浓度变为0.20mol/L,压强增大平衡向正方向移动,氨气的浓度逐渐增大,到8min时达到平衡,浓度约为0.25mol/L,则第5分钟末到此平衡时NH3浓度的变化曲线为。
10. 2CH3OH=CH3OCH3+H2O 吸热 ①>② A < 温度升高,化学反应速率加快 ae
解析:(1)根据平衡常数的表达式分析,甲醚和水为生成物,甲醇为反应物,且家畜的化学计量数为2,所以方程式为2CH3OH=CH3OCH3+H2O;
(2)根据不同温度下的平衡常数分析,温度越高,平衡常数越大,说明升温平衡正向移动,则正反应为吸热;
(3)①根据物质的浓度计算浓度商为:= 1.57<32,说明反应向正向进行,正反应速率大于逆反应速率;
②反应向正向进行,甲醇的百分含量要逐渐减小,所以为A点;因为横坐标为温度,温度升高,化学反应速率加快,所以B的反应速率小于D点的反应速率;
(4)a、升温,平衡正向移动,可以提高反应物的转化率,正确;
b、加入催化剂,反应速率加快,但平衡不移动,转化率不变,错误;
c、压缩,平衡逆向移动,转化率降低,错误;
d、增加水蒸气的浓度,平衡逆向移动,转化率降低,错误;
e、及时分离出产物,平衡正向移动,转化率提高,正确;
所以选ae
