4.3金属的腐蚀与防护(含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.3金属的腐蚀与防护(含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 486.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-25 20:45:39 | ||
图片预览



文档简介
4.3金属的腐蚀与防护同步练习题
一、选择题
1.下列事实中,属于利用牺牲阳极的阴极保护法原理进行金属防护的是
A.金属护栏表面涂漆 B.地下钢管连接镁块
C.汽车底盘喷涂高分子膜 D.水中的钢闸门连接电源的负极
2.下列有关金属的腐蚀与防护的说法错误的是
A.钢铁发生吸氧腐蚀时负极反应式为
B.钢铁在干燥环境中腐蚀相对缓慢
C.金属栏杆喷漆,能够减缓栏杆的腐蚀
D.埋在地下的金属管道与直流电源正极相连可减缓腐蚀
3.根据所学习的电化学知识,下列说法正确的是
A.酸雨后钢铁易发生析氢腐蚀、铁锅存留盐液时易发生吸氧腐蚀
B.铁表面的镀锌层破损后,就完全失去了对铁的保护作用
C.水库的钢闸门与电源正极连接可实现电化学保护
D.智能手机常用的锂离子电池属于一次电池
4.热爱劳动是中华民族的传统美德。下列劳动项目与所涉及的化学知识不相符的是
选项 劳动项目 化学知识
A 餐后将洗净的铁锅擦干 铁在潮湿的环境中容易生锈
B 用厨余垃圾制肥料 厨余垃圾含N、P、K等元素
C 用明矾处理污水 明矾有杀菌消毒的作用
D 冷链运输和冷藏储存抗病毒疫苗 蛋白质受热可变性
A.A B.B C.C D.D
5.2023年天津一中化学组开设了“传感器实验”选修课,其中几位同学利用数字化实验进行铁的电化学腐蚀实验探究,实验结果如图所示,以下说法中正确的是
A.时,体系压强增大的主要原因是反应放热
B.整个过程中,铁是负极,参与反应生成铁离子
C.时,只发生析氢腐蚀,不发生吸氧腐蚀
D.时,正极可能发生的电极反应为:
6.下列说法正确的是
A.钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀
B.电解精炼铜时,若阳极质量减少,则转移到阴极的电子数为
C.农村推广风力发电、光伏发电有利于“碳达峰、碳中和”
D.“嫦娥五号”使用的太阳能电池阵和锂离子电池组,均可将化学能转变成电能
7.下列各种变化是因为构成原电池的是
A.在空气中金属铝表面迅速氧化形成保护层
B.金属表面涂漆以阻止金属被氧化
C.红热的铁丝与水接触铁表面形成黑色物质
D.钢铁在潮湿的空气里很快被腐蚀
8.从2月4日开幕到2月20日闭幕,为期17天的精彩冬奥, “中国之美”与“五环之美”交相辉映,中国式浪漫拨动了全世界的心弦。下列冬奥会有关物品所用材料属于合金的是
A B C D
冰墩墩的外壳 奥运比赛用的冰壶 冬奥会金牌 谷爱凌的滑板
A.A B.B C.C D.D
二、非选择题
9.如图,水槽中试管内有一枚铁钉,放置数天观察:
(1)若液面上升,说明原溶液呈中性或碱性,铁钉发生___腐蚀,电极反应式为:
负极:___;正极:___;
(2)若液面下降,说明原溶液呈酸性,铁钉发生___腐蚀,电极反应式为:
负极:___;正极:___。
10.按要求完成:
(1)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,若忽略氨水浓度的变化,溶液中的c(OH-)约为_______mol·L-1;0.1 mol ·L-1的(NH4)2SO3溶液显________(填“酸”“碱性”或“中性”)。
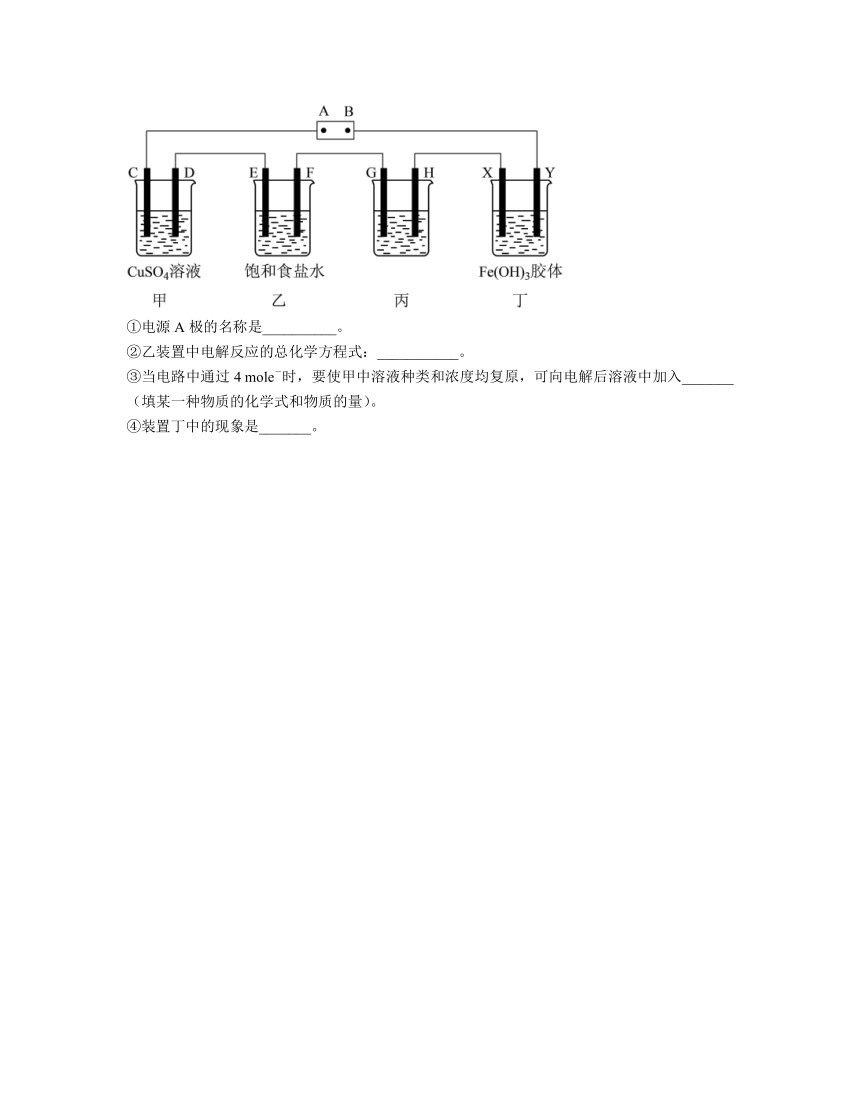
(2)某研究性学习小组将下列装置按如图连接,C、D、E、F、X、Y都是惰性电极,甲、乙、丙中电解质溶液含溶质均为1 mol。将电源接通后,向乙中滴入酚猷溶液,在F极附近显红色。试回答下列问题:
①电源A极的名称是__________。
②乙装置中电解反应的总化学方程式:___________。
③当电路中通过4 mole-时,要使甲中溶液种类和浓度均复原,可向电解后溶液中加入_______(填某一种物质的化学式和物质的量)。
④装置丁中的现象是_______。
【参考答案】
一、选择题
1.B
解析:A.金属护栏表面涂漆,利用的是覆盖保护层法,故A不符合题意;
B.地下钢管连接镁块是利用牺牲阳极的阴极保护法原理,故B符合题意;
C.汽车底盘喷涂高分子膜,利用的是覆盖保护层法,故C不符合题意;
D.水中的钢闸门连接电源的负极,利用的外加电流的阴极保护法,故D不符合题意;
综上所述,答案为B。
2.D
解析:A.钢铁发生吸氧腐蚀时Fe为负极,电极反应式为,A项正确;
B.钢铁在干燥环境中不容易发生电化学腐蚀,因此其腐蚀相对缓慢,B项正确;
C.金属栏杆喷漆,能起到隔绝空气和水的作用,因此能够减缓栏杆的腐蚀,C项正确;
D.利用外加电流的阴极保护法保护金属时,应使金属管道与电源负极相连,D项错误;
答案选D。
3.A
解析:A.酸雨后钢铁所处环境酸性较强,发生析氢腐蚀,盐液显中心,铁锅发生吸氧腐蚀,A正确;
B.锌比铁活泼,镀层破损后形成原电池,Zn为负极,Fe被保护起来,B错误;
C.与电源正极相连后,钢闸门上发生氧化反应,加速腐蚀,钢闸门应与电源负极相连,C错误;
D.锂离子电池可以充电,为二次电池,D错误;
综上所述答案为A。
4.C
解析:A.潮湿环境中铁锅易发生电化学腐蚀,所以餐后将洗净的铁锅擦干,可以防止铁锅生锈,A正确;
B.用厨余垃圾制肥料,是因为厨余垃圾含N、P、K等元素,腐败后可被农作物吸收利用,B正确;
C.明矾溶于水后可以水解产生氢氧化铝胶体,吸附杂质,从而净水,但不能杀菌消毒,C错误;
D.疫苗的主要成分为蛋白质,蛋白质受热易变性,为避免蛋白质变性,冷链运输和冷藏储存抗病毒疫苗,D正确;
综上所述答案为C。
5.D
解析:A.时,溶液酸性较强,铁发生析氢腐蚀生成氢气,体系压强增大的主要原因是反应放出氢气,A错误;
B.整个过程中,铁失去电子发生氧化反应生成亚铁离子,是负极,B错误;
C.析氢腐蚀生成氢气,导致压强变大;吸氧腐蚀,消耗氧气导致压强变小;结合图像可知,时,装置中压强几乎不变,故同时发生析氢腐蚀、吸氧腐蚀,C错误;
D.时,装置中压强减小,溶解氧减小,则正极可能发生的电极反应为氧气得到电子发生还原反应生成水:,D正确;
故选D。
6.C
解析:A.铜的活动性弱于氢,不发生析氢腐蚀,A错误;
B.电解精炼铜时,阳极中的铁、镍等都会放电,不能确定转移电子的物质的量,B错误;
C.风力发电、光伏发电不产生碳的排放物,有利于“碳达峰、碳中和”,C正确;
D.太阳能电池阵是将太阳能转化为电能,D错误;
故选C。
7.D
解析:A.铝直接被氧气氧化,没有构成原电池,故A不选;
B.金属表面涂漆防腐,没有构成原电池,故B不选;
C.红热的铁丝与水接触直接反应生成四氧化三铁,没有构成原电池,故C不选;
D.在潮湿的空气里,钢铁中的铁和少量碳形成了无数微小的原电池,加快了腐蚀,故D可选;
故选D。
8.C
解析:A.冰墩墩外壳是硅胶材质,是无机非金属材料,A不符合题意;
B.冰壶主体用花岗岩做成的,不是合金,B不符合题意;
C.冬奥会金牌不是纯金的,只是表面镀了一层金衣,内里都是金属混合物,属于合金,C符合题意;
D.雪地滑板的主要材料是塑料,属于高分子材料,D不符合题意;
故选C。
二、非选择题
9. 吸氧 Fe-2e=Fe2+ O2+4e-+2H2O=4OH- 析氢 Fe-2e-=Fe2+ 2H++2e-=H2↑
【分析】(1)若试管内液面上升,说明试管内气体压强减小,则铁钉发生吸氧腐蚀,碱性或中性条件下,铁钉发生吸氧腐蚀,负极上铁失电子,正极上氧气得电子;
(2)若试管内液面下降,说明试管内气体压强增大,则铁钉发生析氢腐蚀,酸性条件下、铁钉发生析氢腐蚀,负极上铁失电子发生氧化反应,正极上氢离子得电子变为氢气。
解析:(1)若试管内液面上升,说明试管内气体压强减小,则铁钉发生吸氧腐蚀,碱性或中性条件下,铁钉发生吸氧腐蚀,负极上铁失电子,电极反应式为Fe-2e-=Fe2+,正极上O2得电子,电极反应式为O2+4e-+2H2O=4OH-;
(2)若试管内液面下降,说明试管内气体压强增大,则铁钉发生析氢腐蚀,酸性条件下、铁钉发生析氢腐蚀,负极上铁失电子发生氧化反应,负极的电极反应式为Fe-2e-=Fe2+,正极上氢离子得电子发生还原反应,正极的电极反应式为:2H++2e-=H2↑。
【点睛】钢铁发生腐蚀类型可根据试管内液面的变化确定。若发生析氢腐蚀,则试管中气体体积会增大;若发生吸氧腐蚀,则试管内气体体积会减小。无论发生析氢腐蚀还是吸氧腐蚀,负极上都是铁失去电子变为Fe2+而被氧化损耗。
10. 6×10-3 碱性 正极 2NaCl + 2H2O 2NaOH + H2↑ +Cl2↑ 1mol Cu(OH)2 X极附近红褐色不断变浅,Y极附近红褐色不断加深
【分析】根据电离平衡常数计算氢氧根浓度,再根据相对强弱来判断酸碱性;电源接通后,向乙中滴入酚猷溶液,在F极附近显红色,说明F极为阴极,D、F、H、Y都为阴极,C、E、G、X都为阳极,则A为正极,B为负极。
解析:⑴已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,若忽略氨水浓度的变化,,溶液中的;由于Kb=1.8×10-5 > Ka2=6.2×10-8,碱电离程度大于亚硫酸第二步电离,因此0.1 mol·L-1的(NH4)2SO3溶液,显碱性;故答案为:6×10-3;碱性。
⑵①根据前面分析得出电源A极的名称是正极;故答案为:正极。
②乙装置中电解反应的总化学方程式:2NaCl + 2H2O 2NaOH + H2↑ +Cl2↑;故答案为:2NaCl + 2H2O 2NaOH + H2↑ +Cl2↑。
③当电路中通过4 mole-时,阳极产生氧气,4 mole-— O2,因此生成了1mol氧气,阴极先生成铜单质,根据Cu2+— 2mole- — Cu,1mol铜离子得到了2mol电子,生成1mol铜单质,铜离子反应完后,还有氢离子得电子,根据电子守恒,说明氢离子得到2mol电子,根据2H+— 2mole- — H2,因此生成了1mol氢气,因此整个电解过程生成1mol铜、1mol氧气、1mol氢气,要使甲中溶液种类和浓度均复原,可向电解后溶液中加入1mol Cu(OH)2;故答案为:1mol Cu(OH)2。
④氢氧化铁胶体粒子带正电,因此不断的向阴极区域移动,装置丁中的现象是X极附近红褐色不断变浅,Y极附近红褐色不断加深;故答案为:X极附近红褐色不断变浅,Y极附近红褐色不断加深
一、选择题
1.下列事实中,属于利用牺牲阳极的阴极保护法原理进行金属防护的是
A.金属护栏表面涂漆 B.地下钢管连接镁块
C.汽车底盘喷涂高分子膜 D.水中的钢闸门连接电源的负极
2.下列有关金属的腐蚀与防护的说法错误的是
A.钢铁发生吸氧腐蚀时负极反应式为
B.钢铁在干燥环境中腐蚀相对缓慢
C.金属栏杆喷漆,能够减缓栏杆的腐蚀
D.埋在地下的金属管道与直流电源正极相连可减缓腐蚀
3.根据所学习的电化学知识,下列说法正确的是
A.酸雨后钢铁易发生析氢腐蚀、铁锅存留盐液时易发生吸氧腐蚀
B.铁表面的镀锌层破损后,就完全失去了对铁的保护作用
C.水库的钢闸门与电源正极连接可实现电化学保护
D.智能手机常用的锂离子电池属于一次电池
4.热爱劳动是中华民族的传统美德。下列劳动项目与所涉及的化学知识不相符的是
选项 劳动项目 化学知识
A 餐后将洗净的铁锅擦干 铁在潮湿的环境中容易生锈
B 用厨余垃圾制肥料 厨余垃圾含N、P、K等元素
C 用明矾处理污水 明矾有杀菌消毒的作用
D 冷链运输和冷藏储存抗病毒疫苗 蛋白质受热可变性
A.A B.B C.C D.D
5.2023年天津一中化学组开设了“传感器实验”选修课,其中几位同学利用数字化实验进行铁的电化学腐蚀实验探究,实验结果如图所示,以下说法中正确的是
A.时,体系压强增大的主要原因是反应放热
B.整个过程中,铁是负极,参与反应生成铁离子
C.时,只发生析氢腐蚀,不发生吸氧腐蚀
D.时,正极可能发生的电极反应为:
6.下列说法正确的是
A.钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀
B.电解精炼铜时,若阳极质量减少,则转移到阴极的电子数为
C.农村推广风力发电、光伏发电有利于“碳达峰、碳中和”
D.“嫦娥五号”使用的太阳能电池阵和锂离子电池组,均可将化学能转变成电能
7.下列各种变化是因为构成原电池的是
A.在空气中金属铝表面迅速氧化形成保护层
B.金属表面涂漆以阻止金属被氧化
C.红热的铁丝与水接触铁表面形成黑色物质
D.钢铁在潮湿的空气里很快被腐蚀
8.从2月4日开幕到2月20日闭幕,为期17天的精彩冬奥, “中国之美”与“五环之美”交相辉映,中国式浪漫拨动了全世界的心弦。下列冬奥会有关物品所用材料属于合金的是
A B C D
冰墩墩的外壳 奥运比赛用的冰壶 冬奥会金牌 谷爱凌的滑板
A.A B.B C.C D.D
二、非选择题
9.如图,水槽中试管内有一枚铁钉,放置数天观察:
(1)若液面上升,说明原溶液呈中性或碱性,铁钉发生___腐蚀,电极反应式为:
负极:___;正极:___;
(2)若液面下降,说明原溶液呈酸性,铁钉发生___腐蚀,电极反应式为:
负极:___;正极:___。
10.按要求完成:
(1)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,若忽略氨水浓度的变化,溶液中的c(OH-)约为_______mol·L-1;0.1 mol ·L-1的(NH4)2SO3溶液显________(填“酸”“碱性”或“中性”)。
(2)某研究性学习小组将下列装置按如图连接,C、D、E、F、X、Y都是惰性电极,甲、乙、丙中电解质溶液含溶质均为1 mol。将电源接通后,向乙中滴入酚猷溶液,在F极附近显红色。试回答下列问题:
①电源A极的名称是__________。
②乙装置中电解反应的总化学方程式:___________。
③当电路中通过4 mole-时,要使甲中溶液种类和浓度均复原,可向电解后溶液中加入_______(填某一种物质的化学式和物质的量)。
④装置丁中的现象是_______。
【参考答案】
一、选择题
1.B
解析:A.金属护栏表面涂漆,利用的是覆盖保护层法,故A不符合题意;
B.地下钢管连接镁块是利用牺牲阳极的阴极保护法原理,故B符合题意;
C.汽车底盘喷涂高分子膜,利用的是覆盖保护层法,故C不符合题意;
D.水中的钢闸门连接电源的负极,利用的外加电流的阴极保护法,故D不符合题意;
综上所述,答案为B。
2.D
解析:A.钢铁发生吸氧腐蚀时Fe为负极,电极反应式为,A项正确;
B.钢铁在干燥环境中不容易发生电化学腐蚀,因此其腐蚀相对缓慢,B项正确;
C.金属栏杆喷漆,能起到隔绝空气和水的作用,因此能够减缓栏杆的腐蚀,C项正确;
D.利用外加电流的阴极保护法保护金属时,应使金属管道与电源负极相连,D项错误;
答案选D。
3.A
解析:A.酸雨后钢铁所处环境酸性较强,发生析氢腐蚀,盐液显中心,铁锅发生吸氧腐蚀,A正确;
B.锌比铁活泼,镀层破损后形成原电池,Zn为负极,Fe被保护起来,B错误;
C.与电源正极相连后,钢闸门上发生氧化反应,加速腐蚀,钢闸门应与电源负极相连,C错误;
D.锂离子电池可以充电,为二次电池,D错误;
综上所述答案为A。
4.C
解析:A.潮湿环境中铁锅易发生电化学腐蚀,所以餐后将洗净的铁锅擦干,可以防止铁锅生锈,A正确;
B.用厨余垃圾制肥料,是因为厨余垃圾含N、P、K等元素,腐败后可被农作物吸收利用,B正确;
C.明矾溶于水后可以水解产生氢氧化铝胶体,吸附杂质,从而净水,但不能杀菌消毒,C错误;
D.疫苗的主要成分为蛋白质,蛋白质受热易变性,为避免蛋白质变性,冷链运输和冷藏储存抗病毒疫苗,D正确;
综上所述答案为C。
5.D
解析:A.时,溶液酸性较强,铁发生析氢腐蚀生成氢气,体系压强增大的主要原因是反应放出氢气,A错误;
B.整个过程中,铁失去电子发生氧化反应生成亚铁离子,是负极,B错误;
C.析氢腐蚀生成氢气,导致压强变大;吸氧腐蚀,消耗氧气导致压强变小;结合图像可知,时,装置中压强几乎不变,故同时发生析氢腐蚀、吸氧腐蚀,C错误;
D.时,装置中压强减小,溶解氧减小,则正极可能发生的电极反应为氧气得到电子发生还原反应生成水:,D正确;
故选D。
6.C
解析:A.铜的活动性弱于氢,不发生析氢腐蚀,A错误;
B.电解精炼铜时,阳极中的铁、镍等都会放电,不能确定转移电子的物质的量,B错误;
C.风力发电、光伏发电不产生碳的排放物,有利于“碳达峰、碳中和”,C正确;
D.太阳能电池阵是将太阳能转化为电能,D错误;
故选C。
7.D
解析:A.铝直接被氧气氧化,没有构成原电池,故A不选;
B.金属表面涂漆防腐,没有构成原电池,故B不选;
C.红热的铁丝与水接触直接反应生成四氧化三铁,没有构成原电池,故C不选;
D.在潮湿的空气里,钢铁中的铁和少量碳形成了无数微小的原电池,加快了腐蚀,故D可选;
故选D。
8.C
解析:A.冰墩墩外壳是硅胶材质,是无机非金属材料,A不符合题意;
B.冰壶主体用花岗岩做成的,不是合金,B不符合题意;
C.冬奥会金牌不是纯金的,只是表面镀了一层金衣,内里都是金属混合物,属于合金,C符合题意;
D.雪地滑板的主要材料是塑料,属于高分子材料,D不符合题意;
故选C。
二、非选择题
9. 吸氧 Fe-2e=Fe2+ O2+4e-+2H2O=4OH- 析氢 Fe-2e-=Fe2+ 2H++2e-=H2↑
【分析】(1)若试管内液面上升,说明试管内气体压强减小,则铁钉发生吸氧腐蚀,碱性或中性条件下,铁钉发生吸氧腐蚀,负极上铁失电子,正极上氧气得电子;
(2)若试管内液面下降,说明试管内气体压强增大,则铁钉发生析氢腐蚀,酸性条件下、铁钉发生析氢腐蚀,负极上铁失电子发生氧化反应,正极上氢离子得电子变为氢气。
解析:(1)若试管内液面上升,说明试管内气体压强减小,则铁钉发生吸氧腐蚀,碱性或中性条件下,铁钉发生吸氧腐蚀,负极上铁失电子,电极反应式为Fe-2e-=Fe2+,正极上O2得电子,电极反应式为O2+4e-+2H2O=4OH-;
(2)若试管内液面下降,说明试管内气体压强增大,则铁钉发生析氢腐蚀,酸性条件下、铁钉发生析氢腐蚀,负极上铁失电子发生氧化反应,负极的电极反应式为Fe-2e-=Fe2+,正极上氢离子得电子发生还原反应,正极的电极反应式为:2H++2e-=H2↑。
【点睛】钢铁发生腐蚀类型可根据试管内液面的变化确定。若发生析氢腐蚀,则试管中气体体积会增大;若发生吸氧腐蚀,则试管内气体体积会减小。无论发生析氢腐蚀还是吸氧腐蚀,负极上都是铁失去电子变为Fe2+而被氧化损耗。
10. 6×10-3 碱性 正极 2NaCl + 2H2O 2NaOH + H2↑ +Cl2↑ 1mol Cu(OH)2 X极附近红褐色不断变浅,Y极附近红褐色不断加深
【分析】根据电离平衡常数计算氢氧根浓度,再根据相对强弱来判断酸碱性;电源接通后,向乙中滴入酚猷溶液,在F极附近显红色,说明F极为阴极,D、F、H、Y都为阴极,C、E、G、X都为阳极,则A为正极,B为负极。
解析:⑴已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,若忽略氨水浓度的变化,,溶液中的;由于Kb=1.8×10-5 > Ka2=6.2×10-8,碱电离程度大于亚硫酸第二步电离,因此0.1 mol·L-1的(NH4)2SO3溶液,显碱性;故答案为:6×10-3;碱性。
⑵①根据前面分析得出电源A极的名称是正极;故答案为:正极。
②乙装置中电解反应的总化学方程式:2NaCl + 2H2O 2NaOH + H2↑ +Cl2↑;故答案为:2NaCl + 2H2O 2NaOH + H2↑ +Cl2↑。
③当电路中通过4 mole-时,阳极产生氧气,4 mole-— O2,因此生成了1mol氧气,阴极先生成铜单质,根据Cu2+— 2mole- — Cu,1mol铜离子得到了2mol电子,生成1mol铜单质,铜离子反应完后,还有氢离子得电子,根据电子守恒,说明氢离子得到2mol电子,根据2H+— 2mole- — H2,因此生成了1mol氢气,因此整个电解过程生成1mol铜、1mol氧气、1mol氢气,要使甲中溶液种类和浓度均复原,可向电解后溶液中加入1mol Cu(OH)2;故答案为:1mol Cu(OH)2。
④氢氧化铁胶体粒子带正电,因此不断的向阴极区域移动,装置丁中的现象是X极附近红褐色不断变浅,Y极附近红褐色不断加深;故答案为:X极附近红褐色不断变浅,Y极附近红褐色不断加深
