化学人教版(2019)必修第一册2.2.1氯气的性质 课件(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.2.1氯气的性质 课件(共26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 80.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-25 20:53:45 | ||
图片预览






文档简介
(共26张PPT)
第1课时 氯气的性质
第二章 海水中的重要元素——钠和氯
第二节 氯及其化合物
核心素养学习目标
1.通过在战争中氯气的使用对人类造成的危害对学生进行“化学服务于人类社会”的教育,培养学生社会责任感。
2.通过实验展示、实验探究使学生对氯气的化学性质进行学习和掌握,促进学生化学实验的综合运用能力,培养学生科学探究和实验创新的化学学科核心素养。
3.了解通过化学反应可以探索物质性质、实现物质转化,认识物质及其转化在环境保护中的重要价值。
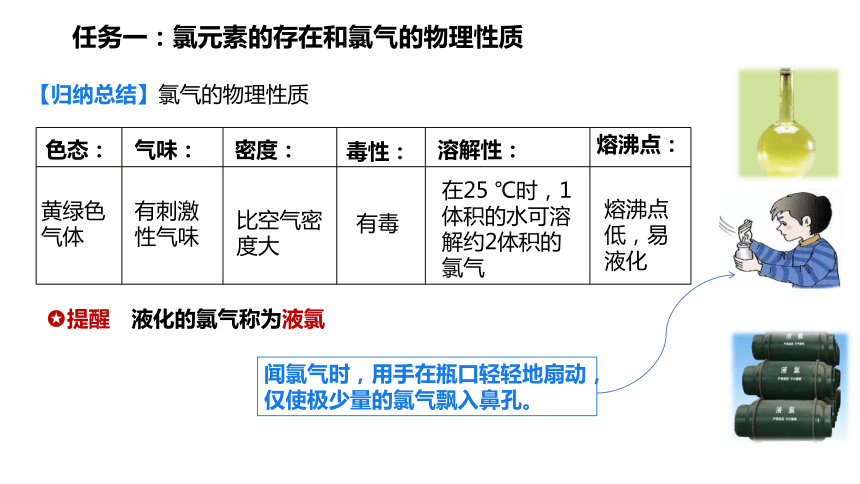
任务一:氯元素的存在和氯气的物理性质
思 考 讨 论
【问题1】你了解的含氯元素的物质有哪些?请举出具体的例子。
NaCl、MgCl2、CaCl2 、 CuCl2 、AgCl 等
【归纳总结】氯元素的存在:在自然界中除了以NaCl、MgCl2、CaCl2等形式大量存在于海水中,还存在于陆地的盐湖和盐矿中,即以化合态存在,氯是一种重要的“成盐元素”
【活动1】观看视频:
【思考交流】
毒气弹之父弗兰茨哈伯
1. 为什么氯气可作为生化武器?
2. 为什么要逃往地势更高的地方呢?
3. 为什么湿毛巾在一定程度上可以防止氯气中毒?4.这其中包含了氯气的哪些性质呢?
任务一:氯元素的存在和氯气的物理性质
色态:
黄绿色气体
气味:
密度:
毒性:
溶解性:
熔沸点:
有刺激性气味
比空气密度大
有毒
在25 ℃时,1体积的水可溶解约2体积的氯气
熔沸点低,易液化
闻氯气时,用手在瓶口轻轻地扇动,仅使极少量的氯气飘入鼻孔。鼻孔。
提醒 液化的氯气称为液氯
任务一:氯元素的存在和氯气的物理性质
【归纳总结】氯气的物理性质
+17
2
8
7
得 e-
+17
2
8
8
Cl
易得电子
Cl-
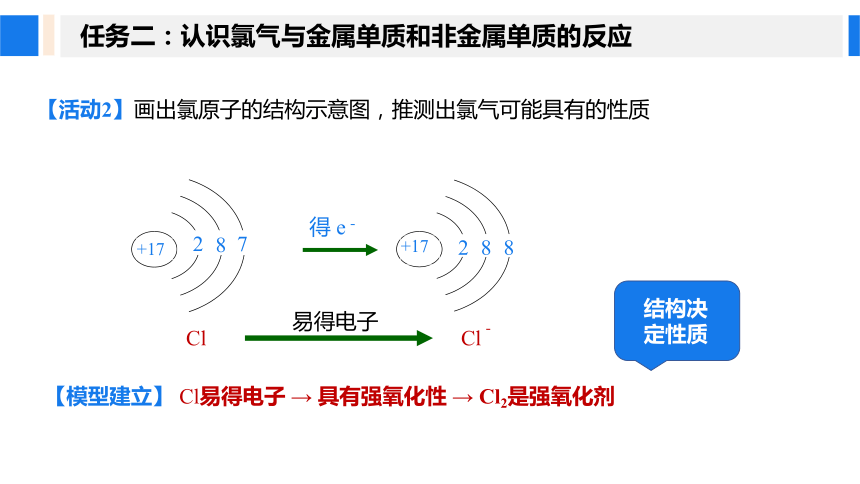
任务二:认识氯气与金属单质和非金属单质的反应
【活动2】画出氯原子的结构示意图,推测出氯气可能具有的性质
【模型建立】 Cl易得电子 → 具有强氧化性 → Cl2是强氧化剂
结构决定性质
氯气与金属钠的反应
氯气与金属铜的反应
氯气与金属铁的反应
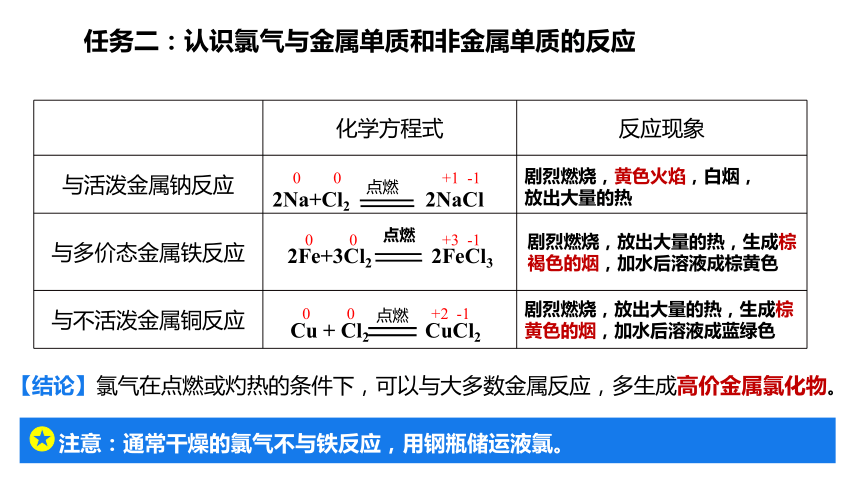
任务二:认识氯气与金属单质和非金属单质的反应
【活动3】 观察氯气与金属钠、金属铁、金属铜单质反应的实验,记录实验现象,书写化学方程式,并标出变价元素的化合价,分析其特点。
剧烈燃烧,黄色火焰,白烟,放出大量的热
剧烈燃烧,放出大量的热,生成棕黄色的烟,加水后溶液成蓝绿色
剧烈燃烧,放出大量的热,生成棕褐色的烟,加水后溶液成棕黄色
点燃
2Na+Cl2 2NaCl
点燃
2Fe+3Cl2 2FeCl3
Cu + Cl2 CuCl2
点燃
0 0 +1 -1
0 0 +3 -1
0 0 +2 -1
任务二:认识氯气与金属单质和非金属单质的反应
【结论】氯气在点燃或灼热的条件下,可以与大多数金属反应,多生成高价金属氯化物。
注意:通常干燥的氯气不与铁反应,用钢瓶储运液氯。
化学方程式 反应现象
与活泼金属钠反应
与多价态金属铁反应
与不活泼金属铜反应
任务二:认识氯气与金属单质和非金属单质的反应
【实验操作】在空气中点燃氢气,然后把导管缓慢伸入盛满氯气的集气瓶中,观察并记录实验现象,写出方程式。
【实验现象】纯净的氢气在氯气中安静的燃烧发出苍白色火焰,集气瓶口上方出现白雾。
【思考交流1】通过H2 在Cl2在中的燃烧,你对燃烧的条件及其本质有什么新的认识?
【归纳总结】燃烧不一定需要氧气的参与,任何发光发热的剧烈化学反应都是燃烧。
方程式:
H2 + Cl2 2HCl
点燃
【活动4】思考氯气和非金属单质的反应
【思考交流2】两种物质反应的条件一定是唯一的吗?如果改变条件,现象有何不同?
任务二:认识氯气与金属单质和非金属单质的反应
【观看视频】将氯气和氢气的混合均匀后,混合气体置于强光照条件下。
【实验现象】氢气与氯气的混合气体在光照条件下发生爆炸
【交流研讨】H2 与Cl2反应,条件不同,现象不同,产物相同。
H2 + Cl2 === 2HCl(爆炸)
方程式:
光照
【评价训练】
1.判断正误
(1)氯气和液氯是两种不同的物质
(2)常温下干燥的液氯能用钢瓶贮存
(3)H2与Cl2混合气体点燃会安静地燃烧,发出苍白色火焰
(4)Cu在Cl2中燃烧产生棕黄色的烟,若反应后,向集气瓶中加少量水振荡,可得到棕黄色溶液
×
√
×
×
任务二:认识氯气与金属单质和非金属单质的反应
2.下列化合物中,不能通过两种单质间化合直接制取的是
A.FeCl3 B.CuCl2 C.HCl D.FeCl2
√
Cl2与金属反应生成高价态金属氯化物FeCl3
3.下列关于氯气的化学性质或实验现象的描述不正确的是
A.在常温下,氯气与金属铁、铜等不反应
B.Fe可在Cl2中燃烧,生成棕黄色的烟是FeCl2
C.纯净的H2在Cl2中燃烧,火焰呈苍白色,并在集气瓶口有白雾出现
D.在做H2与Cl2的光照爆炸实验时,所用的光应当为直射的强光
√
氯气与铁、铜反应需要加热
生成FeCl3,棕褐色的烟
【评价训练】
任务二:认识氯气与金属单质和非金属单质的反应
【活动5】 观看氯气与水反应微观动画视频,尝试书写该反应的化学方程式。
Cl2 + H2O HCl+HClO
任务三:认识氯气与水、碱的反应
【书写表达】写出该反应的化学方程式为 。
(可逆)
次氯酸
【结论分析】是氯气与水反应生成的HClO具有漂白性
实验操作
实验现象
解释
有色布条不褪色
干燥的Cl2没漂白性
有色布条褪色
湿润的Cl2有漂白性
【实验探究】取干燥的和湿润的有色布条各一条,分别放入两个盛有干燥氯气的集气瓶中,盖上玻璃片,观察现象。
任务三:认识氯气与水、碱的反应
【交流研讨】通过现象分析具有漂白性的物质是什么?
【思考】氯水中还有哪些成分呢?
【实验探究】按以下实验步骤对新制氯水的成分进行探究,完成表格内容
实验步骤 实验现象 实验结论
观察氯水的颜色
向氯水中滴加AgNO3溶液,再滴加稀硝酸
向氯水中加入Na2CO3粉末
向氯水中加入有色布条
溶液呈浅黄绿色
氯水中含有Cl2_
产生白色沉淀
氯水中存在Cl-
有无色气体产生
氯水中存在H+
有色布条褪色
氯水中存在HClO
【归纳总结】新制氯水中存在的微粒有:Cl2 ,HClO,H2O
H+,Cl-,ClO-,少量OH-
其中OH-来源于水电离
任务三:认识氯气与水、碱的反应
【实验探究】验证次氯酸光照分解产物的数字化实验(课本P48)
在密闭容器中,氯水的pH、氯离子浓度和氧气的体积随时间的变化如图所示。
【交流研讨】随着时间的推移,溶液的pH减小,酸性增强,氯离子的浓度增大,有氧气生成。
【结论展示】次氯酸不稳定,见光易分解,反应的化学方程式:2HClO === 2HCl+O2↑
【阅读交流】阅读课本科学 技术 社会
光照
任务三:认识氯气与水、碱的反应
任务三:认识氯气与水、碱的反应
【归纳总结】HClO的性质:
A、不稳定性:光照或者加热条件下容易分解放出氧气
2HClO === 2HCl+O2↑
光照
B、强氧化性:杀菌、消毒、漂白(永久漂白)
C、酸性:次氯酸是一元弱酸
注意:新制氯水成分复杂,性质多样。
实验中常用新制氯水代替氯气。
【知识辨析】
对比液氯、新制氯水、久置氯水的成分
H2O、Cl2、HClO
H+、Cl- 、 ClO- (OH - )
H2O
H+、Cl-
Cl2
新制氯水
分子
离子
久置氯水
液 氯
干燥的氯气不能使有色物质褪色;湿润的氯气能使有色物质褪色。
三分子:
四离子:
Cl2 ,HClO,H2O
H+,Cl-,ClO-,少量OH-
任务三:认识氯气与水、碱的反应
【联系生活】制成漂白液和漂白粉
2NaOH+Cl2=NaCl+NaClO+H2O
【实践应用】常用NaOH溶液吸收多余Cl2 (尾气处理 )
(次氯酸钠)
★次氯酸不稳定,次氯酸盐较稳定。
漂白液的有效成分
任务三:认识氯气与水、碱的反应
【阅读思考】次氯酸不稳定,难以保存和运输,有什么办法可以解决吗?
【方法形成】漂白液的制取:将氯气通入到氢氧化钠溶液中。
2Ca(OH)2 + 2Cl2= CaCl2 + Ca(ClO)2 + 2H2O
【交流研讨】 漂白粉(漂粉精)原理:
漂白粉的有效成分
石灰乳
Ca(ClO)2+CO2+H2O===CaCO3+2HClO
CaCl2 + Ca(ClO)2
主要成分
任务三:认识氯气与水、碱的反应
【方法迁移】漂白粉的制取:将氯气通入冷的石灰乳中。
【实际应用】漂白液,漂白粉和漂粉精可作为棉、麻、纸张的漂白剂,又可作为游泳池等场所的消毒剂。
1. 判断正误
(1)氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物
(2)湿润的有色布条遇Cl2褪色,说明Cl2具有漂白性
(3)可用pH试纸测定氯水的pH
(4)Cl2具有很强的氧化性,在化学反应中只能作氧化剂
(5)充满氯气的塑料矿泉水瓶中加入20 mL水,盖好瓶盖,用力振荡,矿泉水瓶会变瘪
【评价训练】
×
√
×
×
×
任务三:认识氯气与水、碱的反应
2.下列离子方程式正确的是
A.氯气与水反应:Cl2+H2O 2H++Cl-+ClO-
B.氯气与澄清石灰水反应:Cl2+2OH-===Cl-+ClO-+H2O
C.氯气与氯化亚铁溶液反应:Cl2+Fe2+===2Cl-+Fe3+
D.金属钠与水反应:Na+2H2O===Na++2OH-+H2↑
√
Cl2+H2O HCl+HClO
2Na+2H2O===2Na++2OH-+H2↑
Cl2+2Fe2+===2Cl-+2Fe3+
【评价训练】
任务三:认识氯气与水、碱的反应
3. (2023·大理高一检测)向氯水中加入下列物质,表中现象及解释均正确的是
选项 加入物质 现象 解释
A AgNO3溶液 有白色沉淀生成 氯水中含有Cl-
B 石蕊溶液 显红色 氯水中有盐酸、次氯酸
C CaCO3 有气体放出 盐酸、次氯酸酸性比碳酸强
D 有色布条 有色布条褪色 Cl2有漂白性
√
先变红后褪色
次氯酸不和CaCO3反应
氯水中存在HClO,具有漂白性
【评价训练】
任务三:认识氯气与水、碱的反应
4. 实验表明:将氯水滴加到蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法不正确的是
A.此实验表明氯水具有酸性、漂白性
B.内环呈白色外环呈红色或浅红色
C.氯气溶于水的反应中还原产物是HClO
D.内外环上颜色的差异表明此变化过程中,盐酸与指示剂的反应比
氧化还原反应快
√
0 -1 +1
Cl2+H2O HCl+HClO
还原产物 氧化产物
【评价训练】
任务三:认识氯气与水、碱的反应
5.氯气及含氯化合物常被用来杀菌、消毒。
(1)我国多数地区的自来水厂使用氯气杀菌、消毒。氯气和水反应生成具有杀菌作用的物质是________________。
(2)工业上将氯气通入氢氧化钠溶液中制取消毒液,反应的化学方程式是_________________________________,其中氧化剂是_______(填名称,下同);消毒液中的有效成分是__________。
(3)使用氯水消毒不如用消毒液方便,原因是_____________________
。
HClO(或次氯酸)
Cl2+2NaOH===NaCl+NaClO+H2O
氯气
次氯酸钠
氯水中次氯酸含量低且次氯酸不稳定,见光易分解
【评价训练】
任务三:认识氯气与水、碱的反应
知识小结
第1课时 氯气的性质
第二章 海水中的重要元素——钠和氯
第二节 氯及其化合物
核心素养学习目标
1.通过在战争中氯气的使用对人类造成的危害对学生进行“化学服务于人类社会”的教育,培养学生社会责任感。
2.通过实验展示、实验探究使学生对氯气的化学性质进行学习和掌握,促进学生化学实验的综合运用能力,培养学生科学探究和实验创新的化学学科核心素养。
3.了解通过化学反应可以探索物质性质、实现物质转化,认识物质及其转化在环境保护中的重要价值。
任务一:氯元素的存在和氯气的物理性质
思 考 讨 论
【问题1】你了解的含氯元素的物质有哪些?请举出具体的例子。
NaCl、MgCl2、CaCl2 、 CuCl2 、AgCl 等
【归纳总结】氯元素的存在:在自然界中除了以NaCl、MgCl2、CaCl2等形式大量存在于海水中,还存在于陆地的盐湖和盐矿中,即以化合态存在,氯是一种重要的“成盐元素”
【活动1】观看视频:
【思考交流】
毒气弹之父弗兰茨哈伯
1. 为什么氯气可作为生化武器?
2. 为什么要逃往地势更高的地方呢?
3. 为什么湿毛巾在一定程度上可以防止氯气中毒?4.这其中包含了氯气的哪些性质呢?
任务一:氯元素的存在和氯气的物理性质
色态:
黄绿色气体
气味:
密度:
毒性:
溶解性:
熔沸点:
有刺激性气味
比空气密度大
有毒
在25 ℃时,1体积的水可溶解约2体积的氯气
熔沸点低,易液化
闻氯气时,用手在瓶口轻轻地扇动,仅使极少量的氯气飘入鼻孔。鼻孔。
提醒 液化的氯气称为液氯
任务一:氯元素的存在和氯气的物理性质
【归纳总结】氯气的物理性质
+17
2
8
7
得 e-
+17
2
8
8
Cl
易得电子
Cl-
任务二:认识氯气与金属单质和非金属单质的反应
【活动2】画出氯原子的结构示意图,推测出氯气可能具有的性质
【模型建立】 Cl易得电子 → 具有强氧化性 → Cl2是强氧化剂
结构决定性质
氯气与金属钠的反应
氯气与金属铜的反应
氯气与金属铁的反应
任务二:认识氯气与金属单质和非金属单质的反应
【活动3】 观察氯气与金属钠、金属铁、金属铜单质反应的实验,记录实验现象,书写化学方程式,并标出变价元素的化合价,分析其特点。
剧烈燃烧,黄色火焰,白烟,放出大量的热
剧烈燃烧,放出大量的热,生成棕黄色的烟,加水后溶液成蓝绿色
剧烈燃烧,放出大量的热,生成棕褐色的烟,加水后溶液成棕黄色
点燃
2Na+Cl2 2NaCl
点燃
2Fe+3Cl2 2FeCl3
Cu + Cl2 CuCl2
点燃
0 0 +1 -1
0 0 +3 -1
0 0 +2 -1
任务二:认识氯气与金属单质和非金属单质的反应
【结论】氯气在点燃或灼热的条件下,可以与大多数金属反应,多生成高价金属氯化物。
注意:通常干燥的氯气不与铁反应,用钢瓶储运液氯。
化学方程式 反应现象
与活泼金属钠反应
与多价态金属铁反应
与不活泼金属铜反应
任务二:认识氯气与金属单质和非金属单质的反应
【实验操作】在空气中点燃氢气,然后把导管缓慢伸入盛满氯气的集气瓶中,观察并记录实验现象,写出方程式。
【实验现象】纯净的氢气在氯气中安静的燃烧发出苍白色火焰,集气瓶口上方出现白雾。
【思考交流1】通过H2 在Cl2在中的燃烧,你对燃烧的条件及其本质有什么新的认识?
【归纳总结】燃烧不一定需要氧气的参与,任何发光发热的剧烈化学反应都是燃烧。
方程式:
H2 + Cl2 2HCl
点燃
【活动4】思考氯气和非金属单质的反应
【思考交流2】两种物质反应的条件一定是唯一的吗?如果改变条件,现象有何不同?
任务二:认识氯气与金属单质和非金属单质的反应
【观看视频】将氯气和氢气的混合均匀后,混合气体置于强光照条件下。
【实验现象】氢气与氯气的混合气体在光照条件下发生爆炸
【交流研讨】H2 与Cl2反应,条件不同,现象不同,产物相同。
H2 + Cl2 === 2HCl(爆炸)
方程式:
光照
【评价训练】
1.判断正误
(1)氯气和液氯是两种不同的物质
(2)常温下干燥的液氯能用钢瓶贮存
(3)H2与Cl2混合气体点燃会安静地燃烧,发出苍白色火焰
(4)Cu在Cl2中燃烧产生棕黄色的烟,若反应后,向集气瓶中加少量水振荡,可得到棕黄色溶液
×
√
×
×
任务二:认识氯气与金属单质和非金属单质的反应
2.下列化合物中,不能通过两种单质间化合直接制取的是
A.FeCl3 B.CuCl2 C.HCl D.FeCl2
√
Cl2与金属反应生成高价态金属氯化物FeCl3
3.下列关于氯气的化学性质或实验现象的描述不正确的是
A.在常温下,氯气与金属铁、铜等不反应
B.Fe可在Cl2中燃烧,生成棕黄色的烟是FeCl2
C.纯净的H2在Cl2中燃烧,火焰呈苍白色,并在集气瓶口有白雾出现
D.在做H2与Cl2的光照爆炸实验时,所用的光应当为直射的强光
√
氯气与铁、铜反应需要加热
生成FeCl3,棕褐色的烟
【评价训练】
任务二:认识氯气与金属单质和非金属单质的反应
【活动5】 观看氯气与水反应微观动画视频,尝试书写该反应的化学方程式。
Cl2 + H2O HCl+HClO
任务三:认识氯气与水、碱的反应
【书写表达】写出该反应的化学方程式为 。
(可逆)
次氯酸
【结论分析】是氯气与水反应生成的HClO具有漂白性
实验操作
实验现象
解释
有色布条不褪色
干燥的Cl2没漂白性
有色布条褪色
湿润的Cl2有漂白性
【实验探究】取干燥的和湿润的有色布条各一条,分别放入两个盛有干燥氯气的集气瓶中,盖上玻璃片,观察现象。
任务三:认识氯气与水、碱的反应
【交流研讨】通过现象分析具有漂白性的物质是什么?
【思考】氯水中还有哪些成分呢?
【实验探究】按以下实验步骤对新制氯水的成分进行探究,完成表格内容
实验步骤 实验现象 实验结论
观察氯水的颜色
向氯水中滴加AgNO3溶液,再滴加稀硝酸
向氯水中加入Na2CO3粉末
向氯水中加入有色布条
溶液呈浅黄绿色
氯水中含有Cl2_
产生白色沉淀
氯水中存在Cl-
有无色气体产生
氯水中存在H+
有色布条褪色
氯水中存在HClO
【归纳总结】新制氯水中存在的微粒有:Cl2 ,HClO,H2O
H+,Cl-,ClO-,少量OH-
其中OH-来源于水电离
任务三:认识氯气与水、碱的反应
【实验探究】验证次氯酸光照分解产物的数字化实验(课本P48)
在密闭容器中,氯水的pH、氯离子浓度和氧气的体积随时间的变化如图所示。
【交流研讨】随着时间的推移,溶液的pH减小,酸性增强,氯离子的浓度增大,有氧气生成。
【结论展示】次氯酸不稳定,见光易分解,反应的化学方程式:2HClO === 2HCl+O2↑
【阅读交流】阅读课本科学 技术 社会
光照
任务三:认识氯气与水、碱的反应
任务三:认识氯气与水、碱的反应
【归纳总结】HClO的性质:
A、不稳定性:光照或者加热条件下容易分解放出氧气
2HClO === 2HCl+O2↑
光照
B、强氧化性:杀菌、消毒、漂白(永久漂白)
C、酸性:次氯酸是一元弱酸
注意:新制氯水成分复杂,性质多样。
实验中常用新制氯水代替氯气。
【知识辨析】
对比液氯、新制氯水、久置氯水的成分
H2O、Cl2、HClO
H+、Cl- 、 ClO- (OH - )
H2O
H+、Cl-
Cl2
新制氯水
分子
离子
久置氯水
液 氯
干燥的氯气不能使有色物质褪色;湿润的氯气能使有色物质褪色。
三分子:
四离子:
Cl2 ,HClO,H2O
H+,Cl-,ClO-,少量OH-
任务三:认识氯气与水、碱的反应
【联系生活】制成漂白液和漂白粉
2NaOH+Cl2=NaCl+NaClO+H2O
【实践应用】常用NaOH溶液吸收多余Cl2 (尾气处理 )
(次氯酸钠)
★次氯酸不稳定,次氯酸盐较稳定。
漂白液的有效成分
任务三:认识氯气与水、碱的反应
【阅读思考】次氯酸不稳定,难以保存和运输,有什么办法可以解决吗?
【方法形成】漂白液的制取:将氯气通入到氢氧化钠溶液中。
2Ca(OH)2 + 2Cl2= CaCl2 + Ca(ClO)2 + 2H2O
【交流研讨】 漂白粉(漂粉精)原理:
漂白粉的有效成分
石灰乳
Ca(ClO)2+CO2+H2O===CaCO3+2HClO
CaCl2 + Ca(ClO)2
主要成分
任务三:认识氯气与水、碱的反应
【方法迁移】漂白粉的制取:将氯气通入冷的石灰乳中。
【实际应用】漂白液,漂白粉和漂粉精可作为棉、麻、纸张的漂白剂,又可作为游泳池等场所的消毒剂。
1. 判断正误
(1)氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物
(2)湿润的有色布条遇Cl2褪色,说明Cl2具有漂白性
(3)可用pH试纸测定氯水的pH
(4)Cl2具有很强的氧化性,在化学反应中只能作氧化剂
(5)充满氯气的塑料矿泉水瓶中加入20 mL水,盖好瓶盖,用力振荡,矿泉水瓶会变瘪
【评价训练】
×
√
×
×
×
任务三:认识氯气与水、碱的反应
2.下列离子方程式正确的是
A.氯气与水反应:Cl2+H2O 2H++Cl-+ClO-
B.氯气与澄清石灰水反应:Cl2+2OH-===Cl-+ClO-+H2O
C.氯气与氯化亚铁溶液反应:Cl2+Fe2+===2Cl-+Fe3+
D.金属钠与水反应:Na+2H2O===Na++2OH-+H2↑
√
Cl2+H2O HCl+HClO
2Na+2H2O===2Na++2OH-+H2↑
Cl2+2Fe2+===2Cl-+2Fe3+
【评价训练】
任务三:认识氯气与水、碱的反应
3. (2023·大理高一检测)向氯水中加入下列物质,表中现象及解释均正确的是
选项 加入物质 现象 解释
A AgNO3溶液 有白色沉淀生成 氯水中含有Cl-
B 石蕊溶液 显红色 氯水中有盐酸、次氯酸
C CaCO3 有气体放出 盐酸、次氯酸酸性比碳酸强
D 有色布条 有色布条褪色 Cl2有漂白性
√
先变红后褪色
次氯酸不和CaCO3反应
氯水中存在HClO,具有漂白性
【评价训练】
任务三:认识氯气与水、碱的反应
4. 实验表明:将氯水滴加到蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法不正确的是
A.此实验表明氯水具有酸性、漂白性
B.内环呈白色外环呈红色或浅红色
C.氯气溶于水的反应中还原产物是HClO
D.内外环上颜色的差异表明此变化过程中,盐酸与指示剂的反应比
氧化还原反应快
√
0 -1 +1
Cl2+H2O HCl+HClO
还原产物 氧化产物
【评价训练】
任务三:认识氯气与水、碱的反应
5.氯气及含氯化合物常被用来杀菌、消毒。
(1)我国多数地区的自来水厂使用氯气杀菌、消毒。氯气和水反应生成具有杀菌作用的物质是________________。
(2)工业上将氯气通入氢氧化钠溶液中制取消毒液,反应的化学方程式是_________________________________,其中氧化剂是_______(填名称,下同);消毒液中的有效成分是__________。
(3)使用氯水消毒不如用消毒液方便,原因是_____________________
。
HClO(或次氯酸)
Cl2+2NaOH===NaCl+NaClO+H2O
氯气
次氯酸钠
氯水中次氯酸含量低且次氯酸不稳定,见光易分解
【评价训练】
任务三:认识氯气与水、碱的反应
知识小结
