化学人教版(2019)必修第一册2.2.2氯气的实验室制备 课件(共18张PPT)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.2.2氯气的实验室制备 课件(共18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-25 20:54:54 | ||
图片预览





文档简介
(共18张PPT)
第2课时 氯气的实验室制法
第二章 海水中的重要元素——钠和氯
第二节 氯及其化合物
1.了解氯气的发现史,学习科学家的研究精神及勤于钻研、严谨求实的科学态度。
2.通过设计氯气的实验室制备方案,让学生了解氯气制取的设计思路和实验操作方法
核心素养学习目标
舍勒 【瑞典】
18世纪,人们致力于采矿事业, 瑞典化学家舍勒也把精力放在了软锰矿(主要成分是MnO2)的研究上。
1774年的一天当他把软锰矿粉末和浓盐酸混合加热时,惊奇的看到一种黄绿色的气体冒出。这种呛人的气体不但能使染料褪色,还有许多奇特的性质。
直到1807年,英国化学家戴维对这种气体进行了细致的研究,并于1810年11月在英国皇家学会上正式定名确认上述黄绿色气体是由一种新元素组成,英文定名为“Chlorine”,希腊文的意思是“绿色的”。
戴维 【英国】
创设情境
【归纳总结】舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。请写出舍勒发现氯气的化学反应方程式。
启示3:科学研究需要有热爱科学的思想和奉献科学的精神。
启示1:科学研究需要有正确的理论作指导,错误的理论只能浪费时间和精力。
启示2:科学研究需要以大量事实为依据,只有大量事实才能推翻错误的理论,建立正确的理论或推动科学理论的发展。
MnO2+4HCl MnCl2+2H2O+Cl2↑
加热
(浓)
【思考交流】从氯气的发现到确认为一种新的元素,时间长达三十多年。你从这一史实中得到什么启示?
任务一:化学史情景的启示
该反应的氧化剂: ;
浓盐酸的作用: ;
氧化剂和还原剂个数之比: 。
结合反应原理,判断气体发生装置类型为 。
1.实验室用二氧化锰与浓盐酸反应制取氯气(教材48页)
【反应原理】
MnO2+4HCl(浓)====MnCl2+Cl2↑+2H2O
△
MnO2+4H++2Cl-==== Mn2++Cl2↑+2H2O
△
MnO2
表现还原性,又表现酸性
1∶2
固 + 液 → 气
△
任务二:认识氯气的实验室制法
【书写表达】将上述反应方程式改写成离子方程式
【全面剖析】
任务二:认识氯气的实验室制法
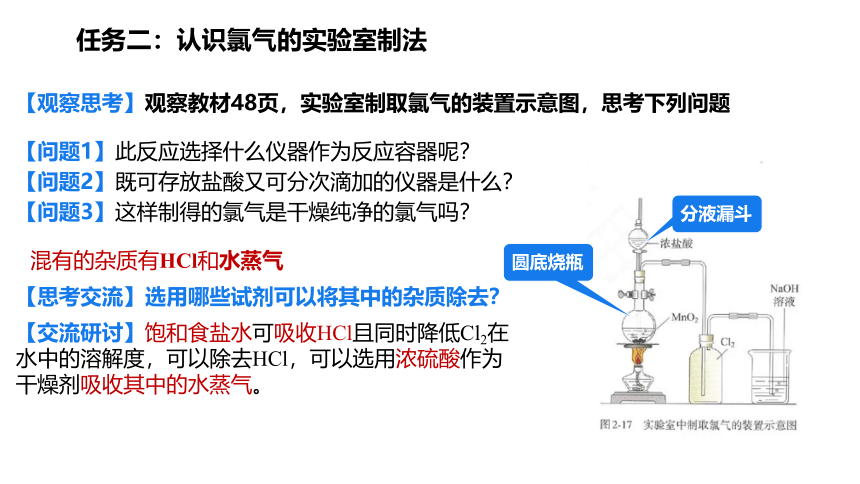
【观察思考】观察教材48页,实验室制取氯气的装置示意图,思考下列问题
【问题2】既可存放盐酸又可分次滴加的仪器是什么?
【问题1】此反应选择什么仪器作为反应容器呢?
【问题3】这样制得的氯气是干燥纯净的氯气吗?
圆底烧瓶
分液漏斗
混有的杂质有HCl和水蒸气
【思考交流】选用哪些试剂可以将其中的杂质除去?
【交流研讨】饱和食盐水可吸收HCl且同时降低Cl2在水中的溶解度,可以除去HCl,可以选用浓硫酸作为干燥剂吸收其中的水蒸气。
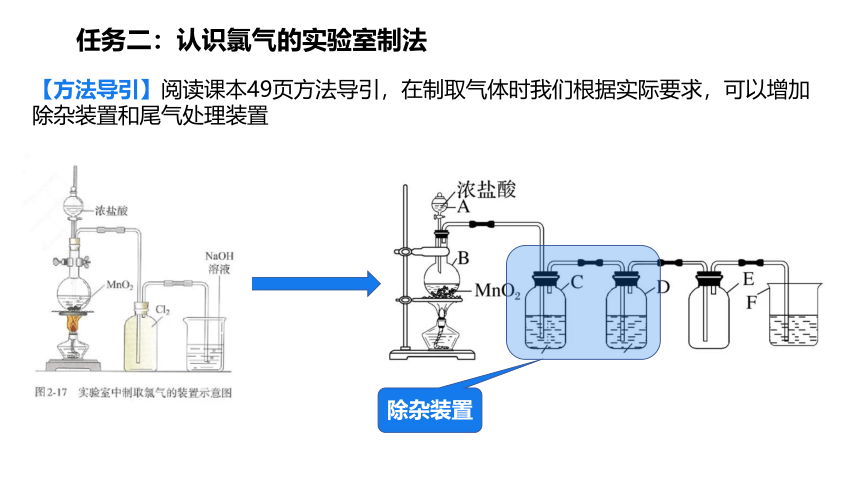
【方法导引】阅读课本49页方法导引,在制取气体时我们根据实际要求,可以增加除杂装置和尾气处理装置
任务二:认识氯气的实验室制法
除杂装置
任务二:认识氯气的实验室制法
【问题5】先除去哪种杂质气体呢?
【问题4】除去气体中杂质的装置是什么?
【问题6】要达到最佳洗涤或干燥效果,从洗气瓶的哪端进入气体?
【交流研讨】
饱和食盐水除去Cl2中少量的HCl气体,
浓硫酸干燥氯气(或除去氯气中的水蒸气)
洗气瓶
长进短出
除杂
除杂装置
【问题7】收集氯气能用排水法吗?为什么?
【问题8】利用排气法收集氯气时应该从哪端进气?
【问题9】多余的氯气能直接排放到空气中吗?
【交流研讨】
任务二:认识氯气的实验室制法
收集装置
尾气处理装置
NaOH吸收过量的氯气,防止污染环境
向上排空气法(氯气的密度比空气的大),气体长进短出
不能,因为氯气与水反应
不能,因为氯气是有毒气体
排饱和食盐水法(氯气在饱和氯化钠溶液中的溶解度很小,可除去HCl气体)。但这样
制得的氯气不是干燥氯气。
①观察法:集气瓶中充满黄绿色气体。
②湿润的淀粉-KI试纸:若出现淀粉-KI试纸变蓝,则证明已集满。原理为
Cl2+2KI===2KCl+I2,置换出的I2遇淀粉变蓝。
③湿润的蓝色石蕊试纸:若出现先变红后褪色,则证明已集满。
任务二:认识氯气的实验室制法
【思考交流】制取氯气还可以用什么方法来收集氯气?
【小组探讨】如何验证氯气已收集满?
任务二:认识氯气的实验室制法
【模型建构】实验室用二氧化锰与浓盐酸反应制备干燥纯净的氯气装置
(1)仪器的安装:顺序——由下而上,从左到右
(2)检查装置气密性;
(3)添加药品:顺序——先固后液,先下后上
(4)缓缓加热:因为浓盐酸具有强烈的挥发性
(5)结束实验:
【知识拓展】制备实验的二意识、三原理、四过程
二意识:安全意识与环保意识
三原理:反应原理、装置原理、操作原理
四过程:气体发生过程、净化过程、收集过程、尾气处理过程
任务二:认识氯气的实验室制法
【实验步骤】
【思考交流】实验室在氯气制取过程中如何进行仪器的组装?
任务二:认识氯气的实验室制法
【实验演示】实验室用二氧化锰与浓盐酸反应制备干燥纯净的氯气
制备装置:
根据反应物状态及反应条件选择
除杂装置:
根据气体及杂质性质选择
收集或性质探究装置:
根据气体密度、在水中溶解性及是否与水反应选择
尾气吸收装置:
根据气体性质选择,防污染环境,防倒吸
【模型建构】实验室中制取气体装置的连接顺序及选择装置的原则
任务二:认识氯气的实验室制法
【问题1】已知稀盐酸与MnO2不反应,含有146 g HCl的浓盐酸与足量的MnO2反应,能生成71 g Cl2吗?
不能。有两个原因:一是随着反应的进行,盐酸浓度变小,Cl-的还原性减弱,MnO2不能再氧化HCl,此反应不再进行;二是浓盐酸有挥发性。
【问题2】氯气有毒,实验中处理尾气能否用饱和石灰水代替NaOH溶液,为什么?
不能。饱和的石灰水中Ca(OH)2的含量也很低,不能把多余Cl2完全吸收。
任务二:认识氯气的实验室制法
【解决问题】实验室用二氧化锰与浓盐酸反应制备干燥纯净的氯气
用KMnO4、KClO3、NaClO、等氧化剂代替MnO2制取氯气,反应不需加热且反应速率较快,如:
①2KMnO4+16HCl(浓)===2MnCl2+2KCl+5Cl2↑+8H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③NaClO+2HCl===NaCl+Cl2↑+H2O
任务二:认识氯气的实验室制法
【拓展应用】实验室制取氯气的其他方法
【联系生活】洁厕灵的主要成分含盐酸,84消毒液的主要成分是NaClO,两者混合在一起会发生反应③,生成氯气,危险!
1.实验室制取氯气时,如图所示操作正确的是
A.用图1装置制取少量氯气
B.用图2装置除去氯气中混有的少量氯化氢
C.用图3装置制取氯气
D.用图4装置干燥氯气
√
稀盐酸不反应
需加热
两者均反应
长进短出
任务二:认识氯气的实验室制法
【评价训练】
2.如图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是
A.a—b—c—d—e—f—g—h
B.a—e—d—c—b—h—i—g
C.a—d—e—c—b—h—i—g
D.a—c—b—d—e—h—i—f
√
制气→除HCl→除H2O→制备FeCl3→吸收Cl2顺序连接
任务二:认识氯气的实验室制法
【评价训练】
第2课时 氯气的实验室制法
第二章 海水中的重要元素——钠和氯
第二节 氯及其化合物
1.了解氯气的发现史,学习科学家的研究精神及勤于钻研、严谨求实的科学态度。
2.通过设计氯气的实验室制备方案,让学生了解氯气制取的设计思路和实验操作方法
核心素养学习目标
舍勒 【瑞典】
18世纪,人们致力于采矿事业, 瑞典化学家舍勒也把精力放在了软锰矿(主要成分是MnO2)的研究上。
1774年的一天当他把软锰矿粉末和浓盐酸混合加热时,惊奇的看到一种黄绿色的气体冒出。这种呛人的气体不但能使染料褪色,还有许多奇特的性质。
直到1807年,英国化学家戴维对这种气体进行了细致的研究,并于1810年11月在英国皇家学会上正式定名确认上述黄绿色气体是由一种新元素组成,英文定名为“Chlorine”,希腊文的意思是“绿色的”。
戴维 【英国】
创设情境
【归纳总结】舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。请写出舍勒发现氯气的化学反应方程式。
启示3:科学研究需要有热爱科学的思想和奉献科学的精神。
启示1:科学研究需要有正确的理论作指导,错误的理论只能浪费时间和精力。
启示2:科学研究需要以大量事实为依据,只有大量事实才能推翻错误的理论,建立正确的理论或推动科学理论的发展。
MnO2+4HCl MnCl2+2H2O+Cl2↑
加热
(浓)
【思考交流】从氯气的发现到确认为一种新的元素,时间长达三十多年。你从这一史实中得到什么启示?
任务一:化学史情景的启示
该反应的氧化剂: ;
浓盐酸的作用: ;
氧化剂和还原剂个数之比: 。
结合反应原理,判断气体发生装置类型为 。
1.实验室用二氧化锰与浓盐酸反应制取氯气(教材48页)
【反应原理】
MnO2+4HCl(浓)====MnCl2+Cl2↑+2H2O
△
MnO2+4H++2Cl-==== Mn2++Cl2↑+2H2O
△
MnO2
表现还原性,又表现酸性
1∶2
固 + 液 → 气
△
任务二:认识氯气的实验室制法
【书写表达】将上述反应方程式改写成离子方程式
【全面剖析】
任务二:认识氯气的实验室制法
【观察思考】观察教材48页,实验室制取氯气的装置示意图,思考下列问题
【问题2】既可存放盐酸又可分次滴加的仪器是什么?
【问题1】此反应选择什么仪器作为反应容器呢?
【问题3】这样制得的氯气是干燥纯净的氯气吗?
圆底烧瓶
分液漏斗
混有的杂质有HCl和水蒸气
【思考交流】选用哪些试剂可以将其中的杂质除去?
【交流研讨】饱和食盐水可吸收HCl且同时降低Cl2在水中的溶解度,可以除去HCl,可以选用浓硫酸作为干燥剂吸收其中的水蒸气。
【方法导引】阅读课本49页方法导引,在制取气体时我们根据实际要求,可以增加除杂装置和尾气处理装置
任务二:认识氯气的实验室制法
除杂装置
任务二:认识氯气的实验室制法
【问题5】先除去哪种杂质气体呢?
【问题4】除去气体中杂质的装置是什么?
【问题6】要达到最佳洗涤或干燥效果,从洗气瓶的哪端进入气体?
【交流研讨】
饱和食盐水除去Cl2中少量的HCl气体,
浓硫酸干燥氯气(或除去氯气中的水蒸气)
洗气瓶
长进短出
除杂
除杂装置
【问题7】收集氯气能用排水法吗?为什么?
【问题8】利用排气法收集氯气时应该从哪端进气?
【问题9】多余的氯气能直接排放到空气中吗?
【交流研讨】
任务二:认识氯气的实验室制法
收集装置
尾气处理装置
NaOH吸收过量的氯气,防止污染环境
向上排空气法(氯气的密度比空气的大),气体长进短出
不能,因为氯气与水反应
不能,因为氯气是有毒气体
排饱和食盐水法(氯气在饱和氯化钠溶液中的溶解度很小,可除去HCl气体)。但这样
制得的氯气不是干燥氯气。
①观察法:集气瓶中充满黄绿色气体。
②湿润的淀粉-KI试纸:若出现淀粉-KI试纸变蓝,则证明已集满。原理为
Cl2+2KI===2KCl+I2,置换出的I2遇淀粉变蓝。
③湿润的蓝色石蕊试纸:若出现先变红后褪色,则证明已集满。
任务二:认识氯气的实验室制法
【思考交流】制取氯气还可以用什么方法来收集氯气?
【小组探讨】如何验证氯气已收集满?
任务二:认识氯气的实验室制法
【模型建构】实验室用二氧化锰与浓盐酸反应制备干燥纯净的氯气装置
(1)仪器的安装:顺序——由下而上,从左到右
(2)检查装置气密性;
(3)添加药品:顺序——先固后液,先下后上
(4)缓缓加热:因为浓盐酸具有强烈的挥发性
(5)结束实验:
【知识拓展】制备实验的二意识、三原理、四过程
二意识:安全意识与环保意识
三原理:反应原理、装置原理、操作原理
四过程:气体发生过程、净化过程、收集过程、尾气处理过程
任务二:认识氯气的实验室制法
【实验步骤】
【思考交流】实验室在氯气制取过程中如何进行仪器的组装?
任务二:认识氯气的实验室制法
【实验演示】实验室用二氧化锰与浓盐酸反应制备干燥纯净的氯气
制备装置:
根据反应物状态及反应条件选择
除杂装置:
根据气体及杂质性质选择
收集或性质探究装置:
根据气体密度、在水中溶解性及是否与水反应选择
尾气吸收装置:
根据气体性质选择,防污染环境,防倒吸
【模型建构】实验室中制取气体装置的连接顺序及选择装置的原则
任务二:认识氯气的实验室制法
【问题1】已知稀盐酸与MnO2不反应,含有146 g HCl的浓盐酸与足量的MnO2反应,能生成71 g Cl2吗?
不能。有两个原因:一是随着反应的进行,盐酸浓度变小,Cl-的还原性减弱,MnO2不能再氧化HCl,此反应不再进行;二是浓盐酸有挥发性。
【问题2】氯气有毒,实验中处理尾气能否用饱和石灰水代替NaOH溶液,为什么?
不能。饱和的石灰水中Ca(OH)2的含量也很低,不能把多余Cl2完全吸收。
任务二:认识氯气的实验室制法
【解决问题】实验室用二氧化锰与浓盐酸反应制备干燥纯净的氯气
用KMnO4、KClO3、NaClO、等氧化剂代替MnO2制取氯气,反应不需加热且反应速率较快,如:
①2KMnO4+16HCl(浓)===2MnCl2+2KCl+5Cl2↑+8H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③NaClO+2HCl===NaCl+Cl2↑+H2O
任务二:认识氯气的实验室制法
【拓展应用】实验室制取氯气的其他方法
【联系生活】洁厕灵的主要成分含盐酸,84消毒液的主要成分是NaClO,两者混合在一起会发生反应③,生成氯气,危险!
1.实验室制取氯气时,如图所示操作正确的是
A.用图1装置制取少量氯气
B.用图2装置除去氯气中混有的少量氯化氢
C.用图3装置制取氯气
D.用图4装置干燥氯气
√
稀盐酸不反应
需加热
两者均反应
长进短出
任务二:认识氯气的实验室制法
【评价训练】
2.如图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是
A.a—b—c—d—e—f—g—h
B.a—e—d—c—b—h—i—g
C.a—d—e—c—b—h—i—g
D.a—c—b—d—e—h—i—f
√
制气→除HCl→除H2O→制备FeCl3→吸收Cl2顺序连接
任务二:认识氯气的实验室制法
【评价训练】
