1.3氧化还原反应 课件(79张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3氧化还原反应 课件(79张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 23.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-25 23:09:40 | ||
图片预览










文档简介
(共79张PPT)
氧化还原反应
第一课时
必修一·第一章第三节
生活中的现象
新切的苹果与放置30分钟后的苹果
新的铁钉与长久放置的铁钉
铁生锈
铁矿石炼铁
Fe →Fe2O3 氧化反应
Fe2O3 → Fe 还原反应
一、氧化还原反应
知识回顾
2CuO + C === 2Cu + CO2↑
高温
失去氧,发生还原反应
得到氧,发生氧化反应
Fe2O3 + 3CO === 2Fe+3CO2
高温
失去氧,发生还原反应
得到氧,发生氧化反应
【氧化还原反应】
氧化反应和还原反应是在一个反应中同时发生(P22)
请标出上述反应中元素化合价的变化情况
请根据初中学过的知识分析以下反应,完成书P22表格
同时开始,同时结束,没有先后顺序
从得失氧角度-氧化还原反应
2CuO + C === 2Cu + CO2↑
高温
失去氧,发生还原反应
得到氧,发生氧化反应
Fe2O3 + 3CO === 2Fe+3CO2
高温
失去氧,发生还原反应
得到氧,发生氧化反应
+2
0
,化合价降低
0
+4
,化合价升高
+3
0
,化合价降低
+2
+4
,化合价升高
【概念】 有元素化合价发生变化的反应就是氧化还原反应
判断依据
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
从元素化合价升降角度-氧化还原反应
氧化还原反应
哪些反应是氧化还原反应?(多选)
思考
A.CuO + CO = Cu + CO2↑
C.CuO + H2 = Cu + H2O
D.Zn + 2HCl = ZnCl2 + H2↑
高温
高温
Δ
B.Fe2O3 + 3CO = 2Fe + 3CO2
一价氢氯钾钠银;二价氧钙钡镁锌。
三铝四硅五价磷,变价元素记在心。
二三铁,二四碳,一七氯,三五氮。
二四六硫要分清,铜汞一二也都有。单质元素价为零
负一硝酸氢氧根,负二碳酸硫酸根。
负三记住磷酸根,正一价的是铵根。
+2
+2
0
+4
+3
+2
+2
+2
0
0
0
+4
0
0
+1
+1
概念
氧化反应:物质所含元素化合价升高的反应。
还原反应:物质所含元素化合价降低的反应。
氧化还原反应:有元素化合价变化的化学反应。
【总结】并非只有得氧、失氧的反应才是氧化还原反应,凡是有化合价升降的化学反应都是氧化还原反应。
氧化还原反应
Zn + 2HCl = ZnCl2 + H2↑
0
0
+2
+1
-1
-1
NaOH + HCl = NaCl + H2O
-1
-1
+1
+1
+1
+1
+1
-2
-2
不是
分析下列反应中各元素化合价在反应前后有无变化,如何变化。并判断是否是氧化还原反应。
是
【练习】
氧化还原反应
练习 判断下列反应是否为氧化还原反应
1. NaCl + AgNO3 = AgCl↓ + NaNO3
2. H2 + Cl2 = 2HCl
3. 2Na + 2H2O = 2NaOH + H2 ↑
点燃
4.2Na +Cl2 = 2NaCl
点燃
+1
-1
+1
-2
+5
-1
+1
+1
-2
+5
×
+1
-1
0
0
√
0
+1
-2
+1
+1
-2
0
√
0
0
+1
-1
√
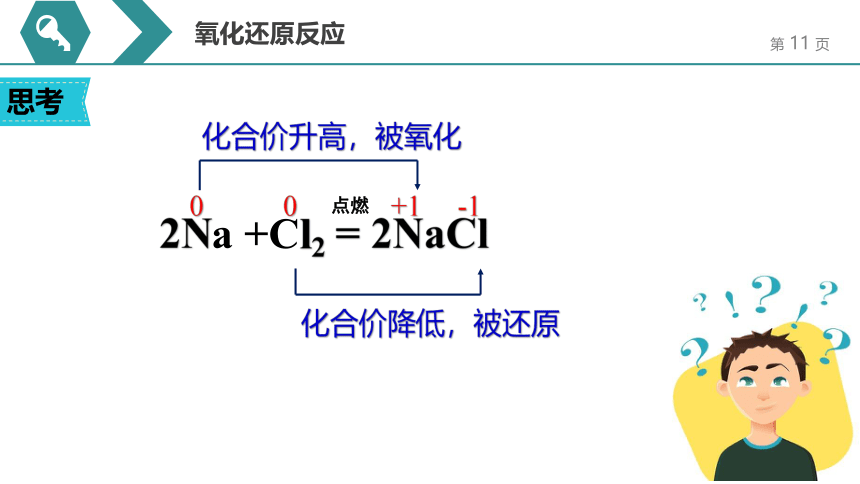
2Na +Cl2 = 2NaCl
思考
氧化还原反应
点燃
化合价升高,被氧化
化合价降低,被还原
0 0 +1 -1
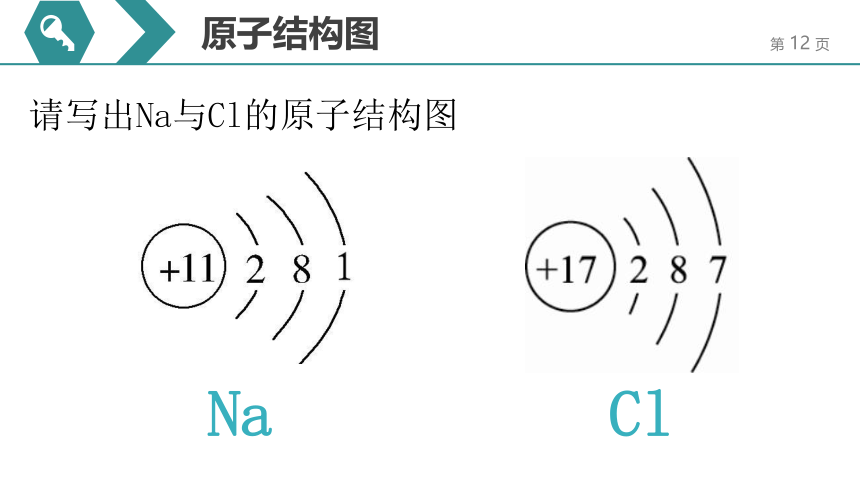
原子结构图
请写出Na与Cl的原子结构图
Na
Cl
下列为一些原子的结构示意图,哪些原子容易失去电子,哪些原子容易得到电子?
原子结构图
H
Na
O
Cl
Ne
+11
Na
+17
Cl
+11
Na+
氯化钠的形成
Cl-
NaCl
从电子转移角度-氧化还原反应
氧化还原反应
化合价发生升降
的原因又是什么呢?
氧化还原反应
H2 + Cl2 === 2HCl
点燃
0
0
+1
-1
化合价升高
化合价降低
+1
1
+17
2
8
7
你的电子
借我用用
Cl
H
你的电子借我用用
电子对偏向Cl
归纳
氧化反应: 物质失去(或偏离)电子的反应
从电子转移的角度认识氧化还原反应
氧化还原反应: 有电子得失(或偏移)的反应
还原反应: 物质得到(或偏向)电子的反应
转移
回顾
归纳
得电子(共用电子对偏向)
还原反应
化合价降低
失电子(共用电子对偏离)
化合价升高
氧化反应
归纳
表观认识
化合价升降(判断依据)
电子转移(得失或偏移)
特征认识
本质认识
得氧失氧(片面)
宏观
微观
(多选)1、CIO2是一种消毒杀菌效率高、二次污染小的用水处理剂。实验室可通过以下反应制得 CIO2:
2KCIO3+H2C2O4 == 2ClO2+K2SO4+2CO2 ↑ +2H2O。下列说法正确的是:
A. KCIO3在反应中失去电子
B. 2ClO2是还原产物
C. H2C2O4在反应中被氧化
D. K2SO4在反应中得到电子被还原
【练一练】
BC
与四类基本反应类型的关系
反应类型 氧化还原反应的实例 非氧化还原反应的实例 结论
化合反应 (A+B=AB) CaO +H2O=Ca(OH)2 ①化合反应不一定是氧化还原反应;
②有单质参加的化合反应一定是氧化还原反应
分解反应 (AB=A+B) NH4HCO3 = NH3↑+CO2↑+H2O ①分解反应不一定是氧化还原反应;
②有单质生成的分解反应一定是氧化还原反应
置换反应(A+BC=B+AC) Fe + CuSO4==FeSO4+Cu 置换反应一定是氧化还原反应
复分解反应(AB+CD=AD+CB) HCI + KOH=KCI+H2O 复分解反应一定不是氧化还原反应
Δ
点燃
2H2+02 == 2H2O
MnO2
2KCIO3 == 2KC1+302↑
氧化还原反应
化合
分解
置换
复分解
C + O2 = CO2
CaO + H2O = Ca(OH)2
2KClO3 = 2KCl + 3O2↑
Cu(OH)2 = CuO + H2O
H2+CuO = Cu + H2O
2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4
△
点燃
△
有单质参加
有单质生成
有单质参加并有单质生成
与四类基本反应类型的关系
△
氧化还原反应
复分解反应
化合反应
分解反应
氧化还原反应
非氧化还原反应
1.化合反应:有单质参加的是氧化还原反应。
2.分解反应:有单质生成的是氧化还原反应。
4.复分解反应:都是非氧化还原反应。
置换反应
3.置换反应:全部是氧化还原反应。
与四类基本反应类型的关系
【练一练】
下列关于氧化还原反应的说法中,错误是:
A.在反应中失去电子的物质被氧化,得到电子的物质被还原
B.在氧化还原反应中氧化产物和还原产物可以是同一物质没有先后顺序
C.氧化还原反应是一种物质首先被氧化,另一种物质再被还原的反应
D.只有氧化没有还原的反应是不存在的
C
同时发生
化学反应的分类
化学反应
按反应形式分:四种基本反应类型
按是否有电子转移分
按反应粒子分
氧化还原反应
非氧化还原反应
离子反应
分子反应
氧化还原反应
练习
氧化还原反应
下列叙述正确的是( )
A.在氧化还原反应中,失去电子的物质,所含元素化合价降低.
B.在氧化还原反应中一定所有的元素化合价都发生变化.
C.氧化还原反应的本质是电子的转移.
C
氧化还原反应
练习 判断下列反应是否为氧化还原反应
2. Fe + 2FeCl3 = 3FeCl2
1. 4HCl(浓) + MnO2 = MnCl2 + Cl2↑ + 2H2O
Δ
二、电子转移的
表示方法
氧化还原反应中电子转移的两种表示方法
1.双线桥法
表示反应前后同一元素原子间电子转移情况。
基本步骤——“三步曲”
氧化还原反应—电子转移的表示方法
练习
1. 2Na + 2H2O = 2NaOH + H2 ↑
2. 2Ca(OH)2 + 2Cl2 = Ca(ClO)2 +CaCl2 + 2H2 O
3. 3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO ↑ + 4H2O
4.SO2 + 2H2S = 3S↓ + 2H2O
注意事项:
2.单线桥法
表示反应前后不同元素原子间电子转移情况。
(1)基本步骤——“三步曲”
注意事项:
氧化还原反应—电子转移的表示方法
练习
1. 2Na + 2H2O = 2NaOH + H2 ↑
2. 2Ca(OH)2 + 2Cl2 = Ca(ClO)2 +CaCl2 + 2H2 O
3. 3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO ↑ + 4H2O
4.SO2 + 2H2S = 3S↓ + 2H2O
BD
氧化还原反应—电子转移的表示方法
作业
3. 2Na + 2H2O = 2NaOH + H2 ↑
4. 2Ca(OH)2 + 2Cl2 = Ca(ClO)2 +CaCl2 + 2H2 O
5. 3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO ↑ + 4H2O
请用单线桥和双线桥标出电子转移的情况
Δ
1. 4HCl(浓) + MnO2 = Cl2↑+MnCl2 + 2H2O
2. 2KClO3 = 2KCl+ 3O2↑
Δ
MnO2
6.SO2+2H2S =3S↓+2H2O
三、氧化剂与还原剂
氧化还原反应—有关概念及其相互关系
氧化反应: 物质所含元素化合价升高的反应。
还原反应: 物质所含元素化合价降低的反应。
氧化剂: 化合价降低的反应物
氧化产物: 氧化反应得到的产物/化合价升高的产物(对应还原剂)
还原剂: 化合价升高的反应物
氧化性: 氧化剂所表现出的得电子的能力。
还原产物: 还原反应得到的产物/化合价降低的产物(对应氧化剂)
还原性: 还原剂所表现出的失电子的能力。
+3 +2 0 +4
化合价降低,得到2×3e-,被还原(还原反应)
氧化剂 还原剂 还原产物 氧化产物
化合价降低,得到电子,被还原(还原反应),氧化剂
化合价升高,失去电子,被氧化(氧化反应),还原剂
氧化剂 + 还原剂 → 还原产物 + 氧化产物
氧化还原反应—有关概念及其相互关系
化合价升高,失去3×2e-,被氧化(氧化反应)
Fe2O3+ 3CO = 2Fe+ 3CO2
高温
Fe:+3→0 ,降低3,得到2×3e-,即6e-
C:+2→+4,升高2,失去3×2e-,即6e-
得电子总数=化合价降低的原子个数×降低的化合价
失电子总数=化合价升高的原子个数×升高的化合价
失电子总数=得电子总数(得失电子守恒)
氧化还原反应—电子转移的表示方法
Δ
1. 4HCl(浓) + MnO2 = Cl2↑+MnCl2 + 2H2O
练习 :
分析化合价变化,电子转移情况,被氧化/还原,氧化/还原剂,氧化/还原产物
2. 2KClO3 = 2KCl+ 3O2↑
Δ
MnO2
回顾
CuO + H2 = Cu + H2O
氧化还原反应—常见的氧化剂还原剂
请分别用双线桥法和单线桥法表示电子转移情况,被氧化/还原,氧化/还原剂,氧化/还原产物
Δ
+2
0
0
+1
氧化剂
还原剂
还原产物
氧化产物
Cu 的化合价:0 +1 +2
最高价态
氧化性
H 的化合价:0 +1
最低价态
还原性
氧化还原反应—常见的氧化剂还原剂
+3
还原性
还原剂
FeCl3
最高价态
氧化性
Fe2+
被还原
KI
最低价态
I2
被氧化
-1
氧化剂
+7
还原剂
KMnO4
最高价态
氧化性
Mn2+
被还原
CH3CH2OH(乙醇)
氧化剂
氧化还原反应—常见的氧化剂还原剂
1.元素氧化性、还原性的判断
若元素处于最高价,则只表现氧化性,只能作氧化剂。
浓H2SO4
+6
若元素处于最低价,则只表现还原性,只能作还原剂。
H2S
-2
若元素处于中间价,既有氧化性又有还原性,可作氧化剂和还原剂。
SO2
H2SO3
+4
+4
下列微粒不具有还原性的是( )
A.K B.Fe2+ C.S2- D.Na+
D
物质在反应中作氧化剂或还原剂,主要取决于元素的化合价。
氧化还原反应—常见的氧化剂还原剂
2.氧化剂
a.活泼的非金属单质
b.高价态含氧化合物
d.过氧化物
c.高价金属阳离子
Cl2 、O2、Br2
浓H2SO4、HNO3、KMnO4、MnO2、 KClO3、HClO、NaClO
Fe3+、Cu2+、Ag+
H2O2、Na2O2
氧化还原反应—常见的氧化剂还原剂
3.还原剂
a.活泼金属
b.某些非金属单质
c.非金属离子及其低价化合物
K、Ca、Na、Mg、Au、Zn、Fe
C、H2
S2-、I-、 H2S、HI、CO、SO2、
浓HCl 、H2SO3 、Na2SO3、NH3
d.低价金属阳离子
Fe2+、Cu+
氧化还原反应—基本规律
4.同种元素不同价态之间的氧化还原反应
同种元素的不同价态间发生氧化还原反应化合价只靠拢不交叉
归中反应:同种元素组成的不同物质发生氧化还原反应,这种元素的化合价向中间靠拢。
H2S + H2SO4(浓)= S + SO2 + H2O
C + CO2 = 2CO
点燃
氧化还原反应—基本规律
4.同种元素不同价态之间的氧化还原反应
歧化反应:反应物中同一物质同一元素化合价有升也有降。
(当元素的化合价处于中间价态时,才能发生歧化)
Cl2 + H2O = HCl + HClO
FeCl3
无法歧化
1.在氧化还原反应中,肯定有一种元素被氧化另一种元素被还原。
2.没有单质参加的反应一定不是氧化还原反应
3.失电子难的原子容易获得电子。
4.在氧化还原反应中,金属单质一定是还原剂,非金属单质一定是氧化剂。
×
×
×
×
氧化还原反应
判断正误并说明理由
四、氧化性、还原性强弱的比较
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
氧化剂 + 还原剂 = 还原产物 + 氧化产物
氧化性:氧化剂 > 氧化产物
还原性: 还原剂 > 还原产物
{
示例: Zn + Fe2+ = Zn2+ + Fe
1.根据氧化还原反应方程式判断
1.根据下列三个离子方程式:
①2Fe3++2I-=2Fe2++I2
②2Fe2++Cl2=2Fe3++2Cl-
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
则这三个离子方程式所涉及微粒的氧化性强弱关系正确的是( )
A.MnO4->I2>Cl2>Fe3+
B.MnO4->Cl2>Fe3+>I2
C.I2>Fe3+>Cl2>MnO4-
D.Cl2>MnO4->Fe3+>I2
B
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
2.有下列氧化还原反应:Cl2+2KBr=2KCl+Br2、Br2+2KI=I2+2KBr,
则I2、Br2、Cl2、的氧化性强弱顺序是———————————,
I-、Cl-、Br-的还原性顺序是——————————————
Cl2﹥Br2﹥I2
I-﹥Br-﹥Cl-
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
2.根据金属性活动顺序表
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
失电子能力减弱,单质还原性逐渐减弱
K+、Ca2+、Na+、Mg2+、Al3+、Zn2+、Fe2+、Sn2+、Pb2+、H+、Cu2+、Hg2+、Ag+
得电子能力增强,阳离子的氧化性逐渐增强
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
F2、Cl2、Br2、I2
F-、Cl-、Br-、I-
单质的氧化性逐渐减弱
阴离子的还原性逐渐增强
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
3.根据氧化产物的价态高低比较
不同氧化剂与相同还原剂作用时,还原剂化合价升高的数值越大,氧化剂的氧化性越强。
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
4.根据反应条件及反应的剧烈程度比较
反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,如是否加热、反应温度高低、有无催化剂和反应物浓度大小等。
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
5.根据同种元素的价态高低判断
一般来说,对于同种元素,价态越高,其氧化性越强;
价态越低,其还原性越强
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
练习
D
五、氧化还原反应的基本规律
氧化还原反应—基本规律
1.守恒规律
a.原子守恒—质量守恒
b.电荷守恒
c.得失电子守恒
d.化合价升降守恒
氧化剂得电子总数=还原剂失电子总数
化合价升高总数=化合价降低总数
微观
宏观
氧化还原反应—基本规律
练习
1.已知M2O7x- + 3S2- + 14H+ = 2M3+ + 3S↓ + 7H2O,则M的化合价为( )
+6
氧化还原反应—基本规律
2.反应先后规律
a.当一种氧化剂遇到多种还原剂时,还原剂按还原性先强后弱的顺序参与反应
d.当一种还原剂遇到多种氧化剂时,氧化剂按氧化性先强后弱的顺序参与反应
将Cl2通入FeBr2溶液中,Fe2+、Br-谁先被氧化?
Fe加入硝酸镁、硝酸铜、硝酸银混合溶液,先置换出哪一种单质?
还原性I->Fe2+>Br-
氧化还原反应—基本规律
3.价态转化规律
同种元素的不同价态间发生氧化还原反应化合价只靠拢不交叉
归中反应:同种元素组成的不同物质发生氧化还原反应,这种元素的化合价向中间靠拢。
歧化反应:反应物中同一物质同一元素化合价有升也有降。
2H2S + 2SO2 = 3S + 2H2 O
Cl2 + H2O = HCl + HClO
六、氧化还原反应方程式的配平
氧化还原反应—氧化还原方程式的配平
一、配平原理—三大守恒
a.原子守恒(质量守恒)
b.电荷守恒
c.得失电子守恒(化合价升降守恒)
氧化还原反应—方程式的配平
二、配平步骤
1.标价态
2.列变化
5.查守恒
标明反应前后化合价有变化的元素的化合价。
列出化合价的变化。
确定氧化剂、还原剂、氧化产物、还原产物的系数,再通过观察法配平其他物质的系数。
求最小公倍数,通过最小公倍数法使化合价升降总值相等。
检查三大守恒。
3.求最小公倍数
4.配系数
C + H2SO4(浓) - CO2↑ + SO2↑ + H2O
氧化还原反应—方程式的配平
练习
Cu + HNO3(稀) - Cu(NO3)2 + NO↑ + H2O
①氧化产物:还原产物=
②体现氧化性与酸性的硝酸的比值为
③转移电子数
3:2
1:3
3molCu~3molHNO3~6NA
练习
MnO2 + HCl(浓) - MnCl2 + Cl2↑ + H2O
Cu + HNO3(浓) - Cu(NO3)2 + NO2↑ + H2O
示例
氧化还原反应—方程式的配平
示例
示例
NH3 + NO - N2 + H2O
S + KOH - K2 S + K2 SO3 + H2O
归中反应:同种元素的不同价态到同一价态
歧化反应:同种元素的一种价态到多种价态
氧化还原反应—方程式的配平
Cu + HNO3(浓) - Cu(NO3)2 + NO2↑ + H2O
三、配平技巧
MnO2 + HCl(浓) - MnCl2 + Cl2↑ + H2O
Cu + HNO3(稀) - Cu(NO3)2 + NO↑ + H2O
KMnO4 + HCl(浓) - KCl + MnCl2 + Cl2↑ + H2O
部分氧化还原反应—可采用逆向配平
氧化还原反应—方程式的配平
四、特殊氧化还原反应的配平
FeS + HNO3 - Fe(NO3)3 + NO↑ + H2SO4 + H2O
Cu2S + HNO3 - Cu(NO3)2 + NO↑ + H2SO4 + H2O
FeS2 + O2 - Fe2O3 + SO2
示例
示例
练习
氧化还原反应—方程式的配平
练习
练习
K2CrO7 + KI + HCl - I2 + KCl + CrCl3+ H2O
Cr2O72- + SO32- + H+ - Cr3+ + SO42- + H2O
注意电荷守恒
氧化还原反应—方程式的配平
五、缺项配平
Cr2O72- + I- + — - Cr3+ + I2 + H2O
缺项常为H+ 、OH- 、H2O
MnO4- + H2O2 + — - Mn2+ + O2↑ + —
ClO- + Fe(OH)3 + — - Cl- + FeO42- + —
氧化还原反应—有关的计算
1.氧化剂与还原剂之比,氧化产物与还原产物之比
①. 3Br2 + 6NaOH = 5NaBr + NaBrO3 + 3H2O
氧化剂与还原剂的物质的量之比 ,氧化产物与还原产物的物质的量之比 。
Δ
②. MnO2 + 4HCl(浓) = MnCl2 + 2H2O + Cl2↑
氧化剂与还原剂的物质的量之比 。
5:1
1:5
1:2
氧化还原反应—有关的计算
2.求转移的电子数
①. 3Br2 + 6NaOH = 5NaBr + NaBrO3 + 3H2O,
如果生成1mol NaBrO3,转移的电子数为 。
②. HClO2 → ClO2↑ + H+ + Cl- + H2O (未配平)
当1molHClO2分解时,转移的电子数为 mol 。
2
5NA
0.8
氧化还原反应—有关的计算
3.求被氧化或被还原后元素的化合价
①. 向KOH溶液中通入11.2L(标准状况)氯气恰好完全反应生成三种含氯盐 。0.7molKCl、0.2molKClO和X。则X是( )
A.0.2mol KClO4 B.0.1mol KClO3 C.0.2mol KClO2 D.0.1mol KClO2
②. 硫代硫酸钠可作为脱氧剂,已知25.0mL 0.1mol/L Na2S2O3溶液恰好把标准状况下112mL Cl2完全转化为Cl-,则S2O32-将转化为( )
B
C
A.S2- B.S C.SO32- D.SO42-
氧化还原反应
第一课时
必修一·第一章第三节
生活中的现象
新切的苹果与放置30分钟后的苹果
新的铁钉与长久放置的铁钉
铁生锈
铁矿石炼铁
Fe →Fe2O3 氧化反应
Fe2O3 → Fe 还原反应
一、氧化还原反应
知识回顾
2CuO + C === 2Cu + CO2↑
高温
失去氧,发生还原反应
得到氧,发生氧化反应
Fe2O3 + 3CO === 2Fe+3CO2
高温
失去氧,发生还原反应
得到氧,发生氧化反应
【氧化还原反应】
氧化反应和还原反应是在一个反应中同时发生(P22)
请标出上述反应中元素化合价的变化情况
请根据初中学过的知识分析以下反应,完成书P22表格
同时开始,同时结束,没有先后顺序
从得失氧角度-氧化还原反应
2CuO + C === 2Cu + CO2↑
高温
失去氧,发生还原反应
得到氧,发生氧化反应
Fe2O3 + 3CO === 2Fe+3CO2
高温
失去氧,发生还原反应
得到氧,发生氧化反应
+2
0
,化合价降低
0
+4
,化合价升高
+3
0
,化合价降低
+2
+4
,化合价升高
【概念】 有元素化合价发生变化的反应就是氧化还原反应
判断依据
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
从元素化合价升降角度-氧化还原反应
氧化还原反应
哪些反应是氧化还原反应?(多选)
思考
A.CuO + CO = Cu + CO2↑
C.CuO + H2 = Cu + H2O
D.Zn + 2HCl = ZnCl2 + H2↑
高温
高温
Δ
B.Fe2O3 + 3CO = 2Fe + 3CO2
一价氢氯钾钠银;二价氧钙钡镁锌。
三铝四硅五价磷,变价元素记在心。
二三铁,二四碳,一七氯,三五氮。
二四六硫要分清,铜汞一二也都有。单质元素价为零
负一硝酸氢氧根,负二碳酸硫酸根。
负三记住磷酸根,正一价的是铵根。
+2
+2
0
+4
+3
+2
+2
+2
0
0
0
+4
0
0
+1
+1
概念
氧化反应:物质所含元素化合价升高的反应。
还原反应:物质所含元素化合价降低的反应。
氧化还原反应:有元素化合价变化的化学反应。
【总结】并非只有得氧、失氧的反应才是氧化还原反应,凡是有化合价升降的化学反应都是氧化还原反应。
氧化还原反应
Zn + 2HCl = ZnCl2 + H2↑
0
0
+2
+1
-1
-1
NaOH + HCl = NaCl + H2O
-1
-1
+1
+1
+1
+1
+1
-2
-2
不是
分析下列反应中各元素化合价在反应前后有无变化,如何变化。并判断是否是氧化还原反应。
是
【练习】
氧化还原反应
练习 判断下列反应是否为氧化还原反应
1. NaCl + AgNO3 = AgCl↓ + NaNO3
2. H2 + Cl2 = 2HCl
3. 2Na + 2H2O = 2NaOH + H2 ↑
点燃
4.2Na +Cl2 = 2NaCl
点燃
+1
-1
+1
-2
+5
-1
+1
+1
-2
+5
×
+1
-1
0
0
√
0
+1
-2
+1
+1
-2
0
√
0
0
+1
-1
√
2Na +Cl2 = 2NaCl
思考
氧化还原反应
点燃
化合价升高,被氧化
化合价降低,被还原
0 0 +1 -1
原子结构图
请写出Na与Cl的原子结构图
Na
Cl
下列为一些原子的结构示意图,哪些原子容易失去电子,哪些原子容易得到电子?
原子结构图
H
Na
O
Cl
Ne
+11
Na
+17
Cl
+11
Na+
氯化钠的形成
Cl-
NaCl
从电子转移角度-氧化还原反应
氧化还原反应
化合价发生升降
的原因又是什么呢?
氧化还原反应
H2 + Cl2 === 2HCl
点燃
0
0
+1
-1
化合价升高
化合价降低
+1
1
+17
2
8
7
你的电子
借我用用
Cl
H
你的电子借我用用
电子对偏向Cl
归纳
氧化反应: 物质失去(或偏离)电子的反应
从电子转移的角度认识氧化还原反应
氧化还原反应: 有电子得失(或偏移)的反应
还原反应: 物质得到(或偏向)电子的反应
转移
回顾
归纳
得电子(共用电子对偏向)
还原反应
化合价降低
失电子(共用电子对偏离)
化合价升高
氧化反应
归纳
表观认识
化合价升降(判断依据)
电子转移(得失或偏移)
特征认识
本质认识
得氧失氧(片面)
宏观
微观
(多选)1、CIO2是一种消毒杀菌效率高、二次污染小的用水处理剂。实验室可通过以下反应制得 CIO2:
2KCIO3+H2C2O4 == 2ClO2+K2SO4+2CO2 ↑ +2H2O。下列说法正确的是:
A. KCIO3在反应中失去电子
B. 2ClO2是还原产物
C. H2C2O4在反应中被氧化
D. K2SO4在反应中得到电子被还原
【练一练】
BC
与四类基本反应类型的关系
反应类型 氧化还原反应的实例 非氧化还原反应的实例 结论
化合反应 (A+B=AB) CaO +H2O=Ca(OH)2 ①化合反应不一定是氧化还原反应;
②有单质参加的化合反应一定是氧化还原反应
分解反应 (AB=A+B) NH4HCO3 = NH3↑+CO2↑+H2O ①分解反应不一定是氧化还原反应;
②有单质生成的分解反应一定是氧化还原反应
置换反应(A+BC=B+AC) Fe + CuSO4==FeSO4+Cu 置换反应一定是氧化还原反应
复分解反应(AB+CD=AD+CB) HCI + KOH=KCI+H2O 复分解反应一定不是氧化还原反应
Δ
点燃
2H2+02 == 2H2O
MnO2
2KCIO3 == 2KC1+302↑
氧化还原反应
化合
分解
置换
复分解
C + O2 = CO2
CaO + H2O = Ca(OH)2
2KClO3 = 2KCl + 3O2↑
Cu(OH)2 = CuO + H2O
H2+CuO = Cu + H2O
2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4
△
点燃
△
有单质参加
有单质生成
有单质参加并有单质生成
与四类基本反应类型的关系
△
氧化还原反应
复分解反应
化合反应
分解反应
氧化还原反应
非氧化还原反应
1.化合反应:有单质参加的是氧化还原反应。
2.分解反应:有单质生成的是氧化还原反应。
4.复分解反应:都是非氧化还原反应。
置换反应
3.置换反应:全部是氧化还原反应。
与四类基本反应类型的关系
【练一练】
下列关于氧化还原反应的说法中,错误是:
A.在反应中失去电子的物质被氧化,得到电子的物质被还原
B.在氧化还原反应中氧化产物和还原产物可以是同一物质没有先后顺序
C.氧化还原反应是一种物质首先被氧化,另一种物质再被还原的反应
D.只有氧化没有还原的反应是不存在的
C
同时发生
化学反应的分类
化学反应
按反应形式分:四种基本反应类型
按是否有电子转移分
按反应粒子分
氧化还原反应
非氧化还原反应
离子反应
分子反应
氧化还原反应
练习
氧化还原反应
下列叙述正确的是( )
A.在氧化还原反应中,失去电子的物质,所含元素化合价降低.
B.在氧化还原反应中一定所有的元素化合价都发生变化.
C.氧化还原反应的本质是电子的转移.
C
氧化还原反应
练习 判断下列反应是否为氧化还原反应
2. Fe + 2FeCl3 = 3FeCl2
1. 4HCl(浓) + MnO2 = MnCl2 + Cl2↑ + 2H2O
Δ
二、电子转移的
表示方法
氧化还原反应中电子转移的两种表示方法
1.双线桥法
表示反应前后同一元素原子间电子转移情况。
基本步骤——“三步曲”
氧化还原反应—电子转移的表示方法
练习
1. 2Na + 2H2O = 2NaOH + H2 ↑
2. 2Ca(OH)2 + 2Cl2 = Ca(ClO)2 +CaCl2 + 2H2 O
3. 3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO ↑ + 4H2O
4.SO2 + 2H2S = 3S↓ + 2H2O
注意事项:
2.单线桥法
表示反应前后不同元素原子间电子转移情况。
(1)基本步骤——“三步曲”
注意事项:
氧化还原反应—电子转移的表示方法
练习
1. 2Na + 2H2O = 2NaOH + H2 ↑
2. 2Ca(OH)2 + 2Cl2 = Ca(ClO)2 +CaCl2 + 2H2 O
3. 3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO ↑ + 4H2O
4.SO2 + 2H2S = 3S↓ + 2H2O
BD
氧化还原反应—电子转移的表示方法
作业
3. 2Na + 2H2O = 2NaOH + H2 ↑
4. 2Ca(OH)2 + 2Cl2 = Ca(ClO)2 +CaCl2 + 2H2 O
5. 3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO ↑ + 4H2O
请用单线桥和双线桥标出电子转移的情况
Δ
1. 4HCl(浓) + MnO2 = Cl2↑+MnCl2 + 2H2O
2. 2KClO3 = 2KCl+ 3O2↑
Δ
MnO2
6.SO2+2H2S =3S↓+2H2O
三、氧化剂与还原剂
氧化还原反应—有关概念及其相互关系
氧化反应: 物质所含元素化合价升高的反应。
还原反应: 物质所含元素化合价降低的反应。
氧化剂: 化合价降低的反应物
氧化产物: 氧化反应得到的产物/化合价升高的产物(对应还原剂)
还原剂: 化合价升高的反应物
氧化性: 氧化剂所表现出的得电子的能力。
还原产物: 还原反应得到的产物/化合价降低的产物(对应氧化剂)
还原性: 还原剂所表现出的失电子的能力。
+3 +2 0 +4
化合价降低,得到2×3e-,被还原(还原反应)
氧化剂 还原剂 还原产物 氧化产物
化合价降低,得到电子,被还原(还原反应),氧化剂
化合价升高,失去电子,被氧化(氧化反应),还原剂
氧化剂 + 还原剂 → 还原产物 + 氧化产物
氧化还原反应—有关概念及其相互关系
化合价升高,失去3×2e-,被氧化(氧化反应)
Fe2O3+ 3CO = 2Fe+ 3CO2
高温
Fe:+3→0 ,降低3,得到2×3e-,即6e-
C:+2→+4,升高2,失去3×2e-,即6e-
得电子总数=化合价降低的原子个数×降低的化合价
失电子总数=化合价升高的原子个数×升高的化合价
失电子总数=得电子总数(得失电子守恒)
氧化还原反应—电子转移的表示方法
Δ
1. 4HCl(浓) + MnO2 = Cl2↑+MnCl2 + 2H2O
练习 :
分析化合价变化,电子转移情况,被氧化/还原,氧化/还原剂,氧化/还原产物
2. 2KClO3 = 2KCl+ 3O2↑
Δ
MnO2
回顾
CuO + H2 = Cu + H2O
氧化还原反应—常见的氧化剂还原剂
请分别用双线桥法和单线桥法表示电子转移情况,被氧化/还原,氧化/还原剂,氧化/还原产物
Δ
+2
0
0
+1
氧化剂
还原剂
还原产物
氧化产物
Cu 的化合价:0 +1 +2
最高价态
氧化性
H 的化合价:0 +1
最低价态
还原性
氧化还原反应—常见的氧化剂还原剂
+3
还原性
还原剂
FeCl3
最高价态
氧化性
Fe2+
被还原
KI
最低价态
I2
被氧化
-1
氧化剂
+7
还原剂
KMnO4
最高价态
氧化性
Mn2+
被还原
CH3CH2OH(乙醇)
氧化剂
氧化还原反应—常见的氧化剂还原剂
1.元素氧化性、还原性的判断
若元素处于最高价,则只表现氧化性,只能作氧化剂。
浓H2SO4
+6
若元素处于最低价,则只表现还原性,只能作还原剂。
H2S
-2
若元素处于中间价,既有氧化性又有还原性,可作氧化剂和还原剂。
SO2
H2SO3
+4
+4
下列微粒不具有还原性的是( )
A.K B.Fe2+ C.S2- D.Na+
D
物质在反应中作氧化剂或还原剂,主要取决于元素的化合价。
氧化还原反应—常见的氧化剂还原剂
2.氧化剂
a.活泼的非金属单质
b.高价态含氧化合物
d.过氧化物
c.高价金属阳离子
Cl2 、O2、Br2
浓H2SO4、HNO3、KMnO4、MnO2、 KClO3、HClO、NaClO
Fe3+、Cu2+、Ag+
H2O2、Na2O2
氧化还原反应—常见的氧化剂还原剂
3.还原剂
a.活泼金属
b.某些非金属单质
c.非金属离子及其低价化合物
K、Ca、Na、Mg、Au、Zn、Fe
C、H2
S2-、I-、 H2S、HI、CO、SO2、
浓HCl 、H2SO3 、Na2SO3、NH3
d.低价金属阳离子
Fe2+、Cu+
氧化还原反应—基本规律
4.同种元素不同价态之间的氧化还原反应
同种元素的不同价态间发生氧化还原反应化合价只靠拢不交叉
归中反应:同种元素组成的不同物质发生氧化还原反应,这种元素的化合价向中间靠拢。
H2S + H2SO4(浓)= S + SO2 + H2O
C + CO2 = 2CO
点燃
氧化还原反应—基本规律
4.同种元素不同价态之间的氧化还原反应
歧化反应:反应物中同一物质同一元素化合价有升也有降。
(当元素的化合价处于中间价态时,才能发生歧化)
Cl2 + H2O = HCl + HClO
FeCl3
无法歧化
1.在氧化还原反应中,肯定有一种元素被氧化另一种元素被还原。
2.没有单质参加的反应一定不是氧化还原反应
3.失电子难的原子容易获得电子。
4.在氧化还原反应中,金属单质一定是还原剂,非金属单质一定是氧化剂。
×
×
×
×
氧化还原反应
判断正误并说明理由
四、氧化性、还原性强弱的比较
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
氧化剂 + 还原剂 = 还原产物 + 氧化产物
氧化性:氧化剂 > 氧化产物
还原性: 还原剂 > 还原产物
{
示例: Zn + Fe2+ = Zn2+ + Fe
1.根据氧化还原反应方程式判断
1.根据下列三个离子方程式:
①2Fe3++2I-=2Fe2++I2
②2Fe2++Cl2=2Fe3++2Cl-
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
则这三个离子方程式所涉及微粒的氧化性强弱关系正确的是( )
A.MnO4->I2>Cl2>Fe3+
B.MnO4->Cl2>Fe3+>I2
C.I2>Fe3+>Cl2>MnO4-
D.Cl2>MnO4->Fe3+>I2
B
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
2.有下列氧化还原反应:Cl2+2KBr=2KCl+Br2、Br2+2KI=I2+2KBr,
则I2、Br2、Cl2、的氧化性强弱顺序是———————————,
I-、Cl-、Br-的还原性顺序是——————————————
Cl2﹥Br2﹥I2
I-﹥Br-﹥Cl-
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
2.根据金属性活动顺序表
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
失电子能力减弱,单质还原性逐渐减弱
K+、Ca2+、Na+、Mg2+、Al3+、Zn2+、Fe2+、Sn2+、Pb2+、H+、Cu2+、Hg2+、Ag+
得电子能力增强,阳离子的氧化性逐渐增强
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
F2、Cl2、Br2、I2
F-、Cl-、Br-、I-
单质的氧化性逐渐减弱
阴离子的还原性逐渐增强
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
3.根据氧化产物的价态高低比较
不同氧化剂与相同还原剂作用时,还原剂化合价升高的数值越大,氧化剂的氧化性越强。
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
4.根据反应条件及反应的剧烈程度比较
反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,如是否加热、反应温度高低、有无催化剂和反应物浓度大小等。
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
5.根据同种元素的价态高低判断
一般来说,对于同种元素,价态越高,其氧化性越强;
价态越低,其还原性越强
氧化还原反应—物质氧化性或还原性相对强弱的判断方法
练习
D
五、氧化还原反应的基本规律
氧化还原反应—基本规律
1.守恒规律
a.原子守恒—质量守恒
b.电荷守恒
c.得失电子守恒
d.化合价升降守恒
氧化剂得电子总数=还原剂失电子总数
化合价升高总数=化合价降低总数
微观
宏观
氧化还原反应—基本规律
练习
1.已知M2O7x- + 3S2- + 14H+ = 2M3+ + 3S↓ + 7H2O,则M的化合价为( )
+6
氧化还原反应—基本规律
2.反应先后规律
a.当一种氧化剂遇到多种还原剂时,还原剂按还原性先强后弱的顺序参与反应
d.当一种还原剂遇到多种氧化剂时,氧化剂按氧化性先强后弱的顺序参与反应
将Cl2通入FeBr2溶液中,Fe2+、Br-谁先被氧化?
Fe加入硝酸镁、硝酸铜、硝酸银混合溶液,先置换出哪一种单质?
还原性I->Fe2+>Br-
氧化还原反应—基本规律
3.价态转化规律
同种元素的不同价态间发生氧化还原反应化合价只靠拢不交叉
归中反应:同种元素组成的不同物质发生氧化还原反应,这种元素的化合价向中间靠拢。
歧化反应:反应物中同一物质同一元素化合价有升也有降。
2H2S + 2SO2 = 3S + 2H2 O
Cl2 + H2O = HCl + HClO
六、氧化还原反应方程式的配平
氧化还原反应—氧化还原方程式的配平
一、配平原理—三大守恒
a.原子守恒(质量守恒)
b.电荷守恒
c.得失电子守恒(化合价升降守恒)
氧化还原反应—方程式的配平
二、配平步骤
1.标价态
2.列变化
5.查守恒
标明反应前后化合价有变化的元素的化合价。
列出化合价的变化。
确定氧化剂、还原剂、氧化产物、还原产物的系数,再通过观察法配平其他物质的系数。
求最小公倍数,通过最小公倍数法使化合价升降总值相等。
检查三大守恒。
3.求最小公倍数
4.配系数
C + H2SO4(浓) - CO2↑ + SO2↑ + H2O
氧化还原反应—方程式的配平
练习
Cu + HNO3(稀) - Cu(NO3)2 + NO↑ + H2O
①氧化产物:还原产物=
②体现氧化性与酸性的硝酸的比值为
③转移电子数
3:2
1:3
3molCu~3molHNO3~6NA
练习
MnO2 + HCl(浓) - MnCl2 + Cl2↑ + H2O
Cu + HNO3(浓) - Cu(NO3)2 + NO2↑ + H2O
示例
氧化还原反应—方程式的配平
示例
示例
NH3 + NO - N2 + H2O
S + KOH - K2 S + K2 SO3 + H2O
归中反应:同种元素的不同价态到同一价态
歧化反应:同种元素的一种价态到多种价态
氧化还原反应—方程式的配平
Cu + HNO3(浓) - Cu(NO3)2 + NO2↑ + H2O
三、配平技巧
MnO2 + HCl(浓) - MnCl2 + Cl2↑ + H2O
Cu + HNO3(稀) - Cu(NO3)2 + NO↑ + H2O
KMnO4 + HCl(浓) - KCl + MnCl2 + Cl2↑ + H2O
部分氧化还原反应—可采用逆向配平
氧化还原反应—方程式的配平
四、特殊氧化还原反应的配平
FeS + HNO3 - Fe(NO3)3 + NO↑ + H2SO4 + H2O
Cu2S + HNO3 - Cu(NO3)2 + NO↑ + H2SO4 + H2O
FeS2 + O2 - Fe2O3 + SO2
示例
示例
练习
氧化还原反应—方程式的配平
练习
练习
K2CrO7 + KI + HCl - I2 + KCl + CrCl3+ H2O
Cr2O72- + SO32- + H+ - Cr3+ + SO42- + H2O
注意电荷守恒
氧化还原反应—方程式的配平
五、缺项配平
Cr2O72- + I- + — - Cr3+ + I2 + H2O
缺项常为H+ 、OH- 、H2O
MnO4- + H2O2 + — - Mn2+ + O2↑ + —
ClO- + Fe(OH)3 + — - Cl- + FeO42- + —
氧化还原反应—有关的计算
1.氧化剂与还原剂之比,氧化产物与还原产物之比
①. 3Br2 + 6NaOH = 5NaBr + NaBrO3 + 3H2O
氧化剂与还原剂的物质的量之比 ,氧化产物与还原产物的物质的量之比 。
Δ
②. MnO2 + 4HCl(浓) = MnCl2 + 2H2O + Cl2↑
氧化剂与还原剂的物质的量之比 。
5:1
1:5
1:2
氧化还原反应—有关的计算
2.求转移的电子数
①. 3Br2 + 6NaOH = 5NaBr + NaBrO3 + 3H2O,
如果生成1mol NaBrO3,转移的电子数为 。
②. HClO2 → ClO2↑ + H+ + Cl- + H2O (未配平)
当1molHClO2分解时,转移的电子数为 mol 。
2
5NA
0.8
氧化还原反应—有关的计算
3.求被氧化或被还原后元素的化合价
①. 向KOH溶液中通入11.2L(标准状况)氯气恰好完全反应生成三种含氯盐 。0.7molKCl、0.2molKClO和X。则X是( )
A.0.2mol KClO4 B.0.1mol KClO3 C.0.2mol KClO2 D.0.1mol KClO2
②. 硫代硫酸钠可作为脱氧剂,已知25.0mL 0.1mol/L Na2S2O3溶液恰好把标准状况下112mL Cl2完全转化为Cl-,则S2O32-将转化为( )
B
C
A.S2- B.S C.SO32- D.SO42-
