2.1.3碳酸钠和碳酸氢钠课件(共30张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.1.3碳酸钠和碳酸氢钠课件(共30张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 43.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-26 11:11:45 | ||
图片预览









文档简介
(共30张PPT)
人教版必修第一册 第二章 海水中的重要元素—钠和氯
第一节
钠及其化合物
第3课时 碳酸钠和碳酸氢钠 焰色试验
碳酸钠结晶和晶体的风化
风化
碳酸钠粉末遇水生成含有结晶水的碳酸钠晶体—水合碳酸钠(Na2CO3·xH2O, x=1、7或10)
Na2CO3+xH2O = Na2CO3·xH2O(密封保存)
碳酸钠晶体在干燥空气里逐渐失去结晶水变成碳酸钠粉末
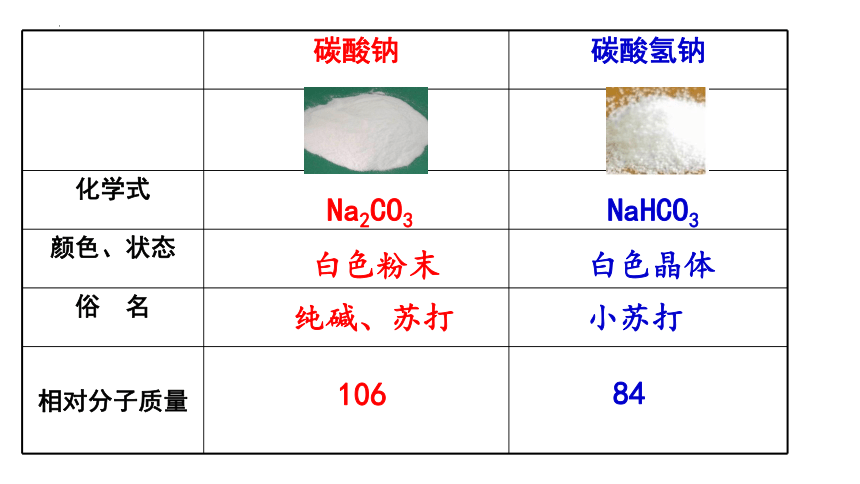
碳酸钠 碳酸氢钠
化学式
颜色、状态
俗 名
相对分子质量
白色粉末
白色晶体
Na2CO3
NaHCO3
纯碱、苏打
小苏打
106
84
碳酸钠的用途
纺织
造纸
制玻璃
制皂
碳酸氢钠的用途
发酵粉的主要成分之一
医疗上用于治疗胃酸过多症
碳酸钠和碳酸氢钠的性质探究
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表
盐 Na2CO3 NaHCO3
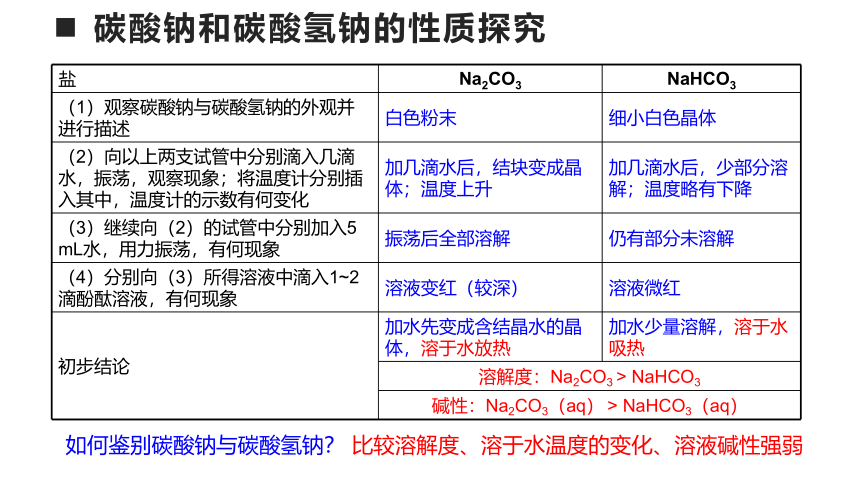
(1)观察Na2CO3和NaHCO3的外观并进行描述
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象
(1)观察Na2CO3与NaHCO3的外观并进行描述
Na2CO3 NaHCO3
色态
Na2CO3
NaHCO3
细小白色晶体
白色粉末
盐 Na2CO3 NaHCO3
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
结块变成晶体;温度上升
少部分溶解;温度略有下降
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
盐 Na2CO3 NaHCO3
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象
振荡后全部溶解
仍有部分未溶解
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象
盐 Na2CO3 NaHCO3
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象
溶液变红(较深)
溶液微红
盐 Na2CO3 NaHCO3
(1)观察碳酸钠与碳酸氢钠的外观并进行描述 白色粉末 细小白色晶体
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化 加几滴水后,结块变成晶体;温度上升 加几滴水后,少部分溶解;温度略有下降
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象 振荡后全部溶解 仍有部分未溶解
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象 溶液变红(较深) 溶液微红
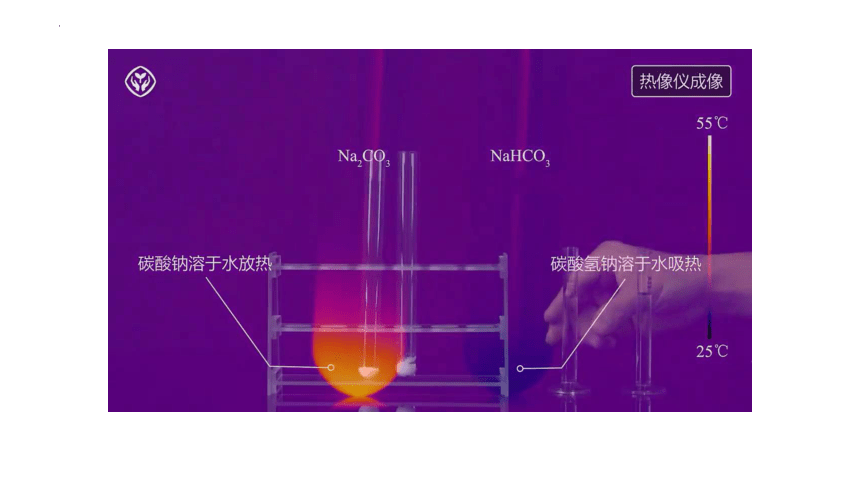
初步结论 加水先变成含结晶水的晶体,溶于水放热 加水少量溶解,溶于水吸热
溶解度:Na2CO3 > NaHCO3
碱性:Na2CO3(aq) > NaHCO3(aq)
如何鉴别碳酸钠与碳酸氢钠?
比较溶解度、溶于水温度的变化、溶液碱性强弱
碳酸钠和碳酸氢钠的性质探究
碳酸钠和碳酸氢钠的热稳定性
【实验2-5】如图,分别加热Na2CO3和NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
碳酸钠和碳酸氢钠的热稳定性
实验现象 实验现象 实验结论
Na2CO3很稳定,受热不分解
澄清石灰水不变浑浊
澄清石灰水变浑浊
NaHCO3不稳定,受热易分解
热稳定性:Na2CO3 > NaHCO3
2NaHCO3 Na2CO3 + H2O + CO2↑
碳酸钠和碳酸氢钠的热稳定性
【套管实验】
Na2CO3
NaHCO3
【现象】
两试管中均有气泡产生,B中澄清石灰水变浑浊,A中澄清石灰水不变浑浊。
碳酸钠、碳酸氢钠与酸的反应
Na2CO3 NaHCO3
现象
化学方程式
Na2CO3+2HCl =2NaCl+H2O+CO2↑
HCO3- + H+ = H2O + CO2 ↑
CO32- + 2H+ = H2O + CO2↑
均有无色气泡产生
碳酸钠、碳酸氢钠与酸的反应
滴加盐酸
滴加盐酸
滴加盐酸
宏观
微观
CO32-
H+
HCO3-
2H+(两步)
H+
(一步)
H2CO3
H2O+CO2
通过该实验,我们还发现碳酸氢钠与盐酸反应更快,用它做胃药,见效也更快。
实验分析:
① NaHCO3与稀盐酸反应要比Na2CO3与稀盐酸反应剧烈得多。因为:CO3 →CO2是两步反应,反应较慢,而HCO3 →CO2是一步反应,反应较快。
-
2-
实验分析
Na2CO3
现象
离子方程式
CO32- + H+ = HCO3-
HCO3- + H+ = H2O +CO2↑
刚开始无明显现象
继续滴加一段时间后产生气泡
往Na2CO3(aq)中滴加稀HCl
Na2CO3
现象
离子方程式
CO32- + 2H+ = H2CO3
立即产生大量气泡
往稀HCl中滴加Na2CO3(aq)
实验分析
碳酸钠、碳酸氢钠与酸的反应
碳酸钠与盐酸
Na2CO3 + HCl = NaHCO3 + NaCl
NaHCO3 + HCl = NaCl + H2O + CO2 ↑
盐酸少量
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
盐酸过量
碳酸氢钠与盐酸
碳酸钠、碳酸氢钠与碱的反应
碳酸钠与氢氧化钠溶液
NaHCO3 + NaOH = Na2CO3 + H2O
不反应
碳酸氢钠与氢氧化钠溶液
碳酸钠、碳酸氢钠与碱的反应
碳酸钠与澄清石灰水
Na2CO3 + Ca(OH)2 = CaCO3 + 2NaOH
碳酸氢钠与澄清石灰水
2NaHCO3 + Ca(OH)2 = CaCO3 + Na2CO3 + 2H2O
澄清石灰水少量
澄清石灰水过量
NaHCO3 + Ca(OH)2 = CaCO3 + NaOH + H2O
碳酸钠、碳酸氢钠与盐的反应
碳酸钠与可溶性钙盐/钡盐
Na2CO3 + CaCl2 = CaCO3 + 2NaCl
碳酸氢钠与可溶性钙盐/钡盐
不反应
碳酸钠、碳酸氢钠与二氧化碳的反应
碳酸钠与二氧化碳
碳酸氢钠与二氧化碳
不反应
Na2CO3 + CO2 + H2O = 2NaHCO3
碳酸钠与碳酸氢钠的转化
a. 少量H+
a. 加热
b. 加NaOH溶液
Na2CO3
NaHCO3
b. 通过量CO2
Na2CO3、NaHCO3鉴别方法
除杂(括号里面为杂质)
对固体进行加热
加入适量NaOH溶液
固体:Na2CO3(NaHCO3)
溶液:NaHCO3(Na2CO3)
通入过量CO2
溶液:Na2CO3(NaHCO3)
焰色试验
很多金属或它们的化合物在灼烧时都会使火焰呈现出特征焰色。根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
【定义】
物理变化
1
2
3
4
将铂丝(或光洁无锈的铁丝)用盐酸洗净
洗
将洗净的铂丝在外焰上灼烧至与原火焰颜色相同
烧
蘸取试样
蘸
在外焰上灼烧,并观察火焰焰色
烧
洗杂质
不能用硫酸:硫酸熔沸点高,难挥发
让盐酸挥发完全,防止铂丝上残留的其他物质对实验的干扰。
【操作】
5
再用盐酸洗净铂丝(或光洁无锈的铁丝),并在外焰上灼烧至与原火焰颜色相同
洗
焰色试验
焰色试验
1. 钾:紫色(透过蓝色钴玻璃)
滤去黄光,避免钠元素的干扰
2. 焰色试验是元素的性质
人教版必修第一册 第二章 海水中的重要元素—钠和氯
第一节
钠及其化合物
第3课时 碳酸钠和碳酸氢钠 焰色试验
碳酸钠结晶和晶体的风化
风化
碳酸钠粉末遇水生成含有结晶水的碳酸钠晶体—水合碳酸钠(Na2CO3·xH2O, x=1、7或10)
Na2CO3+xH2O = Na2CO3·xH2O(密封保存)
碳酸钠晶体在干燥空气里逐渐失去结晶水变成碳酸钠粉末
碳酸钠 碳酸氢钠
化学式
颜色、状态
俗 名
相对分子质量
白色粉末
白色晶体
Na2CO3
NaHCO3
纯碱、苏打
小苏打
106
84
碳酸钠的用途
纺织
造纸
制玻璃
制皂
碳酸氢钠的用途
发酵粉的主要成分之一
医疗上用于治疗胃酸过多症
碳酸钠和碳酸氢钠的性质探究
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表
盐 Na2CO3 NaHCO3
(1)观察Na2CO3和NaHCO3的外观并进行描述
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象
(1)观察Na2CO3与NaHCO3的外观并进行描述
Na2CO3 NaHCO3
色态
Na2CO3
NaHCO3
细小白色晶体
白色粉末
盐 Na2CO3 NaHCO3
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
结块变成晶体;温度上升
少部分溶解;温度略有下降
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
盐 Na2CO3 NaHCO3
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象
振荡后全部溶解
仍有部分未溶解
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象
盐 Na2CO3 NaHCO3
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象
溶液变红(较深)
溶液微红
盐 Na2CO3 NaHCO3
(1)观察碳酸钠与碳酸氢钠的外观并进行描述 白色粉末 细小白色晶体
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化 加几滴水后,结块变成晶体;温度上升 加几滴水后,少部分溶解;温度略有下降
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象 振荡后全部溶解 仍有部分未溶解
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象 溶液变红(较深) 溶液微红
初步结论 加水先变成含结晶水的晶体,溶于水放热 加水少量溶解,溶于水吸热
溶解度:Na2CO3 > NaHCO3
碱性:Na2CO3(aq) > NaHCO3(aq)
如何鉴别碳酸钠与碳酸氢钠?
比较溶解度、溶于水温度的变化、溶液碱性强弱
碳酸钠和碳酸氢钠的性质探究
碳酸钠和碳酸氢钠的热稳定性
【实验2-5】如图,分别加热Na2CO3和NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
碳酸钠和碳酸氢钠的热稳定性
实验现象 实验现象 实验结论
Na2CO3很稳定,受热不分解
澄清石灰水不变浑浊
澄清石灰水变浑浊
NaHCO3不稳定,受热易分解
热稳定性:Na2CO3 > NaHCO3
2NaHCO3 Na2CO3 + H2O + CO2↑
碳酸钠和碳酸氢钠的热稳定性
【套管实验】
Na2CO3
NaHCO3
【现象】
两试管中均有气泡产生,B中澄清石灰水变浑浊,A中澄清石灰水不变浑浊。
碳酸钠、碳酸氢钠与酸的反应
Na2CO3 NaHCO3
现象
化学方程式
Na2CO3+2HCl =2NaCl+H2O+CO2↑
HCO3- + H+ = H2O + CO2 ↑
CO32- + 2H+ = H2O + CO2↑
均有无色气泡产生
碳酸钠、碳酸氢钠与酸的反应
滴加盐酸
滴加盐酸
滴加盐酸
宏观
微观
CO32-
H+
HCO3-
2H+(两步)
H+
(一步)
H2CO3
H2O+CO2
通过该实验,我们还发现碳酸氢钠与盐酸反应更快,用它做胃药,见效也更快。
实验分析:
① NaHCO3与稀盐酸反应要比Na2CO3与稀盐酸反应剧烈得多。因为:CO3 →CO2是两步反应,反应较慢,而HCO3 →CO2是一步反应,反应较快。
-
2-
实验分析
Na2CO3
现象
离子方程式
CO32- + H+ = HCO3-
HCO3- + H+ = H2O +CO2↑
刚开始无明显现象
继续滴加一段时间后产生气泡
往Na2CO3(aq)中滴加稀HCl
Na2CO3
现象
离子方程式
CO32- + 2H+ = H2CO3
立即产生大量气泡
往稀HCl中滴加Na2CO3(aq)
实验分析
碳酸钠、碳酸氢钠与酸的反应
碳酸钠与盐酸
Na2CO3 + HCl = NaHCO3 + NaCl
NaHCO3 + HCl = NaCl + H2O + CO2 ↑
盐酸少量
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
盐酸过量
碳酸氢钠与盐酸
碳酸钠、碳酸氢钠与碱的反应
碳酸钠与氢氧化钠溶液
NaHCO3 + NaOH = Na2CO3 + H2O
不反应
碳酸氢钠与氢氧化钠溶液
碳酸钠、碳酸氢钠与碱的反应
碳酸钠与澄清石灰水
Na2CO3 + Ca(OH)2 = CaCO3 + 2NaOH
碳酸氢钠与澄清石灰水
2NaHCO3 + Ca(OH)2 = CaCO3 + Na2CO3 + 2H2O
澄清石灰水少量
澄清石灰水过量
NaHCO3 + Ca(OH)2 = CaCO3 + NaOH + H2O
碳酸钠、碳酸氢钠与盐的反应
碳酸钠与可溶性钙盐/钡盐
Na2CO3 + CaCl2 = CaCO3 + 2NaCl
碳酸氢钠与可溶性钙盐/钡盐
不反应
碳酸钠、碳酸氢钠与二氧化碳的反应
碳酸钠与二氧化碳
碳酸氢钠与二氧化碳
不反应
Na2CO3 + CO2 + H2O = 2NaHCO3
碳酸钠与碳酸氢钠的转化
a. 少量H+
a. 加热
b. 加NaOH溶液
Na2CO3
NaHCO3
b. 通过量CO2
Na2CO3、NaHCO3鉴别方法
除杂(括号里面为杂质)
对固体进行加热
加入适量NaOH溶液
固体:Na2CO3(NaHCO3)
溶液:NaHCO3(Na2CO3)
通入过量CO2
溶液:Na2CO3(NaHCO3)
焰色试验
很多金属或它们的化合物在灼烧时都会使火焰呈现出特征焰色。根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
【定义】
物理变化
1
2
3
4
将铂丝(或光洁无锈的铁丝)用盐酸洗净
洗
将洗净的铂丝在外焰上灼烧至与原火焰颜色相同
烧
蘸取试样
蘸
在外焰上灼烧,并观察火焰焰色
烧
洗杂质
不能用硫酸:硫酸熔沸点高,难挥发
让盐酸挥发完全,防止铂丝上残留的其他物质对实验的干扰。
【操作】
5
再用盐酸洗净铂丝(或光洁无锈的铁丝),并在外焰上灼烧至与原火焰颜色相同
洗
焰色试验
焰色试验
1. 钾:紫色(透过蓝色钴玻璃)
滤去黄光,避免钠元素的干扰
2. 焰色试验是元素的性质
