2.1.2活化能课件(共36张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.1.2活化能课件(共36张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-26 00:00:00 | ||
图片预览








文档简介
(共36张PPT)
第2课时 活化能
第二章 化学反应速率与化学平衡
第一节 化学反应速率
1.知道化学反应是有历程的。
2.能说出基元反应活化能对化学反应速率的影响。
3.能用简单碰撞理论模型说明外界条件改变对化学反应速率的影响。
课标定位素养阐释
影响化学反应速率的因素
内因
外因
反应物本身的性质
温度、浓度、压强、催化剂、接触面积等
主要因素
基元反应
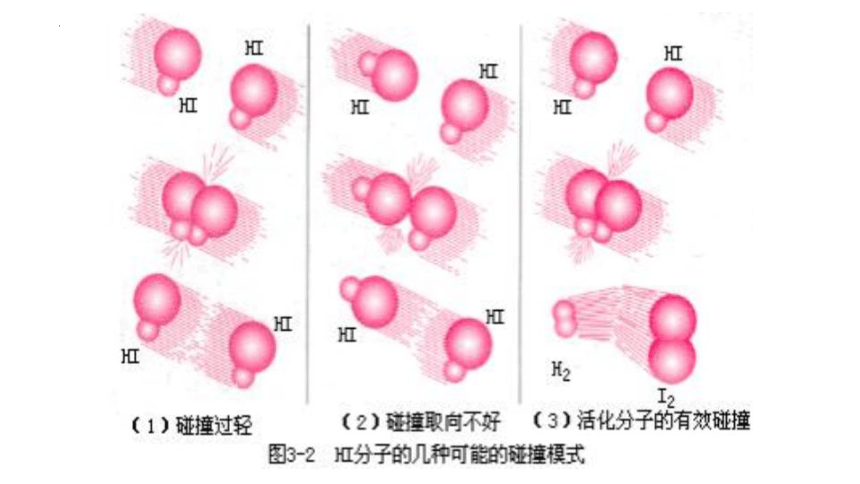
1.大多数化学反应不是经过简单碰撞就能完成的,往往经过多个反应步骤才能实现。
例如,反应2HI══H2+I2
每一步反应都称为基元反应。
这两个先后进行的基元反应反映了2HI══H2+I2的反应历程,又叫反应机理。
2.基元反应发生的先决条件是反应物的分子必须发生碰撞。
带有单电子的原子或原子团
自由基
第一步:2HI H2+2I·
第二步:2I· I2
力量不够
取向不好
好球!有效碰撞
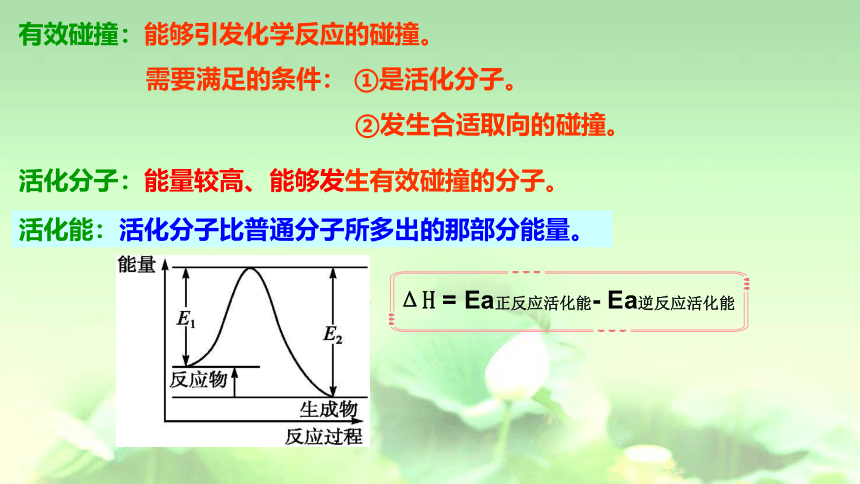
有效碰撞:能够引发化学反应的碰撞。
需要满足的条件: ①是活化分子。
②发生合适取向的碰撞。
活化分子:能量较高、能够发生有效碰撞的分子。
活化能:活化分子比普通分子所多出的那部分能量。
ΔH = Ea正反应活化能- Ea逆反应活化能
一个化学反应由几个基元反应完成,
每一个基元反应都经历一个过渡态,
及达到该过渡态所需要的活化能(如图E1、E2)
基元反应的活化能越大,反应物到达过渡态就越不容易,该基元反应的速率就越慢。一个化学反应的速率取决于速率最慢的基元反应。
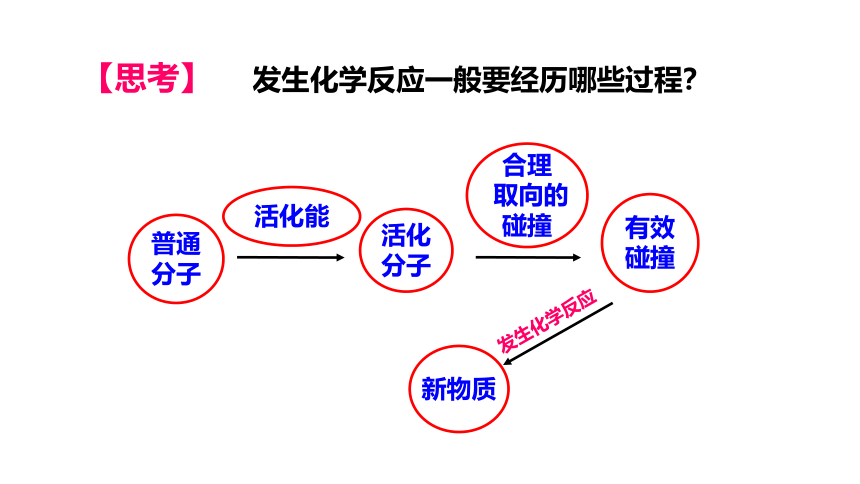
发生化学反应一般要经历哪些过程?
普通
分子
活化能
活化
分子
合理
取向的
碰撞
有效
碰撞
【思考】
新物质
发生化学反应
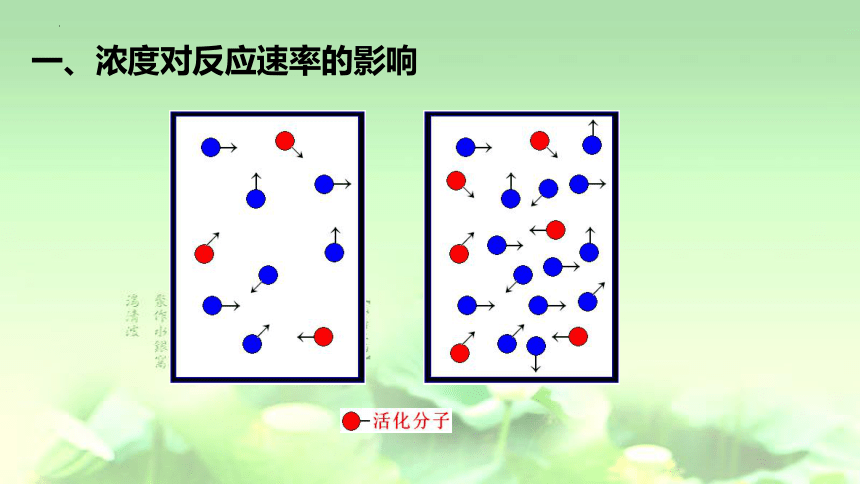
一、浓度对反应速率的影响
用碰撞理论解释浓度对化学反应速率的影响
浓度增大
单位体积内活化分子数增多,活化分子百分数不变
V正 ↑ V逆↑
有效碰撞次数增多
反应速率增大
由于固体和纯液体的浓度可视为常数,故改变用量反应速率不变。
但当固体颗粒变小时,其表面积将增大,其反应速率将加快。
特别提醒
二、 压强对反应速率的影响
浓度增大
单位体积内活化分子的数目增多,活化分子百分数不变
压强增大,气体体积缩小
V正 ↑ V逆↑
有效碰撞次数增多
反应速率增大
用碰撞理论解释压强对化学反应速率的影响
a、压强影响,只适用于讨论有气体参加的反应.
强调:
b、改变压强对化学反应速率产生影响的根本原因是引起浓度的改变。所以在讨论压强对反应速率的影响时,应分析引起压强改变的原因及这种改变对反应体系的浓度产生何种影响。
压强变 体积变 浓度变 速率变
对于有气体参加的反应体系,有以下几种情况:
①恒温时:
增大压强
②恒容时:
a.充入气体反应物
b.充入“惰气”
③恒压时:
充入“惰气”
体积缩小
浓度增大
反应速率加快
浓度增大
反应速率加快
各物质浓度不变
反应速率不变
各物质浓度减小
反应速率减慢
体积增大
在一密闭容器中,发生反应:2SO2 + O2 2SO3
1、容器体积变为原来的2/3
气体反应物浓度增大
反应速率加快
2、容器体积不变,加入SO2,(O2)
气体反应物浓度增大
反应速率加快
3、恒温、恒压时,充入惰性气体
要保持压强不变
体积增大
浓度减小
速率减慢
4、恒温、恒容时,充入惰性气体
体积不变
浓度不变
反应速率不变
增大反应物氢气的浓度,反应速率增大
不变
反应物的浓度不变,反应速率不变
减小
保持压强不变,向其中充入N2,体积变大,
反应物浓度减小,反应速率减小
不变
保持压强不变,向其中充入1 mol H2和
1 mol I2,反应物浓度不变,反应速率不变。
增大
三、温度对反应速率的影响
升高温度,反应物能量增加
单位体积内活化分子数增多, 活化分子百分数增加
V正 ↑ V逆↑
有效碰撞次数增多
反应速率增大
V吸 ↑ V放↑
用碰撞理论解释温度对化学反应速率的影响
升高温度,不论正反应还是逆反应,不论放热反应还是吸热反应,反应速率一般都要加快,只不过增加的程度不同。
特别提醒
温度改变对任何反应的速率都有影响
A
生成物平均能量
活化分子具有能量
反应物平均能量
能量
无催化剂
活化分子能量
反应物平均能量
生成物平均能量
有催化剂
四、催化剂对反应速率的影响
使用催化剂,降低反应的活化能
单位体积内活化分子数增多, 活化分子百分数增加
V正 ↑ V逆↑
有效碰撞次数增多
反应速率增大
用碰撞理论解释催化剂对反应速率的影响
①催化剂有选择性,不同的反应有不同的催化剂。
催化剂具有一定的活化温度,催化剂不同,活化温度不同。
②催化剂不能改变反应,不能改变生成物的量,也不能使本来不会发生的反应变为可能。
③如果为可逆反应,催化剂可同等程度地改变正、逆反应速率。
绝大多数催化剂都有活性温度范围,温度太低时的活性很小,反应速率很小,随温度升高,催化剂的活性增大,反应速率逐渐增大,温度过高又会破坏催化剂的活性。
某反应的反应过程中能量变化如图所示。下列有关叙述正确的是 ( )
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.逆反应的活化能大于正反应的活化能
C
小结:影响化学反应速率的外因
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子 总数 活化分子数 活化分子百分数
增大反应物浓度
增大压强
升高温度
使用催化剂
增加
增加
不变
增加
加快
增加
增加
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
(双选)下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增多
B.有气体参加的化学反应,若增大压强(缩小反应容器的容积),可增大单位体积内的活化分子数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了单位体积中反应物活化分子的百分数
D.催化剂能增大正反应方向单位体积内活化分子的百分数,从而使正反应速率增大,逆反应速率减小
BC
(双选)对于一定条件下进行的化学反应:2SO2+O2 2SO3,改变下列条件,可以提高反应物中活化分子百分数的是( )
A.增大压强 B.升高温度
C.加入正催化剂 D.减小SO2浓度
BC
判断正误,正确的画“√”,错误的画“×”。
(1)大多数化学反应都是基元反应。( )
(2)反应物分子一经碰撞就能发生化学反应。( )
(3)活化分子的碰撞都是有效碰撞。( )
(4)催化剂能降低反应的活化能,增大单位体积内的活化分子数。( )
(5)缩小体积增大压强,可使反应物的活化分子百分数增加。( )
(6)有的催化剂能成千上万倍地增大化学反应速率,可以为化学工业生产带来巨大的经济效益。( )
×
×
×
√
×
√
A
D
如Zn与足量盐酸的反应,反应速率随时间的变化如图所示。
AB段:Zn与盐酸的反应是放热反应,
溶液的温度升高,化学反应速率逐渐增大.
BC段:随着反应的进行,盐酸的浓度逐渐减小,
化学反应速率逐渐减小
在C(s)+CO2(g) 2CO(g)反应中可使反应速率增大的措施是( )
①缩小容器的容积; ②增加碳的量; ③恒容时通入CO2;
④恒压下充入N2; ⑤恒容下充入N2
A.①③⑤ B.②④ C.①③ D.③⑤
C
第2课时 活化能
第二章 化学反应速率与化学平衡
第一节 化学反应速率
1.知道化学反应是有历程的。
2.能说出基元反应活化能对化学反应速率的影响。
3.能用简单碰撞理论模型说明外界条件改变对化学反应速率的影响。
课标定位素养阐释
影响化学反应速率的因素
内因
外因
反应物本身的性质
温度、浓度、压强、催化剂、接触面积等
主要因素
基元反应
1.大多数化学反应不是经过简单碰撞就能完成的,往往经过多个反应步骤才能实现。
例如,反应2HI══H2+I2
每一步反应都称为基元反应。
这两个先后进行的基元反应反映了2HI══H2+I2的反应历程,又叫反应机理。
2.基元反应发生的先决条件是反应物的分子必须发生碰撞。
带有单电子的原子或原子团
自由基
第一步:2HI H2+2I·
第二步:2I· I2
力量不够
取向不好
好球!有效碰撞
有效碰撞:能够引发化学反应的碰撞。
需要满足的条件: ①是活化分子。
②发生合适取向的碰撞。
活化分子:能量较高、能够发生有效碰撞的分子。
活化能:活化分子比普通分子所多出的那部分能量。
ΔH = Ea正反应活化能- Ea逆反应活化能
一个化学反应由几个基元反应完成,
每一个基元反应都经历一个过渡态,
及达到该过渡态所需要的活化能(如图E1、E2)
基元反应的活化能越大,反应物到达过渡态就越不容易,该基元反应的速率就越慢。一个化学反应的速率取决于速率最慢的基元反应。
发生化学反应一般要经历哪些过程?
普通
分子
活化能
活化
分子
合理
取向的
碰撞
有效
碰撞
【思考】
新物质
发生化学反应
一、浓度对反应速率的影响
用碰撞理论解释浓度对化学反应速率的影响
浓度增大
单位体积内活化分子数增多,活化分子百分数不变
V正 ↑ V逆↑
有效碰撞次数增多
反应速率增大
由于固体和纯液体的浓度可视为常数,故改变用量反应速率不变。
但当固体颗粒变小时,其表面积将增大,其反应速率将加快。
特别提醒
二、 压强对反应速率的影响
浓度增大
单位体积内活化分子的数目增多,活化分子百分数不变
压强增大,气体体积缩小
V正 ↑ V逆↑
有效碰撞次数增多
反应速率增大
用碰撞理论解释压强对化学反应速率的影响
a、压强影响,只适用于讨论有气体参加的反应.
强调:
b、改变压强对化学反应速率产生影响的根本原因是引起浓度的改变。所以在讨论压强对反应速率的影响时,应分析引起压强改变的原因及这种改变对反应体系的浓度产生何种影响。
压强变 体积变 浓度变 速率变
对于有气体参加的反应体系,有以下几种情况:
①恒温时:
增大压强
②恒容时:
a.充入气体反应物
b.充入“惰气”
③恒压时:
充入“惰气”
体积缩小
浓度增大
反应速率加快
浓度增大
反应速率加快
各物质浓度不变
反应速率不变
各物质浓度减小
反应速率减慢
体积增大
在一密闭容器中,发生反应:2SO2 + O2 2SO3
1、容器体积变为原来的2/3
气体反应物浓度增大
反应速率加快
2、容器体积不变,加入SO2,(O2)
气体反应物浓度增大
反应速率加快
3、恒温、恒压时,充入惰性气体
要保持压强不变
体积增大
浓度减小
速率减慢
4、恒温、恒容时,充入惰性气体
体积不变
浓度不变
反应速率不变
增大反应物氢气的浓度,反应速率增大
不变
反应物的浓度不变,反应速率不变
减小
保持压强不变,向其中充入N2,体积变大,
反应物浓度减小,反应速率减小
不变
保持压强不变,向其中充入1 mol H2和
1 mol I2,反应物浓度不变,反应速率不变。
增大
三、温度对反应速率的影响
升高温度,反应物能量增加
单位体积内活化分子数增多, 活化分子百分数增加
V正 ↑ V逆↑
有效碰撞次数增多
反应速率增大
V吸 ↑ V放↑
用碰撞理论解释温度对化学反应速率的影响
升高温度,不论正反应还是逆反应,不论放热反应还是吸热反应,反应速率一般都要加快,只不过增加的程度不同。
特别提醒
温度改变对任何反应的速率都有影响
A
生成物平均能量
活化分子具有能量
反应物平均能量
能量
无催化剂
活化分子能量
反应物平均能量
生成物平均能量
有催化剂
四、催化剂对反应速率的影响
使用催化剂,降低反应的活化能
单位体积内活化分子数增多, 活化分子百分数增加
V正 ↑ V逆↑
有效碰撞次数增多
反应速率增大
用碰撞理论解释催化剂对反应速率的影响
①催化剂有选择性,不同的反应有不同的催化剂。
催化剂具有一定的活化温度,催化剂不同,活化温度不同。
②催化剂不能改变反应,不能改变生成物的量,也不能使本来不会发生的反应变为可能。
③如果为可逆反应,催化剂可同等程度地改变正、逆反应速率。
绝大多数催化剂都有活性温度范围,温度太低时的活性很小,反应速率很小,随温度升高,催化剂的活性增大,反应速率逐渐增大,温度过高又会破坏催化剂的活性。
某反应的反应过程中能量变化如图所示。下列有关叙述正确的是 ( )
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.逆反应的活化能大于正反应的活化能
C
小结:影响化学反应速率的外因
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子 总数 活化分子数 活化分子百分数
增大反应物浓度
增大压强
升高温度
使用催化剂
增加
增加
不变
增加
加快
增加
增加
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
(双选)下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增多
B.有气体参加的化学反应,若增大压强(缩小反应容器的容积),可增大单位体积内的活化分子数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了单位体积中反应物活化分子的百分数
D.催化剂能增大正反应方向单位体积内活化分子的百分数,从而使正反应速率增大,逆反应速率减小
BC
(双选)对于一定条件下进行的化学反应:2SO2+O2 2SO3,改变下列条件,可以提高反应物中活化分子百分数的是( )
A.增大压强 B.升高温度
C.加入正催化剂 D.减小SO2浓度
BC
判断正误,正确的画“√”,错误的画“×”。
(1)大多数化学反应都是基元反应。( )
(2)反应物分子一经碰撞就能发生化学反应。( )
(3)活化分子的碰撞都是有效碰撞。( )
(4)催化剂能降低反应的活化能,增大单位体积内的活化分子数。( )
(5)缩小体积增大压强,可使反应物的活化分子百分数增加。( )
(6)有的催化剂能成千上万倍地增大化学反应速率,可以为化学工业生产带来巨大的经济效益。( )
×
×
×
√
×
√
A
D
如Zn与足量盐酸的反应,反应速率随时间的变化如图所示。
AB段:Zn与盐酸的反应是放热反应,
溶液的温度升高,化学反应速率逐渐增大.
BC段:随着反应的进行,盐酸的浓度逐渐减小,
化学反应速率逐渐减小
在C(s)+CO2(g) 2CO(g)反应中可使反应速率增大的措施是( )
①缩小容器的容积; ②增加碳的量; ③恒容时通入CO2;
④恒压下充入N2; ⑤恒容下充入N2
A.①③⑤ B.②④ C.①③ D.③⑤
C
