第2章 物质转化与材料利用(金属的冶炼、氧化还原反应专题学案)(含解析)
文档属性
| 名称 | 第2章 物质转化与材料利用(金属的冶炼、氧化还原反应专题学案)(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-10-27 10:10:27 | ||
图片预览


文档简介
九年级上册科学第二章 金属的冶炼、氧化还原反应专题
知识点提纲
1.金属冶炼就是要把金属从化合态变成游离态(单质)。
(1)湿法炼铜:先用硫酸将铜矿中的铜转变成可溶性的硫酸铜,再将铁放入硫酸铜溶液中把铜置换出来
方程式:CuO+H2SO4=CuSO4+H2O CuSO4+Fe=Cu+FeSO4
(2)火法炼铜:
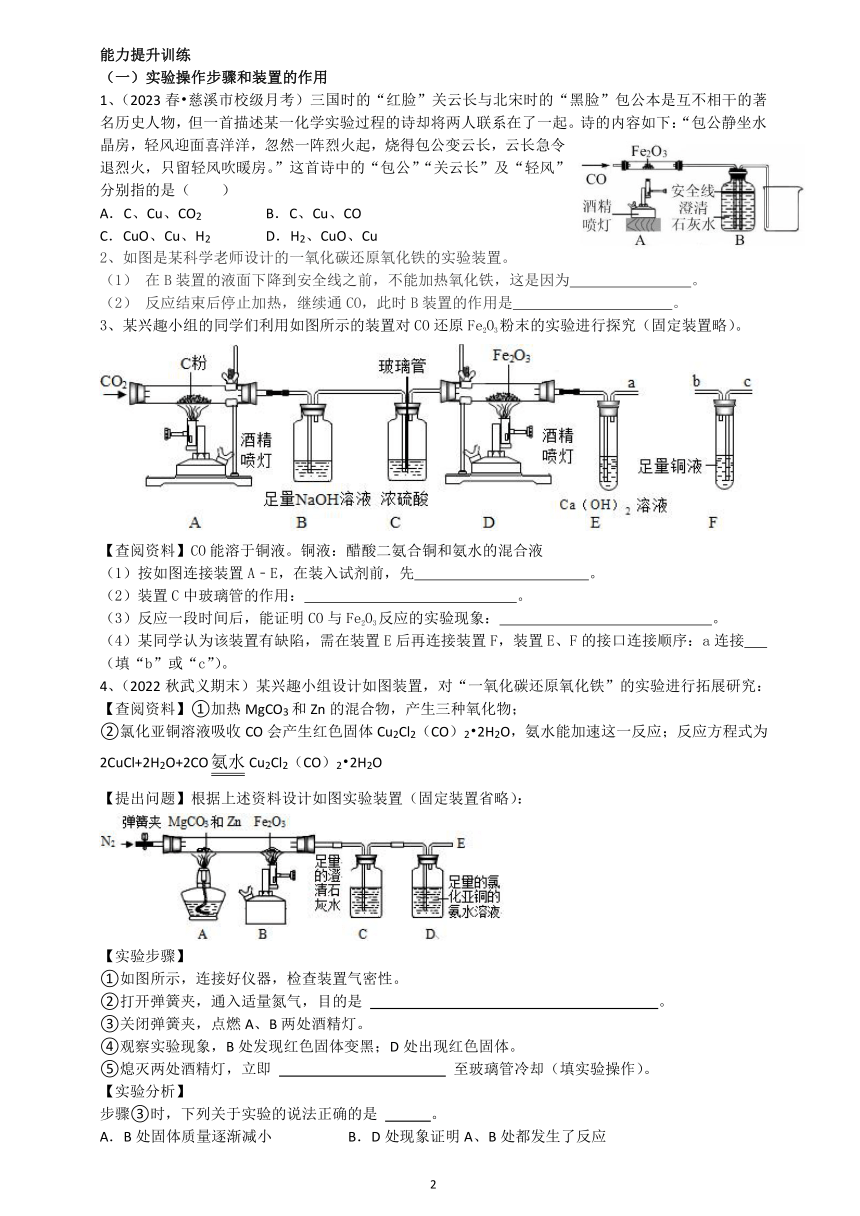
一、让碳与金属氧化物在高温下反应,碳能夺取金属氧化物中的氧,从而得到金属(图1)。
C + 2CuO 2Cu + CO2 ↑
实验步骤:①检查气密性; ②装药品固定试管; ③点燃; ④移导管,熄灭酒精灯
实验现象:黑色固体变红色,生成使澄清石灰水变浑浊的气体。
(1) (2)
二、炽热的炭在高温条件下与二氧化碳反应,生成一氧化碳(一氧化碳会使窒息中毒)。
一氧化碳也会夺取金属氧化物中的氧,产生游离态的金属单质(图2)。
C + CO2 2 CO CO + CuO Cu + CO2
实验步骤:反应前需检验气体纯度。还原过程分四步:一通,二点,三撤,四停。
实验现象:①黑色粉末逐渐变成红色;②生成的气体使澄清石灰水变浑浊。
因CO有毒,增加对尾气处理装置(点燃法或收集法),防止CO污染空气。
实验说明:①先通入一定量的CO,目的是排尽装置内原有的空气,防止加热爆炸;
②实验结束:先移开酒精灯,继续通入CO,直到装置冷却;目的是防止还原的铜又重新氧化。
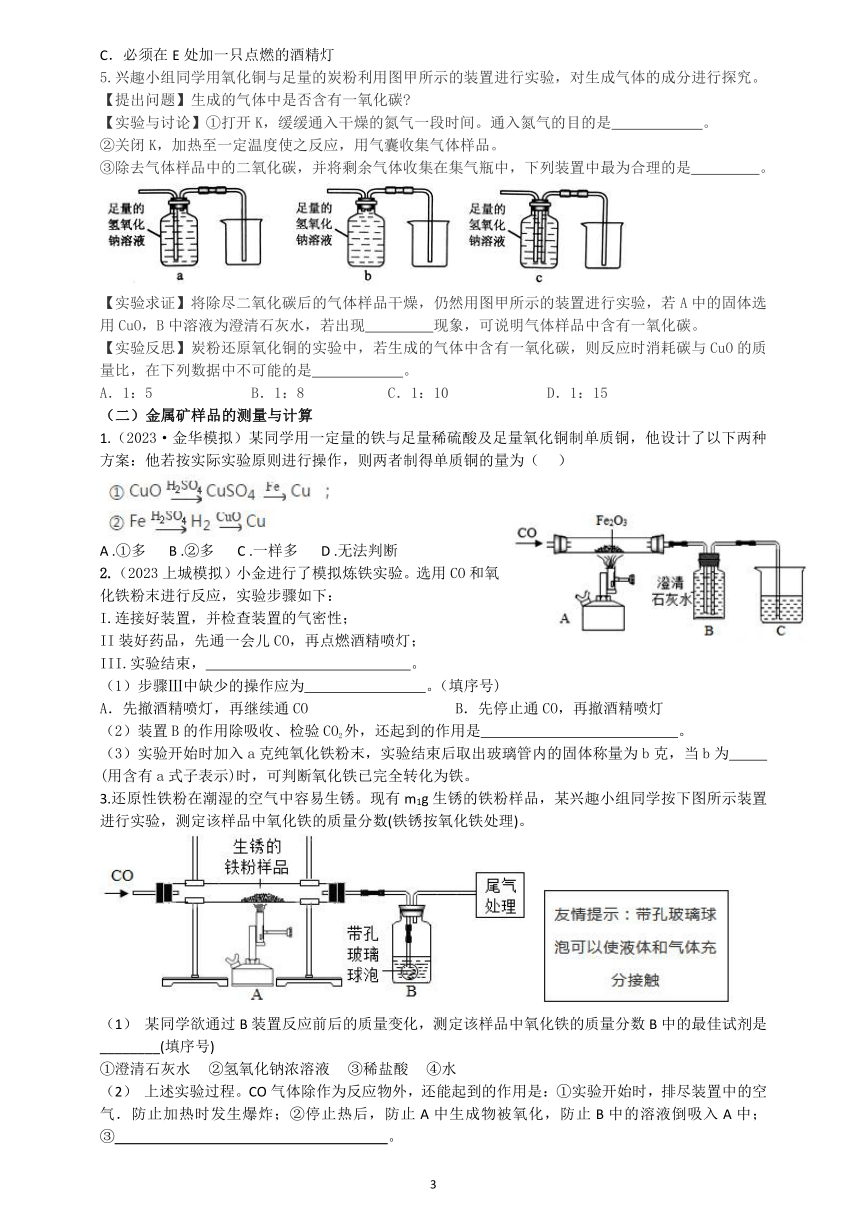
拓展:炼铁,如下实验装置:一氧化碳还原氧化铁(图3)3CO + Fe2O3 2Fe + 3CO2
实验步骤说明和现象:①实验前检查气密性;
②先点燃尾部酒精灯:防止CO逃逸,污染空气(尾气处理);
③先通入一定量的CO气体,目的是排尽装置内原有的空气,防止加热爆炸;
④点燃酒精喷灯,观察实验现象:红色固体变黑色,石灰水变浑浊;
⑤实验结束:先移开酒精喷灯,继续通入CO,直到装置冷却;目的是防止还原的铁粉又重新氧化。
再熄灭尾部酒精灯(尾气处理)
(3) (4)
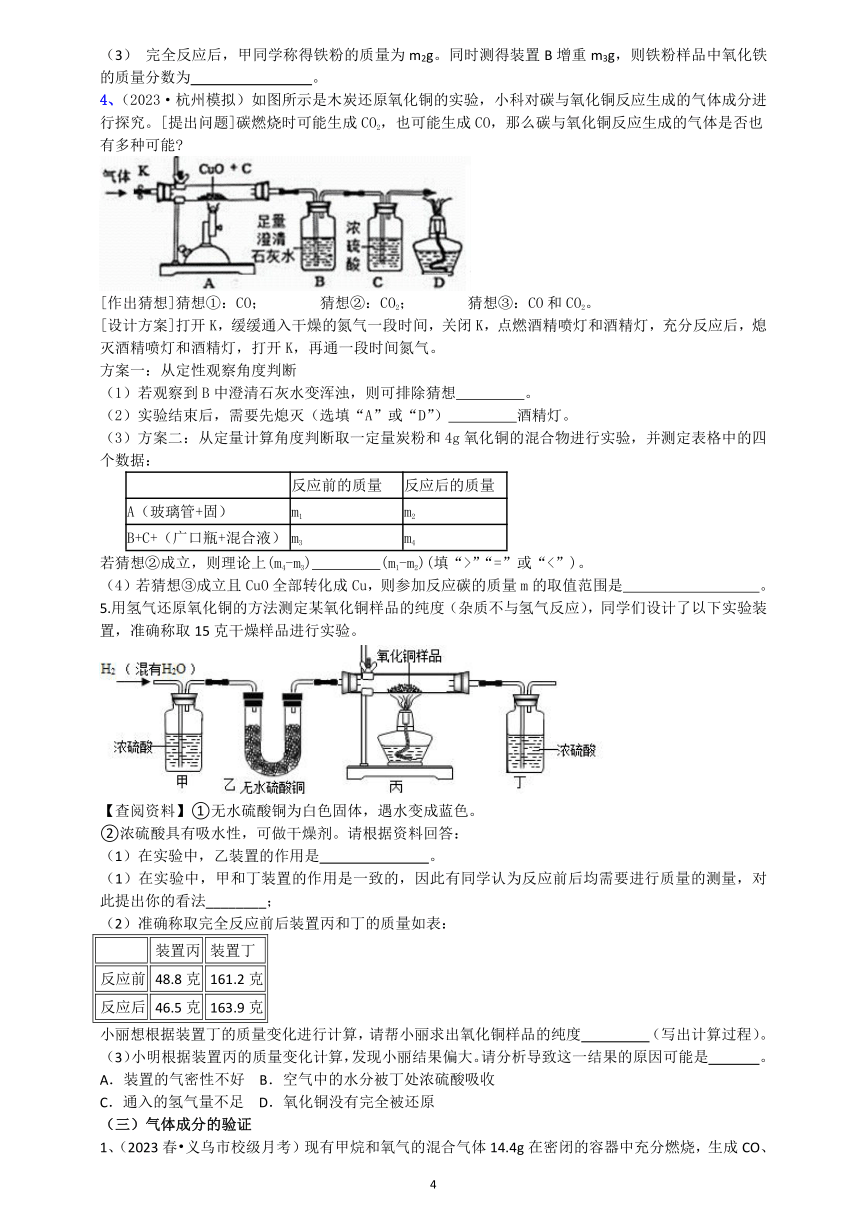
三、氢气也能将金属氧化物变成游离态金属(图4)。H2 + CuO Cu + H2O
注意事项:①试管口略向下倾斜; ②通H2 的导管伸至试管底部于CuO上方。
实验步骤:反应前需检验气体纯度。还原过程分四步:一通,二点,三撤,四停。
实验步骤说明和现象:①先通入一定量的H2,目的是排尽装置内原有的空气,防止加热爆炸;
②点燃酒精灯,观察实验现象:黑色固体变红色,试管口出现小水珠;
③实验结束:先移开酒精灯,继续通入H2,直到装置冷却;目的是防止还原的铜又重新氧化。
能力提升训练
(一)实验操作步骤和装置的作用
1、(2023春 慈溪市校级月考)三国时的“红脸”关云长与北宋时的“黑脸”包公本是互不相干的著名历史人物,但一首描述某一化学实验过程的诗却将两人联系在了一起。诗的内容如下:“包公静坐水晶房,轻风迎面喜洋洋,忽然一阵烈火起,烧得包公变云长,云长急令退烈火,只留轻风吹暖房。”这首诗中的“包公”“关云长”及“轻风”分别指的是( )
A.C、Cu、CO2 B.C、Cu、CO
C.CuO、Cu、H2 D.H2、CuO、Cu
2、如图是某科学老师设计的一氧化碳还原氧化铁的实验装置。
(1) 在B装置的液面下降到安全线之前,不能加热氧化铁,这是因为 。
(2) 反应结束后停止加热,继续通CO,此时B装置的作用是 。
3、某兴趣小组的同学们利用如图所示的装置对CO还原Fe2O3粉末的实验进行探究(固定装置略)。
【查阅资料】CO能溶于铜液。铜液:醋酸二氨合铜和氨水的混合液
(1)按如图连接装置A﹣E,在装入试剂前,先 。
(2)装置C中玻璃管的作用: 。
(3)反应一段时间后,能证明CO与Fe2O3反应的实验现象: 。
(4)某同学认为该装置有缺陷,需在装置E后再连接装置F,装置E、F的接口连接顺序:a连接 (填“b”或“c”)。
4、(2022秋武义期末)某兴趣小组设计如图装置,对“一氧化碳还原氧化铁”的实验进行拓展研究:
【查阅资料】①加热MgCO3和Zn的混合物,产生三种氧化物;
②氯化亚铜溶液吸收CO会产生红色固体Cu2Cl2(CO)2 2H2O,氨水能加速这一反应;反应方程式为2CuCl+2H2O+2COCu2Cl2(CO)2 2H2O
【提出问题】根据上述资料设计如图实验装置(固定装置省略):
【实验步骤】
①如图所示,连接好仪器,检查装置气密性。
②打开弹簧夹,通入适量氮气,目的是 。
③关闭弹簧夹,点燃A、B两处酒精灯。
④观察实验现象,B处发现红色固体变黑;D处出现红色固体。
⑤熄灭两处酒精灯,立即 至玻璃管冷却(填实验操作)。
【实验分析】
步骤③时,下列关于实验的说法正确的是 。
A.B处固体质量逐渐减小 B.D处现象证明A、B处都发生了反应
C.必须在E处加一只点燃的酒精灯
5.兴趣小组同学用氧化铜与足量的炭粉利用图甲所示的装置进行实验,对生成气体的成分进行探究。
【提出问题】生成的气体中是否含有一氧化碳
【实验与讨论】①打开K,缓缓通入干燥的氮气一段时间。通入氮气的目的是 。
②关闭K,加热至一定温度使之反应,用气囊收集气体样品。
③除去气体样品中的二氧化碳,并将剩余气体收集在集气瓶中,下列装置中最为合理的是 。
【实验求证】将除尽二氧化碳后的气体样品干燥,仍然用图甲所示的装置进行实验,若A中的固体选用CuO,B中溶液为澄清石灰水,若出现 现象,可说明气体样品中含有一氧化碳。
【实验反思】炭粉还原氧化铜的实验中,若生成的气体中含有一氧化碳,则反应时消耗碳与CuO的质量比,在下列数据中不可能的是 。
A.1:5 B.1:8 C.1:10 D.1:15
(二)金属矿样品的测量与计算
1.(2023·金华模拟)某同学用一定量的铁与足量稀硫酸及足量氧化铜制单质铜,他设计了以下两种方案:他若按实际实验原则进行操作,则两者制得单质铜的量为( )
A .①多 B .②多 C .一样多 D .无法判断
2.(2023上城模拟)小金进行了模拟炼铁实验。选用CO和氧化铁粉末进行反应,实验步骤如下:
I.连接好装置,并检查装置的气密性;
II装好药品,先通一会儿CO,再点燃酒精喷灯;
III.实验结束, 。
(1)步骤Ⅲ中缺少的操作应为 。(填序号)
A.先撤酒精喷灯,再继续通CO B.先停止通CO,再撤酒精喷灯
(2)装置B的作用除吸收、检验CO2外,还起到的作用是 。
(3)实验开始时加入a克纯氧化铁粉末,实验结束后取出玻璃管内的固体称量为b克,当b为 (用含有a式子表示)时,可判断氧化铁已完全转化为铁。
3.还原性铁粉在潮湿的空气中容易生锈。现有m1g生锈的铁粉样品,某兴趣小组同学按下图所示装置进行实验,测定该样品中氧化铁的质量分数(铁锈按氧化铁处理)。
(1) 某同学欲通过B装置反应前后的质量变化,测定该样品中氧化铁的质量分数B中的最佳试剂是________(填序号)
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2) 上述实验过程。CO气体除作为反应物外,还能起到的作用是:①实验开始时,排尽装置中的空气.防止加热时发生爆炸;②停止热后,防止A中生成物被氧化,防止B中的溶液倒吸入A中;③ 。
(3) 完全反应后,甲同学称得铁粉的质量为m2g。同时测得装置B增重m3g,则铁粉样品中氧化铁的质量分数为 。
4、(2023·杭州模拟)如图所示是木炭还原氧化铜的实验,小科对碳与氧化铜反应生成的气体成分进行探究。[提出问题]碳燃烧时可能生成CO2,也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能
[作出猜想]猜想①:CO; 猜想②:CO2; 猜想③:CO和CO2。
[设计方案]打开K,缓缓通入干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通一段时间氮气。
方案一:从定性观察角度判断
(1)若观察到B中澄清石灰水变浑浊,则可排除猜想 。
(2)实验结束后,需要先熄灭(选填“A”或“D”) 酒精灯。
(3)方案二:从定量计算角度判断取一定量炭粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
反应前的质量 反应后的质量
A(玻璃管+固) m1 m2
B+C+(广口瓶+混合液) m3 m4
若猜想②成立,则理论上(m4-m3) (m1-m2)(填“>”“=”或“<”)。
(4)若猜想③成立且CuO全部转化成Cu,则参加反应碳的质量m的取值范围是 。
5.用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验。
【查阅资料】①无水硫酸铜为白色固体,遇水变成蓝色。
②浓硫酸具有吸水性,可做干燥剂。请根据资料回答:
(1)在实验中,乙装置的作用是 。
(1)在实验中,甲和丁装置的作用是一致的,因此有同学认为反应前后均需要进行质量的测量,对此提出你的看法________;
(2)准确称取完全反应前后装置丙和丁的质量如表:
装置丙 装置丁
反应前 48.8克 161.2克
反应后 46.5克 163.9克
小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度 (写出计算过程)。
(3)小明根据装置丙的质量变化计算,发现小丽结果偏大。请分析导致这一结果的原因可能是 。
A.装置的气密性不好 B.空气中的水分被丁处浓硫酸吸收
C.通入的氢气量不足 D.氧化铜没有完全被还原
(三)气体成分的验证
1、(2023春 义乌市校级月考)现有甲烷和氧气的混合气体14.4g在密闭的容器中充分燃烧,生成CO、CO2和H2O三种物质,冷却到室温后,气体的质量变为原来的二分之一,欲使甲烷完全燃烧,原容器中应增加氧气的质量至少为( )
A.0.8g B.1.6g
C.3.2g D.0.8g﹣1.6g之间
2.(2023八下·义乌期中)某物质充分燃烧的产物是CO2和H2O,为了确定该物质的组成,某小组设计了如图所示实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略)。称取0.84g待测物完全燃烧后,称得D装置增重1.08g,E装置增重2.64g。则下列推断正确的是( )
A.该物质一定含有C,H元素,没有氧元素
B.该物质一定含有C,H,O元素
C.用空气球代替装置A,B更有利于实验的进行
D.B装置的有无对实验结果没有影响
3.(2023·浦江模拟)俄乌冲突导致欧洲天然气断供,欧洲居民争相囤积煤炭。但在使用煤炭的过程中,却发生了中毒事件,这是灼热的煤炭与水反应所生成的气体导致的。那么生成的气体中有哪些成分呢 同学们进行了以下探究。
【查阅资料】煤炭主要成分是碳,遇水或氧气不足时会生成有毒气体一氧化碳。
【建立猜想】同学们对生成的气体成分做了以下猜想:
猜想1:有CO、CO2
猜想2:有CO、H2
猜想3:有CO、CO2和 H2
猜想4:有CO、H2、CO2和 H2O
【初步分析】
(1)小组讨论后,很快否定了猜想1,理由是 。
(2)【实验操作】他们利用下列实验装置进行探究。
如何连接组装实验装置,同学们意见不一。某同学按照C→A→C→B→B→D→B→C的顺序连接装置,将生成的气体通过该装置,请评价该方案是否可行,理由是
(3)同学们最终选择了下图的实验装置进行实验,假设C、D装置内的反应都完全。
①该实验中判断氢气存在的关键现象是 。
②在该实验探究过程中,G装置的作用是 。
4、(2023 杭州模拟)某燃料X在7.2g氧气中燃烧,得到9.2g混合气体(可能含有一氧化碳、二氧化碳、水蒸气)。化学兴趣小组的同学利用如图所示装置验证混合气体的成分。
资料:①浓硫酸具有吸水性。②浓氢氧化钠溶液能吸收二氧化碳。
(1)通过混合气体后,A装置增重4.5g,说明混合气体中含有 。
(2)D装置的作用是 。
(3)当观察到 ,证明混合气体中有CO。
(4)实验结束后,同学们称量B、C装置共增重3.3g,根据以上数据可确定燃料X中所含元素及元素质量比为 。
5、为进一步确定湖边收集的气体的组成,同学们进行了以下探究过程,请你参与并协助他们完成相关学习任务。
【提出猜想】收集的气体中可能含有CH4、CO2、CO和H2O。
【查阅资料】CO+CuOCu+CO2 CH4+4CuO4Cu+CO2+2H2O
【设计方案】:学习小组的同学经过讨论,设计了如图所示的装置进行“猜想”的实验探究。已知:A为储气罐,存放湖边收集的气体;B中装有浓硫酸;C中装有CuO;D中盛装无水硫酸铜白色粉末;E中装有氢氧化钙溶液。
【讨论与交流】
(1)该系列装置还缺少尾气处理装置,写出一种你认为可行的尾气处理方法 。
(2)请你设计完成如图方框内的实验方案(选用下列装置,按连接顺序填写) 。
(3)原气体中若含有CH4,则D中的现象是 。
(4)老师认为以上设计仍有缺陷,不能确定CO气体是否存在。小王同学和小李同学想通过定量实验的方法进行检验,于是对实验方案进行了改进,E装置中的试剂改为足量的氢氧化钠溶液,同时对D、E装置在实验前后的质量进行称量,数据计入下表中:
反应前 反应后
D装置 100g 103.6g
E装置 120g 125.5g
你认为根据上述数据计算后能否得出原气体中含有CO的结论,并简要分析: 。
课后作业
1.某气体可能含有H2、CO2、CO、HCl中的一种或几种,把该气体依次通过澄清石灰水、饱和碳酸氢钠溶液、浓硫酸、灼热的氧化铜、无水硫酸铜、澄清石灰水,观察到的现象是:前面的一瓶澄清石灰水无明显变化,灼热的氧化铜变红色,无水硫酸铜变蓝(无水硫酸铜遇水变蓝),后面的一瓶澄清石灰水变浑浊,下列关于该气体说法错误的是( )
A .一定含有H2 B .一定含有CO C .可能含有HCl D .可能含有CO2
2.某混合气体可能是CO、CO2、H2、H2O、CH4之中的一种或几种组成,为了验证混合气体的成分,设计了如图所示的装置进行实验(白色的无水硫酸铜遇水会变成蓝色,碱石灰是氢氧化钠和氧化钙的混合物),观察到的现象为:A中无明显现象,B中澄清石灰水变浑浊,烧杯中有水雾,迅速取下烧杯,向其中倒入澄清石灰水,澄清石灰水变浑浊.则原混合气体的组成情况可能有( )
A.3种 B.4种 C.5种 D.6种
(2) (3)
3.某混合气体由 CO、CO2、SO2 三种气体组成,小金同学查阅资料,①SO2 能使品红溶液褪色;②SO2 易与高锰酸钾溶液反应而被吸收,并能使其褪色;③SO2 能使氢氧化钡溶液和澄清石灰水变浑浊;④CO 和 CO2 均不能使品红溶液褪色,也不与高锰酸钾溶液反应。为验证这三种气体,同学们设计并进行如下实验:下列说法错误的是( )
A .装置A 的作用是检验并吸收二氧化硫
B .能证明气体中含有 CO2 的现象是B 中品红不褪色,C 中溶液变浑浊
C .若装置按C→D→A→B→E 的顺序连接,则无法验证的气体是 CO2
D .原装置中省略D 装置也能达到实验目的
4.某无色气体可能含有H2、CO、CH4中的一种或几种,依次进行下列实验(假设每一步反应或吸收均完全)( )
①无色气体在氧气中充分燃烧;②燃烧后生成的气体通过盛浓硫酸装置,装置的质量增加10.8g;③再将剩余气体通过盛NaOH溶液的装置;④装置的质量增加13.2g。
A .该气体一定含有H2、CO、CH4 B .该气体可能只含H2和CH4
C .该气体可能只含CO和CH4 D .该气体可能只含CH4
5.某兴趣小组在实验室相对封闭的装置内燃烧某种含碳、氢、氧元素的垃圾,对产生的废气成分(不考虑气态有机物)按如图所示的装置进行检验。
【实验研究】拉动注射器,让废气依次通过装置。
【实验分析】(1) 能证明废气中有水蒸气存在的现象是 ;
(2)【反思评价】小金认为仅根据E中澄清石灰水变浑浊,无法确定一氧化碳的存在,其理由是 ;
小金根据D中的粉末由黑色变为红色,得出废气中存在一氧化碳。小丽认为该结论不够严密,若废气中存在氢气也会出现该现象。要使上述结论更加严密,还应添加的一个实验装置及位置是 。
F装置的作用是 和 。
【实验结果】经检验,废气中存在CO2、CO、H2O。
6.某混合气体可能是 CO、CO2、H2O、H2 中的一种或几种,为确定成分,将 8 克混合气体通入如图装置中(假设每步吸收和反应均完全)。
实验测定的部分实验装置数据如下表:
装置 A B C F
实验前装置和药品总质量/g 100.0 100.0 100.0 100.0
实验后装置和药品总质量/g 100.8 104.2 100.2 104.4
则: 混合气体中含有的气体成分为 ;(计算说明)
7.(2023九下·金华月考)某气体X可能是由H2、CO、CO2中的一种或几种组成,为了解其组成情况,小金设计了如下装置进行实验。
请回答下列问题:
(1)写出CO还原CuO的化学方程式: ;
(2)如果省略B装置,对实验结果的影响是: ;
(3)气体X通过整套装置时,A中液体不浑浊,C中黑色粉末变成光亮的红色,D中液体变浑浊,则气体X的组成情况是 ;
(4)若要检验H2的存在,则应对该装置作何改进 。
8.定性和定量结合既是化学的重要思想,也是研究物质组成的重要方法。某研究性学习小组为检测实验室用H2还原CuO所得红色固体Cu中是否含有Cu2O(红色),进行了认真的探究。请你一起踏上探究之路,回答下列问题。
【查阅资料】
①无水CuSO4遇水变蓝;
②高温灼烧CuO生成Cu2O和O2;
③Cu2O与稀H2SO4反应:Cu2O+H2SO4=Cu+CuSO4+H2O。
【设计实验方案】
方案1 取该红色固体加入适量稀H2SO4,实验现象___________,结论为红色固体中含有Cu2O。
方案2装置如图所示,拟通过干燥管中CuSO4变蓝来判断红色固体是否含有Cu2O。
(1)为确保探究的科学、合理、安全。实验中还应采取的措施有___________;填序号)
①加热前先排尽装置中的空气;
②在氢气发生器与硬质玻璃管之间加一个干燥装置;
③在盛有CuSO4的干燥管后再连接一个装有浓H2SO4的洗气瓶。
(2)由方案2实验后得出结论:红色固体中含有Cu2O。写出红色固体Cu2O与H2反应的化学方程式________ 。
方案3 称得干燥坩埚(常用于固体加热的容器)的质量为ag,取红色固体置于坩埚中称得总质量为bg,在空气中高温灼烧至质量恒定,称得最后坩埚与固体总质量为cg。
(1)该实验方案最少得进行___________次称量;
(2)若确认红色固体中含有Cu2O,则c与a,b应符合的数学关系式为___________。
九年级上册科学第二章 金属的冶炼、氧化还原反应专题答案
能力提升
(一)实验操作步骤和装置的作用
1、【答案】C
【解答】解:由题意可知,包公意指黑色粉末,轻风指氢气,关云长意指红色粉末,退烈火指移去酒精灯,题中的意思指的是黑色的粉末在通入氢气后变成了红色,所以实验指的是氢气还原氧化铜的实验,氢气还原氧化铜,氧化铜是黑色粉末,铜是红色粉末,且有水生成,由以上分析可知:“包公”“关云长”及“轻风”分别指的是CuO、Cu、H2,故选:C。
2.【答案】(1)防止CO与空气混合加热后爆炸 (2) 收集多余的CO,尾气处理
3、【答案】(1)检查装置的气密性
(2)调节压强
(3)D中玻璃管内红色固体变成黑色,E中澄清的石灰水变浑浊
(4)c
【解析】(1)根据密闭装置中进行的实验加药品前要先检查装置气密性分析;
(2)根据有气体参与的装置要注意压强的变化分析;
(3)根据一氧化碳与氧化铁反应生成铁和二氧化碳分析;
(4)根据吸收气体装置要使气体与药品充分接触分析。
【解答】(1)该反应需在密闭装置中进行, 按如图连接装置A﹣E,在装入试剂前,要先检查装置的气密性 ;
(2) 装置C中玻璃管连接外界,其作用是调节压强。
(3)一氧化碳与氧化铁反应生成铁和二氧化碳,反应一段时间,观察到D中玻璃管内红色固体变成黑色,E中澄清的石灰水变浑浊 ,可证明一氧化碳与氧化铁发生了反应。
(4) CO能溶于铜液 , 在装置E后再连接装置F,是为了吸收尾气中的CO,防止污染空气,为使药品充分接触,则a连接c。
4、【答案】排出装置中的空气,防止影响实验结果; 打开弹簧夹通入氮气。 A
【解答】解:【实验步骤】
①如图所示,连接好仪器,检查装置气密性。
②打开弹簧夹,通入适量氮气,目的是排出装置中的空气,防止影响实验结果。
③关闭弹簧夹,点燃A、B两处酒精灯。
④观察实验现象,B处发现红色固体变黑;D处出现红色固体。
⑤熄灭两处酒精灯,立即打开弹簧夹通入氮气至玻璃管冷却。
故答案为:排出装置中的空气,防止影响实验结果;打开弹簧夹通入氮气。
【实验分析】
A.B处固体质量逐渐减小,是因为氧化铁不断和一氧化碳反应,该选项正确。
B.D处现象证明A处都发生了反应,该选项不正确。
C.不需要在E处加一只点燃的酒精灯,是因为D中的药品足量,能够完全吸收一氧化碳,该选项不正确。
故选:A。
5.【答案】
(二)金属矿样品的测量与计算
1.【答案】A
2、【答案】(1)A
(2)收集CO, 防止污染空气
(3)0.7a
【解析】金属冶炼是把金属从化合态变为游离态的过程。用碳、一氧化碳、氢气等还原剂与金属氧化物在高温下发生还原反应,获得金属单质。
【解答】(1)实验结束后,应该先撤酒精喷灯,再继续通CO,防止生成的铁在高温的环境下和氧气反应重新变成氧化铁;选A;
(2)CO是有毒气体,装置B的作用除吸收、检验CO2外,还起到的作用是收集CO, 防止污染空气;
(3)氧化铁全部转化为铁,氧化铁中铁的质量分数=112/160;所以铁的质量b=a×=0.7a;
3. 【答案】 ② 将装置中生成的CO2挤入B中充分吸收 44m3/33m1
4、【答案】(1)① (2)A (3)= (4)0.3g<m<0.6g
【解析】(1)根据二氧化碳能使澄清石灰水变浑浊分析;
(2)根据两处酒精灯的作用分析;
(3)根据质量守恒定律分析;
(4)根据方程式中物质质量关系计算分别生成一氧化碳、二氧化碳时m的值,由此确定生成混合气体m范围分析。
【解答】(1) 二氧化碳能使澄清石灰水变浑浊,若观察到B中澄清石灰水变浑浊,说明气体中一定有二氧化碳,则可排除猜想 ① 。
(2) D处酒精灯是为了处理尾气,防止空气污染,实验结束后,需要先熄灭A处酒精灯。
(3)A玻璃管减少质量即为生成气体质量,BC增重质量为生成二氧化碳质量,若 理论上(m4-m3) = (m1-m2) ,则可证明猜想②成立 。
(4)设生成气体全部为CO,则
CuO + C=Cu+CO
80 12
4g m
m=0.6g
设生成气体全部为CO2,则
2CuO + C=2Cu+CO2
160 12
4g m
m=0.3g
若猜想③成立且CuO全部转化成Cu,则参加反应碳的质量m的取值范围是 0.3g<m<0.6g 。
5.【答案】(1)检验氢气中的水分是否全部吸收(2)甲瓶只是除去H2中的水,丁瓶吸收的水的质量要用来计算氧元素的质量(3)80% (4)B
(三)气体成分的验证
1、【答案】B
【解答】解:现有甲烷和氧气的混合气体14.4g在密闭的容器中充分燃烧,生成CO、CO2和H2O三种物质,冷却到室温后,气体的质量变为原来的二分之一,说明冷却的水蒸气有7.2g,水中氢元素的质量为:7.2g0.8g,水中的氢元素全部来自于甲烷,则甲烷的质量为:0.8g3.2g,甲烷和氧气的混合气体中氧气的质量为:14.4g﹣3.2g=11.2g,
设3.2g甲烷完全燃烧需要氧气的质量为x。
CH4+2O2CO2+2H2O
16 64
3.2g x
x=12.8g
则3.2g甲烷完全燃烧需要氧气的质量为12.8g,欲使甲烷完全燃烧,原容器中应增加氧气的质量至少为:12.8g﹣11.2g=1.6g。
故选:B。
2、【答案】A
【解析】质量守恒:反应物的质量和生成物的总质量相等;反应前后元素的种类和质量不变。
【解答】A. D装置的吸收反应产生的水,因此反应产生了1.08g的水,E装置是吸收反应产生的二氧化碳,因此产生了2.64g的二氧化碳,根据质量守恒可以得出消耗的氧气质量为:1.08g+2.64g-0.84g=2.88g,根据反应前后元素的种类不变可以确定待测物中一定含有C,H两种元素;反应后2.64gCO2中氧元素的质量为:2.64g×=1.92g,1.08gH2O中氧元素的质量为:1.08g×=0.96g,因此反应后氧元素的总质量为:1.92g+0.96g=2.88g,与消耗的氧气质量相等,说明待测物中没有氧元素,A正确
B. 通过A可以得出,B错误
C. 空气中含有水蒸气和二氧化碳,对测量反应产生的水和二氧化碳会产生干扰,因此不能用空气球代替,C错误
D. B装置是用来干燥反应产生的氧气的,通过过氧化氢溶液分解产生的氧气中会带有水蒸气,如果没有B装置,产生的氧气中的水会对测量反应产生的水产生干扰,D错误。
3、【答案】(1)违背质量守恒定律(合理即可)
(2)不可行,无法检验原气体中是否含有水蒸气
(3)F中的无水硫酸铜变蓝;检验CO2,收集尾气
【解析】质量守恒: 1.反应前后物质总质量不变 2.元素的种类不变 3.各元素的总质量不变
【解答】(1)根据质量守恒:反应前后元素种类不变,反应前有C、H、O三种元素,反应后也应有这三种,猜想1中没有H元素,故填:违背了质量守恒定律。
(2)装置A的作用:吸收CO2 装置B的作用:检验水蒸气,装置C的作用:检验CO2,当气体通过溶液后会带出一部分的水蒸气,对检验原气体中是否含有水蒸气会产生干扰,因此需要先检验是否含有水蒸气。故填: 不可行,无法检验原气体中是否含有水蒸气
(3)①H2能与E装置的CuO发生反应:H2+CuOH2O+Cu 现象为黑色固体变红色,且产生的H2O能使F装置中的无水CuSO4变蓝,故填:F中的无水硫酸铜变蓝。
②G装置中澄清石灰水可以用来检验CO2,且该实验中尾气含有CO,CO难溶于水,可以利用该装置收集CO尾气,故填:检验CO2,收集尾气。
4、【答案】(1)H2O或水蒸气;
(2)检验二氧化碳是否完全被吸收了;
(3)玻璃管内红色固体逐渐变为黑色,F装置逐渐变浑浊;
(4)C、H;m(C):m(H)=3:1。
【解答】解:(1)浓硫酸有吸水性,因此浓硫酸增重就说明吸收了水,因此混合气体中含有水蒸气;
(2)氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,所以D装置的澄清石灰水可以检验氢氧化钠溶液是否吸收尽二氧化碳,便于对一氧化碳产生二氧化碳的检验;
(3)一氧化碳具有还原性,可以和氧化铁反应产生铁和二氧化碳,因此观察到的现象是红色固体变成黑色,F中石灰水变浑浊;
(4)B、C装置可以吸收二氧化碳,增重的质量即为二氧化碳的质量,说明二氧化碳的质量为3.3g,因为混合气体质量为9.2g,其中水蒸气为4.5g、3.3g二氧化碳,则生成一氧化碳的质量为1.4g,4.5g水中氢元素的质量为4.5g100%=0.5g,3.3g二氧化碳中碳元素的质量为3.3g100%=0.9g,1.4g一氧化碳中碳元素的质量为1.4g100%=0.6g,根据质量守恒定律燃料X的质量为9.2g﹣7.2g=2g,碳元素和氧元素的质量和为0.9g+0.6g+0.5g=2g,因此X中不含有氧元素,只含有碳、氢元素,所以两种元素的质量比为:(0.9g+0.6g):0.5g=3:1。
故答案为:(1)H2O或水蒸气;
(2)检验二氧化碳是否完全被吸收了;
(3)玻璃管内红色固体逐渐变为黑色,F装置逐渐变浑浊;
(4)C、H;m(C):m(H)=3:1。
5、【答案】(1)点燃处理或用气球收集处理等
(2)2、1、3
(3)白色固体变成蓝色
(4)能,由方程式可知,D装置增重质量为甲烷与氧化铜反应产生水的质量,同时生成二氧化碳质量为4.4克,而E装置增重质量为吸收二氧化碳质量,为5.5克。
课后作业
1.【答案】D 2.【答案】C 3.【答案】C 4.【答案】D
5.【答案】A中变蓝色 废气中原有的CO2没有被除尽,导致E中变浑浊
在DE之间装个A 抽气 和收集尾气
6.【答案】水蒸气 二氧化碳 一氧化碳 氢气
7、【答案】(1)CO+CuO Cu+CO2
(2)无法验证原混合气体中是否含有CO气体
(3)CO或CO、H2
(4)BC之间增加浓硫酸装置,CD之间增加无水硫酸铜装置
【解析】(1)根据反应物、反应条件和生成物,写出反应的化学方程式。
(2)氢氧化钠溶液用于吸收气体中的二氧化碳气体,只有B将其中的二氧化碳气体全部吸收,才能不对后面的验证产生影响。即如果后面D中石灰水变浑浊,则说明反应有二氧化碳产生,即一氧化碳和氧化铜发生了反应,即原来气体含有一氧化碳气体。
(3)A中澄清的石灰水不浑浊,则说明气体中肯定没有二氧化碳。而C中黑色粉末变成光亮的红色,说明氧化铜被还原,则原来气体可能存在一氧化碳或氢气。而D中变浑浊,则说明肯定存在一氧化碳,据此分析解答。
(4)氢气还原氧化铜生成铜和水,因此检验是否有水生成是检验存在氢气的关键。则在反应前要利用浓硫酸的吸水性去掉水分,在反应装置后加入无水硫酸铜检验水的生成,据此分析解答。
【解答】(1)一氧化碳和氧化铜反应,生成铜单质和二氧化碳,则反应的方程式为: CO+CuO Cu+CO2 。
(2)如果省略B装置,对实验结果的影响是:无法验证原混合气体中是否含有CO气体;
(3)气体X通过整套装置时,A中液体不浑浊,C中黑色粉末变成光亮的红色,D中液体变浑浊,则气体X的组成情况是:CO或CO、H2。
(4)若要检验H2的存在,则应对该装置的改进如下:BC之间增加浓硫酸装置,CD之间增加无水硫酸铜装置。
8.【答案】 溶液变为蓝色 ①②③ 4
【详解】设计实验方案:
方案1:
结论为红色固体中含有Cu2O,已知:,硫酸铜溶液呈蓝色,所以取该红色固体加入适量稀H2SO4,实验现象为溶液变为蓝色,结论为红色固体中含有Cu2O。
方案2:
(1)根据硫酸铜是否变蓝判断是否含有氧化亚铜时,要注意水的干扰因素,所以制取的氢气要干燥,可以在氢气发生器与硬质玻璃管之间加一个干燥装置,并且要将空气中的水的干扰排除,可以在盛有硫酸铜的干燥管后再连接一个装有碱石灰的干燥管,实验前要将装置中的空气排净,防止干扰;故答案为①②③;
(2)氢气和氧化亚铜在加热条件下生成铜和水,反应的化学方程式为:;
方案3:
(1)根据在空气中高温灼烧至质量恒定,这一步骤至少需称量2次,加上前面的2次称量,故该实验方案最少得进行4次称量。
(2)单质铜加热生成氧化铜,氧化铜高温灼烧生成Cu2O和O2,故坩埚中最后剩下的红色固体是Cu2O;其质量为:(c-a)g;则铜元素的质量为:,所取红色固体的质量为(b-a)g;若红色固体中含有Cu2O,则铜元素的质量小于(b-a)g,即,故。
知识点提纲
1.金属冶炼就是要把金属从化合态变成游离态(单质)。
(1)湿法炼铜:先用硫酸将铜矿中的铜转变成可溶性的硫酸铜,再将铁放入硫酸铜溶液中把铜置换出来
方程式:CuO+H2SO4=CuSO4+H2O CuSO4+Fe=Cu+FeSO4
(2)火法炼铜:
一、让碳与金属氧化物在高温下反应,碳能夺取金属氧化物中的氧,从而得到金属(图1)。
C + 2CuO 2Cu + CO2 ↑
实验步骤:①检查气密性; ②装药品固定试管; ③点燃; ④移导管,熄灭酒精灯
实验现象:黑色固体变红色,生成使澄清石灰水变浑浊的气体。
(1) (2)
二、炽热的炭在高温条件下与二氧化碳反应,生成一氧化碳(一氧化碳会使窒息中毒)。
一氧化碳也会夺取金属氧化物中的氧,产生游离态的金属单质(图2)。
C + CO2 2 CO CO + CuO Cu + CO2
实验步骤:反应前需检验气体纯度。还原过程分四步:一通,二点,三撤,四停。
实验现象:①黑色粉末逐渐变成红色;②生成的气体使澄清石灰水变浑浊。
因CO有毒,增加对尾气处理装置(点燃法或收集法),防止CO污染空气。
实验说明:①先通入一定量的CO,目的是排尽装置内原有的空气,防止加热爆炸;
②实验结束:先移开酒精灯,继续通入CO,直到装置冷却;目的是防止还原的铜又重新氧化。
拓展:炼铁,如下实验装置:一氧化碳还原氧化铁(图3)3CO + Fe2O3 2Fe + 3CO2
实验步骤说明和现象:①实验前检查气密性;
②先点燃尾部酒精灯:防止CO逃逸,污染空气(尾气处理);
③先通入一定量的CO气体,目的是排尽装置内原有的空气,防止加热爆炸;
④点燃酒精喷灯,观察实验现象:红色固体变黑色,石灰水变浑浊;
⑤实验结束:先移开酒精喷灯,继续通入CO,直到装置冷却;目的是防止还原的铁粉又重新氧化。
再熄灭尾部酒精灯(尾气处理)
(3) (4)
三、氢气也能将金属氧化物变成游离态金属(图4)。H2 + CuO Cu + H2O
注意事项:①试管口略向下倾斜; ②通H2 的导管伸至试管底部于CuO上方。
实验步骤:反应前需检验气体纯度。还原过程分四步:一通,二点,三撤,四停。
实验步骤说明和现象:①先通入一定量的H2,目的是排尽装置内原有的空气,防止加热爆炸;
②点燃酒精灯,观察实验现象:黑色固体变红色,试管口出现小水珠;
③实验结束:先移开酒精灯,继续通入H2,直到装置冷却;目的是防止还原的铜又重新氧化。
能力提升训练
(一)实验操作步骤和装置的作用
1、(2023春 慈溪市校级月考)三国时的“红脸”关云长与北宋时的“黑脸”包公本是互不相干的著名历史人物,但一首描述某一化学实验过程的诗却将两人联系在了一起。诗的内容如下:“包公静坐水晶房,轻风迎面喜洋洋,忽然一阵烈火起,烧得包公变云长,云长急令退烈火,只留轻风吹暖房。”这首诗中的“包公”“关云长”及“轻风”分别指的是( )
A.C、Cu、CO2 B.C、Cu、CO
C.CuO、Cu、H2 D.H2、CuO、Cu
2、如图是某科学老师设计的一氧化碳还原氧化铁的实验装置。
(1) 在B装置的液面下降到安全线之前,不能加热氧化铁,这是因为 。
(2) 反应结束后停止加热,继续通CO,此时B装置的作用是 。
3、某兴趣小组的同学们利用如图所示的装置对CO还原Fe2O3粉末的实验进行探究(固定装置略)。
【查阅资料】CO能溶于铜液。铜液:醋酸二氨合铜和氨水的混合液
(1)按如图连接装置A﹣E,在装入试剂前,先 。
(2)装置C中玻璃管的作用: 。
(3)反应一段时间后,能证明CO与Fe2O3反应的实验现象: 。
(4)某同学认为该装置有缺陷,需在装置E后再连接装置F,装置E、F的接口连接顺序:a连接 (填“b”或“c”)。
4、(2022秋武义期末)某兴趣小组设计如图装置,对“一氧化碳还原氧化铁”的实验进行拓展研究:
【查阅资料】①加热MgCO3和Zn的混合物,产生三种氧化物;
②氯化亚铜溶液吸收CO会产生红色固体Cu2Cl2(CO)2 2H2O,氨水能加速这一反应;反应方程式为2CuCl+2H2O+2COCu2Cl2(CO)2 2H2O
【提出问题】根据上述资料设计如图实验装置(固定装置省略):
【实验步骤】
①如图所示,连接好仪器,检查装置气密性。
②打开弹簧夹,通入适量氮气,目的是 。
③关闭弹簧夹,点燃A、B两处酒精灯。
④观察实验现象,B处发现红色固体变黑;D处出现红色固体。
⑤熄灭两处酒精灯,立即 至玻璃管冷却(填实验操作)。
【实验分析】
步骤③时,下列关于实验的说法正确的是 。
A.B处固体质量逐渐减小 B.D处现象证明A、B处都发生了反应
C.必须在E处加一只点燃的酒精灯
5.兴趣小组同学用氧化铜与足量的炭粉利用图甲所示的装置进行实验,对生成气体的成分进行探究。
【提出问题】生成的气体中是否含有一氧化碳
【实验与讨论】①打开K,缓缓通入干燥的氮气一段时间。通入氮气的目的是 。
②关闭K,加热至一定温度使之反应,用气囊收集气体样品。
③除去气体样品中的二氧化碳,并将剩余气体收集在集气瓶中,下列装置中最为合理的是 。
【实验求证】将除尽二氧化碳后的气体样品干燥,仍然用图甲所示的装置进行实验,若A中的固体选用CuO,B中溶液为澄清石灰水,若出现 现象,可说明气体样品中含有一氧化碳。
【实验反思】炭粉还原氧化铜的实验中,若生成的气体中含有一氧化碳,则反应时消耗碳与CuO的质量比,在下列数据中不可能的是 。
A.1:5 B.1:8 C.1:10 D.1:15
(二)金属矿样品的测量与计算
1.(2023·金华模拟)某同学用一定量的铁与足量稀硫酸及足量氧化铜制单质铜,他设计了以下两种方案:他若按实际实验原则进行操作,则两者制得单质铜的量为( )
A .①多 B .②多 C .一样多 D .无法判断
2.(2023上城模拟)小金进行了模拟炼铁实验。选用CO和氧化铁粉末进行反应,实验步骤如下:
I.连接好装置,并检查装置的气密性;
II装好药品,先通一会儿CO,再点燃酒精喷灯;
III.实验结束, 。
(1)步骤Ⅲ中缺少的操作应为 。(填序号)
A.先撤酒精喷灯,再继续通CO B.先停止通CO,再撤酒精喷灯
(2)装置B的作用除吸收、检验CO2外,还起到的作用是 。
(3)实验开始时加入a克纯氧化铁粉末,实验结束后取出玻璃管内的固体称量为b克,当b为 (用含有a式子表示)时,可判断氧化铁已完全转化为铁。
3.还原性铁粉在潮湿的空气中容易生锈。现有m1g生锈的铁粉样品,某兴趣小组同学按下图所示装置进行实验,测定该样品中氧化铁的质量分数(铁锈按氧化铁处理)。
(1) 某同学欲通过B装置反应前后的质量变化,测定该样品中氧化铁的质量分数B中的最佳试剂是________(填序号)
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2) 上述实验过程。CO气体除作为反应物外,还能起到的作用是:①实验开始时,排尽装置中的空气.防止加热时发生爆炸;②停止热后,防止A中生成物被氧化,防止B中的溶液倒吸入A中;③ 。
(3) 完全反应后,甲同学称得铁粉的质量为m2g。同时测得装置B增重m3g,则铁粉样品中氧化铁的质量分数为 。
4、(2023·杭州模拟)如图所示是木炭还原氧化铜的实验,小科对碳与氧化铜反应生成的气体成分进行探究。[提出问题]碳燃烧时可能生成CO2,也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能
[作出猜想]猜想①:CO; 猜想②:CO2; 猜想③:CO和CO2。
[设计方案]打开K,缓缓通入干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通一段时间氮气。
方案一:从定性观察角度判断
(1)若观察到B中澄清石灰水变浑浊,则可排除猜想 。
(2)实验结束后,需要先熄灭(选填“A”或“D”) 酒精灯。
(3)方案二:从定量计算角度判断取一定量炭粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
反应前的质量 反应后的质量
A(玻璃管+固) m1 m2
B+C+(广口瓶+混合液) m3 m4
若猜想②成立,则理论上(m4-m3) (m1-m2)(填“>”“=”或“<”)。
(4)若猜想③成立且CuO全部转化成Cu,则参加反应碳的质量m的取值范围是 。
5.用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验。
【查阅资料】①无水硫酸铜为白色固体,遇水变成蓝色。
②浓硫酸具有吸水性,可做干燥剂。请根据资料回答:
(1)在实验中,乙装置的作用是 。
(1)在实验中,甲和丁装置的作用是一致的,因此有同学认为反应前后均需要进行质量的测量,对此提出你的看法________;
(2)准确称取完全反应前后装置丙和丁的质量如表:
装置丙 装置丁
反应前 48.8克 161.2克
反应后 46.5克 163.9克
小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度 (写出计算过程)。
(3)小明根据装置丙的质量变化计算,发现小丽结果偏大。请分析导致这一结果的原因可能是 。
A.装置的气密性不好 B.空气中的水分被丁处浓硫酸吸收
C.通入的氢气量不足 D.氧化铜没有完全被还原
(三)气体成分的验证
1、(2023春 义乌市校级月考)现有甲烷和氧气的混合气体14.4g在密闭的容器中充分燃烧,生成CO、CO2和H2O三种物质,冷却到室温后,气体的质量变为原来的二分之一,欲使甲烷完全燃烧,原容器中应增加氧气的质量至少为( )
A.0.8g B.1.6g
C.3.2g D.0.8g﹣1.6g之间
2.(2023八下·义乌期中)某物质充分燃烧的产物是CO2和H2O,为了确定该物质的组成,某小组设计了如图所示实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略)。称取0.84g待测物完全燃烧后,称得D装置增重1.08g,E装置增重2.64g。则下列推断正确的是( )
A.该物质一定含有C,H元素,没有氧元素
B.该物质一定含有C,H,O元素
C.用空气球代替装置A,B更有利于实验的进行
D.B装置的有无对实验结果没有影响
3.(2023·浦江模拟)俄乌冲突导致欧洲天然气断供,欧洲居民争相囤积煤炭。但在使用煤炭的过程中,却发生了中毒事件,这是灼热的煤炭与水反应所生成的气体导致的。那么生成的气体中有哪些成分呢 同学们进行了以下探究。
【查阅资料】煤炭主要成分是碳,遇水或氧气不足时会生成有毒气体一氧化碳。
【建立猜想】同学们对生成的气体成分做了以下猜想:
猜想1:有CO、CO2
猜想2:有CO、H2
猜想3:有CO、CO2和 H2
猜想4:有CO、H2、CO2和 H2O
【初步分析】
(1)小组讨论后,很快否定了猜想1,理由是 。
(2)【实验操作】他们利用下列实验装置进行探究。
如何连接组装实验装置,同学们意见不一。某同学按照C→A→C→B→B→D→B→C的顺序连接装置,将生成的气体通过该装置,请评价该方案是否可行,理由是
(3)同学们最终选择了下图的实验装置进行实验,假设C、D装置内的反应都完全。
①该实验中判断氢气存在的关键现象是 。
②在该实验探究过程中,G装置的作用是 。
4、(2023 杭州模拟)某燃料X在7.2g氧气中燃烧,得到9.2g混合气体(可能含有一氧化碳、二氧化碳、水蒸气)。化学兴趣小组的同学利用如图所示装置验证混合气体的成分。
资料:①浓硫酸具有吸水性。②浓氢氧化钠溶液能吸收二氧化碳。
(1)通过混合气体后,A装置增重4.5g,说明混合气体中含有 。
(2)D装置的作用是 。
(3)当观察到 ,证明混合气体中有CO。
(4)实验结束后,同学们称量B、C装置共增重3.3g,根据以上数据可确定燃料X中所含元素及元素质量比为 。
5、为进一步确定湖边收集的气体的组成,同学们进行了以下探究过程,请你参与并协助他们完成相关学习任务。
【提出猜想】收集的气体中可能含有CH4、CO2、CO和H2O。
【查阅资料】CO+CuOCu+CO2 CH4+4CuO4Cu+CO2+2H2O
【设计方案】:学习小组的同学经过讨论,设计了如图所示的装置进行“猜想”的实验探究。已知:A为储气罐,存放湖边收集的气体;B中装有浓硫酸;C中装有CuO;D中盛装无水硫酸铜白色粉末;E中装有氢氧化钙溶液。
【讨论与交流】
(1)该系列装置还缺少尾气处理装置,写出一种你认为可行的尾气处理方法 。
(2)请你设计完成如图方框内的实验方案(选用下列装置,按连接顺序填写) 。
(3)原气体中若含有CH4,则D中的现象是 。
(4)老师认为以上设计仍有缺陷,不能确定CO气体是否存在。小王同学和小李同学想通过定量实验的方法进行检验,于是对实验方案进行了改进,E装置中的试剂改为足量的氢氧化钠溶液,同时对D、E装置在实验前后的质量进行称量,数据计入下表中:
反应前 反应后
D装置 100g 103.6g
E装置 120g 125.5g
你认为根据上述数据计算后能否得出原气体中含有CO的结论,并简要分析: 。
课后作业
1.某气体可能含有H2、CO2、CO、HCl中的一种或几种,把该气体依次通过澄清石灰水、饱和碳酸氢钠溶液、浓硫酸、灼热的氧化铜、无水硫酸铜、澄清石灰水,观察到的现象是:前面的一瓶澄清石灰水无明显变化,灼热的氧化铜变红色,无水硫酸铜变蓝(无水硫酸铜遇水变蓝),后面的一瓶澄清石灰水变浑浊,下列关于该气体说法错误的是( )
A .一定含有H2 B .一定含有CO C .可能含有HCl D .可能含有CO2
2.某混合气体可能是CO、CO2、H2、H2O、CH4之中的一种或几种组成,为了验证混合气体的成分,设计了如图所示的装置进行实验(白色的无水硫酸铜遇水会变成蓝色,碱石灰是氢氧化钠和氧化钙的混合物),观察到的现象为:A中无明显现象,B中澄清石灰水变浑浊,烧杯中有水雾,迅速取下烧杯,向其中倒入澄清石灰水,澄清石灰水变浑浊.则原混合气体的组成情况可能有( )
A.3种 B.4种 C.5种 D.6种
(2) (3)
3.某混合气体由 CO、CO2、SO2 三种气体组成,小金同学查阅资料,①SO2 能使品红溶液褪色;②SO2 易与高锰酸钾溶液反应而被吸收,并能使其褪色;③SO2 能使氢氧化钡溶液和澄清石灰水变浑浊;④CO 和 CO2 均不能使品红溶液褪色,也不与高锰酸钾溶液反应。为验证这三种气体,同学们设计并进行如下实验:下列说法错误的是( )
A .装置A 的作用是检验并吸收二氧化硫
B .能证明气体中含有 CO2 的现象是B 中品红不褪色,C 中溶液变浑浊
C .若装置按C→D→A→B→E 的顺序连接,则无法验证的气体是 CO2
D .原装置中省略D 装置也能达到实验目的
4.某无色气体可能含有H2、CO、CH4中的一种或几种,依次进行下列实验(假设每一步反应或吸收均完全)( )
①无色气体在氧气中充分燃烧;②燃烧后生成的气体通过盛浓硫酸装置,装置的质量增加10.8g;③再将剩余气体通过盛NaOH溶液的装置;④装置的质量增加13.2g。
A .该气体一定含有H2、CO、CH4 B .该气体可能只含H2和CH4
C .该气体可能只含CO和CH4 D .该气体可能只含CH4
5.某兴趣小组在实验室相对封闭的装置内燃烧某种含碳、氢、氧元素的垃圾,对产生的废气成分(不考虑气态有机物)按如图所示的装置进行检验。
【实验研究】拉动注射器,让废气依次通过装置。
【实验分析】(1) 能证明废气中有水蒸气存在的现象是 ;
(2)【反思评价】小金认为仅根据E中澄清石灰水变浑浊,无法确定一氧化碳的存在,其理由是 ;
小金根据D中的粉末由黑色变为红色,得出废气中存在一氧化碳。小丽认为该结论不够严密,若废气中存在氢气也会出现该现象。要使上述结论更加严密,还应添加的一个实验装置及位置是 。
F装置的作用是 和 。
【实验结果】经检验,废气中存在CO2、CO、H2O。
6.某混合气体可能是 CO、CO2、H2O、H2 中的一种或几种,为确定成分,将 8 克混合气体通入如图装置中(假设每步吸收和反应均完全)。
实验测定的部分实验装置数据如下表:
装置 A B C F
实验前装置和药品总质量/g 100.0 100.0 100.0 100.0
实验后装置和药品总质量/g 100.8 104.2 100.2 104.4
则: 混合气体中含有的气体成分为 ;(计算说明)
7.(2023九下·金华月考)某气体X可能是由H2、CO、CO2中的一种或几种组成,为了解其组成情况,小金设计了如下装置进行实验。
请回答下列问题:
(1)写出CO还原CuO的化学方程式: ;
(2)如果省略B装置,对实验结果的影响是: ;
(3)气体X通过整套装置时,A中液体不浑浊,C中黑色粉末变成光亮的红色,D中液体变浑浊,则气体X的组成情况是 ;
(4)若要检验H2的存在,则应对该装置作何改进 。
8.定性和定量结合既是化学的重要思想,也是研究物质组成的重要方法。某研究性学习小组为检测实验室用H2还原CuO所得红色固体Cu中是否含有Cu2O(红色),进行了认真的探究。请你一起踏上探究之路,回答下列问题。
【查阅资料】
①无水CuSO4遇水变蓝;
②高温灼烧CuO生成Cu2O和O2;
③Cu2O与稀H2SO4反应:Cu2O+H2SO4=Cu+CuSO4+H2O。
【设计实验方案】
方案1 取该红色固体加入适量稀H2SO4,实验现象___________,结论为红色固体中含有Cu2O。
方案2装置如图所示,拟通过干燥管中CuSO4变蓝来判断红色固体是否含有Cu2O。
(1)为确保探究的科学、合理、安全。实验中还应采取的措施有___________;填序号)
①加热前先排尽装置中的空气;
②在氢气发生器与硬质玻璃管之间加一个干燥装置;
③在盛有CuSO4的干燥管后再连接一个装有浓H2SO4的洗气瓶。
(2)由方案2实验后得出结论:红色固体中含有Cu2O。写出红色固体Cu2O与H2反应的化学方程式________ 。
方案3 称得干燥坩埚(常用于固体加热的容器)的质量为ag,取红色固体置于坩埚中称得总质量为bg,在空气中高温灼烧至质量恒定,称得最后坩埚与固体总质量为cg。
(1)该实验方案最少得进行___________次称量;
(2)若确认红色固体中含有Cu2O,则c与a,b应符合的数学关系式为___________。
九年级上册科学第二章 金属的冶炼、氧化还原反应专题答案
能力提升
(一)实验操作步骤和装置的作用
1、【答案】C
【解答】解:由题意可知,包公意指黑色粉末,轻风指氢气,关云长意指红色粉末,退烈火指移去酒精灯,题中的意思指的是黑色的粉末在通入氢气后变成了红色,所以实验指的是氢气还原氧化铜的实验,氢气还原氧化铜,氧化铜是黑色粉末,铜是红色粉末,且有水生成,由以上分析可知:“包公”“关云长”及“轻风”分别指的是CuO、Cu、H2,故选:C。
2.【答案】(1)防止CO与空气混合加热后爆炸 (2) 收集多余的CO,尾气处理
3、【答案】(1)检查装置的气密性
(2)调节压强
(3)D中玻璃管内红色固体变成黑色,E中澄清的石灰水变浑浊
(4)c
【解析】(1)根据密闭装置中进行的实验加药品前要先检查装置气密性分析;
(2)根据有气体参与的装置要注意压强的变化分析;
(3)根据一氧化碳与氧化铁反应生成铁和二氧化碳分析;
(4)根据吸收气体装置要使气体与药品充分接触分析。
【解答】(1)该反应需在密闭装置中进行, 按如图连接装置A﹣E,在装入试剂前,要先检查装置的气密性 ;
(2) 装置C中玻璃管连接外界,其作用是调节压强。
(3)一氧化碳与氧化铁反应生成铁和二氧化碳,反应一段时间,观察到D中玻璃管内红色固体变成黑色,E中澄清的石灰水变浑浊 ,可证明一氧化碳与氧化铁发生了反应。
(4) CO能溶于铜液 , 在装置E后再连接装置F,是为了吸收尾气中的CO,防止污染空气,为使药品充分接触,则a连接c。
4、【答案】排出装置中的空气,防止影响实验结果; 打开弹簧夹通入氮气。 A
【解答】解:【实验步骤】
①如图所示,连接好仪器,检查装置气密性。
②打开弹簧夹,通入适量氮气,目的是排出装置中的空气,防止影响实验结果。
③关闭弹簧夹,点燃A、B两处酒精灯。
④观察实验现象,B处发现红色固体变黑;D处出现红色固体。
⑤熄灭两处酒精灯,立即打开弹簧夹通入氮气至玻璃管冷却。
故答案为:排出装置中的空气,防止影响实验结果;打开弹簧夹通入氮气。
【实验分析】
A.B处固体质量逐渐减小,是因为氧化铁不断和一氧化碳反应,该选项正确。
B.D处现象证明A处都发生了反应,该选项不正确。
C.不需要在E处加一只点燃的酒精灯,是因为D中的药品足量,能够完全吸收一氧化碳,该选项不正确。
故选:A。
5.【答案】
(二)金属矿样品的测量与计算
1.【答案】A
2、【答案】(1)A
(2)收集CO, 防止污染空气
(3)0.7a
【解析】金属冶炼是把金属从化合态变为游离态的过程。用碳、一氧化碳、氢气等还原剂与金属氧化物在高温下发生还原反应,获得金属单质。
【解答】(1)实验结束后,应该先撤酒精喷灯,再继续通CO,防止生成的铁在高温的环境下和氧气反应重新变成氧化铁;选A;
(2)CO是有毒气体,装置B的作用除吸收、检验CO2外,还起到的作用是收集CO, 防止污染空气;
(3)氧化铁全部转化为铁,氧化铁中铁的质量分数=112/160;所以铁的质量b=a×=0.7a;
3. 【答案】 ② 将装置中生成的CO2挤入B中充分吸收 44m3/33m1
4、【答案】(1)① (2)A (3)= (4)0.3g<m<0.6g
【解析】(1)根据二氧化碳能使澄清石灰水变浑浊分析;
(2)根据两处酒精灯的作用分析;
(3)根据质量守恒定律分析;
(4)根据方程式中物质质量关系计算分别生成一氧化碳、二氧化碳时m的值,由此确定生成混合气体m范围分析。
【解答】(1) 二氧化碳能使澄清石灰水变浑浊,若观察到B中澄清石灰水变浑浊,说明气体中一定有二氧化碳,则可排除猜想 ① 。
(2) D处酒精灯是为了处理尾气,防止空气污染,实验结束后,需要先熄灭A处酒精灯。
(3)A玻璃管减少质量即为生成气体质量,BC增重质量为生成二氧化碳质量,若 理论上(m4-m3) = (m1-m2) ,则可证明猜想②成立 。
(4)设生成气体全部为CO,则
CuO + C=Cu+CO
80 12
4g m
m=0.6g
设生成气体全部为CO2,则
2CuO + C=2Cu+CO2
160 12
4g m
m=0.3g
若猜想③成立且CuO全部转化成Cu,则参加反应碳的质量m的取值范围是 0.3g<m<0.6g 。
5.【答案】(1)检验氢气中的水分是否全部吸收(2)甲瓶只是除去H2中的水,丁瓶吸收的水的质量要用来计算氧元素的质量(3)80% (4)B
(三)气体成分的验证
1、【答案】B
【解答】解:现有甲烷和氧气的混合气体14.4g在密闭的容器中充分燃烧,生成CO、CO2和H2O三种物质,冷却到室温后,气体的质量变为原来的二分之一,说明冷却的水蒸气有7.2g,水中氢元素的质量为:7.2g0.8g,水中的氢元素全部来自于甲烷,则甲烷的质量为:0.8g3.2g,甲烷和氧气的混合气体中氧气的质量为:14.4g﹣3.2g=11.2g,
设3.2g甲烷完全燃烧需要氧气的质量为x。
CH4+2O2CO2+2H2O
16 64
3.2g x
x=12.8g
则3.2g甲烷完全燃烧需要氧气的质量为12.8g,欲使甲烷完全燃烧,原容器中应增加氧气的质量至少为:12.8g﹣11.2g=1.6g。
故选:B。
2、【答案】A
【解析】质量守恒:反应物的质量和生成物的总质量相等;反应前后元素的种类和质量不变。
【解答】A. D装置的吸收反应产生的水,因此反应产生了1.08g的水,E装置是吸收反应产生的二氧化碳,因此产生了2.64g的二氧化碳,根据质量守恒可以得出消耗的氧气质量为:1.08g+2.64g-0.84g=2.88g,根据反应前后元素的种类不变可以确定待测物中一定含有C,H两种元素;反应后2.64gCO2中氧元素的质量为:2.64g×=1.92g,1.08gH2O中氧元素的质量为:1.08g×=0.96g,因此反应后氧元素的总质量为:1.92g+0.96g=2.88g,与消耗的氧气质量相等,说明待测物中没有氧元素,A正确
B. 通过A可以得出,B错误
C. 空气中含有水蒸气和二氧化碳,对测量反应产生的水和二氧化碳会产生干扰,因此不能用空气球代替,C错误
D. B装置是用来干燥反应产生的氧气的,通过过氧化氢溶液分解产生的氧气中会带有水蒸气,如果没有B装置,产生的氧气中的水会对测量反应产生的水产生干扰,D错误。
3、【答案】(1)违背质量守恒定律(合理即可)
(2)不可行,无法检验原气体中是否含有水蒸气
(3)F中的无水硫酸铜变蓝;检验CO2,收集尾气
【解析】质量守恒: 1.反应前后物质总质量不变 2.元素的种类不变 3.各元素的总质量不变
【解答】(1)根据质量守恒:反应前后元素种类不变,反应前有C、H、O三种元素,反应后也应有这三种,猜想1中没有H元素,故填:违背了质量守恒定律。
(2)装置A的作用:吸收CO2 装置B的作用:检验水蒸气,装置C的作用:检验CO2,当气体通过溶液后会带出一部分的水蒸气,对检验原气体中是否含有水蒸气会产生干扰,因此需要先检验是否含有水蒸气。故填: 不可行,无法检验原气体中是否含有水蒸气
(3)①H2能与E装置的CuO发生反应:H2+CuOH2O+Cu 现象为黑色固体变红色,且产生的H2O能使F装置中的无水CuSO4变蓝,故填:F中的无水硫酸铜变蓝。
②G装置中澄清石灰水可以用来检验CO2,且该实验中尾气含有CO,CO难溶于水,可以利用该装置收集CO尾气,故填:检验CO2,收集尾气。
4、【答案】(1)H2O或水蒸气;
(2)检验二氧化碳是否完全被吸收了;
(3)玻璃管内红色固体逐渐变为黑色,F装置逐渐变浑浊;
(4)C、H;m(C):m(H)=3:1。
【解答】解:(1)浓硫酸有吸水性,因此浓硫酸增重就说明吸收了水,因此混合气体中含有水蒸气;
(2)氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,所以D装置的澄清石灰水可以检验氢氧化钠溶液是否吸收尽二氧化碳,便于对一氧化碳产生二氧化碳的检验;
(3)一氧化碳具有还原性,可以和氧化铁反应产生铁和二氧化碳,因此观察到的现象是红色固体变成黑色,F中石灰水变浑浊;
(4)B、C装置可以吸收二氧化碳,增重的质量即为二氧化碳的质量,说明二氧化碳的质量为3.3g,因为混合气体质量为9.2g,其中水蒸气为4.5g、3.3g二氧化碳,则生成一氧化碳的质量为1.4g,4.5g水中氢元素的质量为4.5g100%=0.5g,3.3g二氧化碳中碳元素的质量为3.3g100%=0.9g,1.4g一氧化碳中碳元素的质量为1.4g100%=0.6g,根据质量守恒定律燃料X的质量为9.2g﹣7.2g=2g,碳元素和氧元素的质量和为0.9g+0.6g+0.5g=2g,因此X中不含有氧元素,只含有碳、氢元素,所以两种元素的质量比为:(0.9g+0.6g):0.5g=3:1。
故答案为:(1)H2O或水蒸气;
(2)检验二氧化碳是否完全被吸收了;
(3)玻璃管内红色固体逐渐变为黑色,F装置逐渐变浑浊;
(4)C、H;m(C):m(H)=3:1。
5、【答案】(1)点燃处理或用气球收集处理等
(2)2、1、3
(3)白色固体变成蓝色
(4)能,由方程式可知,D装置增重质量为甲烷与氧化铜反应产生水的质量,同时生成二氧化碳质量为4.4克,而E装置增重质量为吸收二氧化碳质量,为5.5克。
课后作业
1.【答案】D 2.【答案】C 3.【答案】C 4.【答案】D
5.【答案】A中变蓝色 废气中原有的CO2没有被除尽,导致E中变浑浊
在DE之间装个A 抽气 和收集尾气
6.【答案】水蒸气 二氧化碳 一氧化碳 氢气
7、【答案】(1)CO+CuO Cu+CO2
(2)无法验证原混合气体中是否含有CO气体
(3)CO或CO、H2
(4)BC之间增加浓硫酸装置,CD之间增加无水硫酸铜装置
【解析】(1)根据反应物、反应条件和生成物,写出反应的化学方程式。
(2)氢氧化钠溶液用于吸收气体中的二氧化碳气体,只有B将其中的二氧化碳气体全部吸收,才能不对后面的验证产生影响。即如果后面D中石灰水变浑浊,则说明反应有二氧化碳产生,即一氧化碳和氧化铜发生了反应,即原来气体含有一氧化碳气体。
(3)A中澄清的石灰水不浑浊,则说明气体中肯定没有二氧化碳。而C中黑色粉末变成光亮的红色,说明氧化铜被还原,则原来气体可能存在一氧化碳或氢气。而D中变浑浊,则说明肯定存在一氧化碳,据此分析解答。
(4)氢气还原氧化铜生成铜和水,因此检验是否有水生成是检验存在氢气的关键。则在反应前要利用浓硫酸的吸水性去掉水分,在反应装置后加入无水硫酸铜检验水的生成,据此分析解答。
【解答】(1)一氧化碳和氧化铜反应,生成铜单质和二氧化碳,则反应的方程式为: CO+CuO Cu+CO2 。
(2)如果省略B装置,对实验结果的影响是:无法验证原混合气体中是否含有CO气体;
(3)气体X通过整套装置时,A中液体不浑浊,C中黑色粉末变成光亮的红色,D中液体变浑浊,则气体X的组成情况是:CO或CO、H2。
(4)若要检验H2的存在,则应对该装置的改进如下:BC之间增加浓硫酸装置,CD之间增加无水硫酸铜装置。
8.【答案】 溶液变为蓝色 ①②③ 4
【详解】设计实验方案:
方案1:
结论为红色固体中含有Cu2O,已知:,硫酸铜溶液呈蓝色,所以取该红色固体加入适量稀H2SO4,实验现象为溶液变为蓝色,结论为红色固体中含有Cu2O。
方案2:
(1)根据硫酸铜是否变蓝判断是否含有氧化亚铜时,要注意水的干扰因素,所以制取的氢气要干燥,可以在氢气发生器与硬质玻璃管之间加一个干燥装置,并且要将空气中的水的干扰排除,可以在盛有硫酸铜的干燥管后再连接一个装有碱石灰的干燥管,实验前要将装置中的空气排净,防止干扰;故答案为①②③;
(2)氢气和氧化亚铜在加热条件下生成铜和水,反应的化学方程式为:;
方案3:
(1)根据在空气中高温灼烧至质量恒定,这一步骤至少需称量2次,加上前面的2次称量,故该实验方案最少得进行4次称量。
(2)单质铜加热生成氧化铜,氧化铜高温灼烧生成Cu2O和O2,故坩埚中最后剩下的红色固体是Cu2O;其质量为:(c-a)g;则铜元素的质量为:,所取红色固体的质量为(b-a)g;若红色固体中含有Cu2O,则铜元素的质量小于(b-a)g,即,故。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
