2.1.1化学反应速率及其影响因素课件(共36张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.1.1化学反应速率及其影响因素课件(共36张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 40.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-26 15:15:06 | ||
图片预览











文档简介
(共36张PPT)
第1课时 化学反应速率和影响因素
第二章 化学反应速率与化学平衡
第一节 化学反应速率
1.知道化学反应速率的表示方法,能进行化学反应速率的简单计算。
2.能说出测定化学反应速率的简单方法 。
3.能通过实验探究,知道温度、浓度、压强和催化剂对化学反应速率的影响 。
课标定位素养阐释
电动车自燃(90秒)
食物腐败(5天)
不同的化学反应进行的快慢千差万别,快与慢是相对而言的,
是一种定性的比较。
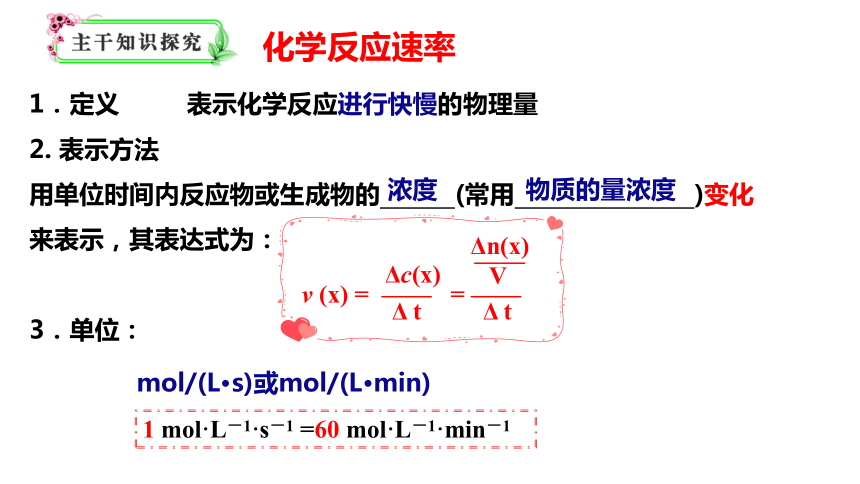
1.定义 表示化学反应进行快慢的物理量
2. 表示方法
用单位时间内反应物或生成物的 (常用 )变化
来表示,其表达式为:
3.单位:
化学反应速率
浓度
物质的量浓度
mol/(L·s)或mol/(L·min)
v (x) = —— = ——
Δc(x)
Δ t
Δ t
Δn(x)
V
——
1 mol·L-1·s-1 =60 mol·L-1·min-1
对化学反应速率的理解
(1)化学反应速率实际上指的是某物质在某一时间段内化学反应的平均速率,
而不是某一时刻的即时速率。均取正值.
(2)由于固体或纯液体,在一定温度下,单位体积内的物质的量保持不变,
即固体或纯液体的浓度是个常数,所以对于有纯液体或固体参与的化学反应
不能用纯液体或固体的浓度变化来表示化学反应速率。
(3)由于压强的变化对固体和液体的体积影响很小,故改变压强对它们的浓度影响很小,所以改变压强对无气体参与的反应的化学反应速率无影响。
(4)对于同一化学反应,在相同的反应时间内,用不同的物质来表示其反应速率,
其数值可能不同,但这些不同的数值表示的都是同一个反应的速率。因此,表示化学反应的速率时,必须指明是用反应体系中的哪种物质作依据。
4.化学反应速率的测定。
化学反应速率可以通过实验测定。可以用来测定的物理量除了物质的浓度之外,还可以是气体的体积、体系的压强、颜色的深浅、光的吸收、导电能力等。
对反应Zn+H2SO4═ZnSO4+H2↑,你可以用哪些方法测定该反应的化学反应速率
①测定收集一定体积的H2所用的时间;
②测定一段时间内溶液中H+浓度的变化;
③测定一段时间内锌粒质量的变化;等等。
5.影响化学反应速率的因素及影响结果
影响化学反应速率的因素 影响结果
内因 反应物的性质 在其他条件相同时,反应物的化学性质越活泼,化学反应速率越大;反应物的化学性质越不活泼,化学反应速率越小
外因 催化剂 在其他条件相同时,使用催化剂能极大地改变化学反应速率
温度 在其他条件相同时,升高温度,加快化学反应速率;
降低温度,减慢化学反应速率。
反应物的浓度 在其他条件相同时,增大反应物的浓度,加快化学反应速率;
减小反应物的浓度,减慢化学反应速率。
大量实验证明,温度每升高10℃,化学反应速率通常增大为原来的2~4倍。这表明温度对反应速率的影响非常显著.
影响化学反应速率的因素 影响结果
外 因 气态反应物的压强 在其他条件相同时,增大气态反应物的压强,加快化学反应速率;
减小气态反应物的压强,减慢化学反应速率。
固体反应物的表面积 在其他条件相同时,
增大固体反应物的表面积,加快化学反应速率;
减小固体反应物的表面积,减慢化学反应速率。
其他 光波、电磁波、超声波、溶剂等,也能影响化学反应速率
浓度对化学反应速率的影响。
当其他条件不变时,增大反应物浓度,反应速率增大;
减小反应物浓度,反应速率减小。
如果增大浓度改变了物质的性质,浓度对反应速率的影响规律不再适用。对于铁与稀硫酸的反应,适当增大稀硫酸的浓度,生成氢气的速率增大;
但使用浓硫酸与铁反应,将不再生成氢气,且铁发生钝化现象。
对于可逆反应,增大反应物浓度,正反应速率瞬间增大;在增大反应物浓度的瞬间生成物浓度不变,逆反应速率不变。但随着反应的进行,反应物浓度逐渐减小,生成物的浓度逐渐增大,故v(正)逐渐减小,而v(逆)逐渐增大,直到两者相等。此时v(正)、v(逆)都比原来大。
温度对反应速率的影响。
在通常情况下,当其他条件不变时,升高温度,化学反应速率增大;
降低温度,化学反应速率减小。
大量实验表明:温度每升高10 ℃,化学反应速率通常增大到原来的2~4倍。温度对反应速率的影响规律,对吸热反应、放热反应都适用,且不受反应物状态的限制。
对于可逆反应,
升温时,吸热方向的反应速率增大的程度大于放热方向的反应速率增大的程度;
降温时,吸热方向的反应速率减小的程度大于放热方向的反应速率减小的程度。
催化剂对化学反应速率的影响。
当其他条件不变时,使用催化剂,可以改变化学反应速率。
对于有催化剂的反应,反应温度要考虑催化剂的活性。对于生物酶催化反应,如果温度过高,酶失去活性,反应速率会减小。
能够增大化学反应速率的催化剂叫做正催化剂,
能够减小化学反应速率的催化剂叫做负催化剂。一般情况下所说的催化剂指正催化剂。
催化剂有选择性,不同的反应有不同的催化剂。
催化剂具有一定的活化温度,催化剂不同,活化温度不同。
对于可逆反应,催化剂可同等程度地改变正、逆反应速率。
催化剂不能改变反应物的转化率,也不能使本来不会发生的反应变为可能。
压强对化学反应速率的影响。
对于有气体参加的化学反应,通过改变反应容器的容积而导致压强变化,同时改变了反应物的浓度(如图所示),反应速率改变。
当其他条件不变时,增大压强,反应速率增大;减小压强,反应速率减小。
改变压强,对化学反应速率的影响的根本原因是引起浓度改变。
(1)增大压强,化学反应速率不一定增大。压强的变化对固体和液体的体积影响很小,
改变压强对它们的浓度影响很小,所以一般认为改变压强对没有气体参与的化学反应的反应速率无影响。
(2)在进行化学实验时,常把固体试剂溶于水配成溶液后再进行化学实验。
固体试剂溶于水后,在水分子的作用下,溶质被分散成单个分子或离子,
增加了反应物分子或离子之间的有效碰撞,反应速率增大。
(3)分析压强改变对化学反应速率的影响时,关键看气体反应物浓度是否有变化:
若气体反应物浓度有变化,化学反应速率一定改变;
若气体反应物浓度无变化,化学反应速率不改变。
同时要注意通常所说的增大压强是指压缩容积。
(1).通常情况下,为什么硫黄粉在空气中燃烧只能产生微弱的淡蓝色火焰,
而在纯氧气中燃烧更旺,产生明亮的蓝紫色火焰
纯氧气中,氧气的浓度大,化学反应速率大,相同时间内产生的热量多。
(2).实验室用过氧化氢溶液制取氧气时,为什么要加入少量MnO2
加入MnO2,可增大过氧化氢的分解速率,增大氧气的产生速率。
(3).比较Mg、Al的金属性时,可将同样大小的两块金属片分别与同体积、同浓度的盐酸反应,通过观察反应的剧烈程度来比较两者的金属性。实验中依据的原理是什么 采用了什么方法
Mg比Al的金属性强,与盐酸反应时产生氢气的速率大(反应剧烈)。
采用的是定性观察法。
把形状、大小相同的锌粒分别投入到
10 mL 1 mol·L-1的盐酸和20 mL 1 mol·L-1的盐酸中,
哪个反应速率较大
一样大。因为c(H+)相同,锌粒也完全相同。
已知影响化学反应速率的因素有温度、固体的表面积、反应物的状态、物质的浓度、催化剂等,可以通过控制这些因素来调控化学反应速率。实验室用30%左右的硫酸(约3.7 mol·L-1)与锌粒反应制取氢气。下列措施中不能增大制取氢气的化学反应速率的是( )
A.适当升高温度 B.改用98.3%的浓硫酸
C.将锌粒改为锌粉 D.寻找一种合适的催化剂并加入其中
B
化学反应速率的计算方法
2.关系式法:
化学反应速率之比=物质的量浓度变化之比
=物质的量变化之比
=化学计量数之比
D
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是 ( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
C
比较反应的快慢
同一化学反应速率用不同物质表示时数值可能不同,比较化学反应速率的快慢不能只看数值大小,而要进行一定的转化。
(1)原数值是用不同物质的变化表示的,应该换算成用同一种物质表示;
(2)单位不同的,应该换算成相同单位,然后再进行比较。
反应E+F=G在温度T1下进行,反应M+N=K在温度T2下进行,已知:T1>T2,
且E和F的浓度均大于M和N的浓度,则两者的反应速率 (填序号)。 A.前者大 B.后者大C.一样大 D.无法判断
D
同一反应
对于可逆反应A(g)+3B(g) 2C(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A.v(A)=0.5 mol/(L·min)
B.v(B)=1.2 mol/(L·min)
C.v(C)=0.4 mol/(L·min)
D.v(C)=1.1 mol/(L·min)
D
反应A(g)+3B(g) 2C(g)+2D(g)在四种不同情况下的反应速率,分别为
①vA=0.015 mol/(L·s)
②vB=0.06 mol/(L·s)
③vC=0.04 mol/(L·s)
④vD=2.7 mol/(L·min)
该反应的快慢顺序为______________________
④>③=②>①
vD=0.045 mol/(L·s)
把下列四种X溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到100 mL。此时,X与盐酸缓缓地进行反应,其中化学反应速率最大的是( )
A.10 ℃ 20 mL 3 mol·L-1的X溶液
B.20 ℃ 30 mL 2 mol·L-1的X溶液
C.20 ℃ 10 mL 4 mol·L-1的X溶液
D.10 ℃ 20 mL 2 mol·L-1的X溶液
B
用稀硫酸与过量锌粒反应制取氢气,欲增大化学反应速率而不改变生成氢气的量,下列措施不可行的是( )A.升高温度 B.滴加少量浓硫酸C.滴加少量硫酸铜溶液 D.改用等质量的锌粉
B
编号 金属 mol 酸的浓度及体积 反应温度/℃
A Mg, 0.1 6 mol·L-1硝酸 10 mL 60
B Mg, 0.1 3 mol·L-1 盐酸 10 mL 60
C Fe, 0.1 3 mol·L-1 盐酸 10 mL 60
D Mg, 0.1 3 mol·L-1硫酸 10 mL 60
下表是各组反应的反应物和反应温度,反应刚开始时,产生H2的速率最大的是( )
D
(6)改变温度会显著改变化学反应速率,所以温度对化学反应速率起决定作用。( )
(7)改变压强一定会改变化学反应速率。( )
(8)影响化学反应速率的因素只有浓度、温度、压强和催化剂。( )
判断正误,正确的画“√”,错误的画“×”。
(1)化学反应的快慢可以定性描述,也可以定量表示。( )
(2)化学反应速率通常用单位时间内某物质的浓度改变量表示,所以不能用固体物质表示。( )
(3)在同一个化学反应里,在某时间段内,用不同物质表示的化学反应速率一定不相等( )
(4)在同一个化学反应里,在某时间段内,用不同物质表示的化学反应速率之比等于其化学计量数之比。( )
(5)也可以用单位时间内某气体的体积变化量来表示化学反应速率 。( )
√
√
×
√
√
×
×
×
(8)化学反应速率是表示化学反应进行快慢程度的物理量。( )
(9)在同一个反应中,可以用反应物或生成物来表示反应速率。( )
(10)对同一个化学反应,用不同物质表示的化学反应速率,其数值越大,则表示的化学反应速率越大。( )
(7)工业生产如氨、硫酸、硝酸的合成中都使用了催化剂,其目的是增大反应速率,提高生产效率。( )
判断正误,正确的画“√”,错误的画“×”。
(1)对于任何化学反应,反应速率越大,反应现象越明显。( )
(2)化学反应速率为0.1 mol·(L·s)-1是指在第1s末某物质的物质的量浓度为0.1 mol·L-1。
(3)可用化学反应中的任意物质在某段时间内的浓度变化量来表示其反应速率。( )
(4)一般情况下,当其他条件不变时,增大反应物的浓度,反应速率增大。( )
(5)对于任何化学反应,反应速率越大越好。( )
(6)不同的金属与稀盐酸反应的快慢差别很大,这是由反应物本身的性质决定的。( )
×
×
×
√
×
√
√
√
√
×
(双选)10 mL 1 mol·L-1的盐酸与过量的锌粉反应,下列能减小反应速率但又不影响氢气生成总量的是( )A.加入少量K2SO4溶液B.加入少量CuSO4溶液C.加入少量Na2CO3固体D.加水
AD
可逆反应mA(g)+nB(g) pC(g)+gD(g)的v-t图像如图甲所示,若其他条件都不变,只是在反应前加入合适的正催化剂,则其v-t图像如图乙所示。①a1=a2 ②a1t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图乙中阴影部分面积更大。以上所述正确的组合为( )
A.②④⑤⑦
B.②④⑥⑧C.②③⑤⑦
D.①③⑥⑧
A
将固体NH4Br置于密闭容器中,在某温度下发生反应:NH4Br(s) NH3(g)+HBr(g), 2HBr(g) Br2(g)+H2(g),2 min后,测得H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )A.0.5 mol·L-1·min-1B.2.5 mol·L-1·min-1C.2 mol·L-1·min-1D.1.25 mol·L-1·min-1
B
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )
A.图1实验可通过定性观察产生气泡的快慢来比较反应速率的大小B.若图1所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间D.为检查图2装置的气密性,可关闭分液漏斗的活塞,将注射器活塞拉出一定距离到某处,
一段时间后松开活塞,若活塞仍在某处,说明装置气密性良好
BD
最后活塞回到原位置,说明装置气密性良好,若仍留在某处,说明装置漏气。
第1课时 化学反应速率和影响因素
第二章 化学反应速率与化学平衡
第一节 化学反应速率
1.知道化学反应速率的表示方法,能进行化学反应速率的简单计算。
2.能说出测定化学反应速率的简单方法 。
3.能通过实验探究,知道温度、浓度、压强和催化剂对化学反应速率的影响 。
课标定位素养阐释
电动车自燃(90秒)
食物腐败(5天)
不同的化学反应进行的快慢千差万别,快与慢是相对而言的,
是一种定性的比较。
1.定义 表示化学反应进行快慢的物理量
2. 表示方法
用单位时间内反应物或生成物的 (常用 )变化
来表示,其表达式为:
3.单位:
化学反应速率
浓度
物质的量浓度
mol/(L·s)或mol/(L·min)
v (x) = —— = ——
Δc(x)
Δ t
Δ t
Δn(x)
V
——
1 mol·L-1·s-1 =60 mol·L-1·min-1
对化学反应速率的理解
(1)化学反应速率实际上指的是某物质在某一时间段内化学反应的平均速率,
而不是某一时刻的即时速率。均取正值.
(2)由于固体或纯液体,在一定温度下,单位体积内的物质的量保持不变,
即固体或纯液体的浓度是个常数,所以对于有纯液体或固体参与的化学反应
不能用纯液体或固体的浓度变化来表示化学反应速率。
(3)由于压强的变化对固体和液体的体积影响很小,故改变压强对它们的浓度影响很小,所以改变压强对无气体参与的反应的化学反应速率无影响。
(4)对于同一化学反应,在相同的反应时间内,用不同的物质来表示其反应速率,
其数值可能不同,但这些不同的数值表示的都是同一个反应的速率。因此,表示化学反应的速率时,必须指明是用反应体系中的哪种物质作依据。
4.化学反应速率的测定。
化学反应速率可以通过实验测定。可以用来测定的物理量除了物质的浓度之外,还可以是气体的体积、体系的压强、颜色的深浅、光的吸收、导电能力等。
对反应Zn+H2SO4═ZnSO4+H2↑,你可以用哪些方法测定该反应的化学反应速率
①测定收集一定体积的H2所用的时间;
②测定一段时间内溶液中H+浓度的变化;
③测定一段时间内锌粒质量的变化;等等。
5.影响化学反应速率的因素及影响结果
影响化学反应速率的因素 影响结果
内因 反应物的性质 在其他条件相同时,反应物的化学性质越活泼,化学反应速率越大;反应物的化学性质越不活泼,化学反应速率越小
外因 催化剂 在其他条件相同时,使用催化剂能极大地改变化学反应速率
温度 在其他条件相同时,升高温度,加快化学反应速率;
降低温度,减慢化学反应速率。
反应物的浓度 在其他条件相同时,增大反应物的浓度,加快化学反应速率;
减小反应物的浓度,减慢化学反应速率。
大量实验证明,温度每升高10℃,化学反应速率通常增大为原来的2~4倍。这表明温度对反应速率的影响非常显著.
影响化学反应速率的因素 影响结果
外 因 气态反应物的压强 在其他条件相同时,增大气态反应物的压强,加快化学反应速率;
减小气态反应物的压强,减慢化学反应速率。
固体反应物的表面积 在其他条件相同时,
增大固体反应物的表面积,加快化学反应速率;
减小固体反应物的表面积,减慢化学反应速率。
其他 光波、电磁波、超声波、溶剂等,也能影响化学反应速率
浓度对化学反应速率的影响。
当其他条件不变时,增大反应物浓度,反应速率增大;
减小反应物浓度,反应速率减小。
如果增大浓度改变了物质的性质,浓度对反应速率的影响规律不再适用。对于铁与稀硫酸的反应,适当增大稀硫酸的浓度,生成氢气的速率增大;
但使用浓硫酸与铁反应,将不再生成氢气,且铁发生钝化现象。
对于可逆反应,增大反应物浓度,正反应速率瞬间增大;在增大反应物浓度的瞬间生成物浓度不变,逆反应速率不变。但随着反应的进行,反应物浓度逐渐减小,生成物的浓度逐渐增大,故v(正)逐渐减小,而v(逆)逐渐增大,直到两者相等。此时v(正)、v(逆)都比原来大。
温度对反应速率的影响。
在通常情况下,当其他条件不变时,升高温度,化学反应速率增大;
降低温度,化学反应速率减小。
大量实验表明:温度每升高10 ℃,化学反应速率通常增大到原来的2~4倍。温度对反应速率的影响规律,对吸热反应、放热反应都适用,且不受反应物状态的限制。
对于可逆反应,
升温时,吸热方向的反应速率增大的程度大于放热方向的反应速率增大的程度;
降温时,吸热方向的反应速率减小的程度大于放热方向的反应速率减小的程度。
催化剂对化学反应速率的影响。
当其他条件不变时,使用催化剂,可以改变化学反应速率。
对于有催化剂的反应,反应温度要考虑催化剂的活性。对于生物酶催化反应,如果温度过高,酶失去活性,反应速率会减小。
能够增大化学反应速率的催化剂叫做正催化剂,
能够减小化学反应速率的催化剂叫做负催化剂。一般情况下所说的催化剂指正催化剂。
催化剂有选择性,不同的反应有不同的催化剂。
催化剂具有一定的活化温度,催化剂不同,活化温度不同。
对于可逆反应,催化剂可同等程度地改变正、逆反应速率。
催化剂不能改变反应物的转化率,也不能使本来不会发生的反应变为可能。
压强对化学反应速率的影响。
对于有气体参加的化学反应,通过改变反应容器的容积而导致压强变化,同时改变了反应物的浓度(如图所示),反应速率改变。
当其他条件不变时,增大压强,反应速率增大;减小压强,反应速率减小。
改变压强,对化学反应速率的影响的根本原因是引起浓度改变。
(1)增大压强,化学反应速率不一定增大。压强的变化对固体和液体的体积影响很小,
改变压强对它们的浓度影响很小,所以一般认为改变压强对没有气体参与的化学反应的反应速率无影响。
(2)在进行化学实验时,常把固体试剂溶于水配成溶液后再进行化学实验。
固体试剂溶于水后,在水分子的作用下,溶质被分散成单个分子或离子,
增加了反应物分子或离子之间的有效碰撞,反应速率增大。
(3)分析压强改变对化学反应速率的影响时,关键看气体反应物浓度是否有变化:
若气体反应物浓度有变化,化学反应速率一定改变;
若气体反应物浓度无变化,化学反应速率不改变。
同时要注意通常所说的增大压强是指压缩容积。
(1).通常情况下,为什么硫黄粉在空气中燃烧只能产生微弱的淡蓝色火焰,
而在纯氧气中燃烧更旺,产生明亮的蓝紫色火焰
纯氧气中,氧气的浓度大,化学反应速率大,相同时间内产生的热量多。
(2).实验室用过氧化氢溶液制取氧气时,为什么要加入少量MnO2
加入MnO2,可增大过氧化氢的分解速率,增大氧气的产生速率。
(3).比较Mg、Al的金属性时,可将同样大小的两块金属片分别与同体积、同浓度的盐酸反应,通过观察反应的剧烈程度来比较两者的金属性。实验中依据的原理是什么 采用了什么方法
Mg比Al的金属性强,与盐酸反应时产生氢气的速率大(反应剧烈)。
采用的是定性观察法。
把形状、大小相同的锌粒分别投入到
10 mL 1 mol·L-1的盐酸和20 mL 1 mol·L-1的盐酸中,
哪个反应速率较大
一样大。因为c(H+)相同,锌粒也完全相同。
已知影响化学反应速率的因素有温度、固体的表面积、反应物的状态、物质的浓度、催化剂等,可以通过控制这些因素来调控化学反应速率。实验室用30%左右的硫酸(约3.7 mol·L-1)与锌粒反应制取氢气。下列措施中不能增大制取氢气的化学反应速率的是( )
A.适当升高温度 B.改用98.3%的浓硫酸
C.将锌粒改为锌粉 D.寻找一种合适的催化剂并加入其中
B
化学反应速率的计算方法
2.关系式法:
化学反应速率之比=物质的量浓度变化之比
=物质的量变化之比
=化学计量数之比
D
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是 ( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
C
比较反应的快慢
同一化学反应速率用不同物质表示时数值可能不同,比较化学反应速率的快慢不能只看数值大小,而要进行一定的转化。
(1)原数值是用不同物质的变化表示的,应该换算成用同一种物质表示;
(2)单位不同的,应该换算成相同单位,然后再进行比较。
反应E+F=G在温度T1下进行,反应M+N=K在温度T2下进行,已知:T1>T2,
且E和F的浓度均大于M和N的浓度,则两者的反应速率 (填序号)。 A.前者大 B.后者大C.一样大 D.无法判断
D
同一反应
对于可逆反应A(g)+3B(g) 2C(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A.v(A)=0.5 mol/(L·min)
B.v(B)=1.2 mol/(L·min)
C.v(C)=0.4 mol/(L·min)
D.v(C)=1.1 mol/(L·min)
D
反应A(g)+3B(g) 2C(g)+2D(g)在四种不同情况下的反应速率,分别为
①vA=0.015 mol/(L·s)
②vB=0.06 mol/(L·s)
③vC=0.04 mol/(L·s)
④vD=2.7 mol/(L·min)
该反应的快慢顺序为______________________
④>③=②>①
vD=0.045 mol/(L·s)
把下列四种X溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到100 mL。此时,X与盐酸缓缓地进行反应,其中化学反应速率最大的是( )
A.10 ℃ 20 mL 3 mol·L-1的X溶液
B.20 ℃ 30 mL 2 mol·L-1的X溶液
C.20 ℃ 10 mL 4 mol·L-1的X溶液
D.10 ℃ 20 mL 2 mol·L-1的X溶液
B
用稀硫酸与过量锌粒反应制取氢气,欲增大化学反应速率而不改变生成氢气的量,下列措施不可行的是( )A.升高温度 B.滴加少量浓硫酸C.滴加少量硫酸铜溶液 D.改用等质量的锌粉
B
编号 金属 mol 酸的浓度及体积 反应温度/℃
A Mg, 0.1 6 mol·L-1硝酸 10 mL 60
B Mg, 0.1 3 mol·L-1 盐酸 10 mL 60
C Fe, 0.1 3 mol·L-1 盐酸 10 mL 60
D Mg, 0.1 3 mol·L-1硫酸 10 mL 60
下表是各组反应的反应物和反应温度,反应刚开始时,产生H2的速率最大的是( )
D
(6)改变温度会显著改变化学反应速率,所以温度对化学反应速率起决定作用。( )
(7)改变压强一定会改变化学反应速率。( )
(8)影响化学反应速率的因素只有浓度、温度、压强和催化剂。( )
判断正误,正确的画“√”,错误的画“×”。
(1)化学反应的快慢可以定性描述,也可以定量表示。( )
(2)化学反应速率通常用单位时间内某物质的浓度改变量表示,所以不能用固体物质表示。( )
(3)在同一个化学反应里,在某时间段内,用不同物质表示的化学反应速率一定不相等( )
(4)在同一个化学反应里,在某时间段内,用不同物质表示的化学反应速率之比等于其化学计量数之比。( )
(5)也可以用单位时间内某气体的体积变化量来表示化学反应速率 。( )
√
√
×
√
√
×
×
×
(8)化学反应速率是表示化学反应进行快慢程度的物理量。( )
(9)在同一个反应中,可以用反应物或生成物来表示反应速率。( )
(10)对同一个化学反应,用不同物质表示的化学反应速率,其数值越大,则表示的化学反应速率越大。( )
(7)工业生产如氨、硫酸、硝酸的合成中都使用了催化剂,其目的是增大反应速率,提高生产效率。( )
判断正误,正确的画“√”,错误的画“×”。
(1)对于任何化学反应,反应速率越大,反应现象越明显。( )
(2)化学反应速率为0.1 mol·(L·s)-1是指在第1s末某物质的物质的量浓度为0.1 mol·L-1。
(3)可用化学反应中的任意物质在某段时间内的浓度变化量来表示其反应速率。( )
(4)一般情况下,当其他条件不变时,增大反应物的浓度,反应速率增大。( )
(5)对于任何化学反应,反应速率越大越好。( )
(6)不同的金属与稀盐酸反应的快慢差别很大,这是由反应物本身的性质决定的。( )
×
×
×
√
×
√
√
√
√
×
(双选)10 mL 1 mol·L-1的盐酸与过量的锌粉反应,下列能减小反应速率但又不影响氢气生成总量的是( )A.加入少量K2SO4溶液B.加入少量CuSO4溶液C.加入少量Na2CO3固体D.加水
AD
可逆反应mA(g)+nB(g) pC(g)+gD(g)的v-t图像如图甲所示,若其他条件都不变,只是在反应前加入合适的正催化剂,则其v-t图像如图乙所示。①a1=a2 ②a1
A.②④⑤⑦
B.②④⑥⑧C.②③⑤⑦
D.①③⑥⑧
A
将固体NH4Br置于密闭容器中,在某温度下发生反应:NH4Br(s) NH3(g)+HBr(g), 2HBr(g) Br2(g)+H2(g),2 min后,测得H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )A.0.5 mol·L-1·min-1B.2.5 mol·L-1·min-1C.2 mol·L-1·min-1D.1.25 mol·L-1·min-1
B
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )
A.图1实验可通过定性观察产生气泡的快慢来比较反应速率的大小B.若图1所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间D.为检查图2装置的气密性,可关闭分液漏斗的活塞,将注射器活塞拉出一定距离到某处,
一段时间后松开活塞,若活塞仍在某处,说明装置气密性良好
BD
最后活塞回到原位置,说明装置气密性良好,若仍留在某处,说明装置漏气。
