2.2.1氯气的性质汇报课课件(共18张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.1氯气的性质汇报课课件(共18张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 497.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-26 15:17:39 | ||
图片预览


文档简介
(共18张PPT)
氯气的性质
1
氯气的物理性质
2
氯气的化学性质
3
氯气的用途
目录
CONTENTS
氯气的物理性质
PART ONE
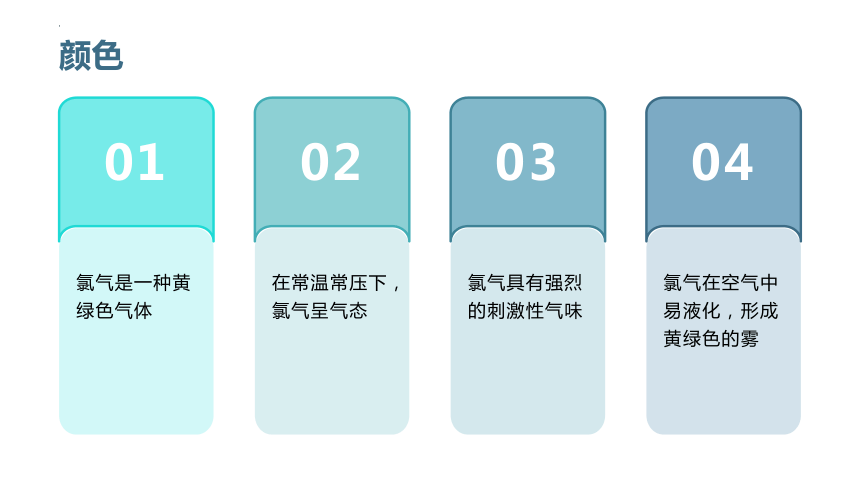
颜色
01
02
03
04
氯气是一种黄绿色气体
在常温常压下,氯气呈气态
氯气具有强烈的刺激性气味
氯气在空气中易液化,形成黄绿色的雾
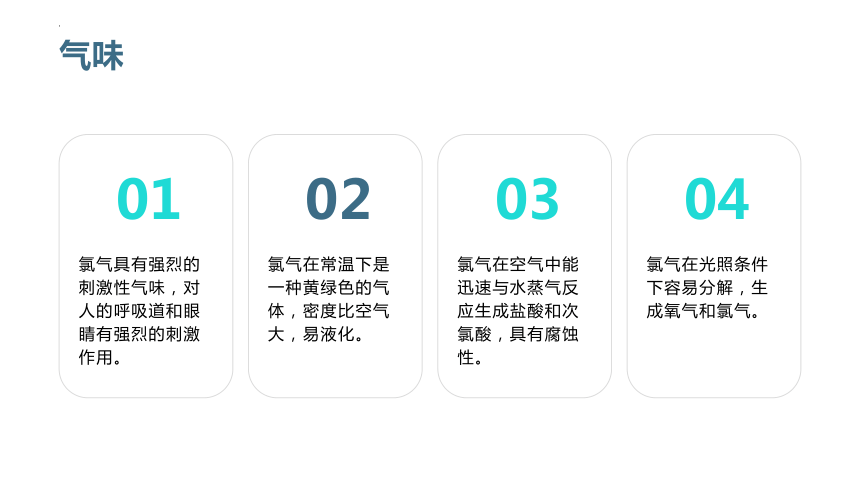
气味
氯气具有强烈的刺激性气味,对人的呼吸道和眼睛有强烈的刺激作用。
氯气在常温下是一种黄绿色的气体,密度比空气大,易液化。
01
02
氯气在空气中能迅速与水蒸气反应生成盐酸和次氯酸,具有腐蚀性。
03
氯气在光照条件下容易分解,生成氧气和氯气。
04
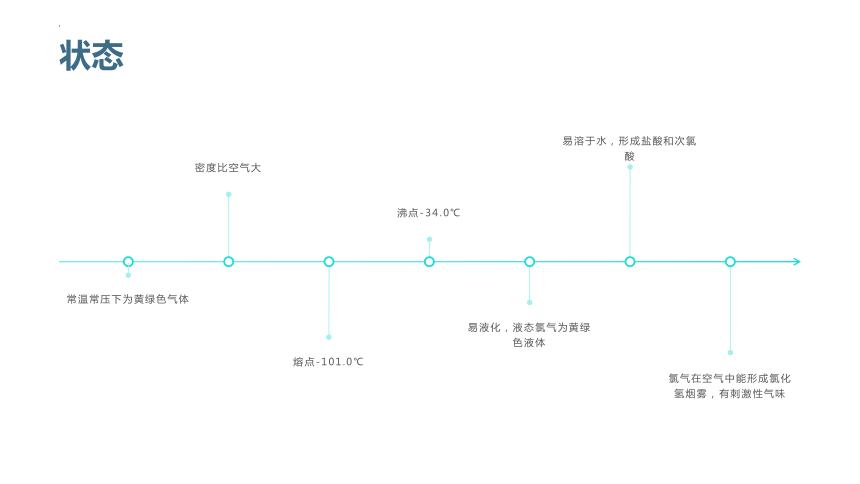
状态
熔点-101.0℃
易液化,液态氯气为黄绿色液体
氯气在空气中能形成氯化氢烟雾,有刺激性气味
常温常压下为黄绿色气体
密度比空气大
易溶于水,形成盐酸和次氯酸
沸点-34.0℃
水溶性
04
03
氯气在水中的溶解度:1:2
01
氯气在水中的溶解速度:快速溶解
02
氯气在水中的溶解热:释放热量
氯气在水中的溶解平衡:与温度、压力有关
氯气的化学性质
PART TWO
与金属反应
与铜反应:生成氯化铜,释放出大量的热
与镁反应:生成氯化镁,释放出大量的热
与银反应:生成氯化银,释放出大量的热
与铂反应:生成氯化铂,释放出大量的热
与铅反应:生成氯化铅,释放出大量的热
与铁反应:生成氯化铁,释放出大量的热
与铝反应:生成氯化铝,释放出大量的热
与锌反应:生成氯化锌,释放出大量的热
与金反应:生成氯化金,释放出大量的热
与汞反应:生成氯化汞,释放出大量的热
与非金属反应
01
与氢气反应:生成氯化氢气体
05
与有机物反应:生成氯代烃等有机氯化物
03
与水反应:生成盐酸和次氯酸
02
与氧气反应:生成氯气
04
与碱反应:生成氯化物和次氯酸盐
与金属反应:生成金属氯化物,如氯化钠等
06
与水反应
氯气与水反应生成盐酸和次氯酸
反应方程式:Cl2 + H2O → HCl + HClO
次氯酸具有强氧化性,能杀菌消毒
盐酸具有腐蚀性,需小心处理
与碱反应
氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水
氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水
氯气与氨水反应生成氯化铵、次氯酸铵和水
氯气与氢氧化钾反应生成氯化钾、次氯酸钾和水
氯气的用途
PART THREE
消毒
01
02
03
04
氯气是一种有效的消毒剂,能够杀死多种细菌、病毒和真菌。
氯气常用于饮用水的消毒,确保饮用水的安全。
氯气也可以用于游泳池、医院、食品加工厂等场所的消毒。
氯气消毒的优点是快速、高效,但需要注意安全,避免过量使用。
漂白
添加标题
添加标题
添加标题
添加标题
氯气常用于纺织工业的漂白处理
氯气是一种强氧化剂,具有漂白作用
氯气也可以用于纸张、皮革等材料的漂白
氯气漂白效果显著,但需要注意安全防护,避免对人体和环境造成伤害
工业用途
化学合成:用于合成有机氯化合物,如聚氯乙烯、氯丁橡胶等
冶金工业:用于金属表面处理,如电镀、酸洗等
电子工业:用于半导体、集成电路等电子元件的清洗和蚀刻
氯碱工业:用于生产氯碱、盐酸、氢氧化钠等化学品
漂白剂:用于纺织、造纸、食品等行业的漂白处理
消毒剂:用于饮用水、游泳池、医疗设施等的消毒
实验室用途
01
02
03
04
消毒剂:氯气是一种有效的消毒剂,可以杀死细菌、病毒等微生物。
氧化剂:氯气具有强氧化性,可以用于氧化还原反应,如将亚铁离子氧化为铁离子。
催化剂:氯气可以用作催化剂,如用于合成聚氯乙烯等高分子材料。
气体分析:氯气可以用于气体分析,如检测空气中的氯气含量。
THANK YOU
氯气的性质
1
氯气的物理性质
2
氯气的化学性质
3
氯气的用途
目录
CONTENTS
氯气的物理性质
PART ONE
颜色
01
02
03
04
氯气是一种黄绿色气体
在常温常压下,氯气呈气态
氯气具有强烈的刺激性气味
氯气在空气中易液化,形成黄绿色的雾
气味
氯气具有强烈的刺激性气味,对人的呼吸道和眼睛有强烈的刺激作用。
氯气在常温下是一种黄绿色的气体,密度比空气大,易液化。
01
02
氯气在空气中能迅速与水蒸气反应生成盐酸和次氯酸,具有腐蚀性。
03
氯气在光照条件下容易分解,生成氧气和氯气。
04
状态
熔点-101.0℃
易液化,液态氯气为黄绿色液体
氯气在空气中能形成氯化氢烟雾,有刺激性气味
常温常压下为黄绿色气体
密度比空气大
易溶于水,形成盐酸和次氯酸
沸点-34.0℃
水溶性
04
03
氯气在水中的溶解度:1:2
01
氯气在水中的溶解速度:快速溶解
02
氯气在水中的溶解热:释放热量
氯气在水中的溶解平衡:与温度、压力有关
氯气的化学性质
PART TWO
与金属反应
与铜反应:生成氯化铜,释放出大量的热
与镁反应:生成氯化镁,释放出大量的热
与银反应:生成氯化银,释放出大量的热
与铂反应:生成氯化铂,释放出大量的热
与铅反应:生成氯化铅,释放出大量的热
与铁反应:生成氯化铁,释放出大量的热
与铝反应:生成氯化铝,释放出大量的热
与锌反应:生成氯化锌,释放出大量的热
与金反应:生成氯化金,释放出大量的热
与汞反应:生成氯化汞,释放出大量的热
与非金属反应
01
与氢气反应:生成氯化氢气体
05
与有机物反应:生成氯代烃等有机氯化物
03
与水反应:生成盐酸和次氯酸
02
与氧气反应:生成氯气
04
与碱反应:生成氯化物和次氯酸盐
与金属反应:生成金属氯化物,如氯化钠等
06
与水反应
氯气与水反应生成盐酸和次氯酸
反应方程式:Cl2 + H2O → HCl + HClO
次氯酸具有强氧化性,能杀菌消毒
盐酸具有腐蚀性,需小心处理
与碱反应
氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水
氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水
氯气与氨水反应生成氯化铵、次氯酸铵和水
氯气与氢氧化钾反应生成氯化钾、次氯酸钾和水
氯气的用途
PART THREE
消毒
01
02
03
04
氯气是一种有效的消毒剂,能够杀死多种细菌、病毒和真菌。
氯气常用于饮用水的消毒,确保饮用水的安全。
氯气也可以用于游泳池、医院、食品加工厂等场所的消毒。
氯气消毒的优点是快速、高效,但需要注意安全,避免过量使用。
漂白
添加标题
添加标题
添加标题
添加标题
氯气常用于纺织工业的漂白处理
氯气是一种强氧化剂,具有漂白作用
氯气也可以用于纸张、皮革等材料的漂白
氯气漂白效果显著,但需要注意安全防护,避免对人体和环境造成伤害
工业用途
化学合成:用于合成有机氯化合物,如聚氯乙烯、氯丁橡胶等
冶金工业:用于金属表面处理,如电镀、酸洗等
电子工业:用于半导体、集成电路等电子元件的清洗和蚀刻
氯碱工业:用于生产氯碱、盐酸、氢氧化钠等化学品
漂白剂:用于纺织、造纸、食品等行业的漂白处理
消毒剂:用于饮用水、游泳池、医疗设施等的消毒
实验室用途
01
02
03
04
消毒剂:氯气是一种有效的消毒剂,可以杀死细菌、病毒等微生物。
氧化剂:氯气具有强氧化性,可以用于氧化还原反应,如将亚铁离子氧化为铁离子。
催化剂:氯气可以用作催化剂,如用于合成聚氯乙烯等高分子材料。
气体分析:氯气可以用于气体分析,如检测空气中的氯气含量。
THANK YOU
