3.1.3 电离平衡常数课件(共21张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.1.3 电离平衡常数课件(共21张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-26 00:00:00 | ||
图片预览







文档简介
(共21张PPT)
第2讲 电离平衡常数
新人教版 化学 选择性必修一
第三章 水溶液中的离子反应与平衡
第一节 电离平衡
复习导入
K=
mA(g) + nB(g) pC(g) + qD(g)
化学平衡常数(K值)越大,反应进行的程度________.
问题:怎样定量的比较弱电解质的电离程度相对大小呢?
越大
参照化学平衡常数,思考交流
(1)你认为什么是电离平衡常数?
(2)电离平衡常数表示什么意义?
(3)在一定的温度下,电离平衡常数越大,说明弱电解质的电离程度越 ,弱酸的酸性越 (或弱碱的碱性越 )
(4)影响电离平衡常数的因素是什么?
强
强
大
温度……
写出醋酸的电离方程式,并写出该电离方程式的平衡常数表达式。
【写一写】
K=
c(CH3COO )·c(H+)
c(CH3COOH)
这个常数叫做电离平衡常数,简称电离常数。
CH3COOH H+ + CH3COO
1.概念
在一定条件下,当弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的 ,与溶液中 之比是一个常数,这个常数叫做电离平衡常数,简称电离常数。
各种离子浓度的乘积
未电离分子的浓度
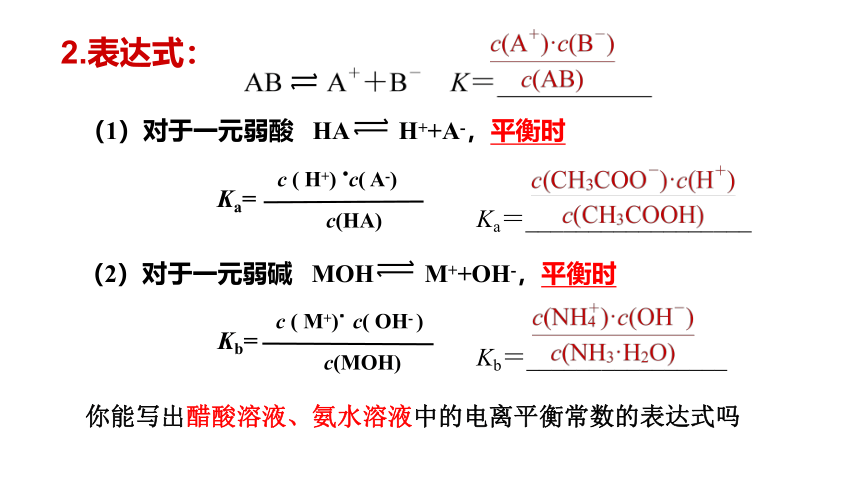
(1)对于一元弱酸 HA H++A-,平衡时
Ka=
c ( H+) .c( A-)
c(HA)
(2)对于一元弱碱 MOH M++OH-,平衡时
Kb=
c ( M+).c( OH- )
c(MOH)
2.表达式:
你能写出醋酸溶液、氨水溶液中的电离平衡常数的表达式吗
Ka=__________________
Kb=________________
多元弱酸的电离是分步进行的,每步各有电离常数,通常用K1、K2、K3等来分别表示。例如H3PO4的电离:
(3)多元弱酸的分步电离
(主要)
(弱)
(极弱)
K1
=7.1×10-3
=6.3×10-8
=4.2×10-13
K2
K3
当Ka1 >>Ka2 时,计算多元弱酸中的c(H+)
或比较多元弱酸酸性的相对强弱时
通常只考虑第一步电离
多元弱酸的酸性主要由第一步决定
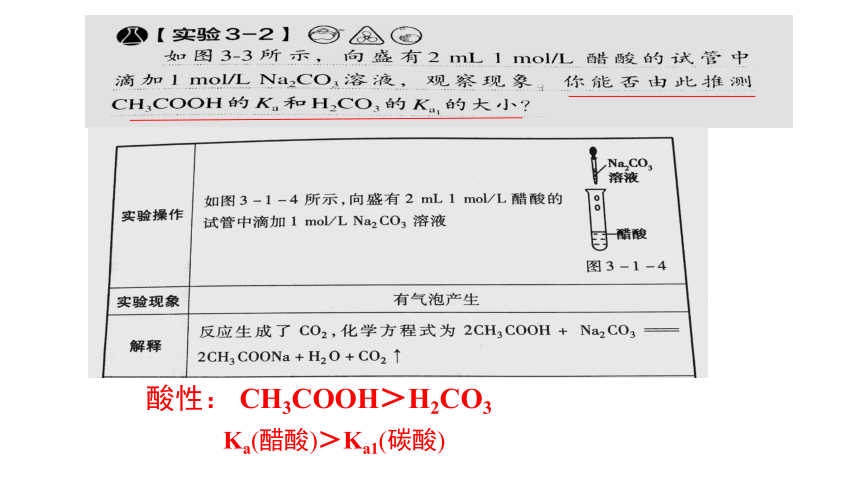
酸性: CH3COOH>H2CO3
Ka(醋酸)>Ka1(碳酸)
电离平衡常数:Ka(醋酸)=1.75×10-5
Ka1(碳酸)=4.5×10-7
Ka(醋酸)>Ka1(碳酸)
25℃时
【实验结论】
查阅课本P125
在相同条件下,弱酸的电离常数越大,酸性越强。
电离平衡常数的意义
3.意义
表示弱电解质的电离能力。一定温度下,电离常数越大,弱电解质的电离程度越 ,酸(或碱)性越 。
4.电离常数的影响因素
(1)内因:同一温度下,不同的弱电解质的电离常数 ,说明电离常数首先由弱电解质的 ______ 所决定。
(2)外因:对于同一弱电解质,电离平衡常数只与 有关,由于电离为_____过程,所以电离平衡常数随 而增大。
大
强
不同
本身的性质
温度
吸热
温度升高
5、电离常数的计算
【例】在某温度时,溶质的物质的量浓度为0.2mol·L-1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10-3 mol·L-1,试计算该温度下NH3·H2O的电离常数(Kb)。
【解】NH3·H2O的电离方程式及有关粒子的浓度如下:
NH3·H2O NH4+ + OH-
起始浓度/(mol·L-1 )
变化浓度/(mol·L-1 )
平衡浓度/(mol·L-1 )
0.2
0
0
1.7×10-3
1.7×10-3
1.7×10-3
1.7×10-3
1.7×10-3
0.2-1.7×10-3
c(NH3·H2O)=(0.2-1.7×10-3)mol·L-1≈0.2mol·L-1
Kb=
c(NH4+)·c(OH-)
c(NH3·H2O)
=
(1.7×10-3)·(1.7×10-3)
0.2
≈1.4×10-5
【答】该温度下NH3·H2O的电离常数约为1.4×10-5。
1.利用“三段式”求Ka或Kb
例:25 ℃ a mol·L-1的CH3COOH
CH3COOH CH3COO-+H+
起始浓度/mol·L-1 a 0 0
变化浓度/mol·L-1 x x x
平衡浓度/mol·L-1 a-x x x
注意 由于弱电解质的电离程度比较小,平衡时弱电解质的浓度(a-x) mol·L-1一般近似为a mol·L-1。
1.利用“三段式”求Ka或Kb
【例】已知25℃下,醋酸溶液中存在下述关系:c(H+)·c(CH3COO)/c(CH3COOH)=1.75×10-5其中的数值是该温度下醋酸的电离平衡常数。试回答下述问题:
(1)当向该溶液中加入一定量的盐酸时,上式中的数值 (填增大、减小、不变),理由是 。
温度不变,弱电解质的电离平衡常数不变
不变
(2)若醋酸的起始浓度为0.010mol/L,平衡时氢离子浓度c(H+)
是 (提示:醋酸的电离常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.010mol/L。)
4.18×10-4mol/L
【解析】(2)设电离平衡时H+物质的量浓度为x
因醋酸的电离程度很小,故0.010-x≈0.010
0.010
0
0
0.010-x
x
x
即 x2/0.010=1.75×10-5
x=4.18×10-4mol/L
K=
=1.75×10-5
x2
0.010-x
=
CH3COOH CH3COO-+H+
c(始)
c(平)
c(H+) ·c(CH3COO-)
c(CH3COOH)
c(转)
x
x
x
1、比较弱电解质酸性(或碱性)强弱
弱酸 电离常数
CH3COOH
H2CO3
H2C2O4
H3PO4
1.75×10-5
K1=4.5×10-7
K2=4.7×10-11
K1=5.0×10-2
K2=5.4×10-5
K1=7.1×10-3
K2=6.3×10-8
K3=4.2×10-13
→几种弱酸的电离平衡常数(25℃)
草酸>磷酸>醋酸>碳酸
比较上表中四种酸的酸性强弱:
查阅课本P125
二、电离常数的应用
一定温度下,电离常数越大,弱电解质的电离程度越 大 ,酸(或碱)性越 强 。
二、电离常数的应用
课堂练习
已知某温度下,Ka(HCN)=6.2×10-10、Ka(HF)=6.8×10-4、Ka(CH3COOH)=1.8×10-5、Ka(HNO2)=6.4×10-6。该温度下,物质的量浓度都为0.1 mol·L-1的下列物质的溶液中,c(H+)由大到小的顺序是( )
A.HCN>HNO2>CH3COOH>HF
B.HCN>CH3COOH>HF>HNO2
C.HF>CH3COOH>HNO2>HCN
D.CH3COOH>HCN>HF>HNO2
C
K越小,其电离程度越小,c(H+)越小,则酸性越弱
2、
2、
二、电离常数的应用
3.比较弱电解质中微粒浓度比值的变化。
依据弱电解质的电离常数表达式,可以比较浓度改变时(温度不变)溶液中某些微粒浓度的变化。
eg:醋酸溶液中加水稀释过程中 是如何变化的
加水稀释,K值不变,c(H+)减小,则 始终保持增大。
二、电离常数的应用
常温下,将0.1 mol·L-1的CH3COOH溶液加水稀释,请填写下列表达式的数值变化情况(填“变大”“变小”或“不变”)。
课堂练习
c(H+)
c(CH3COOH)
(1)
c(CH3COOH)
c(CH3COO )· c(H+)
(2)
c(CH3COOH)
c(CH3COO-)
(3)
变小
不变
变大
二、电离常数的应用
4.比较离子结合质子的能力大小
弱酸的Ka值越小,酸性越弱,酸根阴离子结合H+的能力就越强。
弱酸 HCOOH H2S H2CO3 HClO
(25 ℃) K=1.77×10-4 K1=1.3×10-7 K2=7.1×10-15 K1=4.4×10-7 K2=4.7×10-11 3.0×10-8
(1)HCOOH、H2S、H2CO3、HClO的酸性由强到弱的顺序为
___________________________________。
(2)同浓度的HCOO-、HS-、S2-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为_______________________________________________
HCOOH>H2CO3>H2S>HClO
S2->CO32->ClO->HS->HCO3->HCOO-
2.根据表中提供的数据,判断下列离子方程式或化学方程式书写正确的是
化学式 HClO H2CO3
电离常数/mol·L-1 K=3×10-8 K1=4×10-7 K2=4×10-11
A.向Na2CO3溶液中滴加少量氯水:CO32-+2Cl2+H2O=2Cl-+2HClO+CO2↑
B.向NaHCO3溶液中滴加少量氯水:2HCO3-+Cl2=Cl-+ClO-+2CO2↑+H2O
C.向NaClO溶液中通入少量CO2:CO2+H2O+NaClO = NaHCO3 + HClO
D.向NaClO溶液中通入过量CO2:CO2+2NaClO+H2O = Na2CO3 + 2HClO
酸性:H2CO3>HClO>HCO3-
二、电离常数的计算及应用
4.利用电离平衡常数判断反应能否发生
HCO3-
NaHCO3
电离平衡常数的应用
(1)根据电离平衡常数可以判断弱酸(或弱碱)的相对强弱,相同条件下,电离平衡常数越大,酸性(或碱性)越强。
(2)根据浓度商Q与电离平衡常数K的相对大小判断电离平衡的移动方向。
(3)根据电离平衡常数判断溶液中微粒浓度比值的变化情况。
返回
方法指导
(4)利用电离平衡常数判断反应能否发生
第2讲 电离平衡常数
新人教版 化学 选择性必修一
第三章 水溶液中的离子反应与平衡
第一节 电离平衡
复习导入
K=
mA(g) + nB(g) pC(g) + qD(g)
化学平衡常数(K值)越大,反应进行的程度________.
问题:怎样定量的比较弱电解质的电离程度相对大小呢?
越大
参照化学平衡常数,思考交流
(1)你认为什么是电离平衡常数?
(2)电离平衡常数表示什么意义?
(3)在一定的温度下,电离平衡常数越大,说明弱电解质的电离程度越 ,弱酸的酸性越 (或弱碱的碱性越 )
(4)影响电离平衡常数的因素是什么?
强
强
大
温度……
写出醋酸的电离方程式,并写出该电离方程式的平衡常数表达式。
【写一写】
K=
c(CH3COO )·c(H+)
c(CH3COOH)
这个常数叫做电离平衡常数,简称电离常数。
CH3COOH H+ + CH3COO
1.概念
在一定条件下,当弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的 ,与溶液中 之比是一个常数,这个常数叫做电离平衡常数,简称电离常数。
各种离子浓度的乘积
未电离分子的浓度
(1)对于一元弱酸 HA H++A-,平衡时
Ka=
c ( H+) .c( A-)
c(HA)
(2)对于一元弱碱 MOH M++OH-,平衡时
Kb=
c ( M+).c( OH- )
c(MOH)
2.表达式:
你能写出醋酸溶液、氨水溶液中的电离平衡常数的表达式吗
Ka=__________________
Kb=________________
多元弱酸的电离是分步进行的,每步各有电离常数,通常用K1、K2、K3等来分别表示。例如H3PO4的电离:
(3)多元弱酸的分步电离
(主要)
(弱)
(极弱)
K1
=7.1×10-3
=6.3×10-8
=4.2×10-13
K2
K3
当Ka1 >>Ka2 时,计算多元弱酸中的c(H+)
或比较多元弱酸酸性的相对强弱时
通常只考虑第一步电离
多元弱酸的酸性主要由第一步决定
酸性: CH3COOH>H2CO3
Ka(醋酸)>Ka1(碳酸)
电离平衡常数:Ka(醋酸)=1.75×10-5
Ka1(碳酸)=4.5×10-7
Ka(醋酸)>Ka1(碳酸)
25℃时
【实验结论】
查阅课本P125
在相同条件下,弱酸的电离常数越大,酸性越强。
电离平衡常数的意义
3.意义
表示弱电解质的电离能力。一定温度下,电离常数越大,弱电解质的电离程度越 ,酸(或碱)性越 。
4.电离常数的影响因素
(1)内因:同一温度下,不同的弱电解质的电离常数 ,说明电离常数首先由弱电解质的 ______ 所决定。
(2)外因:对于同一弱电解质,电离平衡常数只与 有关,由于电离为_____过程,所以电离平衡常数随 而增大。
大
强
不同
本身的性质
温度
吸热
温度升高
5、电离常数的计算
【例】在某温度时,溶质的物质的量浓度为0.2mol·L-1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10-3 mol·L-1,试计算该温度下NH3·H2O的电离常数(Kb)。
【解】NH3·H2O的电离方程式及有关粒子的浓度如下:
NH3·H2O NH4+ + OH-
起始浓度/(mol·L-1 )
变化浓度/(mol·L-1 )
平衡浓度/(mol·L-1 )
0.2
0
0
1.7×10-3
1.7×10-3
1.7×10-3
1.7×10-3
1.7×10-3
0.2-1.7×10-3
c(NH3·H2O)=(0.2-1.7×10-3)mol·L-1≈0.2mol·L-1
Kb=
c(NH4+)·c(OH-)
c(NH3·H2O)
=
(1.7×10-3)·(1.7×10-3)
0.2
≈1.4×10-5
【答】该温度下NH3·H2O的电离常数约为1.4×10-5。
1.利用“三段式”求Ka或Kb
例:25 ℃ a mol·L-1的CH3COOH
CH3COOH CH3COO-+H+
起始浓度/mol·L-1 a 0 0
变化浓度/mol·L-1 x x x
平衡浓度/mol·L-1 a-x x x
注意 由于弱电解质的电离程度比较小,平衡时弱电解质的浓度(a-x) mol·L-1一般近似为a mol·L-1。
1.利用“三段式”求Ka或Kb
【例】已知25℃下,醋酸溶液中存在下述关系:c(H+)·c(CH3COO)/c(CH3COOH)=1.75×10-5其中的数值是该温度下醋酸的电离平衡常数。试回答下述问题:
(1)当向该溶液中加入一定量的盐酸时,上式中的数值 (填增大、减小、不变),理由是 。
温度不变,弱电解质的电离平衡常数不变
不变
(2)若醋酸的起始浓度为0.010mol/L,平衡时氢离子浓度c(H+)
是 (提示:醋酸的电离常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.010mol/L。)
4.18×10-4mol/L
【解析】(2)设电离平衡时H+物质的量浓度为x
因醋酸的电离程度很小,故0.010-x≈0.010
0.010
0
0
0.010-x
x
x
即 x2/0.010=1.75×10-5
x=4.18×10-4mol/L
K=
=1.75×10-5
x2
0.010-x
=
CH3COOH CH3COO-+H+
c(始)
c(平)
c(H+) ·c(CH3COO-)
c(CH3COOH)
c(转)
x
x
x
1、比较弱电解质酸性(或碱性)强弱
弱酸 电离常数
CH3COOH
H2CO3
H2C2O4
H3PO4
1.75×10-5
K1=4.5×10-7
K2=4.7×10-11
K1=5.0×10-2
K2=5.4×10-5
K1=7.1×10-3
K2=6.3×10-8
K3=4.2×10-13
→几种弱酸的电离平衡常数(25℃)
草酸>磷酸>醋酸>碳酸
比较上表中四种酸的酸性强弱:
查阅课本P125
二、电离常数的应用
一定温度下,电离常数越大,弱电解质的电离程度越 大 ,酸(或碱)性越 强 。
二、电离常数的应用
课堂练习
已知某温度下,Ka(HCN)=6.2×10-10、Ka(HF)=6.8×10-4、Ka(CH3COOH)=1.8×10-5、Ka(HNO2)=6.4×10-6。该温度下,物质的量浓度都为0.1 mol·L-1的下列物质的溶液中,c(H+)由大到小的顺序是( )
A.HCN>HNO2>CH3COOH>HF
B.HCN>CH3COOH>HF>HNO2
C.HF>CH3COOH>HNO2>HCN
D.CH3COOH>HCN>HF>HNO2
C
K越小,其电离程度越小,c(H+)越小,则酸性越弱
2、
2、
二、电离常数的应用
3.比较弱电解质中微粒浓度比值的变化。
依据弱电解质的电离常数表达式,可以比较浓度改变时(温度不变)溶液中某些微粒浓度的变化。
eg:醋酸溶液中加水稀释过程中 是如何变化的
加水稀释,K值不变,c(H+)减小,则 始终保持增大。
二、电离常数的应用
常温下,将0.1 mol·L-1的CH3COOH溶液加水稀释,请填写下列表达式的数值变化情况(填“变大”“变小”或“不变”)。
课堂练习
c(H+)
c(CH3COOH)
(1)
c(CH3COOH)
c(CH3COO )· c(H+)
(2)
c(CH3COOH)
c(CH3COO-)
(3)
变小
不变
变大
二、电离常数的应用
4.比较离子结合质子的能力大小
弱酸的Ka值越小,酸性越弱,酸根阴离子结合H+的能力就越强。
弱酸 HCOOH H2S H2CO3 HClO
(25 ℃) K=1.77×10-4 K1=1.3×10-7 K2=7.1×10-15 K1=4.4×10-7 K2=4.7×10-11 3.0×10-8
(1)HCOOH、H2S、H2CO3、HClO的酸性由强到弱的顺序为
___________________________________。
(2)同浓度的HCOO-、HS-、S2-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为_______________________________________________
HCOOH>H2CO3>H2S>HClO
S2->CO32->ClO->HS->HCO3->HCOO-
2.根据表中提供的数据,判断下列离子方程式或化学方程式书写正确的是
化学式 HClO H2CO3
电离常数/mol·L-1 K=3×10-8 K1=4×10-7 K2=4×10-11
A.向Na2CO3溶液中滴加少量氯水:CO32-+2Cl2+H2O=2Cl-+2HClO+CO2↑
B.向NaHCO3溶液中滴加少量氯水:2HCO3-+Cl2=Cl-+ClO-+2CO2↑+H2O
C.向NaClO溶液中通入少量CO2:CO2+H2O+NaClO = NaHCO3 + HClO
D.向NaClO溶液中通入过量CO2:CO2+2NaClO+H2O = Na2CO3 + 2HClO
酸性:H2CO3>HClO>HCO3-
二、电离常数的计算及应用
4.利用电离平衡常数判断反应能否发生
HCO3-
NaHCO3
电离平衡常数的应用
(1)根据电离平衡常数可以判断弱酸(或弱碱)的相对强弱,相同条件下,电离平衡常数越大,酸性(或碱性)越强。
(2)根据浓度商Q与电离平衡常数K的相对大小判断电离平衡的移动方向。
(3)根据电离平衡常数判断溶液中微粒浓度比值的变化情况。
返回
方法指导
(4)利用电离平衡常数判断反应能否发生
