3.3.2盐类水解的影响因素及其应用 课件(19张) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.3.2盐类水解的影响因素及其应用 课件(19张) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 8.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-26 15:38:28 | ||
图片预览






文档简介
(共19张PPT)
第三章 水溶液中的离子反应与平衡
第2课时
第三节 盐类的水解
CHEMICAL REACTION RATE AND CHEMICAL EQUILIBRIUM
第三章
新课导入
纯碱溶液可用于清洗油污
为什么用纯碱溶液去油污而不用小苏打呢?
用热水溶解的纯碱溶液去污效果更好,这是为什么?
酸的电离常数越小,则该强碱弱酸盐越_______水解,其水解程度_______,溶液的_______越强。
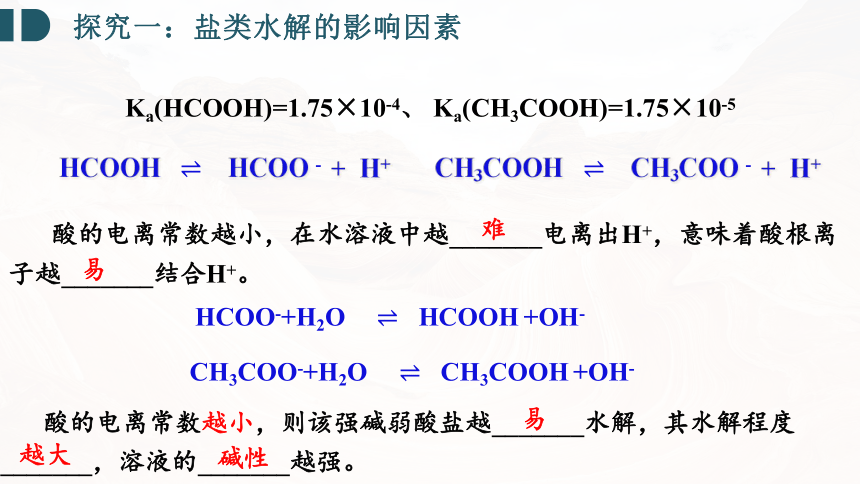
探究一:盐类水解的影响因素
Ka(HCOOH)=1.75×10-4、 Ka(CH3COOH)=1.75×10-5
酸的电离常数越小,在水溶液中越_______电离出H+,意味着酸根离子越_______结合H+。
难
易
碱性
CH3COOH CH3COO - + H+
HCOOH HCOO - + H+
HCOO-+H2O HCOOH +OH-
CH3COO-+H2O CH3COOH +OH-
越大
易
探究一:盐类水解的影响因素
酸(或碱)越弱,其对应的弱酸阴离子(或弱碱阳离子)的水解程度越大,溶液的碱性(或酸性)越强,即越弱越水解
外因:反应条件
内因:盐的性质
盐类水解程度的大小
(主要因素)
探究一:盐类水解的影响因素
反应条件对FeCl3水解平衡的影响
1、FeCl3溶液呈酸性还是碱性?原因是 (用离子方程式表示)。
呈酸性
Fe3+ + 3H2O Fe(OH)3 + 3H+
2、盐类水解反应是吸热还是放热?
酸 + 碱 盐 + 水
中和
水解
吸热
谁强显谁性
3、影响盐类水解平衡的因素有哪些?
探究一:盐类水解的影响因素
升温,水解平衡正向移动,盐的水解程度增大
盐类水解是吸热反应
温度对水解平衡的影响
Fe3+ + 3H2O Fe(OH)3 + 3H+
应用:
热的纯碱溶液更易去油污
探究一:盐类水解的影响因素
浓度对水解平衡的影响
改变溶液pH,如何影响水解平衡?
Na2CO3溶液:CO32- + H2O HCO3- + OH—
HCO3- + H2O H2CO3 + OH—
加入NaOH固体
滴加盐酸溶液
应用:
FeCl3溶液、CuSO4溶液的配制
加入相应的酸,抑制水解
将FeCl3晶体直接溶于蒸馏水中,为什么制得的液体会出现丁达尔效应?
探究一:盐类水解的影响因素
浓度对水解平衡的影响
自来水
自来水+10 mL饱和明矾溶液
明矾具有净水作用
Al3+ + 3H2O Al(OH)3 + 3H+
加水稀释促进水解
(胶体)
探究一:盐类水解的影响因素
浓度、温度对水解平衡的共同影响
将硫酸铜溶液中加入到热水中,现象?
越稀越水解
越热越水解
回忆:氢氧化铁胶体如何制备?
方法:向沸水中逐滴加入5~6滴饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热。
Fe3+ + 3H2O Fe(OH)3 + 3H+
(胶体)
出现沉淀
思考与讨论
外界条件 移动方向 如何解释
加入NaHCO3固体
加入AlCl3固体
加入NaCl固体
加入金属Na
逆向
改变外界条件后,FeCl3水解平衡反应向什么方向移动?为什么?
Fe3+ + 3H2O Fe(OH)3 + 3H+
正向
增大生成物浓度,平衡逆向移动。
减小生成物浓度,平衡正向移动。
不移动
不改变参与水解的离子浓度。
正向
减小生成物浓度,平衡正向移动。
同性相抑,异性相促
随堂练习
【例题1】向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )
A、减小、增大、减小
B、增大、减小、减小
C、减小、增大、增大
D、增大、减小、增大
随堂练习
【例题2】
(1)同温度下,等浓度的四种盐溶液中c(NH4+)由大到小的顺序是 (填字母)。(HA为弱酸)
A.NH4HSO4 B.NH4A C.(NH4)2SO4 D.NH4Cl
(2)泡沬灭火器在使用时将Al2(SO4)3和NaHCO3的浓溶液混合,请用离子方程式表示其灭火原理: 。
(3)解释草木灰(碳酸钾)不能与铵态氮肥混合使用的原因 。
C>A>D>B
Al3++3=Al(OH)3 ↓+3CO2↑
碳酸根和铵根在一定条件发生双水解,生成二氧化碳和氨气,影响肥效
探究一:盐类水解的影响因素
NH4+ + H2O NH3 H2O+H+
Fe3+ + 3H2O Fe(OH)3 + 3H+
Cu2+ + 2H2O Cu(OH)2 + 2H+
同温度、同浓度时,3种微粒的水解程度?
电荷是阳离子水解最重要的影响因素。
水解程度:M+ < M2+ < M3+ < M4+
探究一:盐类水解的影响因素
水解程度:M+ < M2+ < M3+ < M4+
应用:
胶体的制备
水解程度不同,氢氧化物颗粒的大小不同
铝盐(明矾)、铁盐做净水剂
无机化合物的制备:TiCl4制备TiO2、SnCl2制备SnO2
K2FeO4净水的双重作用
探究一:盐类水解的影响因素
水解程度:M+ < M2+ < M3+ < M4+
应用:
从MCln溶液中如何得到MCln固体?
NH4Cl溶液
NH4Cl固体
蒸发浓缩,冷却结晶
探究一:盐类水解的影响因素
水解程度:M+ < M2+ < M3+ < M4+
应用:
从MCln溶液中如何得到MCln固体?
MgCl2溶液
无水MgCl2
蒸发浓缩,冷却结晶
MgCl2 6H2O
在HCl气流中加热,或与SOCl2共热
探究一:盐类水解的影响因素
水解程度:M+ < M2+ < M3+ < M4+
应用:
从MCln溶液中如何得到MCln固体?
AlCl3溶液
Al2O3
蒸发浓缩,冷却结晶
Al(OH)3
加热灼烧
AlCl3·H2O
在HCl气流中或滴加浓盐酸后,
蒸发浓缩,冷却结晶
探究一:盐类水解的影响因素
水解程度:M+ < M2+ < M3+ < M4+
应用:
从MCln溶液中如何得到MCln固体?
从M2(SO4)n溶液中如何得到M2(SO4)n固体?
基本都能得到无水盐
HCl挥发促进水解
随堂练习
【例题3】下列物质的水溶液经加热浓缩、蒸干、灼烧后仍能得到原物质的是( )
AlCl3
Ca(HCO3)2
Na2SO4
Na2SO3
FeCl3
C
第三章 水溶液中的离子反应与平衡
第2课时
第三节 盐类的水解
CHEMICAL REACTION RATE AND CHEMICAL EQUILIBRIUM
第三章
新课导入
纯碱溶液可用于清洗油污
为什么用纯碱溶液去油污而不用小苏打呢?
用热水溶解的纯碱溶液去污效果更好,这是为什么?
酸的电离常数越小,则该强碱弱酸盐越_______水解,其水解程度_______,溶液的_______越强。
探究一:盐类水解的影响因素
Ka(HCOOH)=1.75×10-4、 Ka(CH3COOH)=1.75×10-5
酸的电离常数越小,在水溶液中越_______电离出H+,意味着酸根离子越_______结合H+。
难
易
碱性
CH3COOH CH3COO - + H+
HCOOH HCOO - + H+
HCOO-+H2O HCOOH +OH-
CH3COO-+H2O CH3COOH +OH-
越大
易
探究一:盐类水解的影响因素
酸(或碱)越弱,其对应的弱酸阴离子(或弱碱阳离子)的水解程度越大,溶液的碱性(或酸性)越强,即越弱越水解
外因:反应条件
内因:盐的性质
盐类水解程度的大小
(主要因素)
探究一:盐类水解的影响因素
反应条件对FeCl3水解平衡的影响
1、FeCl3溶液呈酸性还是碱性?原因是 (用离子方程式表示)。
呈酸性
Fe3+ + 3H2O Fe(OH)3 + 3H+
2、盐类水解反应是吸热还是放热?
酸 + 碱 盐 + 水
中和
水解
吸热
谁强显谁性
3、影响盐类水解平衡的因素有哪些?
探究一:盐类水解的影响因素
升温,水解平衡正向移动,盐的水解程度增大
盐类水解是吸热反应
温度对水解平衡的影响
Fe3+ + 3H2O Fe(OH)3 + 3H+
应用:
热的纯碱溶液更易去油污
探究一:盐类水解的影响因素
浓度对水解平衡的影响
改变溶液pH,如何影响水解平衡?
Na2CO3溶液:CO32- + H2O HCO3- + OH—
HCO3- + H2O H2CO3 + OH—
加入NaOH固体
滴加盐酸溶液
应用:
FeCl3溶液、CuSO4溶液的配制
加入相应的酸,抑制水解
将FeCl3晶体直接溶于蒸馏水中,为什么制得的液体会出现丁达尔效应?
探究一:盐类水解的影响因素
浓度对水解平衡的影响
自来水
自来水+10 mL饱和明矾溶液
明矾具有净水作用
Al3+ + 3H2O Al(OH)3 + 3H+
加水稀释促进水解
(胶体)
探究一:盐类水解的影响因素
浓度、温度对水解平衡的共同影响
将硫酸铜溶液中加入到热水中,现象?
越稀越水解
越热越水解
回忆:氢氧化铁胶体如何制备?
方法:向沸水中逐滴加入5~6滴饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热。
Fe3+ + 3H2O Fe(OH)3 + 3H+
(胶体)
出现沉淀
思考与讨论
外界条件 移动方向 如何解释
加入NaHCO3固体
加入AlCl3固体
加入NaCl固体
加入金属Na
逆向
改变外界条件后,FeCl3水解平衡反应向什么方向移动?为什么?
Fe3+ + 3H2O Fe(OH)3 + 3H+
正向
增大生成物浓度,平衡逆向移动。
减小生成物浓度,平衡正向移动。
不移动
不改变参与水解的离子浓度。
正向
减小生成物浓度,平衡正向移动。
同性相抑,异性相促
随堂练习
【例题1】向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )
A、减小、增大、减小
B、增大、减小、减小
C、减小、增大、增大
D、增大、减小、增大
随堂练习
【例题2】
(1)同温度下,等浓度的四种盐溶液中c(NH4+)由大到小的顺序是 (填字母)。(HA为弱酸)
A.NH4HSO4 B.NH4A C.(NH4)2SO4 D.NH4Cl
(2)泡沬灭火器在使用时将Al2(SO4)3和NaHCO3的浓溶液混合,请用离子方程式表示其灭火原理: 。
(3)解释草木灰(碳酸钾)不能与铵态氮肥混合使用的原因 。
C>A>D>B
Al3++3=Al(OH)3 ↓+3CO2↑
碳酸根和铵根在一定条件发生双水解,生成二氧化碳和氨气,影响肥效
探究一:盐类水解的影响因素
NH4+ + H2O NH3 H2O+H+
Fe3+ + 3H2O Fe(OH)3 + 3H+
Cu2+ + 2H2O Cu(OH)2 + 2H+
同温度、同浓度时,3种微粒的水解程度?
电荷是阳离子水解最重要的影响因素。
水解程度:M+ < M2+ < M3+ < M4+
探究一:盐类水解的影响因素
水解程度:M+ < M2+ < M3+ < M4+
应用:
胶体的制备
水解程度不同,氢氧化物颗粒的大小不同
铝盐(明矾)、铁盐做净水剂
无机化合物的制备:TiCl4制备TiO2、SnCl2制备SnO2
K2FeO4净水的双重作用
探究一:盐类水解的影响因素
水解程度:M+ < M2+ < M3+ < M4+
应用:
从MCln溶液中如何得到MCln固体?
NH4Cl溶液
NH4Cl固体
蒸发浓缩,冷却结晶
探究一:盐类水解的影响因素
水解程度:M+ < M2+ < M3+ < M4+
应用:
从MCln溶液中如何得到MCln固体?
MgCl2溶液
无水MgCl2
蒸发浓缩,冷却结晶
MgCl2 6H2O
在HCl气流中加热,或与SOCl2共热
探究一:盐类水解的影响因素
水解程度:M+ < M2+ < M3+ < M4+
应用:
从MCln溶液中如何得到MCln固体?
AlCl3溶液
Al2O3
蒸发浓缩,冷却结晶
Al(OH)3
加热灼烧
AlCl3·H2O
在HCl气流中或滴加浓盐酸后,
蒸发浓缩,冷却结晶
探究一:盐类水解的影响因素
水解程度:M+ < M2+ < M3+ < M4+
应用:
从MCln溶液中如何得到MCln固体?
从M2(SO4)n溶液中如何得到M2(SO4)n固体?
基本都能得到无水盐
HCl挥发促进水解
随堂练习
【例题3】下列物质的水溶液经加热浓缩、蒸干、灼烧后仍能得到原物质的是( )
AlCl3
Ca(HCO3)2
Na2SO4
Na2SO3
FeCl3
C
