1.3.2氧化剂和还原剂课件(共19张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.2氧化剂和还原剂课件(共19张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-26 15:26:28 | ||
图片预览



文档简介
(共19张PPT)
第2课时 氧化剂和还原剂
第一章 第三节 氧化还原反应
单击此处
添加文档标题
氧化还原反应
01
复习回顾
02
氧化还原反应:
凡是有元素化合价升降的反应,都是氧化还原反应。
03
判断依据:
元素化合价的升降
04
本质:
电子的转移(电子得失和偏移)
05
口诀:
口诀:
升—失—氧(被氧化,氧化反应)
降—得—还(被还原,还原反应)
复习回顾
4、电子转移的表示方法:
双线桥:
单线桥:
1、标价态
2、连双线
(从反应物指向生成物的同一元素)
3、注得失
1、标价态
2、连单线
(反应物中,升高元素指向降低元素
3、注数目
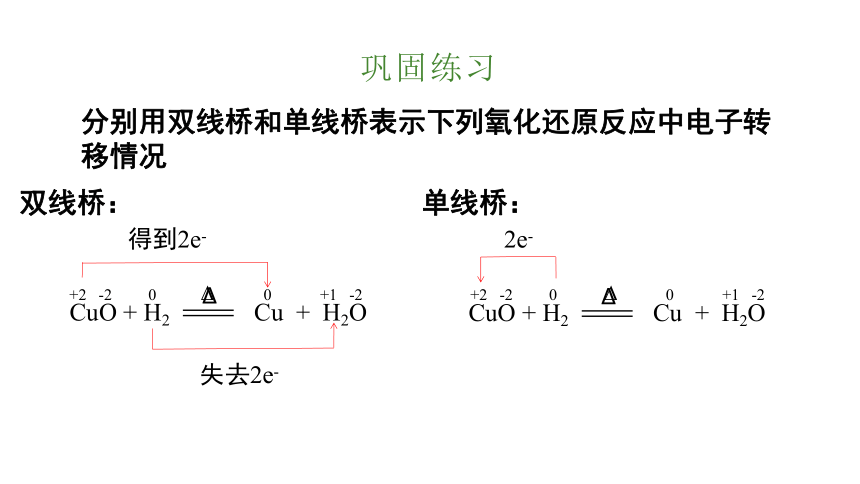
巩固练习
分别用双线桥和单线桥表示下列氧化还原反应中电子转移情况
双线桥:
单线桥:
+2 -2 0 0 +1 -2
得到2e-
失去2e-
+2 -2 0 0 +1 -2
2e-
CuO + H2
Cu + H2O
CuO + H2
Cu + H2O
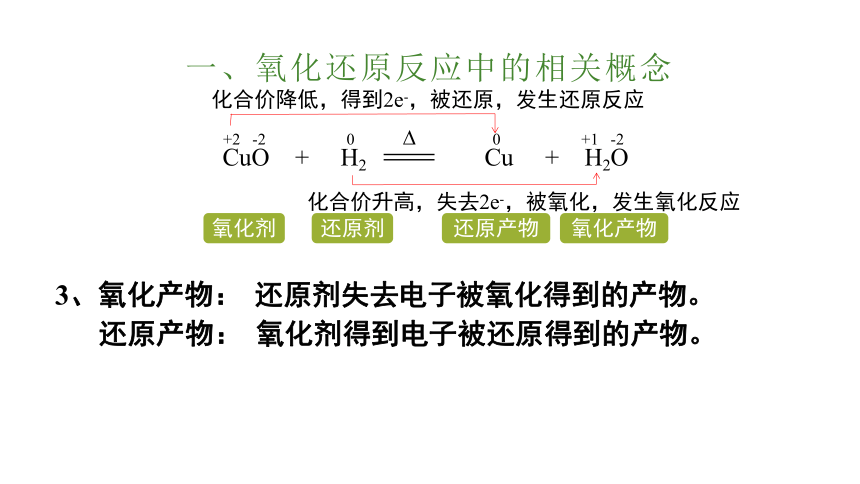
一、氧化还原反应中的相关概念
1、氧化剂:
得到电子(电子对偏向)化合价降低的反应物。
还原剂:
失去电子(电子对偏离)化合价升高的反应物。
2、氧化性:
物质得电子的能力。
还原性:
物质失电子的能力。
CuO + H2
Cu + H2O
+2 -2 0 0 +1 -2
化合价降低,得到2e-,被还原,发生还原反应
化合价升高,失去2e-,被氧化,发生氧化反应
氧化剂
还原剂
氧化剂具有氧化性。
还原剂具有还原性。
一、氧化还原反应中的相关概念
3、氧化产物:
还原剂失去电子被氧化得到的产物。
还原产物:
氧化剂得到电子被还原得到的产物。
CuO + H2
Cu + H2O
+2 -2 0 0 +1 -2
化合价降低,得到2e-,被还原,发生还原反应
化合价升高,失去2e-,被氧化,发生氧化反应
氧化剂
还原剂
氧化产物
还原产物
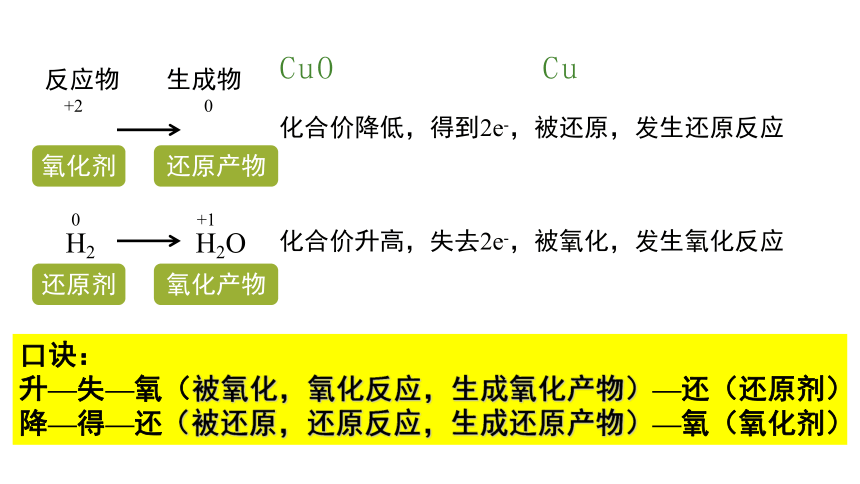
CuO Cu
反应物
生成物
化合价降低,得到2e-,被还原,发生还原反应
化合价升高,失去2e-,被氧化,发生氧化反应
氧化剂
+2 0
H2 H2O
0 +1
还原剂
还原产物
氧化产物
口诀:
升—失—氧(被氧化,氧化反应,生成氧化产物)—还(还原剂)
降—得—还(被还原,还原反应,生成还原产物)—氧(氧化剂)
巩固练习
1、某国外化学教材中有一张关于氧化还原反应的插图:
由图可知,
在该反应中是( )
A、氧化剂 B、还原剂 C、氧化产物 D、还原产物
化合物A
失电子
化合物B
得电子
B
氧化剂
还原剂
氧化产物
还原产物
Zn + H2SO4 ===== ZnSO4 + H2 ↑
0 +1 +2 0
还原剂
氧化剂
氧化产物
还原产物
2KClO3 ===== 2KCl + 3O2 ↑
+5 -2 -1 0
既是还原剂,又是氧化剂
还原产物
氧化产物
2、指出下列反应中的氧化剂、还原剂、氧化产物和还原产物
C + O2 ===== CO2
0 0 +4 -2
还原剂
氧化剂
是氧化产物
点燃
MnO2
又是还原产物
1、标价态
2、找变化元素,明价态变化
3、口诀判断
4、氧化剂和还原剂的关系
氧化剂
还原剂
单线桥:
CuO + H2
Cu + H2O
+2 -2 0 0 +1 -2
2e-
失电子数=得电子数=转移电子数
=化合价升高(降低)数×原子数
1、Cu+2FeCl3 === 2FeCl2+CuCl2 反应中, 失去电子被氧化,
是还原剂, 是氧化剂被还原,发生还原反应,
转移的电子数 ;
Cu
FeCl3
Cu
2e-
0 +3 +2 +2
2e-
巩固练习
2、分析下列变化过程是氧化还是还原,再填空:
(1)Fe →FeCl2是( )反应,需加( )剂
(2)CuO→ Cu是( )反应,需加( )剂
氧化
还原
氧化
还原
0 +2
+2 0
二、常见的氧化剂和还原剂
氧化剂 还原剂
活泼非金属单质:O2、Cl2 活泼金属单质:Al、Zn、Fe
某些非金属单质:H2、C
变价元素的高价态化合物: KMnO4、FeCl3、HNO3、浓硫酸 变价元素较低价态的化合物:
CO、KI、FeSO4
物质中所含元素的化合价高低与物质的氧化性、还原性有什么关系?
交流探讨
物质中所含元素的化合价高低与物质的氧化性、还原性有什么关系?
FeCl3
FeSO4
Fe
所含Fe化合价
0
+2
+3
总结:
最高价态
中间价态
最低价态
只有还原性
既有氧化性
又有还原性
只有氧化性
巩固练习
下列物质只具有氧化性的是( );只具有还原性的是( );即具有氧化性又具有还原性的是( )。
A. SO2 B. Fe3+ C. Cl2 D. Al E. F2
BE
D
AC
三、根据氧化还原方程式判断物质氧化性还原性强弱
在氧化还原反应中:
氧化剂具有较强的氧化性,还原剂具有较强的还原性;
氧化产物具有较弱的氧化性,还原产物具有较弱的还原性。
因此
氧化性:
氧化剂﹥氧化产物
还原性:
还原剂﹥还原产物
特点:比什么性,找什么剂,产物之性小于剂。
根据下列反应判断H2SO3 、 I- 、 Fe2+ 、 NO的还原性
由强到弱的顺序是 。
H2SO3 + I2 + H2O = 2HI + H2SO4
2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2
3FeCl2 + 4HNO3 = 2FeCl3 + NO↑ + 2H2O + Fe(NO3)3
H2SO3 > I- > Fe2+ > NO
+4 0 -1 +6
(H2SO3 > I-)
+3 -1 +2 0
( I- > Fe2+ )
+2 +5 +3 +2 +3
(Fe2+ > NO)
巩固练习
氧化剂
还原剂
氧化产物
还原产物
还原剂
还原产物
还原产物
还原剂
课堂小结
口诀:
升—失—氧(被氧化,氧化反应,生成氧化产物)—还(还原剂)
降—得—还(被还原,还原反应,生成还原产物)—氧(氧化剂)
氧化剂 + 还原剂 =====
还原产物 + 氧化产物
化合价降低,得电子,被还原,发生还原反应
化合价升高,失电子,被氧化,发生氧化反应
2、氧化性、还原性和元素化合价之间的关系
3、根据氧化还原方程式判断物质氧化性还原性强弱
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
特点:比什么性,找什么剂,产物之性小于剂。
第2课时 氧化剂和还原剂
第一章 第三节 氧化还原反应
单击此处
添加文档标题
氧化还原反应
01
复习回顾
02
氧化还原反应:
凡是有元素化合价升降的反应,都是氧化还原反应。
03
判断依据:
元素化合价的升降
04
本质:
电子的转移(电子得失和偏移)
05
口诀:
口诀:
升—失—氧(被氧化,氧化反应)
降—得—还(被还原,还原反应)
复习回顾
4、电子转移的表示方法:
双线桥:
单线桥:
1、标价态
2、连双线
(从反应物指向生成物的同一元素)
3、注得失
1、标价态
2、连单线
(反应物中,升高元素指向降低元素
3、注数目
巩固练习
分别用双线桥和单线桥表示下列氧化还原反应中电子转移情况
双线桥:
单线桥:
+2 -2 0 0 +1 -2
得到2e-
失去2e-
+2 -2 0 0 +1 -2
2e-
CuO + H2
Cu + H2O
CuO + H2
Cu + H2O
一、氧化还原反应中的相关概念
1、氧化剂:
得到电子(电子对偏向)化合价降低的反应物。
还原剂:
失去电子(电子对偏离)化合价升高的反应物。
2、氧化性:
物质得电子的能力。
还原性:
物质失电子的能力。
CuO + H2
Cu + H2O
+2 -2 0 0 +1 -2
化合价降低,得到2e-,被还原,发生还原反应
化合价升高,失去2e-,被氧化,发生氧化反应
氧化剂
还原剂
氧化剂具有氧化性。
还原剂具有还原性。
一、氧化还原反应中的相关概念
3、氧化产物:
还原剂失去电子被氧化得到的产物。
还原产物:
氧化剂得到电子被还原得到的产物。
CuO + H2
Cu + H2O
+2 -2 0 0 +1 -2
化合价降低,得到2e-,被还原,发生还原反应
化合价升高,失去2e-,被氧化,发生氧化反应
氧化剂
还原剂
氧化产物
还原产物
CuO Cu
反应物
生成物
化合价降低,得到2e-,被还原,发生还原反应
化合价升高,失去2e-,被氧化,发生氧化反应
氧化剂
+2 0
H2 H2O
0 +1
还原剂
还原产物
氧化产物
口诀:
升—失—氧(被氧化,氧化反应,生成氧化产物)—还(还原剂)
降—得—还(被还原,还原反应,生成还原产物)—氧(氧化剂)
巩固练习
1、某国外化学教材中有一张关于氧化还原反应的插图:
由图可知,
在该反应中是( )
A、氧化剂 B、还原剂 C、氧化产物 D、还原产物
化合物A
失电子
化合物B
得电子
B
氧化剂
还原剂
氧化产物
还原产物
Zn + H2SO4 ===== ZnSO4 + H2 ↑
0 +1 +2 0
还原剂
氧化剂
氧化产物
还原产物
2KClO3 ===== 2KCl + 3O2 ↑
+5 -2 -1 0
既是还原剂,又是氧化剂
还原产物
氧化产物
2、指出下列反应中的氧化剂、还原剂、氧化产物和还原产物
C + O2 ===== CO2
0 0 +4 -2
还原剂
氧化剂
是氧化产物
点燃
MnO2
又是还原产物
1、标价态
2、找变化元素,明价态变化
3、口诀判断
4、氧化剂和还原剂的关系
氧化剂
还原剂
单线桥:
CuO + H2
Cu + H2O
+2 -2 0 0 +1 -2
2e-
失电子数=得电子数=转移电子数
=化合价升高(降低)数×原子数
1、Cu+2FeCl3 === 2FeCl2+CuCl2 反应中, 失去电子被氧化,
是还原剂, 是氧化剂被还原,发生还原反应,
转移的电子数 ;
Cu
FeCl3
Cu
2e-
0 +3 +2 +2
2e-
巩固练习
2、分析下列变化过程是氧化还是还原,再填空:
(1)Fe →FeCl2是( )反应,需加( )剂
(2)CuO→ Cu是( )反应,需加( )剂
氧化
还原
氧化
还原
0 +2
+2 0
二、常见的氧化剂和还原剂
氧化剂 还原剂
活泼非金属单质:O2、Cl2 活泼金属单质:Al、Zn、Fe
某些非金属单质:H2、C
变价元素的高价态化合物: KMnO4、FeCl3、HNO3、浓硫酸 变价元素较低价态的化合物:
CO、KI、FeSO4
物质中所含元素的化合价高低与物质的氧化性、还原性有什么关系?
交流探讨
物质中所含元素的化合价高低与物质的氧化性、还原性有什么关系?
FeCl3
FeSO4
Fe
所含Fe化合价
0
+2
+3
总结:
最高价态
中间价态
最低价态
只有还原性
既有氧化性
又有还原性
只有氧化性
巩固练习
下列物质只具有氧化性的是( );只具有还原性的是( );即具有氧化性又具有还原性的是( )。
A. SO2 B. Fe3+ C. Cl2 D. Al E. F2
BE
D
AC
三、根据氧化还原方程式判断物质氧化性还原性强弱
在氧化还原反应中:
氧化剂具有较强的氧化性,还原剂具有较强的还原性;
氧化产物具有较弱的氧化性,还原产物具有较弱的还原性。
因此
氧化性:
氧化剂﹥氧化产物
还原性:
还原剂﹥还原产物
特点:比什么性,找什么剂,产物之性小于剂。
根据下列反应判断H2SO3 、 I- 、 Fe2+ 、 NO的还原性
由强到弱的顺序是 。
H2SO3 + I2 + H2O = 2HI + H2SO4
2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2
3FeCl2 + 4HNO3 = 2FeCl3 + NO↑ + 2H2O + Fe(NO3)3
H2SO3 > I- > Fe2+ > NO
+4 0 -1 +6
(H2SO3 > I-)
+3 -1 +2 0
( I- > Fe2+ )
+2 +5 +3 +2 +3
(Fe2+ > NO)
巩固练习
氧化剂
还原剂
氧化产物
还原产物
还原剂
还原产物
还原产物
还原剂
课堂小结
口诀:
升—失—氧(被氧化,氧化反应,生成氧化产物)—还(还原剂)
降—得—还(被还原,还原反应,生成还原产物)—氧(氧化剂)
氧化剂 + 还原剂 =====
还原产物 + 氧化产物
化合价降低,得电子,被还原,发生还原反应
化合价升高,失电子,被氧化,发生氧化反应
2、氧化性、还原性和元素化合价之间的关系
3、根据氧化还原方程式判断物质氧化性还原性强弱
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
特点:比什么性,找什么剂,产物之性小于剂。
