4.1.1 原子结构课件(共29张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.1 原子结构课件(共29张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 13.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-27 08:45:11 | ||
图片预览






文档简介
(共29张PPT)
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第1课时 原子结构
2
1
本节重点
本节难点
原子的构成
原子核外电子排布,两等式关系
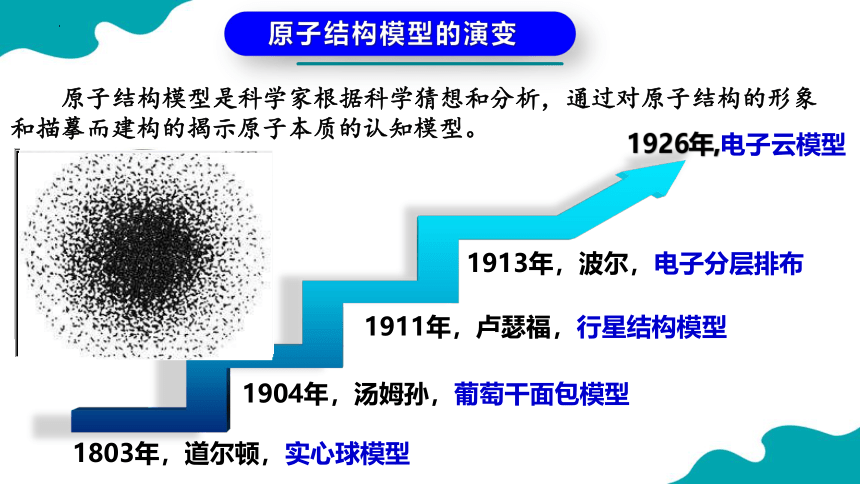
原子结构模型是科学家根据科学猜想和分析,通过对原子结构的形象和描摹而建构的揭示原子本质的认知模型。
原子结构模型的演变
1803年,道尔顿,实心球模型
1904年,汤姆孙,葡萄干面包模型
1911年,卢瑟福,行星结构模型
1913年,波尔,电子分层排布
1926年,电子云模型
原子结构
根据初中的化学知识,同学们描述一下原子的结构
原子
原子核
核外电子
质子
中子
体积很小
质量很大
质量近似相等
质量可以忽略
质子
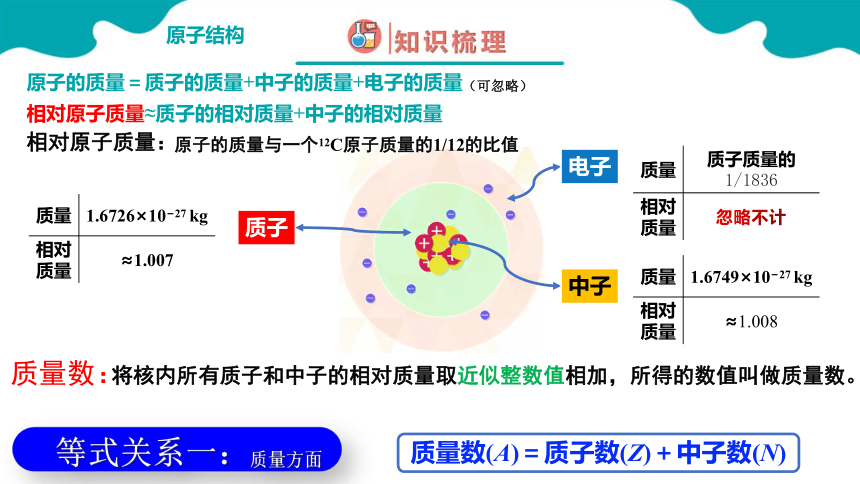
质量 1.6726×10 27 kg
相对质量 ≈1.007
中子
质量 1.6749×10 27 kg
相对质量 ≈1.008
电子
质量 质子质量的1/1836
相对质量 忽略不计
原子的质量=质子的质量+中子的质量+电子的质量(可忽略)
相对原子质量≈质子的相对质量+中子的相对质量
质量数:
将核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。
质量数(A)=质子数(Z)+中子数(N)
相对原子质量:
原子的质量与一个12C原子质量的1/12的比值
等式关系一:质量方面
原子结构
质量数(A)= 质子数(Z)+ 中子数(N)
X
A
Z
—— 元素符号
质量数 ———
原子的表示方法:
质量数:
为什么质子数和中子数之和会叫做质量数呢?
在某种程度上可以代表原子的质量,即质量数越大,原子的质量越大
质子数 ———
质量数(A)=质子数(Z)+中子数(N)
根据质量数的定义,可以将一个具体的原子表示如下:
原子结构
原子
原子核
核外电子
质子
中子
Z个
Z个
(A-Z)个
例如:什么是12C原子?
质量数为12的C原子
6个质子
6个电子
6个中子
原子核内各微粒的数量关系:
核电荷数=质子数=核外电子数=原子序数
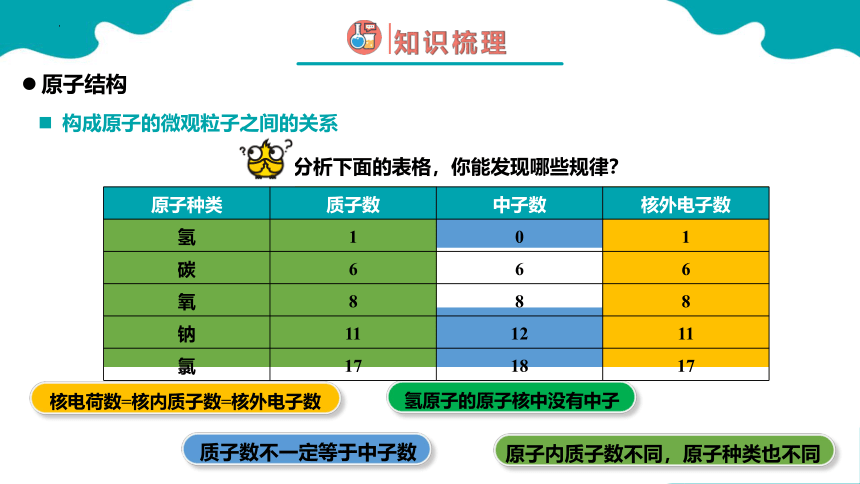
分析下面的表格,你能发现哪些规律?
核电荷数=核内质子数=核外电子数
质子数不一定等于中子数
氢原子的原子核中没有中子
原子内质子数不同,原子种类也不同
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
构成原子的微观粒子之间的关系
原子结构
1、已知 H 原子的质子数是 1,中子数是 0,求此 H 原子的
质量数为多少
质量数(A)= 质子数(Z)+ 中子数(N)
2、已知 O 原子的质量数是 20,求此 O 原子的中子数为多少
中子数(A)= 质量数(Z)- 质子数(N)
结论:原子序数 = 质子数 = 核外电子数 = 核电荷数
1 + 0 = 1
20 - 8 = 12
质量数
质子数
微粒
中子数
电子数
23
12
32
35
45
18
10
16
16
80
11
35
Br
80
35
X+
23
11
S2-
32
16
在多个电子的原子里,电子是如何运动的呢?
在多电子原子中,电子的能量是不相同的。在离核较近的区域内运动的电子能量较低,在离核较远的区域内运动的电子能量较高。
1、电子层
在含有多个电子的原子里,电子分别在能量不同的区域内运动。我们把不同的区域简化为不连续的壳层,也称为电子层。
2、电子在核外运动的主要区域离核远近不同,电子所具有的能量也不同
下表是稀有气体元素原子的电子层排布,从中你能发现什么规律?
核外电子的排布规律
(1) K层为最外层时,最多容纳多少电子?其余层为最外层,最多容纳多少电子?
(1) K层为最外层时,最多容纳2个电子,其余层为最外层,最多容纳8个电子.
(2) 次外层最多容纳多少电子?
(1) K层为最外层时,最多容纳2个电子,其余层为最外层,最多容纳8个电子.
(2) 次外层最多容纳18个电子?
(1) K层为最外层时,最多容纳2个电子,其余层为最外层,最多容纳8个电子.
(2) 次外层最多容纳18个电子.
(3) 第n层最多容纳多少电子?
(1) K层为最外层时,最多容纳2个电子,其余层为最外层,最多容纳8个电子.
(2) 次外层最多容纳18个电子.
(3) 第n层最多容纳2×n2电子.
核外电子的排布规律
(4)电子总是尽先由里向外排列.
核外电子排布的表示方法
(1)原子结构示意图
17号氯
原子核
+
17
原子核带正电
核电荷数
第1层
2
K层
第2层
8
L层
第3层
7
M层
原子结构示意图中,核电荷数等于核外电子数
+11
2
8
1
K L M
Na
根据Na元素的核外电子排布,我们可以发现,K层最多可以排布2个电子,L层最多可以排布8个电子。
结论:
铁是由原子直接构成的物质,用手触摸铁不会被电到说明铁原子不带电,铁原子不带电的原因?
质子数
核电荷数
原子序数
核外电子数
由于原子里质子数=电子数,一个质子和一个电子所带的电量相等,电性相反,所以整个原子不显电性。
思考:原子不带电,什么微粒带电?原因是什么?
(2)离子结构示意图
离子结构示意图中,核电荷数与核外电子数不相等:
阳离子:核外电子数 核电荷数;
阴离子:核外电子数 核电荷数。
<
>
(3)电荷守恒的等式关系:求解微粒中的电子数
1.不带电微粒(分子、原子):
电子数=质子数
原子序数 = 质子数 = 核外电子数 = 核电荷数
2.带正电微粒(阳离子):
电子数=质子数-|微粒所带电荷数|
3.带负电微粒(阴离子):
电子数=质子数+|微粒所带电荷数|
例题1:求解下列1个微粒所含的电子数?
Ne 、H2O 、Ca2+ 、NH4+ 、S2- 、SO42- 、
等式关系二:电量方面
原子的核外电子排布规律:
(1)电子总是尽先由里向外排列;
(2)每个电子层最多可以容纳2×n2个电子;
(3)最外层最多可以容纳8个电子(K层为最外层时,最多容纳2个);
(4)次外层最多容纳18个电子。
例题2:根据原子的核外电子排布规律,写出33号元素的原子结构示意图
例题3:用原子结构示意图表示1~20号元素的核外电子排布
前20号元素的核外电子排布
练习一:依据前20号元素的原子结构特点,回答下列问题:
1.最外层电子数等于次外层电子数的元素:__________。
Be Ar
2.最外层电子数是次外层电子数的2倍的元素:_____是次外层3倍的是:_____ ;
C
O
3.次外层电子数是最外层电子数的2倍的元素:_________。
Li Si
4.电子层数与最外层电子数相等的元素:_____________。
H Be Al
练习二:(1)22.4L(标准状况)氢气含有的质子数为_________
(2)1mol 16O2 和 1mol18O2 中,中子数比为_________
练习三.短周期常见原子的核外电子排布规律
(1)原子核中无中子的原子: 。
(2)最外层有1个电子的元素: 。
(3)最外层有2个电子的元素: 。
(4)最外层电子数等于次外层电子数的元素: 。
(5)电子层数与最外层电子数相等的元素: 。
(6)电子总数为最外层电子数2倍的元素: 。
(7)次外层电子数是最外层电子数2倍的元素: 。
(8)内层电子总数是最外层电子数2倍的元素: 。
H
H、Li、Na
Be、Mg、He
Be、Ar
H、Be、Al
Be
Li、Si
Li、P
练习四.主族元素X、Y,已知X的质子数为a,X2+比Y2-核外少8个电子,若Y原子的质量数为b,
则Y原子核内中子数为( )
A.b-a-4 B.b-a-8
C.b+a+8 D.b-a-12
【答案】A
已知X的质子数为a,X2+比Y2-核外少8个电子,所以X与Y同周期,所以Y的质子数为:a+4,则Y原子核内中子数为:b-a-4,故选A。
练习五:已知A、B、C三种元素的原子中,质子数为A(1)三种元素的元素符号:
A________;B________;C________。
(2)画出三种元素的原子结构示意图:
A________;B________;C_________。
C
Si
Cl
总结:
原子结构模型的演变
等式关系一:质量方面
等式关系二:电量方面
核外电子的排布规律
原子的表示方法:
原子结构
1911年,卢瑟福用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔,发现:
金箔散射实验
大多数α粒子能穿透金箔而不改变原来的运动方向;
一小部分α粒子改变了原来的运动方向;
有极少数α粒子被弹了回来。
原子不是一个实心球体
金的原子核带正电荷
金原子核的质量很大
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第1课时 原子结构
2
1
本节重点
本节难点
原子的构成
原子核外电子排布,两等式关系
原子结构模型是科学家根据科学猜想和分析,通过对原子结构的形象和描摹而建构的揭示原子本质的认知模型。
原子结构模型的演变
1803年,道尔顿,实心球模型
1904年,汤姆孙,葡萄干面包模型
1911年,卢瑟福,行星结构模型
1913年,波尔,电子分层排布
1926年,电子云模型
原子结构
根据初中的化学知识,同学们描述一下原子的结构
原子
原子核
核外电子
质子
中子
体积很小
质量很大
质量近似相等
质量可以忽略
质子
质量 1.6726×10 27 kg
相对质量 ≈1.007
中子
质量 1.6749×10 27 kg
相对质量 ≈1.008
电子
质量 质子质量的1/1836
相对质量 忽略不计
原子的质量=质子的质量+中子的质量+电子的质量(可忽略)
相对原子质量≈质子的相对质量+中子的相对质量
质量数:
将核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。
质量数(A)=质子数(Z)+中子数(N)
相对原子质量:
原子的质量与一个12C原子质量的1/12的比值
等式关系一:质量方面
原子结构
质量数(A)= 质子数(Z)+ 中子数(N)
X
A
Z
—— 元素符号
质量数 ———
原子的表示方法:
质量数:
为什么质子数和中子数之和会叫做质量数呢?
在某种程度上可以代表原子的质量,即质量数越大,原子的质量越大
质子数 ———
质量数(A)=质子数(Z)+中子数(N)
根据质量数的定义,可以将一个具体的原子表示如下:
原子结构
原子
原子核
核外电子
质子
中子
Z个
Z个
(A-Z)个
例如:什么是12C原子?
质量数为12的C原子
6个质子
6个电子
6个中子
原子核内各微粒的数量关系:
核电荷数=质子数=核外电子数=原子序数
分析下面的表格,你能发现哪些规律?
核电荷数=核内质子数=核外电子数
质子数不一定等于中子数
氢原子的原子核中没有中子
原子内质子数不同,原子种类也不同
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
构成原子的微观粒子之间的关系
原子结构
1、已知 H 原子的质子数是 1,中子数是 0,求此 H 原子的
质量数为多少
质量数(A)= 质子数(Z)+ 中子数(N)
2、已知 O 原子的质量数是 20,求此 O 原子的中子数为多少
中子数(A)= 质量数(Z)- 质子数(N)
结论:原子序数 = 质子数 = 核外电子数 = 核电荷数
1 + 0 = 1
20 - 8 = 12
质量数
质子数
微粒
中子数
电子数
23
12
32
35
45
18
10
16
16
80
11
35
Br
80
35
X+
23
11
S2-
32
16
在多个电子的原子里,电子是如何运动的呢?
在多电子原子中,电子的能量是不相同的。在离核较近的区域内运动的电子能量较低,在离核较远的区域内运动的电子能量较高。
1、电子层
在含有多个电子的原子里,电子分别在能量不同的区域内运动。我们把不同的区域简化为不连续的壳层,也称为电子层。
2、电子在核外运动的主要区域离核远近不同,电子所具有的能量也不同
下表是稀有气体元素原子的电子层排布,从中你能发现什么规律?
核外电子的排布规律
(1) K层为最外层时,最多容纳多少电子?其余层为最外层,最多容纳多少电子?
(1) K层为最外层时,最多容纳2个电子,其余层为最外层,最多容纳8个电子.
(2) 次外层最多容纳多少电子?
(1) K层为最外层时,最多容纳2个电子,其余层为最外层,最多容纳8个电子.
(2) 次外层最多容纳18个电子?
(1) K层为最外层时,最多容纳2个电子,其余层为最外层,最多容纳8个电子.
(2) 次外层最多容纳18个电子.
(3) 第n层最多容纳多少电子?
(1) K层为最外层时,最多容纳2个电子,其余层为最外层,最多容纳8个电子.
(2) 次外层最多容纳18个电子.
(3) 第n层最多容纳2×n2电子.
核外电子的排布规律
(4)电子总是尽先由里向外排列.
核外电子排布的表示方法
(1)原子结构示意图
17号氯
原子核
+
17
原子核带正电
核电荷数
第1层
2
K层
第2层
8
L层
第3层
7
M层
原子结构示意图中,核电荷数等于核外电子数
+11
2
8
1
K L M
Na
根据Na元素的核外电子排布,我们可以发现,K层最多可以排布2个电子,L层最多可以排布8个电子。
结论:
铁是由原子直接构成的物质,用手触摸铁不会被电到说明铁原子不带电,铁原子不带电的原因?
质子数
核电荷数
原子序数
核外电子数
由于原子里质子数=电子数,一个质子和一个电子所带的电量相等,电性相反,所以整个原子不显电性。
思考:原子不带电,什么微粒带电?原因是什么?
(2)离子结构示意图
离子结构示意图中,核电荷数与核外电子数不相等:
阳离子:核外电子数 核电荷数;
阴离子:核外电子数 核电荷数。
<
>
(3)电荷守恒的等式关系:求解微粒中的电子数
1.不带电微粒(分子、原子):
电子数=质子数
原子序数 = 质子数 = 核外电子数 = 核电荷数
2.带正电微粒(阳离子):
电子数=质子数-|微粒所带电荷数|
3.带负电微粒(阴离子):
电子数=质子数+|微粒所带电荷数|
例题1:求解下列1个微粒所含的电子数?
Ne 、H2O 、Ca2+ 、NH4+ 、S2- 、SO42- 、
等式关系二:电量方面
原子的核外电子排布规律:
(1)电子总是尽先由里向外排列;
(2)每个电子层最多可以容纳2×n2个电子;
(3)最外层最多可以容纳8个电子(K层为最外层时,最多容纳2个);
(4)次外层最多容纳18个电子。
例题2:根据原子的核外电子排布规律,写出33号元素的原子结构示意图
例题3:用原子结构示意图表示1~20号元素的核外电子排布
前20号元素的核外电子排布
练习一:依据前20号元素的原子结构特点,回答下列问题:
1.最外层电子数等于次外层电子数的元素:__________。
Be Ar
2.最外层电子数是次外层电子数的2倍的元素:_____是次外层3倍的是:_____ ;
C
O
3.次外层电子数是最外层电子数的2倍的元素:_________。
Li Si
4.电子层数与最外层电子数相等的元素:_____________。
H Be Al
练习二:(1)22.4L(标准状况)氢气含有的质子数为_________
(2)1mol 16O2 和 1mol18O2 中,中子数比为_________
练习三.短周期常见原子的核外电子排布规律
(1)原子核中无中子的原子: 。
(2)最外层有1个电子的元素: 。
(3)最外层有2个电子的元素: 。
(4)最外层电子数等于次外层电子数的元素: 。
(5)电子层数与最外层电子数相等的元素: 。
(6)电子总数为最外层电子数2倍的元素: 。
(7)次外层电子数是最外层电子数2倍的元素: 。
(8)内层电子总数是最外层电子数2倍的元素: 。
H
H、Li、Na
Be、Mg、He
Be、Ar
H、Be、Al
Be
Li、Si
Li、P
练习四.主族元素X、Y,已知X的质子数为a,X2+比Y2-核外少8个电子,若Y原子的质量数为b,
则Y原子核内中子数为( )
A.b-a-4 B.b-a-8
C.b+a+8 D.b-a-12
【答案】A
已知X的质子数为a,X2+比Y2-核外少8个电子,所以X与Y同周期,所以Y的质子数为:a+4,则Y原子核内中子数为:b-a-4,故选A。
练习五:已知A、B、C三种元素的原子中,质子数为A
A________;B________;C________。
(2)画出三种元素的原子结构示意图:
A________;B________;C_________。
C
Si
Cl
总结:
原子结构模型的演变
等式关系一:质量方面
等式关系二:电量方面
核外电子的排布规律
原子的表示方法:
原子结构
1911年,卢瑟福用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔,发现:
金箔散射实验
大多数α粒子能穿透金箔而不改变原来的运动方向;
一小部分α粒子改变了原来的运动方向;
有极少数α粒子被弹了回来。
原子不是一个实心球体
金的原子核带正电荷
金原子核的质量很大
