2.3.1物质的量 课件(共39张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.3.1物质的量 课件(共39张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-27 08:58:03 | ||
图片预览










文档简介
(共39张PPT)
第三节 物质的量
第1课时 物质的量的单位——摩尔
01
物质的量
02
阿伏加德罗常数
03
摩尔质量
目
录
【大显身手】
多年后的一天,胡子花白的马先生,带着100桶硬币,捐赠给银行。聪明的你,如果你是银行工作人员,该如何将这笔“巨款”准确高效的存入银行呢?
先将不同面值的硬币进行分类!
然后,针对不同面值,分别数出1000枚硬币,称出质量。用相应面值硬币的总质量,除以这1000枚硬币集合体的质量,可求得硬币的数目。
1000枚硬币的质量
n
以上,便可得到硬币的总数量为1000 n
数量
质量
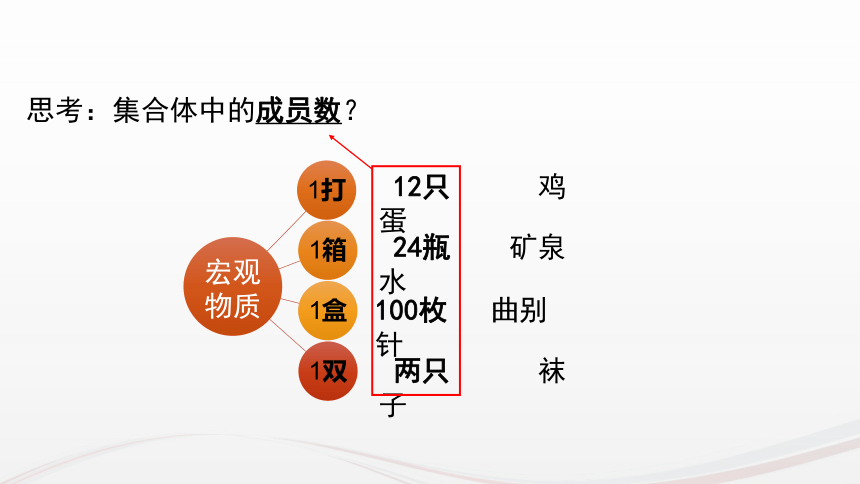
如何将可称量与肉眼看不见、难以称量联系起来?宏观物质微观粒子可称量物质肉眼看不见难以称量宏观物质
12只鸡蛋
24瓶矿泉水
100枚曲别针
两只袜子
把微小物质扩大倍数,形成一定数目的集合体。
方便生活、交流、科学研究。
1 集合体 分子、原子、离子、质子、电子……
微观粒子
摩尔
学习任务一:物质的量
1. 定义:表示含有一定数目粒子的集合体的物理量。
符号为 n。
2. 单位:摩尔,简称摩,符号mol。
思考:集合体中的成员数?
宏观物质
12只 鸡蛋
24瓶 矿泉水
100枚 曲别针
两只 袜子
微观粒子
1 mol =?个分子、原子、离子、质子、电子……
国际上规定,1mol粒子集合体所含的粒子数约为6.02×1023。
如果把6.02×1023粒米给全球70亿人吃,每人每天吃一斤,能吃多久呢?
一粒大米的质量约为0.02g,6.02×1023粒大米的质量
0.02×6.02×1023=1.204×1022 g =1.204×1016 吨
≈10万年
摩尔是七个物理量之一。
物质的量就是物质的质量,简写为物质量。
1. 下列叙述是否正确?
错误。物质的量是七个基本物理量之一。
错误。物质的量是专有名词,不可添字,也不可删字。
【随堂巩固】
(3) 1摩尔大米含有 6.02×1023粒米。
(4) 1 mol 氯。
错误。物质的量只适用于微观粒子,不能用来说明宏观物质。
错误。没有指出具体的微粒,是分子、原子或离子?
【随堂巩固】
2. 说出下列符号的意义
①2H, ②2mol H, ③2mol H+, ④2mol H2
3. 用化学符号表示
①2摩尔水分子、 ②5摩尔硫酸根离子、 ③2.3 摩尔碳酸氢根离子 ④b摩尔亚铁离子
【随堂巩固】
1) 国际单位制中七个基本物理量之一,符号是n。
3. “物质的量”几点说明:
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流强度 安培 A
热力学温度 开尔文 K
发光强度 坎德拉 cd
国际单位制(SI)的七个基本物理量
物质的量
摩尔
mol
1) 国际单位制中七个基本物理量之一,符号是n。
2)“物质的量”是物理量的全称,专有名词,不能添字,不能删字。
物质的质量
(×)
物质量
(×)
物质的数量
(×)
3. “物质的量”几点说明:
3) 只能描述微观粒子,如原子、分子、离子、中子、质子等。
1mol 苹果 ( x ),1mol 土豆 ( x ) 。
4) 必须指明具体粒子的种类,常用化学式表示。
如1mol H+、 1mol H2,不能用“1mol氢” 含糊无意义的表示。
5) 物质的量的数值可以是整数,也可以是小数。
如:6mol H, 0.3mol N2
学习任务二:阿伏加德罗常数1.定义:1mol任何粒子的粒子数叫做阿伏加德罗常数。2.符号:NA,通常用6.02×1023mol-1表示。3.阿伏加德罗常数是一个物理量,单位:mol-1。世界摩尔日10/23
思考:如何理解阿伏加德罗常数(NA)与6.02×1023 mol-1、6.02×1023的关系?
(1) 联系:三者均可表示1 mol 粒子的个数。
(2) 区别:阿伏加德罗常数(NA)是一个精确数值;
NA ≈ 6.02×1023 mol-1,有单位;
6.02×1023,只是一个数值,无单位。
n (物质的量) N (粒子总数)
……
……
a mol H a× NA个H
1mol H NA个H
2mol H 2× NA个H
N = n NA
n =
N
NA
4. 物质的量、阿伏加德罗常数与粒子数(N)之间的关系:
1.1mol氯原子含有个氯原子;2.0.3mol硫酸根离子含有个硫酸根离子;3.10mol水分子含有个氢原子,含有个质子,含有个水分子;1×NA0.3×NA20×NA100×NA10×NA【随堂巩固】4. 下列关于阿伏加德罗常数的说法正确的是:
阿伏加德罗常数是一个纯数,没有单位;
阿伏加德罗常数就是6.02×1023;
阿伏加德罗常数是指1mol任何粒子的粒子数;
阿伏加德罗常数的近似值为: 6.02×1023 mol-1。
【随堂巩固】
5. 知识拓展
(1) 1摩尔水分子中有多少摩尔氢原子,多少摩尔氧原子
H2O 2H O
微粒个数
微粒集体
物质的量
1
2
1
NA
2NA
NA
1mol
2 mol
1 mol
结论:微粒之间的物质的量之比等于微粒间个数比
N1
N2
n1
=
n2
点燃
(2) 2H2 + O2 === 2H2O
微粒个数
物质的量
2个
1个
2个
2mol
1mol
2mol
化学方程式中,反应过程中各物质的物质的量之比等于其化学计量系数之比。
思考:1mol 物质的质量到底有多大?
1mol H2O,
约含有6.02×1023个水分子,质量是18g。
1mol Al,
约含有6.02×1023个铝原子,质量是27g。
1mol不同物质所含的粒子数是相同的,但由于不同粒子的质量不同,1mol不同物质的质量也不同。
【实践体验】
粒子符号 物质的式量 每个粒子的质量(g/个) 1mol物质含有的粒子数(个)
C 12 1.993X10-23 6.02X1023
Fe 56 9.032X10-23 6.02X1023
H2SO4 98 1.628X10-22 6.02X1023
H2O 18 2.990X10-23 6.02X1023
Na+ 23 3.821X10-23 6.02X1023
OH- 17 2.824X10-23 6.02X1023
12
56
98
18
23
17
1mol物质的质量(g)
讨论:根据你的计算结果,可得出什么规律
结论:1mol任何粒子或物质的质量以克为单位时,其数值都与该粒子的相对原子质量或相对分子质量相等。
学习任务三:摩尔质量
3. 定义式:
M=
m
n
1. 定义:单位物质的量 (1mol) 的物质所具有的质量叫做摩尔质量。
2. 符号是M,单位:g/mol (或g·mol-1)
1mol H2SO4的摩尔质量为_________
5mol H2SO4的摩尔质量为_________
H2SO4的相对分子质量为_____
1 mol H2O的质量为_________
n molH2O的质量为_________
24.5 g H2SO4的物质的量是___________
98 g/mol
98 g/mol
98
0.25 mol
18g
18n g
【随堂巩固】
4. “摩尔质量”几点说明:
1) 摩尔质量有单位,g·mol-1,数值上等于该物质的式量;
2) 对于指定物质,摩尔质量是定值,不随其物质的量多少而改变;
3) 混合物的摩尔质量称为平均摩尔质量,其数值随各物质的含量改变而发生变化。
混合气体 (2 mol H2+1mol O2)的平均摩尔质量?
M=12 g/mol
5. 质量、物质的量和摩尔质量关系
定义式:
M=
m
n
变形式:
m=n·M
m
M
n =
物质的量
(单位:mol)
质量
(单位:g)
摩尔质量
(单位:g/mol)
6. 质量m、物质的量n、摩尔质量M、NA、粒子数N之间的关系
质量
m
物质的量
n
粒子数
N
÷M
×M
×NA
÷NA
1. 49g H2SO4的物质的量是多少?所含H2SO4分子的个数是多少?
n= = = 0.5 mol
M
m
98g/mol
49 g
N= n×NA
=0.5 mol × 6.02 × 1023 mol-1
=3.01 × 1023
【随堂巩固】
2. 19.6g硫酸是_______mol H2SO4,含有_____________个硫酸分子,其中含有______mol H,计____________个氢原子,含有______mol O ,计_____________个氧原子。
0.2
1.2×1023
2.4×1023
0.4
4.8×1023
0.8
【随堂巩固】
物质的量 (n):表示含有一定数目粒子的集合体。
国际单位制七个基本物理量之一 ,单位:摩尔、简称摩(mol)
摩尔质量(M):单位物质的量的物质所具有的质量 。
数值上等于物质的式量。符号:M,单位:g/mol 或者g·mol-1
阿伏加德罗常数(NA) :1 mol 任何粒子的粒子数。
符号:NA 单位:mol-1, 数值: 约为6.02×1023
【本课小结】
第三节 物质的量
第1课时 物质的量的单位——摩尔
01
物质的量
02
阿伏加德罗常数
03
摩尔质量
目
录
【大显身手】
多年后的一天,胡子花白的马先生,带着100桶硬币,捐赠给银行。聪明的你,如果你是银行工作人员,该如何将这笔“巨款”准确高效的存入银行呢?
先将不同面值的硬币进行分类!
然后,针对不同面值,分别数出1000枚硬币,称出质量。用相应面值硬币的总质量,除以这1000枚硬币集合体的质量,可求得硬币的数目。
1000枚硬币的质量
n
以上,便可得到硬币的总数量为1000 n
数量
质量
如何将可称量与肉眼看不见、难以称量联系起来?宏观物质微观粒子可称量物质肉眼看不见难以称量宏观物质
12只鸡蛋
24瓶矿泉水
100枚曲别针
两只袜子
把微小物质扩大倍数,形成一定数目的集合体。
方便生活、交流、科学研究。
1 集合体 分子、原子、离子、质子、电子……
微观粒子
摩尔
学习任务一:物质的量
1. 定义:表示含有一定数目粒子的集合体的物理量。
符号为 n。
2. 单位:摩尔,简称摩,符号mol。
思考:集合体中的成员数?
宏观物质
12只 鸡蛋
24瓶 矿泉水
100枚 曲别针
两只 袜子
微观粒子
1 mol =?个分子、原子、离子、质子、电子……
国际上规定,1mol粒子集合体所含的粒子数约为6.02×1023。
如果把6.02×1023粒米给全球70亿人吃,每人每天吃一斤,能吃多久呢?
一粒大米的质量约为0.02g,6.02×1023粒大米的质量
0.02×6.02×1023=1.204×1022 g =1.204×1016 吨
≈10万年
摩尔是七个物理量之一。
物质的量就是物质的质量,简写为物质量。
1. 下列叙述是否正确?
错误。物质的量是七个基本物理量之一。
错误。物质的量是专有名词,不可添字,也不可删字。
【随堂巩固】
(3) 1摩尔大米含有 6.02×1023粒米。
(4) 1 mol 氯。
错误。物质的量只适用于微观粒子,不能用来说明宏观物质。
错误。没有指出具体的微粒,是分子、原子或离子?
【随堂巩固】
2. 说出下列符号的意义
①2H, ②2mol H, ③2mol H+, ④2mol H2
3. 用化学符号表示
①2摩尔水分子、 ②5摩尔硫酸根离子、 ③2.3 摩尔碳酸氢根离子 ④b摩尔亚铁离子
【随堂巩固】
1) 国际单位制中七个基本物理量之一,符号是n。
3. “物质的量”几点说明:
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流强度 安培 A
热力学温度 开尔文 K
发光强度 坎德拉 cd
国际单位制(SI)的七个基本物理量
物质的量
摩尔
mol
1) 国际单位制中七个基本物理量之一,符号是n。
2)“物质的量”是物理量的全称,专有名词,不能添字,不能删字。
物质的质量
(×)
物质量
(×)
物质的数量
(×)
3. “物质的量”几点说明:
3) 只能描述微观粒子,如原子、分子、离子、中子、质子等。
1mol 苹果 ( x ),1mol 土豆 ( x ) 。
4) 必须指明具体粒子的种类,常用化学式表示。
如1mol H+、 1mol H2,不能用“1mol氢” 含糊无意义的表示。
5) 物质的量的数值可以是整数,也可以是小数。
如:6mol H, 0.3mol N2
学习任务二:阿伏加德罗常数1.定义:1mol任何粒子的粒子数叫做阿伏加德罗常数。2.符号:NA,通常用6.02×1023mol-1表示。3.阿伏加德罗常数是一个物理量,单位:mol-1。世界摩尔日10/23
思考:如何理解阿伏加德罗常数(NA)与6.02×1023 mol-1、6.02×1023的关系?
(1) 联系:三者均可表示1 mol 粒子的个数。
(2) 区别:阿伏加德罗常数(NA)是一个精确数值;
NA ≈ 6.02×1023 mol-1,有单位;
6.02×1023,只是一个数值,无单位。
n (物质的量) N (粒子总数)
……
……
a mol H a× NA个H
1mol H NA个H
2mol H 2× NA个H
N = n NA
n =
N
NA
4. 物质的量、阿伏加德罗常数与粒子数(N)之间的关系:
1.1mol氯原子含有个氯原子;2.0.3mol硫酸根离子含有个硫酸根离子;3.10mol水分子含有个氢原子,含有个质子,含有个水分子;1×NA0.3×NA20×NA100×NA10×NA【随堂巩固】4. 下列关于阿伏加德罗常数的说法正确的是:
阿伏加德罗常数是一个纯数,没有单位;
阿伏加德罗常数就是6.02×1023;
阿伏加德罗常数是指1mol任何粒子的粒子数;
阿伏加德罗常数的近似值为: 6.02×1023 mol-1。
【随堂巩固】
5. 知识拓展
(1) 1摩尔水分子中有多少摩尔氢原子,多少摩尔氧原子
H2O 2H O
微粒个数
微粒集体
物质的量
1
2
1
NA
2NA
NA
1mol
2 mol
1 mol
结论:微粒之间的物质的量之比等于微粒间个数比
N1
N2
n1
=
n2
点燃
(2) 2H2 + O2 === 2H2O
微粒个数
物质的量
2个
1个
2个
2mol
1mol
2mol
化学方程式中,反应过程中各物质的物质的量之比等于其化学计量系数之比。
思考:1mol 物质的质量到底有多大?
1mol H2O,
约含有6.02×1023个水分子,质量是18g。
1mol Al,
约含有6.02×1023个铝原子,质量是27g。
1mol不同物质所含的粒子数是相同的,但由于不同粒子的质量不同,1mol不同物质的质量也不同。
【实践体验】
粒子符号 物质的式量 每个粒子的质量(g/个) 1mol物质含有的粒子数(个)
C 12 1.993X10-23 6.02X1023
Fe 56 9.032X10-23 6.02X1023
H2SO4 98 1.628X10-22 6.02X1023
H2O 18 2.990X10-23 6.02X1023
Na+ 23 3.821X10-23 6.02X1023
OH- 17 2.824X10-23 6.02X1023
12
56
98
18
23
17
1mol物质的质量(g)
讨论:根据你的计算结果,可得出什么规律
结论:1mol任何粒子或物质的质量以克为单位时,其数值都与该粒子的相对原子质量或相对分子质量相等。
学习任务三:摩尔质量
3. 定义式:
M=
m
n
1. 定义:单位物质的量 (1mol) 的物质所具有的质量叫做摩尔质量。
2. 符号是M,单位:g/mol (或g·mol-1)
1mol H2SO4的摩尔质量为_________
5mol H2SO4的摩尔质量为_________
H2SO4的相对分子质量为_____
1 mol H2O的质量为_________
n molH2O的质量为_________
24.5 g H2SO4的物质的量是___________
98 g/mol
98 g/mol
98
0.25 mol
18g
18n g
【随堂巩固】
4. “摩尔质量”几点说明:
1) 摩尔质量有单位,g·mol-1,数值上等于该物质的式量;
2) 对于指定物质,摩尔质量是定值,不随其物质的量多少而改变;
3) 混合物的摩尔质量称为平均摩尔质量,其数值随各物质的含量改变而发生变化。
混合气体 (2 mol H2+1mol O2)的平均摩尔质量?
M=12 g/mol
5. 质量、物质的量和摩尔质量关系
定义式:
M=
m
n
变形式:
m=n·M
m
M
n =
物质的量
(单位:mol)
质量
(单位:g)
摩尔质量
(单位:g/mol)
6. 质量m、物质的量n、摩尔质量M、NA、粒子数N之间的关系
质量
m
物质的量
n
粒子数
N
÷M
×M
×NA
÷NA
1. 49g H2SO4的物质的量是多少?所含H2SO4分子的个数是多少?
n= = = 0.5 mol
M
m
98g/mol
49 g
N= n×NA
=0.5 mol × 6.02 × 1023 mol-1
=3.01 × 1023
【随堂巩固】
2. 19.6g硫酸是_______mol H2SO4,含有_____________个硫酸分子,其中含有______mol H,计____________个氢原子,含有______mol O ,计_____________个氧原子。
0.2
1.2×1023
2.4×1023
0.4
4.8×1023
0.8
【随堂巩固】
物质的量 (n):表示含有一定数目粒子的集合体。
国际单位制七个基本物理量之一 ,单位:摩尔、简称摩(mol)
摩尔质量(M):单位物质的量的物质所具有的质量 。
数值上等于物质的式量。符号:M,单位:g/mol 或者g·mol-1
阿伏加德罗常数(NA) :1 mol 任何粒子的粒子数。
符号:NA 单位:mol-1, 数值: 约为6.02×1023
【本课小结】
