2.2 氯及其化合物 同步练习题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2 氯及其化合物 同步练习题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 85.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-27 14:03:44 | ||
图片预览


文档简介
2.2 氯及其化合物 同步练习题
一、选择题
1.下列离子方程式中正确的是
A.用氯气作为水的消毒剂:Cl2+H2O=2H++Cl-+ClO-
B.用FeCl3溶液腐蚀印刷铜电路板:Cu+Fe3+=Fe2++Cu2+
C.Fe片放入稀盐酸中:2Fe+6H+=2Fe3++3H2↑
D.氢氧化钡溶液与盐酸的反应:OH-+H+=H2O
2.下列化合物中,不能通过两种单质间化合直接制取的是
A.NaCl B.CuCl2 C.FeCl2 D.FeCl3
3.下列说法不正确的是
A.碳酸钠广泛应用于制玻璃、造纸、纺织等领域
B.碳酸氢钠可作为制药的原料、食品加工中的发酵粉
C.氯气大量用于饮用水消毒、爆破、制造盐酸等
D.次氯酸钙既可以作漂白棉、麻的漂白剂,又可用作游泳池等场所的消毒剂
4.下列物质在氯气中燃烧能够产生白雾的是
A.铁 B.氢气 C.红磷 D.铜
5.下列氯气参与的化学反应中,方程式书写不正确的是
A.钠与氯气在加热条件下反应:
B.铁与氯气在加热条件下反应:
C.铜与氯气在加热条件下反应:
D.纯净的氢气在氯气中安静地燃烧:
6.新制的饱和氯水与久置氯水的主要区别是
序号 新制的氯水 久置氯水
A 不能与锌反应放出气体 能与锌反应放出气体
B 有漂白作用 无漂白作用
C 不含氯离子 含氯离子
D 酸性强 酸性弱
A.A B.B C.C D.D
7.下列物质久置于空气中易发生化学变化的有
①氯水 ②碳酸钠晶体 ③烧碱 ④漂白粉 ⑤过氧化钠 ⑥碳酸氢钠
A.5 种 B.4 种 C.3 种 D.2 种
8.下列关于电解饱和食盐水过程说法正确的是
A.电解饱和食盐水的工厂可以生产盐酸 B.与电源正极相连的电极区有NaOH生成
C.与电源的负极相连的电极上有氯气生成 D.电解饱和食盐水的过程中Na+浓度减小
二、非选择题
9.某些化学反应可用下式表示:,回答下列问题:
(1)若C为氯化钠,D为能使澄清石灰水变浑浊的无味气体,则A与B的两种组合分别是:_________或_________。
(2)若A为,B为盐酸,C是黄绿色的单质气体,该反应的离子方程式为_______。
(3)若C、D均为气体,完成反应的化学方程式:___________。
10.回答下列问题:
(1)实验室需要用NaOH配制0.2mol/LNaOH溶液450mL。
①完成本实验所必需的仪器有:托盘天平、药匙、烧杯、玻璃棒、胶头滴管、___。
②配制该溶液需称取NaOH___g。
③称量完毕,将药品倒入烧杯中,溶解、冷却,转移、洗涤。溶解过程中需要使用玻璃棒,目的是___。
(2)取上述配制的NaOH溶液200mL制取消毒液:向该NaOH溶液通入Cl2,使得NaOH恰好完全反应。完成下列填空。
①该消毒液制备的化学方程式为___,该反应消耗的Cl2在标准状况下的体积为___。
②该消毒液的的保存方式为__,原因为___。
③该消毒液不能与洁厕灵(主要成分为浓盐酸)混用,否则会产生中毒危险。若将二者混合,每产生1molCl2,转移电子个数约为___。
11.现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈黄绿色,把四种气体分别通入酸化的硝酸银溶液中,通入B、D气体时立即出现白色沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D。把无色无刺激性气味的气体C通入澄清石灰水时,石灰水变浑浊。
(1)A、B、C、D的化学式分别为:
A________;B________;C________;D________。
(2)写出下列各反应的化学方程式:
A与B________________________________。
B与水______________________________。
C与澄清石灰水________________________。
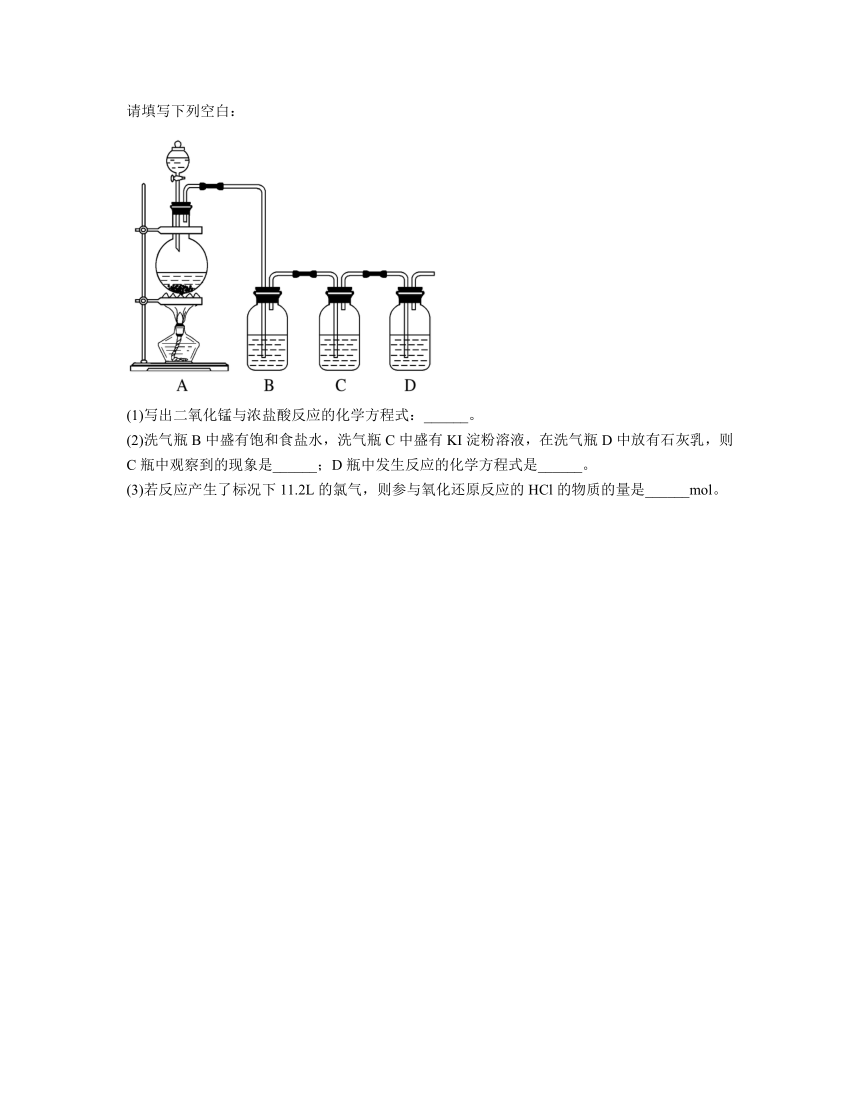
12.如图所示装置可用于二氧化锰与浓盐酸在加热条件下制取氯气,并利用产物进行后续实验,请填写下列空白:
(1)写出二氧化锰与浓盐酸反应的化学方程式:______。
(2)洗气瓶B中盛有饱和食盐水,洗气瓶C中盛有KI淀粉溶液,在洗气瓶D中放有石灰乳,则C瓶中观察到的现象是______;D瓶中发生反应的化学方程式是______。
(3)若反应产生了标况下11.2L的氯气,则参与氧化还原反应的HCl的物质的量是______mol。
【参考答案】
一、选择题
1.D
解析:A.氯气溶液水生成氯化氢和次氯酸,次氯酸为弱酸不能拆,,A错误;
B.电荷不守恒,,B错误;
C.铁与盐酸反应生成亚铁离子,,C错误;
D.氢氧化钡溶液与盐酸反应,生成氯化钡和水,D正确;
故答案为:D。
2.C
解析:A.钠与氯气在常温下生成氯化钠,通过两种单质间化合能够生成NaCl,故A正确;
B.铜与氯气在加热条件下反应生成氯化铜,通过两种单质间化合能够生成氯化铜,故B正确;
C.铁与氯气反应生成氯化铁,得不到氯化亚铁,故C错误;
D.氯气具有强氧化性,能与金属单质发生化合反应生成高价氯化物,铁与氯气反应生成氯化铁,故D正确;
故选:C。
3.C
解析:A.碳酸钠具有较强的碱性,可用于制玻璃、肥皂、造纸、纺织等工业,故A正确;
B.NaHCO3碱性较弱,可与酸反应,可用于治胃酸过多,可作为制药的原料,NaHCO3不稳定,受热会分解产生二氧化碳气体,可做发酵粉等,故B正确;
C.氯气是有毒气体,氯水中溶有较多的氯气,不能大量用于饮用水消毒,故C错误;
D.次氯酸钙具有强氧化性,能使蛋白质变性而杀菌消毒,同时也具有漂白性,所以漂白粉既可做漂白棉麻纸张的漂白剂,又可做游泳池及环境的消毒剂,故D正确;
故选:C。
4.B
解析:A.Fe与与氯气反应生成固体氯化铁,会观察到棕褐色的烟,A不符合;
B.H2与氯气反应生成气体HCl,极易结合水蒸气变为盐酸小液滴,则会观察到白雾,B符合;
C.P与氯气反应生成PCl5白色固体,C不符合;
D.Cu与氯气反应生成固体氯化铜,会观察到棕黄色的烟,D不符合;
故答案为:B。
5.B
解析:A.钠与氯气在加热条件下反应生成氯化钠,A正确;
B.铁与氯气在加热条件下反应生成氯化铁,B错误;
C.铜与氯气在加热条件下反应生成氯化铜,C正确;
D.纯净的氢气在氯气中安静地燃烧生成氯化氢,D正确;
故选B。
6.B
【分析】新制的氯水中含有Cl2、H2O、HClO、H+、Cl-、ClO-、OH-等粒子,具有酸性、强氧化性、漂白性;氯水久置时,次氯酸分解生成盐酸和氧气,最后得到盐酸溶液;
解析:A.新制氯水和久制氯水中均含有氢离子,可以与锌反应生成气体,A错误;
B.新制氯水中因为有HClO分子,故具有漂白性,久置氯水中次氯酸分子分解,无漂白性,B正确;
C.根据分析,新制氯水中含Cl-,久置氯水中只含氢离子和氯离子,C错误;
D.久制氯水的酸性强于新制氯水,D错误;
故答案为:B。
7.A
解析:①氯水中的HClO见光易分解,氯水久置最终得到盐酸,易变质;
②碳酸钠晶体空气久置易失去结晶水,易变质;
③烧碱易吸收空气中的二氧化碳最终转化成碳酸钠,易变质;
④漂白粉中次氯酸钙能与空气中的二氧化碳和水发生反应,易变质;
⑤过氧化钠易与二氧化碳和水反应,在空气中易变质;
⑥碳酸氢钠受热才能发生分解反应,在空气中很难反应,较为稳定;
故选:A。
8.A
解析:A.电解饱和食盐水制得的H2和Cl2可作为生产盐酸的原材料,A正确;
B.与电源正极相连的电极是阳极,电极反应式为,Cl2可与NaOH反应,因此该电极区不能生成NaOH,B错误;
C.与电源负极相连的电极是阴极,电极反应式为,没有Cl2生成,C错误;
D.电解的总反应方程式为:2NaCl+2H2O=2NaOH+Cl2↑+H2↑,反应过程水被消耗,Na+浓度增大,D错误;
故选A。
二、非选择题
9.(1) 碳酸钠和盐酸 碳酸氢钠和盐酸
(2)
(3)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
解析:(1)由题意可知A与B反应生成了氯化钠、水和二氧化碳,则A和B可以是碳酸钠和盐酸,也可以是碳酸氢钠和盐酸。
(2)由题意可知,方程式为浓盐酸和二氧化锰加热条件下反应制取氯气,则离子方程式为:。
(3)依据得失电子守恒和原子守恒,可知C、D为二氧化碳和二氧化硫,化学方程式为:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。
10.(1) 500mL容量瓶 4.0 搅拌,起到加速NaOH溶解的作用
(2) Cl2+2NaOH=NaClO+NaCl+H2O 448mL 密封避光保存 NaClO水解产生的HClO容易见光分解 NA或6.02×1023
解析: (1)①无450 mL规格的容量瓶,故选择500 mL容量瓶。
②n(NaOH)=C(NaOH)×V(NaOH)=0.2mol/L×0.5L=0.1mol,m(NaOH)=M(NaOH)×n(NaOH)=0.1mol/L×40g/mol=4 g。
③搅拌,起到加速NaOH溶解的作用。
(2)①Cl2+2NaOH=NaClO+NaCl+H2O;n(NaOH)=C(NaOH)×V(NaOH)=0.2mol/L×0.2L=0.04mol,根据:Cl2~2NaOH,则n(Cl2)=0.02mol,V(Cl2)=0.02mol×22.4L/mol=448mL。
②由于消毒液的有效成分NaClO水解产生的HClO容易见光分解,因此需密封避光保存。
③该消毒液不能与洁厕灵混用,会发生反应 ,反应过程中,氯气与转移的电子数的比例为1∶1,故产生1 mol Cl2,转移电子的物质的量为1 mol,即NA或6.02×1023个。
11. H2 Cl2 CO2 HCl H2 + Cl22HCl H2O+ Cl2 = HCl + HClO CO2 + Ca(OH)2 = CaCO3↓+ H2O
【分析】现有A、B、C、D四种气体,A是密度最小的气体,则A为氢气,B在通常情况下呈黄绿色,则B为氯气,把四种气体分别通入酸化的硝酸银溶液中,通入B、D气体时立即出现白色沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D,则D为HCl,把无色无刺激性气味的气体C通入澄清石灰水时,石灰水变浑浊,则C为CO2。
解析:(1)根据上面分析得到A、B、C、D的化学式分别为:A为H2;B为Cl2;C为CO2;D为HCl;故答案为:H2;Cl2;CO2;HCl。
(2)A与B是氢气在氯气中点燃生成氯化氢,反应方程式为:H2 + Cl22HCl;B与水是氯气与水反应生成盐酸和次氯酸,反应方程式为H2O+ Cl2 = HCl + HClO;C与澄清石灰水是二氧化碳和澄清石灰水反应生成碳酸钙和水,反应方程式为CO2 + Ca(OH)2 = CaCO3↓+ H2O;故答案为:H2 + Cl22HCl;H2O+ Cl2 = HCl + HClO;CO2 + Ca(OH)2 = CaCO3↓+ H2O。
12. 溶液变蓝色 1
解析:(1) 二氧化锰与浓盐酸反应的化学方程式,故答案为:;
(2)生成的氯气具有氧化性,与KI淀粉溶液发生氧化反应生成I2,I2可以使淀粉容易变蓝色;D中放有石灰乳,石灰乳的成分是Ca(OH)2,D瓶中发生反应的化学方程式是,所以故答案为:溶液变蓝色,;
(3) 盐酸参加氧化还原反应生成氯气,根据氯守恒参与氧化还原反应的盐酸的物质的量是盐酸的2倍所以参与氧化还原反应的盐酸的物质的量是,故答案为:1
一、选择题
1.下列离子方程式中正确的是
A.用氯气作为水的消毒剂:Cl2+H2O=2H++Cl-+ClO-
B.用FeCl3溶液腐蚀印刷铜电路板:Cu+Fe3+=Fe2++Cu2+
C.Fe片放入稀盐酸中:2Fe+6H+=2Fe3++3H2↑
D.氢氧化钡溶液与盐酸的反应:OH-+H+=H2O
2.下列化合物中,不能通过两种单质间化合直接制取的是
A.NaCl B.CuCl2 C.FeCl2 D.FeCl3
3.下列说法不正确的是
A.碳酸钠广泛应用于制玻璃、造纸、纺织等领域
B.碳酸氢钠可作为制药的原料、食品加工中的发酵粉
C.氯气大量用于饮用水消毒、爆破、制造盐酸等
D.次氯酸钙既可以作漂白棉、麻的漂白剂,又可用作游泳池等场所的消毒剂
4.下列物质在氯气中燃烧能够产生白雾的是
A.铁 B.氢气 C.红磷 D.铜
5.下列氯气参与的化学反应中,方程式书写不正确的是
A.钠与氯气在加热条件下反应:
B.铁与氯气在加热条件下反应:
C.铜与氯气在加热条件下反应:
D.纯净的氢气在氯气中安静地燃烧:
6.新制的饱和氯水与久置氯水的主要区别是
序号 新制的氯水 久置氯水
A 不能与锌反应放出气体 能与锌反应放出气体
B 有漂白作用 无漂白作用
C 不含氯离子 含氯离子
D 酸性强 酸性弱
A.A B.B C.C D.D
7.下列物质久置于空气中易发生化学变化的有
①氯水 ②碳酸钠晶体 ③烧碱 ④漂白粉 ⑤过氧化钠 ⑥碳酸氢钠
A.5 种 B.4 种 C.3 种 D.2 种
8.下列关于电解饱和食盐水过程说法正确的是
A.电解饱和食盐水的工厂可以生产盐酸 B.与电源正极相连的电极区有NaOH生成
C.与电源的负极相连的电极上有氯气生成 D.电解饱和食盐水的过程中Na+浓度减小
二、非选择题
9.某些化学反应可用下式表示:,回答下列问题:
(1)若C为氯化钠,D为能使澄清石灰水变浑浊的无味气体,则A与B的两种组合分别是:_________或_________。
(2)若A为,B为盐酸,C是黄绿色的单质气体,该反应的离子方程式为_______。
(3)若C、D均为气体,完成反应的化学方程式:___________。
10.回答下列问题:
(1)实验室需要用NaOH配制0.2mol/LNaOH溶液450mL。
①完成本实验所必需的仪器有:托盘天平、药匙、烧杯、玻璃棒、胶头滴管、___。
②配制该溶液需称取NaOH___g。
③称量完毕,将药品倒入烧杯中,溶解、冷却,转移、洗涤。溶解过程中需要使用玻璃棒,目的是___。
(2)取上述配制的NaOH溶液200mL制取消毒液:向该NaOH溶液通入Cl2,使得NaOH恰好完全反应。完成下列填空。
①该消毒液制备的化学方程式为___,该反应消耗的Cl2在标准状况下的体积为___。
②该消毒液的的保存方式为__,原因为___。
③该消毒液不能与洁厕灵(主要成分为浓盐酸)混用,否则会产生中毒危险。若将二者混合,每产生1molCl2,转移电子个数约为___。
11.现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈黄绿色,把四种气体分别通入酸化的硝酸银溶液中,通入B、D气体时立即出现白色沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D。把无色无刺激性气味的气体C通入澄清石灰水时,石灰水变浑浊。
(1)A、B、C、D的化学式分别为:
A________;B________;C________;D________。
(2)写出下列各反应的化学方程式:
A与B________________________________。
B与水______________________________。
C与澄清石灰水________________________。
12.如图所示装置可用于二氧化锰与浓盐酸在加热条件下制取氯气,并利用产物进行后续实验,请填写下列空白:
(1)写出二氧化锰与浓盐酸反应的化学方程式:______。
(2)洗气瓶B中盛有饱和食盐水,洗气瓶C中盛有KI淀粉溶液,在洗气瓶D中放有石灰乳,则C瓶中观察到的现象是______;D瓶中发生反应的化学方程式是______。
(3)若反应产生了标况下11.2L的氯气,则参与氧化还原反应的HCl的物质的量是______mol。
【参考答案】
一、选择题
1.D
解析:A.氯气溶液水生成氯化氢和次氯酸,次氯酸为弱酸不能拆,,A错误;
B.电荷不守恒,,B错误;
C.铁与盐酸反应生成亚铁离子,,C错误;
D.氢氧化钡溶液与盐酸反应,生成氯化钡和水,D正确;
故答案为:D。
2.C
解析:A.钠与氯气在常温下生成氯化钠,通过两种单质间化合能够生成NaCl,故A正确;
B.铜与氯气在加热条件下反应生成氯化铜,通过两种单质间化合能够生成氯化铜,故B正确;
C.铁与氯气反应生成氯化铁,得不到氯化亚铁,故C错误;
D.氯气具有强氧化性,能与金属单质发生化合反应生成高价氯化物,铁与氯气反应生成氯化铁,故D正确;
故选:C。
3.C
解析:A.碳酸钠具有较强的碱性,可用于制玻璃、肥皂、造纸、纺织等工业,故A正确;
B.NaHCO3碱性较弱,可与酸反应,可用于治胃酸过多,可作为制药的原料,NaHCO3不稳定,受热会分解产生二氧化碳气体,可做发酵粉等,故B正确;
C.氯气是有毒气体,氯水中溶有较多的氯气,不能大量用于饮用水消毒,故C错误;
D.次氯酸钙具有强氧化性,能使蛋白质变性而杀菌消毒,同时也具有漂白性,所以漂白粉既可做漂白棉麻纸张的漂白剂,又可做游泳池及环境的消毒剂,故D正确;
故选:C。
4.B
解析:A.Fe与与氯气反应生成固体氯化铁,会观察到棕褐色的烟,A不符合;
B.H2与氯气反应生成气体HCl,极易结合水蒸气变为盐酸小液滴,则会观察到白雾,B符合;
C.P与氯气反应生成PCl5白色固体,C不符合;
D.Cu与氯气反应生成固体氯化铜,会观察到棕黄色的烟,D不符合;
故答案为:B。
5.B
解析:A.钠与氯气在加热条件下反应生成氯化钠,A正确;
B.铁与氯气在加热条件下反应生成氯化铁,B错误;
C.铜与氯气在加热条件下反应生成氯化铜,C正确;
D.纯净的氢气在氯气中安静地燃烧生成氯化氢,D正确;
故选B。
6.B
【分析】新制的氯水中含有Cl2、H2O、HClO、H+、Cl-、ClO-、OH-等粒子,具有酸性、强氧化性、漂白性;氯水久置时,次氯酸分解生成盐酸和氧气,最后得到盐酸溶液;
解析:A.新制氯水和久制氯水中均含有氢离子,可以与锌反应生成气体,A错误;
B.新制氯水中因为有HClO分子,故具有漂白性,久置氯水中次氯酸分子分解,无漂白性,B正确;
C.根据分析,新制氯水中含Cl-,久置氯水中只含氢离子和氯离子,C错误;
D.久制氯水的酸性强于新制氯水,D错误;
故答案为:B。
7.A
解析:①氯水中的HClO见光易分解,氯水久置最终得到盐酸,易变质;
②碳酸钠晶体空气久置易失去结晶水,易变质;
③烧碱易吸收空气中的二氧化碳最终转化成碳酸钠,易变质;
④漂白粉中次氯酸钙能与空气中的二氧化碳和水发生反应,易变质;
⑤过氧化钠易与二氧化碳和水反应,在空气中易变质;
⑥碳酸氢钠受热才能发生分解反应,在空气中很难反应,较为稳定;
故选:A。
8.A
解析:A.电解饱和食盐水制得的H2和Cl2可作为生产盐酸的原材料,A正确;
B.与电源正极相连的电极是阳极,电极反应式为,Cl2可与NaOH反应,因此该电极区不能生成NaOH,B错误;
C.与电源负极相连的电极是阴极,电极反应式为,没有Cl2生成,C错误;
D.电解的总反应方程式为:2NaCl+2H2O=2NaOH+Cl2↑+H2↑,反应过程水被消耗,Na+浓度增大,D错误;
故选A。
二、非选择题
9.(1) 碳酸钠和盐酸 碳酸氢钠和盐酸
(2)
(3)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
解析:(1)由题意可知A与B反应生成了氯化钠、水和二氧化碳,则A和B可以是碳酸钠和盐酸,也可以是碳酸氢钠和盐酸。
(2)由题意可知,方程式为浓盐酸和二氧化锰加热条件下反应制取氯气,则离子方程式为:。
(3)依据得失电子守恒和原子守恒,可知C、D为二氧化碳和二氧化硫,化学方程式为:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。
10.(1) 500mL容量瓶 4.0 搅拌,起到加速NaOH溶解的作用
(2) Cl2+2NaOH=NaClO+NaCl+H2O 448mL 密封避光保存 NaClO水解产生的HClO容易见光分解 NA或6.02×1023
解析: (1)①无450 mL规格的容量瓶,故选择500 mL容量瓶。
②n(NaOH)=C(NaOH)×V(NaOH)=0.2mol/L×0.5L=0.1mol,m(NaOH)=M(NaOH)×n(NaOH)=0.1mol/L×40g/mol=4 g。
③搅拌,起到加速NaOH溶解的作用。
(2)①Cl2+2NaOH=NaClO+NaCl+H2O;n(NaOH)=C(NaOH)×V(NaOH)=0.2mol/L×0.2L=0.04mol,根据:Cl2~2NaOH,则n(Cl2)=0.02mol,V(Cl2)=0.02mol×22.4L/mol=448mL。
②由于消毒液的有效成分NaClO水解产生的HClO容易见光分解,因此需密封避光保存。
③该消毒液不能与洁厕灵混用,会发生反应 ,反应过程中,氯气与转移的电子数的比例为1∶1,故产生1 mol Cl2,转移电子的物质的量为1 mol,即NA或6.02×1023个。
11. H2 Cl2 CO2 HCl H2 + Cl22HCl H2O+ Cl2 = HCl + HClO CO2 + Ca(OH)2 = CaCO3↓+ H2O
【分析】现有A、B、C、D四种气体,A是密度最小的气体,则A为氢气,B在通常情况下呈黄绿色,则B为氯气,把四种气体分别通入酸化的硝酸银溶液中,通入B、D气体时立即出现白色沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D,则D为HCl,把无色无刺激性气味的气体C通入澄清石灰水时,石灰水变浑浊,则C为CO2。
解析:(1)根据上面分析得到A、B、C、D的化学式分别为:A为H2;B为Cl2;C为CO2;D为HCl;故答案为:H2;Cl2;CO2;HCl。
(2)A与B是氢气在氯气中点燃生成氯化氢,反应方程式为:H2 + Cl22HCl;B与水是氯气与水反应生成盐酸和次氯酸,反应方程式为H2O+ Cl2 = HCl + HClO;C与澄清石灰水是二氧化碳和澄清石灰水反应生成碳酸钙和水,反应方程式为CO2 + Ca(OH)2 = CaCO3↓+ H2O;故答案为:H2 + Cl22HCl;H2O+ Cl2 = HCl + HClO;CO2 + Ca(OH)2 = CaCO3↓+ H2O。
12. 溶液变蓝色 1
解析:(1) 二氧化锰与浓盐酸反应的化学方程式,故答案为:;
(2)生成的氯气具有氧化性,与KI淀粉溶液发生氧化反应生成I2,I2可以使淀粉容易变蓝色;D中放有石灰乳,石灰乳的成分是Ca(OH)2,D瓶中发生反应的化学方程式是,所以故答案为:溶液变蓝色,;
(3) 盐酸参加氧化还原反应生成氯气,根据氯守恒参与氧化还原反应的盐酸的物质的量是盐酸的2倍所以参与氧化还原反应的盐酸的物质的量是,故答案为:1
