4.3金属的腐蚀与防护 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.3金属的腐蚀与防护 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 | 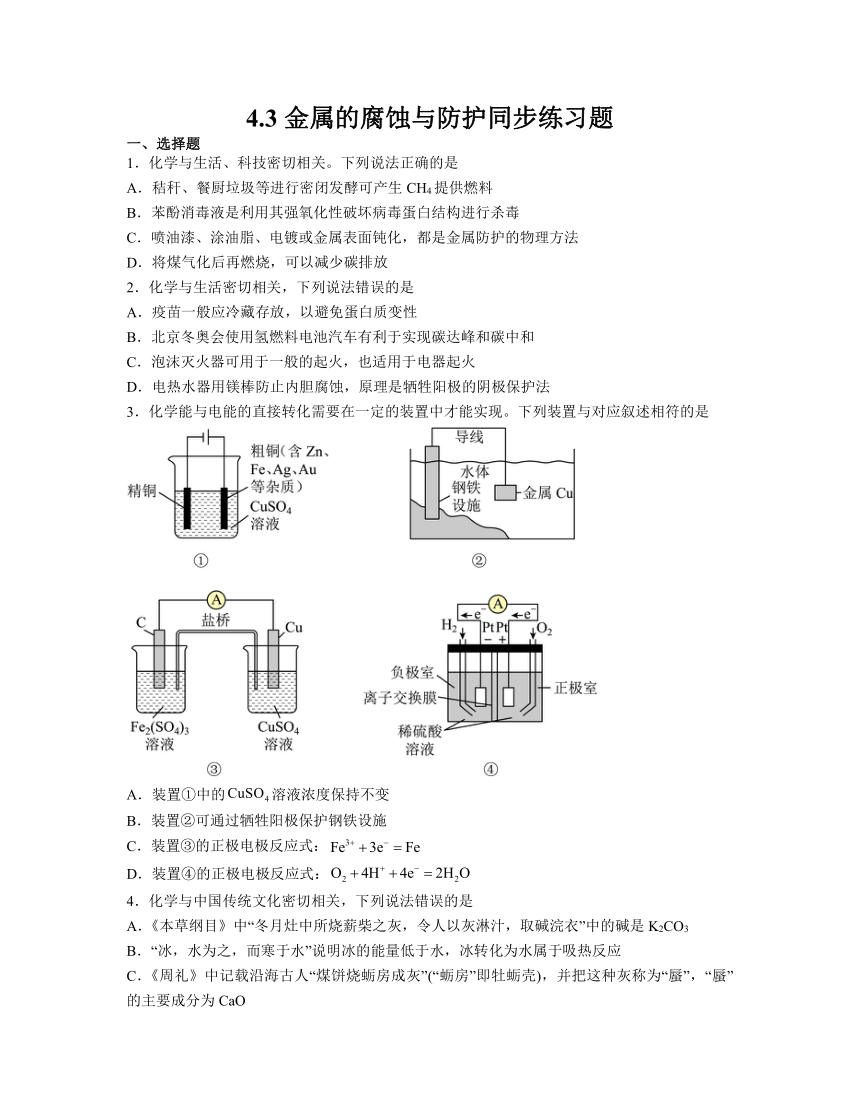 | |
| 格式 | docx | ||
| 文件大小 | 221.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-27 14:06:32 | ||
图片预览



文档简介
4.3金属的腐蚀与防护同步练习题
一、选择题
1.化学与生活、科技密切相关。下列说法正确的是
A.秸秆、餐厨垃圾等进行密闭发酵可产生CH4提供燃料
B.苯酚消毒液是利用其强氧化性破坏病毒蛋白结构进行杀毒
C.喷油漆、涂油脂、电镀或金属表面钝化,都是金属防护的物理方法
D.将煤气化后再燃烧,可以减少碳排放
2.化学与生活密切相关,下列说法错误的是
A.疫苗一般应冷藏存放,以避免蛋白质变性
B.北京冬奥会使用氢燃料电池汽车有利于实现碳达峰和碳中和
C.泡沫灭火器可用于一般的起火,也适用于电器起火
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
3.化学能与电能的直接转化需要在一定的装置中才能实现。下列装置与对应叙述相符的是
A.装置①中的溶液浓度保持不变
B.装置②可通过牺牲阳极保护钢铁设施
C.装置③的正极电极反应式:
D.装置④的正极电极反应式:
4.化学与中国传统文化密切相关,下列说法错误的是
A.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3
B.“冰,水为之,而寒于水”说明冰的能量低于水,冰转化为水属于吸热反应
C.《周礼》中记载沿海古人“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”,“蜃”的主要成分为CaO
D.黑铁(生铁)在空气中发生的腐蚀主要是电化学腐蚀
5.劳动创造美好生活。下列对劳动项目利用的化学原理解释正确的是
选项 劳动项目 化学原理
A 用明矾净化生活用水 具有强氧化性,能杀菌消毒
B 铁闸门定期刷换油漆 避免钢铁与空气发生化学腐蚀而生锈
C 用热的纯碱溶液洗涤餐具上的油污 高温更有利于油脂溶解于纯碱溶液
D 处理锅炉水垢中的,先用饱和溶液浸泡,再用盐酸除去 将转化为沉淀,能溶于盐酸
A.A B.B C.C D.D
6.下列事实能用勒夏特列原理解释的是
A.配制溶液,常将晶体溶于较浓的盐酸中
B.把食品存放在冰箱里可延长保质期
C.合成氨工业中使用铁触媒作催化剂
D.用牺牲阳极法保护船舶的外壳
7.将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比是
A.1∶2∶3 B.3∶2∶1 C.6∶3∶1 D.6∶3∶2
8.化学与人类生产、生活密切相关,下列说法不正确的是
A.过量施用化肥会造成水体富营养化,产生水华等污染现象
B.电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法
C.葡萄酒中通常含有微量,既可以杀菌又可以防止营养成分被氧化
D.“奋斗者”号全海深载人潜水器的载人舱用的钛合金比纯金属钛具有更高的强度、韧性和熔点
二、非选择题
9.《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也令人体会到化学方法在文物保护中的巨大作用。某博物馆修复出土铁器的过程如下:
(1)检测锈蚀产物
主要成分的化学式
Fe3O4 Fe2O3·H2O FeO(OH) FeOCl
铁器在具有O2、________等环境中容易被腐蚀。
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
①Fe转化为Fe2+。
②Fe2+在自然环境中形成FeO(OH),该物质中铁元素的化合价为________。
③FeO(OH)和Fe2+反应形成致密的Fe3O4保护层,Fe2+的作用是________(填字母)。
a.氧化剂
b.还原剂
c.既不是氧化剂也不是还原剂
10.I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是_______腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:_______
II.美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
(1)a是_______极;电极反应式为_______。
(2)已知:2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ/mol,飞船上宇航员的生活用水由燃料电池提供。已知这种电池发1度电(3600KJ)时能生成360g水,则该电池的能量的利用率为_______。
【参考答案】
一、选择题
1.A
解析:A.秸秆、餐厨垃圾等进行密闭发酵,可产生沼气,沼气的主要成分是CH4,CH4具有可燃性,则可提供燃料,A正确;
B.苯酚能够使蛋白质变性,具有杀菌消毒作用,故可以用作消毒液,但不是利用其强氧化性破坏病毒蛋白结构进行杀毒,B错误,
C.喷油漆、涂油脂保护金属是物理方法,但电镀或金属表面钝化,都是金属防护的化学方法,C错误;
D.煤的气化是将煤和水蒸气高温反应转化为水煤气(主要成分为CO和H2),其中CO燃烧仍然产生CO2,故将煤气化后再燃烧,不可以减少碳排放,D错误;
2.C
解析:A.疫苗主要成分是蛋白质,蛋白质在温度较高时易变性,因此疫苗一般应冷藏存放,以避免蛋白质变性,故A正确;
B.北京冬奥会使用氢燃料电池汽车减少二氧化碳的排放,有利于实现碳达峰和碳中和,故B正确;
C.泡沫灭火器可用于一般的起火,电器着火时,电器中的金属会与二氧化碳反应,因此泡沫灭火器不适用于电器起火,故C错误;
D.电热水器主要是铁制容器,镁活泼性比铁强,用镁棒防止内胆腐蚀,镁作负极,铁作正极受到一定保护,因此其原理是牺牲阳极的阴极保护法,故D正确。
综上所述,答案为C。
3.D
解析:A.装置①阳极先是锌失去电子,再是铁失去电子,再是铜失去电子,而阴极铜离子得到电子,因此溶液中的浓度会降低,故A不符合题意;
B.装置②可通过牺牲阳极保护钢铁设施,则应该接一块活泼性比铁强的金属,比如金属锌,而不是能接活泼性比铁弱的金属,或则会加快铁的腐蚀,故B不符合题意;
C.装置③的正极是铁离子得到电子变为亚铁离子,其电极反应式:,故C不符合题意;
D.装置④是氢氧酸性燃料电池,则正极电极反应式:,故D符合题意。
综上所述,答案为D。
4.B
解析:A.烧薪柴得到的草木灰中含K2CO3,溶液显碱性,能去除衣服上的污渍,故A正确;
B.“冰,水为之,而寒于水”说明相同质量的水和冰,冰的温度低于水,所以水的能量高,冰转化为水吸热过程,没有新物质生成,属于物理变化,不是吸热反应,故B错误;
C.牡蛎壳的主要成分是碳酸钙,碳酸钙分解生成氧化钙,所以“蜃“的主要成分为CaO,故C正确;
D.生铁含有Fe和C形成原电池,在空气中吸收氧气,铁失电子而氧气得电子,主要发生电化腐蚀,故D正确;
故选:B。
5.D
解析:A.明矾净水的原理是水解产生胶体,从而吸附水中悬浮物,A项错误;
B.刷换油漆是为了避免钢铁与空气发生电化学腐蚀而生锈,B项错误;
C.升高温度,能促进的水解,溶液碱性增强,更有利于酯的水解,C项错误;
D.用饱和溶液浸泡锅炉水垢中的,能使转化为更难溶的沉淀,能与盐酸反应生成可溶性钙盐,从而被除去,D项正确;
故选D。
6.A
解析:A.将晶体溶于较浓的盐酸中,盐酸可以使得铁离子的水解逆向移动,抑制铁离子的水解,用勒夏特列原理解释,A符合题意;
B.把食品存放在冰箱里可延长保质期,是降低温度减小食物腐败速率,不用勒夏特列原理解释,B不符合题意;
C.催化剂加快反应速率,不改变平衡移动,不用勒夏特列原理解释,C不符合题意;
D.用牺牲阳极法保护船舶的外壳,是利用原电池原理使得船舶钢铁做负极被保护,不用勒夏特列原理解释,D不符合题意;
故选A。
7.D
解析:试题分析:三个电解槽串联,则转移的电子数相等,设均转移6e-,
由K++e-═K、Mg2++2e-═Mg、Al3++3e-═Al,
则6e-~6K~3Mg~2Al,
所以析出钾、镁、铝的物质的量之比为6:3:2,
故选D。
考点:原电池和电解池的工作原理
点评:本题考查电解,明确电解中转移电子数的关系及电极反应式是解答本题的关键,题目难度不大。
8.D
【分析】水体富营养化,导致水污染。利用原电池原理,负极被腐蚀,正极被保护,习惯叫法是牺牲阳极的阴极保护法,细菌主要成分是蛋白质,根据蛋白质变性条件判断;合金的特点是熔点低,硬度大的特点。
解析:A.过量使用的化肥会随雨水流入河流和湖泊,造成水体富营养化,产生水华等污染现象,A正确;
B.金属内胆由铁合金制成,镁的金属活动性强于铁,镁棒作原电池的负极,从而保护了金属内胆不被腐蚀,原理是牺牲阳极的阴极保护法,B正确;
C.葡萄酒中通常含有微量,可以起到杀菌的作用,二氧化硫具有较强的还原性,可以起抗氧化作用,防止营养成分被氧化,C正确;
D.钛合金比纯金属钛具有更高的强度、韧性,但熔点比纯钛低,D错误。
故选答案D。
【点睛】本题考查化学与STSE,根据金属的腐蚀、蛋白质的性质、合金的性质进行判断。
二、非选择题
9. H2O(潮湿) +3 c
解析:(1)铁器在具有O2、H2O(潮湿)等环境中容易被腐蚀。
(2)②根据化合物中化合价代数和为0,可知FeO(OH)中铁元素的化合价为+3。③反应中元素的化合价均不变化,所以Fe2+的作用是既不是氧化剂也不是还原剂,选c。
10. 吸氧 O2+2H2O+4e-=4OH- 负 H2+2OH--2e-=2H2O 62.9%(或63%)
【分析】I.(1)中性或弱酸性条件下,钢铁发生吸氧腐蚀;
(2)铁、碳和电解质溶液构成原电池,碳作正极,正极上氧气得电子发生还原反应;
II.(1)氢氧燃料电池中,H2失去电子被氧化,a为负极;O2得到电子被还原,b为正极;
(2)1度为1KW·h,即3600 kJ,由2H2(气)+O2(气)2H2O(l)+572 kJ可知,生成360 gH2O(l)放出的热量=360×572/36=5720 kJ,而这些热能只能转化为3600 kJ的电能,据此计算能量的转化率。
解析:I.(1)弱酸或中性条件下,钢铁发生吸氧腐蚀;
因此,本题正确答案是:吸氧;
(2)铁、碳和电解质溶液构成原电池,碳作正极,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-;
因此,本题正确答案是: O2+2H2O+4e-=4OH-;
II.(1)由图示可知,参与电极反应的是H2和O2,生成的是H2O,故在反应中H2失去电子被氧化,a为负极;O2得到电子被还原,b为正极。电极反应分别为:H2+2OH--2e-=2H2O;
综上所述,故为:负,H2+2OH--2e-=2H2O;
(2)1度为1KW·h,即3600 kJ,由2H2(气)+O2(气)=2H2O(l)+572 kJ可知,生成360 gH2O(l)放出的热量=360×572/36=5720 kJ,而这些热能只能转化为3600 kJ的电能,所以能量的转化率=3600/5720×100%=62.9%;综上所述,故为:62.9%(或63%)
一、选择题
1.化学与生活、科技密切相关。下列说法正确的是
A.秸秆、餐厨垃圾等进行密闭发酵可产生CH4提供燃料
B.苯酚消毒液是利用其强氧化性破坏病毒蛋白结构进行杀毒
C.喷油漆、涂油脂、电镀或金属表面钝化,都是金属防护的物理方法
D.将煤气化后再燃烧,可以减少碳排放
2.化学与生活密切相关,下列说法错误的是
A.疫苗一般应冷藏存放,以避免蛋白质变性
B.北京冬奥会使用氢燃料电池汽车有利于实现碳达峰和碳中和
C.泡沫灭火器可用于一般的起火,也适用于电器起火
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
3.化学能与电能的直接转化需要在一定的装置中才能实现。下列装置与对应叙述相符的是
A.装置①中的溶液浓度保持不变
B.装置②可通过牺牲阳极保护钢铁设施
C.装置③的正极电极反应式:
D.装置④的正极电极反应式:
4.化学与中国传统文化密切相关,下列说法错误的是
A.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3
B.“冰,水为之,而寒于水”说明冰的能量低于水,冰转化为水属于吸热反应
C.《周礼》中记载沿海古人“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”,“蜃”的主要成分为CaO
D.黑铁(生铁)在空气中发生的腐蚀主要是电化学腐蚀
5.劳动创造美好生活。下列对劳动项目利用的化学原理解释正确的是
选项 劳动项目 化学原理
A 用明矾净化生活用水 具有强氧化性,能杀菌消毒
B 铁闸门定期刷换油漆 避免钢铁与空气发生化学腐蚀而生锈
C 用热的纯碱溶液洗涤餐具上的油污 高温更有利于油脂溶解于纯碱溶液
D 处理锅炉水垢中的,先用饱和溶液浸泡,再用盐酸除去 将转化为沉淀,能溶于盐酸
A.A B.B C.C D.D
6.下列事实能用勒夏特列原理解释的是
A.配制溶液,常将晶体溶于较浓的盐酸中
B.把食品存放在冰箱里可延长保质期
C.合成氨工业中使用铁触媒作催化剂
D.用牺牲阳极法保护船舶的外壳
7.将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比是
A.1∶2∶3 B.3∶2∶1 C.6∶3∶1 D.6∶3∶2
8.化学与人类生产、生活密切相关,下列说法不正确的是
A.过量施用化肥会造成水体富营养化,产生水华等污染现象
B.电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法
C.葡萄酒中通常含有微量,既可以杀菌又可以防止营养成分被氧化
D.“奋斗者”号全海深载人潜水器的载人舱用的钛合金比纯金属钛具有更高的强度、韧性和熔点
二、非选择题
9.《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也令人体会到化学方法在文物保护中的巨大作用。某博物馆修复出土铁器的过程如下:
(1)检测锈蚀产物
主要成分的化学式
Fe3O4 Fe2O3·H2O FeO(OH) FeOCl
铁器在具有O2、________等环境中容易被腐蚀。
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
①Fe转化为Fe2+。
②Fe2+在自然环境中形成FeO(OH),该物质中铁元素的化合价为________。
③FeO(OH)和Fe2+反应形成致密的Fe3O4保护层,Fe2+的作用是________(填字母)。
a.氧化剂
b.还原剂
c.既不是氧化剂也不是还原剂
10.I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是_______腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:_______
II.美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
(1)a是_______极;电极反应式为_______。
(2)已知:2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ/mol,飞船上宇航员的生活用水由燃料电池提供。已知这种电池发1度电(3600KJ)时能生成360g水,则该电池的能量的利用率为_______。
【参考答案】
一、选择题
1.A
解析:A.秸秆、餐厨垃圾等进行密闭发酵,可产生沼气,沼气的主要成分是CH4,CH4具有可燃性,则可提供燃料,A正确;
B.苯酚能够使蛋白质变性,具有杀菌消毒作用,故可以用作消毒液,但不是利用其强氧化性破坏病毒蛋白结构进行杀毒,B错误,
C.喷油漆、涂油脂保护金属是物理方法,但电镀或金属表面钝化,都是金属防护的化学方法,C错误;
D.煤的气化是将煤和水蒸气高温反应转化为水煤气(主要成分为CO和H2),其中CO燃烧仍然产生CO2,故将煤气化后再燃烧,不可以减少碳排放,D错误;
2.C
解析:A.疫苗主要成分是蛋白质,蛋白质在温度较高时易变性,因此疫苗一般应冷藏存放,以避免蛋白质变性,故A正确;
B.北京冬奥会使用氢燃料电池汽车减少二氧化碳的排放,有利于实现碳达峰和碳中和,故B正确;
C.泡沫灭火器可用于一般的起火,电器着火时,电器中的金属会与二氧化碳反应,因此泡沫灭火器不适用于电器起火,故C错误;
D.电热水器主要是铁制容器,镁活泼性比铁强,用镁棒防止内胆腐蚀,镁作负极,铁作正极受到一定保护,因此其原理是牺牲阳极的阴极保护法,故D正确。
综上所述,答案为C。
3.D
解析:A.装置①阳极先是锌失去电子,再是铁失去电子,再是铜失去电子,而阴极铜离子得到电子,因此溶液中的浓度会降低,故A不符合题意;
B.装置②可通过牺牲阳极保护钢铁设施,则应该接一块活泼性比铁强的金属,比如金属锌,而不是能接活泼性比铁弱的金属,或则会加快铁的腐蚀,故B不符合题意;
C.装置③的正极是铁离子得到电子变为亚铁离子,其电极反应式:,故C不符合题意;
D.装置④是氢氧酸性燃料电池,则正极电极反应式:,故D符合题意。
综上所述,答案为D。
4.B
解析:A.烧薪柴得到的草木灰中含K2CO3,溶液显碱性,能去除衣服上的污渍,故A正确;
B.“冰,水为之,而寒于水”说明相同质量的水和冰,冰的温度低于水,所以水的能量高,冰转化为水吸热过程,没有新物质生成,属于物理变化,不是吸热反应,故B错误;
C.牡蛎壳的主要成分是碳酸钙,碳酸钙分解生成氧化钙,所以“蜃“的主要成分为CaO,故C正确;
D.生铁含有Fe和C形成原电池,在空气中吸收氧气,铁失电子而氧气得电子,主要发生电化腐蚀,故D正确;
故选:B。
5.D
解析:A.明矾净水的原理是水解产生胶体,从而吸附水中悬浮物,A项错误;
B.刷换油漆是为了避免钢铁与空气发生电化学腐蚀而生锈,B项错误;
C.升高温度,能促进的水解,溶液碱性增强,更有利于酯的水解,C项错误;
D.用饱和溶液浸泡锅炉水垢中的,能使转化为更难溶的沉淀,能与盐酸反应生成可溶性钙盐,从而被除去,D项正确;
故选D。
6.A
解析:A.将晶体溶于较浓的盐酸中,盐酸可以使得铁离子的水解逆向移动,抑制铁离子的水解,用勒夏特列原理解释,A符合题意;
B.把食品存放在冰箱里可延长保质期,是降低温度减小食物腐败速率,不用勒夏特列原理解释,B不符合题意;
C.催化剂加快反应速率,不改变平衡移动,不用勒夏特列原理解释,C不符合题意;
D.用牺牲阳极法保护船舶的外壳,是利用原电池原理使得船舶钢铁做负极被保护,不用勒夏特列原理解释,D不符合题意;
故选A。
7.D
解析:试题分析:三个电解槽串联,则转移的电子数相等,设均转移6e-,
由K++e-═K、Mg2++2e-═Mg、Al3++3e-═Al,
则6e-~6K~3Mg~2Al,
所以析出钾、镁、铝的物质的量之比为6:3:2,
故选D。
考点:原电池和电解池的工作原理
点评:本题考查电解,明确电解中转移电子数的关系及电极反应式是解答本题的关键,题目难度不大。
8.D
【分析】水体富营养化,导致水污染。利用原电池原理,负极被腐蚀,正极被保护,习惯叫法是牺牲阳极的阴极保护法,细菌主要成分是蛋白质,根据蛋白质变性条件判断;合金的特点是熔点低,硬度大的特点。
解析:A.过量使用的化肥会随雨水流入河流和湖泊,造成水体富营养化,产生水华等污染现象,A正确;
B.金属内胆由铁合金制成,镁的金属活动性强于铁,镁棒作原电池的负极,从而保护了金属内胆不被腐蚀,原理是牺牲阳极的阴极保护法,B正确;
C.葡萄酒中通常含有微量,可以起到杀菌的作用,二氧化硫具有较强的还原性,可以起抗氧化作用,防止营养成分被氧化,C正确;
D.钛合金比纯金属钛具有更高的强度、韧性,但熔点比纯钛低,D错误。
故选答案D。
【点睛】本题考查化学与STSE,根据金属的腐蚀、蛋白质的性质、合金的性质进行判断。
二、非选择题
9. H2O(潮湿) +3 c
解析:(1)铁器在具有O2、H2O(潮湿)等环境中容易被腐蚀。
(2)②根据化合物中化合价代数和为0,可知FeO(OH)中铁元素的化合价为+3。③反应中元素的化合价均不变化,所以Fe2+的作用是既不是氧化剂也不是还原剂,选c。
10. 吸氧 O2+2H2O+4e-=4OH- 负 H2+2OH--2e-=2H2O 62.9%(或63%)
【分析】I.(1)中性或弱酸性条件下,钢铁发生吸氧腐蚀;
(2)铁、碳和电解质溶液构成原电池,碳作正极,正极上氧气得电子发生还原反应;
II.(1)氢氧燃料电池中,H2失去电子被氧化,a为负极;O2得到电子被还原,b为正极;
(2)1度为1KW·h,即3600 kJ,由2H2(气)+O2(气)2H2O(l)+572 kJ可知,生成360 gH2O(l)放出的热量=360×572/36=5720 kJ,而这些热能只能转化为3600 kJ的电能,据此计算能量的转化率。
解析:I.(1)弱酸或中性条件下,钢铁发生吸氧腐蚀;
因此,本题正确答案是:吸氧;
(2)铁、碳和电解质溶液构成原电池,碳作正极,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-;
因此,本题正确答案是: O2+2H2O+4e-=4OH-;
II.(1)由图示可知,参与电极反应的是H2和O2,生成的是H2O,故在反应中H2失去电子被氧化,a为负极;O2得到电子被还原,b为正极。电极反应分别为:H2+2OH--2e-=2H2O;
综上所述,故为:负,H2+2OH--2e-=2H2O;
(2)1度为1KW·h,即3600 kJ,由2H2(气)+O2(气)=2H2O(l)+572 kJ可知,生成360 gH2O(l)放出的热量=360×572/36=5720 kJ,而这些热能只能转化为3600 kJ的电能,所以能量的转化率=3600/5720×100%=62.9%;综上所述,故为:62.9%(或63%)
